参芍软肝汤抗大鼠肝纤维化的作用机制研究*
丁晓明,牟艳杰,杨凤革,张贤梅,孙勤国
(湖北省武汉市第三医院中医科 430060)
论著·基础研究
参芍软肝汤抗大鼠肝纤维化的作用机制研究*
丁晓明,牟艳杰,杨凤革,张贤梅,孙勤国△
(湖北省武汉市第三医院中医科 430060)
目的 研究参芍软肝汤抗大鼠肝纤维化的作用及其机制。方法 选取Wistar雄性大鼠72只,正常喂养1周后分为对照组(n=12)和造模组(n=60),造模组采用40%四氯化碳(CCl4)橄榄油溶液腹腔皮下注射构建大鼠肝纤维化模型,造模成功后分为模型组(等量生理盐水灌胃)、阳性对照组(秋水仙碱0.154 mg·kg-1·d-1)、低剂量组(每100 g体质量2 mL,含参芍软肝汤生药0.23 g/mL)、中剂量组(每100 g体质量2 mL,含参芍软肝汤生药0.46 g/mL)及高剂量组(每100 g体质量2 mL,含参芍软肝汤生药0.69 g/mL)各12只,均治疗8周后观察大鼠的肝纤维化相关指标的差异。结果 对照组大鼠全部为0期标准,阳性对照组大鼠的肝组织纤维化程度显著优于模型组(P<0.05),低剂量组、中剂量组、高剂量组的大鼠肝组织纤维化程度逐渐减轻,高剂量组大鼠肝组织纤维化程度显著轻于模型组和低剂量组(P<0.05)。模型组大鼠的Ⅲ型前胶原(PC-Ⅲ)、层粘连蛋白(LN)、Ⅳ-C型胶原(Ⅳ-C)、透明质酸(HA)检测值均显著高于对照组大鼠(P<0.05),阳性对照组、低剂量组、中剂量组、高剂量组的PC-Ⅲ、LN、Ⅳ-C、HA检测值均显著低于模型组大鼠(P<0.05)。模型组大鼠的血清超氧化物歧化酶(SOD)检测值均显著低于对照组大鼠(P<0.05),模型组大鼠的血清丙二醛(MDA)水平显著高于对照组大鼠(P<0.05);阳性对照组、低剂量组、中剂量组、高剂量组的血清SOD检测值均显著高于模型组大鼠(P<0.05),血清MDA水平显著低于模型组大鼠(P<0.05)。结论 参芍软肝汤能有效减轻大鼠肝纤维化程度,其作用机制为降低血清肝纤维化指标的水平,抑制过氧化物产生,减轻自由基对肝细胞的损伤作用。
肝硬化;中草药;机制
肝纤维化是指由各种致病因子所致肝内结缔组织异常增生,导致肝内弥漫性细胞外基质过度沉淀的病理过程,是各种慢性肝病的病理基础。病理学检查可见肝脏假小叶形成,肝细胞排列紊乱、纤维组织增生、血管分布相对不足,进而导致门静脉高压等并发症[1]。中医对肝硬化的认识着重于整体观念的理解,慢性肝病病因乘久,病邪乘机侵犯脾脏、胃以及肠道等器官,使得气血淤滞而搏结[2-3],通过针对性地解毒利湿驱邪、温阳活血扶正治疗,可以缓解肝硬化的发生发展,改善肝硬化患者的生存质量[4]。本实验重在分析参芍软肝汤抗大鼠肝纤维化的效果并初步探讨其可能的作用机制。
1 材料与方法
1.1 实验动物 健康清洁级成年雄性(SD)大鼠72只购自武汉大学动物实验中心[SCXK(鄂)2008-0004],体质量(180±20)g;面粉、猪油及胆固醇配成的混合饲料由湖北中医药大学实验动物中心提供;中药材原料购自湖北辰美中药有限公司,参芍软肝汤含有丹参、白芍、郁金、海藻、制鳖甲、垂盆草、女贞子、茯苓、制附片、炙甘草10味中药成分,加水煎煮,去渣后浓缩至2.3 g/mL,密封,4 ℃保存,为本院制剂室配置;苏木素伊丽春红酸性复红液试剂盒购自谷歌生物;大鼠血清透明质酸(HA)、层粘连蛋白(LN)、Ⅳ-C型胶原(Ⅳ-C)和 Ⅲ型前胶原(PC-Ⅲ)酶联免疫吸附试验(ELISA)试剂盒购自南京安培化工科技有限公司,检测仪器为美国Biotek酶标仪;超氧化物歧化酶(SOD)检测试剂盒及丙二醛(MDA)试剂盒购自上海西唐生物科技有限公司;全自动生化分析仪购自美国贝克曼公司。
1.2 方法
1.2.1 分组 72只大鼠分为对照组(n=12)和造模组(n=60)。造模组分为模型组、阳性对照组、低剂量组、中剂量组及高剂量组各12只。各组大鼠初始体质量比较差异无统计学意义。
1.2.2 建立肝纤维化模型 采用四氯化碳(CCl4)皮下注射法诱导大鼠肝纤维化模型。雄性 Wistar 大鼠 60 只,按《中药药物实验方法学》用复合因素造模,实验第 1 天皮下注射40% CCl4橄榄油溶液 0.5 mL/100 g体质量,以后每隔3 d,皮下注射 40% CCl4橄榄油溶液 0.3 mL/100 g 体质量,以 79.5% 单纯面粉、20% 猪油及 0.5% 胆固醇配成混合饲料喂养制成大鼠肝纤维化模型。阳性对照组及治疗组在造模同时给药持续8周,正常对照组以同样方法注射等量植物油。模型组除正常饮食、饮水外,每日给予 0.9% 氯化钠灌胃,皮下注射40%CCl4橄榄油。
1.2.3 取材 对照组、模型组(等量生理盐水灌胃)、阳性对照组(秋水仙碱0.154 mg·kg-1·d-1)、低剂量组(100 g/2 mL,含参芍软肝汤生药0.23 g/mL)、中剂量组(100 g/2 mL,含参芍软肝汤生药0.46 g/mL)及高剂量组(100 g/2 mL,含参芍软肝汤生药0.69 g/mL),各组动物模型均于治疗8周后处死,取下腔静脉血液,分离血清样本;迅速取部分肝组织以4%甲醛固定,用于肝组织病理及免疫组织化学染色观察。
1.2.4 肝组织标本的制备及观察 每只大鼠取相同部位肝脏用4%多聚甲醛固定,石蜡包埋切片,对各组大鼠的肝组织采用HE染色观察病理变化,另采用Masson三色染色,石蜡切片脱蜡至水,依次用自来水和蒸馏水冲洗,用Regaud苏木精染液或Weigert苏木精液染核5~10 min,采用磷酸盐缓冲液清洗3次,每次5 min,用Masson 丽春红酸性复红液5~10 min,1%磷钼酸水溶液分化3~5 min,95%乙醇、无水乙醇、二甲苯透明,中性树胶封固。在光镜下观察并对肝组织纤维化程度进行评级,0期:无胶原纤维形成;Ⅰ期:汇管区扩大,纤维组织将汇管区粘连;Ⅱ期:汇管区周围纤维化,纤维间隔形成,小叶结构基本保留;Ⅲ期:肝组织汇管区与中央静脉之间出现广泛的纤维粘连;Ⅳ期:假小叶形成。所有切片由病理科医师进行评价,每张切片选取8个高倍视野。
1.2.5 ELISA法测定各组大鼠血清的肝纤维化指标 PC-Ⅲ、LN、Ⅳ-C、HA及SOD、MDA的水平。
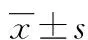
2 结 果
2.1 干预治疗8周后各组大鼠的肝纤维化程度比较 对照组大鼠全部为0期标准,阳性对照组大鼠的肝纤维化程度显著优于模型组(P<0.05),低剂量组、中剂量组、高剂量组的大鼠肝纤维化程度逐渐减轻,高剂量组大鼠肝组织纤维化程度显著轻于模型组和低剂量组(P<0.05),见表1。
各组大鼠肝组织切片染色后结果见图1。A为对照组大鼠肝组织HE染色结果,可见肝小叶结构清晰完整,肝细胞围绕中央静脉呈放射状排列,无变形坏死,未见肝纤维组织增生;B为模型组,可见肝组织中肝小叶结构遭到破坏,肝细胞排列紊乱、坏死、炎症细胞浸润;C为阳性对照组,D、E、F分别为低剂量组、中剂量组、高剂量组,可见肝脏组织结构逐渐恢复。Masson染色结果显示胶原纤维、黏液、软骨呈蓝色(如光绿液染色为绿色),胞质、肌肉、纤维素、神经胶质呈红色,胞核呈黑蓝色。各组纤维化程度同HE染色结果一致(图A1-F1)。
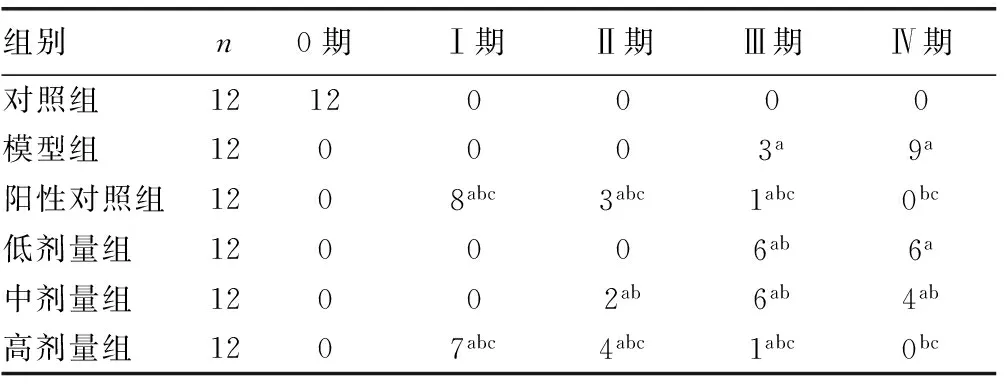
表1 干预治疗8周后各组大鼠的肝组织纤维化程度比较(n)
a:P<0.05,与对照组比较;b:P<0.05,与模型组比较;c:P<0.05,与低剂量组比较。
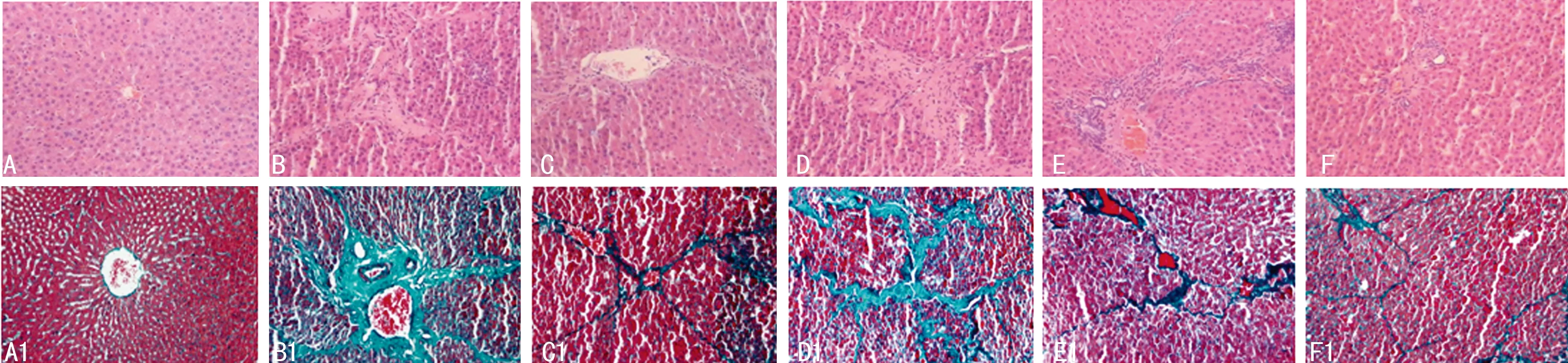
A:对照组(HE×100);B:模型组(HE×100);C:阳性对照组(HE×100);D:低剂量组(HE×100);E:中剂量组(HE×100);F:高剂量组(HE×100);A1:对照组(Masson×200);B1:模型组(Masson×200);C1:阳性对照组(Masson×200);D1:低剂量组(Masson×200);E1:中剂量组(Masson×200);F1:高剂量组(Masson×200)。
图1 肝组织切片
a:P<0.05,与对照组比较;b:P<0.05,与模型组比较;c:P<0.05,与低剂量组比较。
2.2 干预治疗8周后各组大鼠血清的肝纤维化指标变化情况 模型组大鼠的PC-Ⅲ、LN、Ⅳ-C、HA检测值均显著高于对照组大鼠(P<0.05),阳性对照组、低剂量组、中剂量组、高剂量组的PC-Ⅲ、LN、Ⅳ-C、HA检测值均显著低于模型组大鼠(P<0.05),见表2。
2.3 干预治疗8周后各组大鼠的血清SOD、MDA水平变化情况 模型组大鼠的血清SOD检测值均显著低于对照组大鼠(P<0.05),模型组大鼠的血清MDA水平显著高于对照组大鼠(P<0.05);阳性对照组、低剂量组、中剂量组、高剂量组的血清SOD检测值均显著高于模型组大鼠(P<0.05),血清MDA水平显著低于模型组大鼠(P<0.05),见表3。
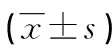
表3 干预治疗8周后各组大鼠的血清SOD、MDA水平变化情况
a:P<0.05,与对照组比较;b:P<0.05,与模型组比较;c:P<0.05,与低剂量组比较。
3 讨 论
肝纤维化是机体对各种致病因素引起的慢性肝损伤后的一种自我修复反应,尽管早期的肝纤维化临床症状不是很明显,但当肝脏受到持续的损伤时,肝纤维化可发展成肝硬化,肝硬化可导致门脉高压、肝衰竭、肝性脑病、肝细胞癌等并发症。有报道显示,肝硬化5 年、10 年后发展成肝癌的概率分别约为17%、40%[5]。目前肝移植是严重肝病唯一有效的治疗措施,但肝纤维化在某种程度上可逆转[6]。 因此有效的抗纤维化药物是十分必要的[7]。目前对于肝硬化发生机制的研究表明,层粘连蛋白、胶原蛋白Ⅳ以及胶原纤维的增生是导致肝硬化恶化的重要原因[8-9]。中医理论认为,肝硬化过程中肝细胞正常的解毒、合成等功能受到多种因素的干扰,进而引起肝失疏泄、气滞血淤、肝血不足、脾胃运化失调等病理变化[10]。通过疏肝活血理气解毒、温阳健脾利湿扶正等方式,可以改善间质代偿性增生[11],并抑再生肝内胆管的异常生成。另一方面,中医治疗肝硬化注重对疾病系统性的整体调节和辨证用药,“见肝之病、知肝传脾、当先实脾”,参芍软肝汤含有丹参、白芍、郁金、海藻、制鳖甲、垂盆草、女贞子、茯苓、制附片、炙甘草10种中药成分,在调理肝脏血流的同时可以“散脾之湿毒”、“扶正以祛邪”,进而达到整体治疗的目的。
通过本实验可以看出,不同的造模组通过四氯化碳进行肝脏纤维化诱导,模型组采用常规的秋水仙碱治疗,中药治疗组采用不同剂量的参芍软肝汤治疗,经过治疗后处死动物并取肝脏组织染色分析,可见模型组的大鼠肝脏组织均呈现不同的假小叶结构,再生的红染纤维组织包裹肝细胞以及胆管细胞形成排列紊乱的非线性结构,提示造模成功[12]。而低剂量组、中剂量组、高剂量组的大鼠肝组织纤维化程度逐渐减轻,高剂量参芍软肝汤治疗组的大鼠肝脏纤维再生程度较低,虽然可见肝组织中肝小叶结构遭到破坏,肝细胞排列紊乱、坏死、炎症细胞浸润,但Masson染色结果显示高剂量组的假小叶数量较少,间质染色提示纤维化程度较轻,提示了参芍软肝汤对于治疗或者抑制肝脏纤维化的过程中具有一定的剂量依赖性。通过肝脏纤维化的生化指标分析可见,阳性对照组、低剂量组、中剂量组、高剂量组的PC-Ⅲ、LN、Ⅳ-C、HA检测值均显著低于模型组大鼠,而高剂量组的HA、LN、Ⅳ-C等均有较为显著的下降,其中LN可下降至(37.1±9.4)g/L,而Ⅳ-C的下降更为显著,其平均值仅为(8.5±0.9)g/L,提示了高剂量的参芍软肝汤对于抑制四氯化碳诱导的肝脏纤维化过程的抑制作用。据《温病条辨》记载,参芍软肝汤可以主“经年不愈,下焦阴阳皆虚,不能收摄,少腹气结”之证,散肝血解淤毒的同时可以调理阴阳气血,参芍软肝汤对于抑制肝脏纤维化的作用可能与“附子固守下焦之阳”、“茯苓、炙甘草守补中焦”有关。为进一步分析其作用机制,高剂量组的血清SOD检测值均显著高于模型组大鼠,而血清MDA呈现了相反的变化,SOD通过抑制细胞膜的过氧化损伤作用进而稳定细胞膜以及细胞核[13],维持细胞内第二信使传递的稳定性,而MDA在过氧化损伤的过程中可以通过调节白三烯等炎症因子进而促进缺血再灌注损伤[14-15],本研究结果提示参芍软肝汤可能通过促进SOD的上调并抑制MDA的表达进而抑制肝脏纤维化,但本研究并未探讨SOD介导的细胞内信号作用及其与MDA的交互作用,提示了本研究的不足之处。
参芍软肝汤对于减轻大鼠肝纤维化程度的作用存在明显的剂量依赖性,其机制可能与抑制过氧化物产生、减轻自由基对肝细胞的损伤作用有关,但本研究仅限于动物试验,相关结论和机制有待进一步探讨。
[1]张庆辉,石好岭,侯森,等.乙型病毒性肝炎肝硬化合并2型糖尿病患者发生原发性肝细胞肝癌的危险性分析[J].中华实用诊断与治疗杂志,2015,29(1):76-77.
[2]张国栋.低剂量干扰素治疗丙肝肝硬化疗效及影响因素分析[J].现代仪器与医疗,2013,19(4):5-7.
[3]徐英.参芍汤加减治疗腹泻型肠易激综合征临床观察[J].实用中医药杂志,2011,27(3):161-163.
[4]徐建军,潘锋,徐虹.中药正肝汤对乙型肝炎肝硬化患者血清瘦素、脂联素水平以及胰岛素抵抗影响的分析[J].中华流行病学杂志,2015,36(4):399-401.
[5]Parveen N,Aleem AK,Habeeb MA,et al.An update on hepatic stem cells:bench to bedside[J].Curr Pharm Biotechnol,2011,12(2):226-230.
[6]Ramachandran P,Iredale JP.Reversibility of liver fibrosis[J].Ann Hepatol,2009,8(1):283-291.
[7]Henderson NC,Iredale JP.Liver fibrosis:cellular mechanisms of progression and resolution[J].Clin Sci(Lond),2007,112(5):265-280.
[8]马建红,王霞,贡桂英.丹参强肝胶囊治疗慢性乙型病毒性肝炎肝纤维化54例疗效观察[J].河北中医,2015,37(3):342-344.
[9]李杨,吴丽娜,李英伦,等.中药对黄曲霉毒素B1引起肝损伤过程中细胞色素P450影响的研究进展[J].动物医学进展,2015,36(3):107-111.
[10]李荣,李蓉.苦参黄芪汤抗大鼠肝纤维化作用机制的研究[J].陕西中医,2011,23(12):1674-1676.
[11]董丽娴,杨敏,赵洁,等.乙型肝炎肝硬化患者血清促血小板生成素水平与不同HBV-DNA载量、Child-Pugh分级、血小板数之间的关系[J/CD].中华消化病与影像杂志(电子版),2015,31(1):14-17.
[12]Zheng J,Wu C,Lin Z,et al.Curcumin up-regulates phosphatase and tensin homologue deleted on chromosome 10 through microRNA-mediated control of DNA methylation--a novel mechanism suppressing liver fibrosis[J].FEBS J,2014,281(1):88-103.
[13]Aoudjehane L,Bisch G,Scatton O,et al.Infection of human liver myofibroblasts by hepatitis C virus:A direct mechanism of liver fibrosis in hepatitis C[J].PLoS One,2015,10(7):134-141.
[14]Zhang X,Li FH,Liu P,et al.Study on effect of artificial CsB and its components on bile acid metabolism in rats with liver fibrosis and its mechanism[J].Zhongguo Zhong Yao Za Zhi,2013,38(22):3943-3948.
[15]Wu BR,Zheng YL,Sang XL,et al.Role of the IGF-1/PI3K pathway and the molecular mechanism of Fuzhenghuayu therapy in a spontaneous recovery rat model of liver fibrosis[J].Zhonghua Gan Zang Bing Za Zhi,2013,21(9):674-678.
Study on effect and mechanism of Shenshaoruangan Decoction on liver fibrosis in rats*
Ding Xiaoming,Mou Yanjie,Yang Fengge,Zhang Xianmei,Sun Qinguo△
(Department of Traditional Chinese Medicine,Wuhan Municipal Third Hospital,Wuhan,Hubei 430060,China)
[Abstract] Objective To study the effect and mechanism of Shenshaoruangan Decoction on liver fibrosis in rats.Methods Seventy-two male Wistar rats were selected and normally fed for 1 week.Then they divided into the control group(n=12) and model constructing group(n=60).The model constructing group was subcutaneously and intraperitoneally injected by 40% CCl4olive oil for constructing fibrosis rat model.After successfully constructing model,which was divided into the model group(equivalent normal saline gavage),positive control group(colchicines 0.154 mg·kg-1·d-1),low-dose group(2 mL per 100 g body mass,containing Shenshaoruangan Decoction crude drug 0.23 g/mL),medium-dose group(2 mL per 100 g body mass,containing Shenshaoruangan Decoction crude drug 0.46 g/mL) and high-dose group(100 g/2 mL,containing Shenshaoruangan Decoction crude drug 0.69 g/mL),12 cases in each group.The differences of related indicators rat hepatic fibrosis after 8-weeks treatment were observed.Results The control group was the stage 0 standard,the liver fibrosis degree in the positive control group was significantly better than that in the model group(P<0.05);the liver fibrosis degree in the low-dose group,medium-dose group and high-dose group was gradually alleviated;the liver fibrosis degree in the high-dose group was significantly slighter than that in the model group and-dose group(P<0.05).The detection values of PC-Ⅲ,LN,Ⅳ-C and HA in the model group were significantly higher than those in the control group(P<0.05),and the detection values of PC-Ⅲ,LN,Ⅳ-C and HA in the positive control group,low-dose group,medium-dose group and high-dose group were significantly lower than those in the model group(P<0.05).Serum SOD detection value of the model group was significantly lower than that in the control group(P<0.05),the serum MDA level in the model group was significantly higher than that in the control group(P<0.05);serum SOD level in the positive control group,low-dose group,medium-dose group and high-dose group was significantly higher than that in the model group(P<0.05),while serum MDA level in those group was significantly lower than that in the model group(P<0.05).Conclusion Shenshaoruangan Decoction can effectively alleviate the liver fibrosis degree,and its mechanism is to reduce the levels of liver fibrosis indicators,inhibit the prodmotion of peroxides and alleviate the damage of free radicals on liver cells.
livercirrhosis;drugs,chinese herbal;mecnanism
10.3969/j.issn.1671-8348.2017.13.004
湖北省武汉市卫生和计划生育委员会资助项目(WZ16A11)。 作者简介:丁晓明(1982-),硕士,主治医师,主要从事中医临床研究。△
,E-mail:707986890@qq.com。
R575
A
1671-8348(2017)13-1740-03
2016-11-21
2017-01-09)

