石楠不同部位提取物抗氧化活性1)
李彦 张治海 邓凯航 张欢 梁宗锁
(西北农林科技大学,杨凌,712100) (安塞果业发展局) (西北农林科技大学)
石楠不同部位提取物抗氧化活性1)
李彦 张治海 邓凯航 张欢 梁宗锁
(西北农林科技大学,杨凌,712100) (安塞果业发展局) (西北农林科技大学)
为考察石楠(PhotiniaserrulataLindl.)抗氧化活性与总原花青素、总酚和总黄酮质量分数之间的关系以及提取溶剂对其抗氧化活性的影响,采用不同溶剂对石楠不同部位进行了超声提取;测定了总原花青素、总酚和总黄酮质量分数;以DPPH自由基清除活性、ABTS自由基清除活性、铁离子还原能力和铜离子还原能力综合评价了其抗氧化能力。结果表明:石楠不同部位抗氧化能力差异显著,枝-韧皮部和果序-轴抗氧化活性最强,这与高质量分数的总原花青素、总酚和总黄酮有关;不同溶剂的提取效果具有显著性差异,枝-韧皮部的总原花青素质量分数为(10.77±0.08)%~(29.31±0.69)%;总黄酮质量分数为(2.60±0.02)%~(7.02±0.01)%;总酚质量分数为(3.15±0.02)%~(6.42±0.07)%,其中85%甲醇提取总原花青素效果最好,70%丙酮提取总酚和总黄酮效果最好。相关性分析表明,石楠不同部位总原花青素、总酚和总黄酮质量分数与抗氧化活性之间呈现极显著正相关(P<0.01),说明石楠总原花青素、总酚和总黄酮可能作为石楠抗氧化成分协同发挥抗氧化活性。
石楠;总原花青素;总酚;总黄酮;抗氧化活性
石楠,蔷薇科石楠属(Photinia)植物,广泛分布于长江流域及秦岭以南地区,因独特的树形和不断变幻颜色的叶子而常用于观赏树种[1]。研究表明,石楠叶熊果酸和齐墩果酸具有显著的抗炎、抗肿瘤、促进免疫等药理作用[2-3];卫强等对石楠叶红、绿色素的研究发现其主要成分分别为黄酮类和叶绿素类,并具有较强的抗氧化活性[4]。为充分利用石楠资源,开发其各部位药用价值,课题组前期研究发现其果、枝、叶和花等均含丰富的原花青素、多酚和黄酮,且不同部位含量差异显著。原花青素(OPC)是指从植物分离得到的无色、在热酸处理下能产生花色素的物质,具有极强的抗氧化活性和自由基清除功能[5],可通过回收脂溶性维生素E和减少DNA氧化损伤来发挥抗氧化作用[6];多酚和黄酮具有显著的清除自由基、抗氧化等功能,对人类健康十分重要[7]。
为系统反映石楠不同部位总原花青素、总酚和总黄酮质量分数与抗氧化活性的关系,本研究以去离子水、85%甲醇、80%乙醇和70%丙酮作溶剂,对石楠枝(韧皮部和木质部)、叶(幼叶和老叶)、花序(轴和小花)和果序(轴和果实)进行超声提取;测定石楠各部位总原花青素、总酚和总黄酮质量分数;以1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除活性、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基清除活性、铁离子还原能力(FRAP)和铜离子还原能力(CUPRAC)评价其抗氧化活性;为石楠资源的有效开发和综合利用提供参考。
1 材料与方法
1.1 仪器设备
UV-1700紫外可见分光光度计,日本株式会社岛津制作所;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;SB25-12DTD超声波清洗机,宁波新芝生物科技股份有限公司;SHB-III型循环水式多用真空泵,郑州长城科工贸有限公司;UPW-II-90型超纯水机,成都市超纯科技有限公司;KDC-140HR高速冷冻离心机,安徽中科中佳科学仪器有限公司。
1.2 材料与试剂
石楠材料于2016年3月采自西北农林科技大学校内,经西北农林科技大学生命科学学院梁宗锁教授鉴定为蔷薇科石楠属石楠(PhotiniaserrulataLindl.)。将石楠的枝(木质部和韧皮部)、叶(幼叶和老叶)、花序(轴和小花)和果序(轴和果实)室温干燥后粉碎,过60目筛,保存备用。
原花青素分析标准品(UV≥95%),上海源叶生物科技有限公司;对-二甲基氨基肉桂醛(DMAC)、儿茶素、新亚铜、福林-酚试剂,阿拉丁;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、2,4,6-三吡啶基-1,3,5-三嗪(TPTZ)、L-抗坏血酸(Vc)、没食子酸,美国Sigma-Aldrich公司;其余化学试剂为国产分析纯,水为去离子水。
1.3 方法
1.3.1 石楠材料的预处理
取石楠8个部位粗粉各20 g,分别加入去离子水、85%甲醇、70%丙酮、80%乙醇600 mL,浸泡24 h,于40 kHz下超声提取30 min,8 000 r·min-1离心5 min,上清液于冰箱中4 ℃保存备用。
1.3.2 抗氧化活性测定
DPPH自由基清除活性测定:参照Sharma et al.[8]的方法,绘制标准曲线,得到A517(Y)和L-抗坏血酸质量浓度(X)的回归方程,Y=6.835 2X+0.001 4,R2=0.999 6,各样品以同法测定。下同。
ABTS自由基清除活性测定:参照Re et al.[9]的方法,绘制标准曲线,得到A734(Y)和L-抗坏血酸质量浓度(X)的回归方程,Y=7.920 1X-0.012 2,R2=0.999 4。
铁离子还原能力测定:参照Benzie et al.[10]的方法,绘制标准曲线,得到A593(Y)和L-抗坏血酸质量浓度(X)的回归方程,Y=10.893X+0.095 9,R2=0.999 5。
1.3.3 石楠抗氧化成分质量分数测定
总原花青素质量分数测定:采用改良的对-二甲基氨基肉桂醛法[12]测定总原花青素质量分数。绘制标准曲线,得到A640(Y)和原花青素标准品质量浓度(X)的回归方程:Y=4.277 1X+0.025 5,R2=0.996 8,各样品以同法测定,质量分数由回归方程计算,下同。
总酚质量分数测定:采用改良的Folin-Ciocalteu法[13]测定总酚质量分数。绘制标准曲线,得到A765(Y)和没食子酸标准品质量浓度(X)的回归方程,Y=3.013 1X-0.011 3,R2=0.998 4。
总黄酮质量分数测定:采用改良的亚硝酸钠-氯化铝-氢氧化钠显色法[14]测定总黄酮质量分数。绘制标准曲线,得到A506(Y)和儿茶素标准品质量浓度(X)的回归方程,Y=1.606 5X+0.004 5,R2=0.999 9。
1.4 数据分析
采用Excel 2007和SPSS 22.0软件进行数据处理,所有指标平行测定3次,测定结果以平均值±标准差表示。试验结果采用单因素方差分析(One-way ANVOA)进行邓肯氏(Duncan’s)差异分析,P<0.05为具有显著性差异。
2 结果与分析
2.1 石楠抗氧化活性
目前,体外测定抗氧化能力方法较多,然而没有一种可以作为标准而代替全部方法,所以在研究某物质抗氧化作用时,一般选取2种以上、以不同机制为基础的方法,来共同说明该物质的抗氧化能力[15]。本试验选取4种体外抗氧化测定方法共同说明石楠抗氧化活性。
2.1.1 自由基清除活性
由表1可见,石楠各部位均表现出较强的自由基清除活性。相同溶剂提取条件下,石楠不同部位DPPH自由基清除活性由高到低依次为:果序-轴、枝-韧皮部、花序-轴、果序-果实、幼叶、枝-木质部、老叶、花序-小花,其中,80%乙醇提取条件下,果序-轴的DPPH自由基清除活性最强,为(229.04±1.80)mg·g-1,是果序-果实的3倍、花序-小花的15倍;ABTS自由基清除活性由高到低依次为:果序-轴、枝-韧皮部、花序-轴、幼叶、果序-果实、老叶、枝-木质部、花序-小花,其中,80%乙醇提取条件下,果序-轴的ABTS自由基清除活性最强,为(168.87±3.18)mg·g-1,是果序-果实的5倍、枝-木质部的9倍。自由基清除活性均呈现出果序-轴和枝-韧皮部最强,而花序-小花最弱,说明石楠不同部位之间自由基活性差异较大,可为石楠抗氧化部位的充分利用提供参考。相关性分析表明(表2),二者相关系数(r)为0.972,在0.01水平呈现极显著相关,说明石楠DPPH自由基清除活性强的部位,ABTS自由基清除活性也相应较强。
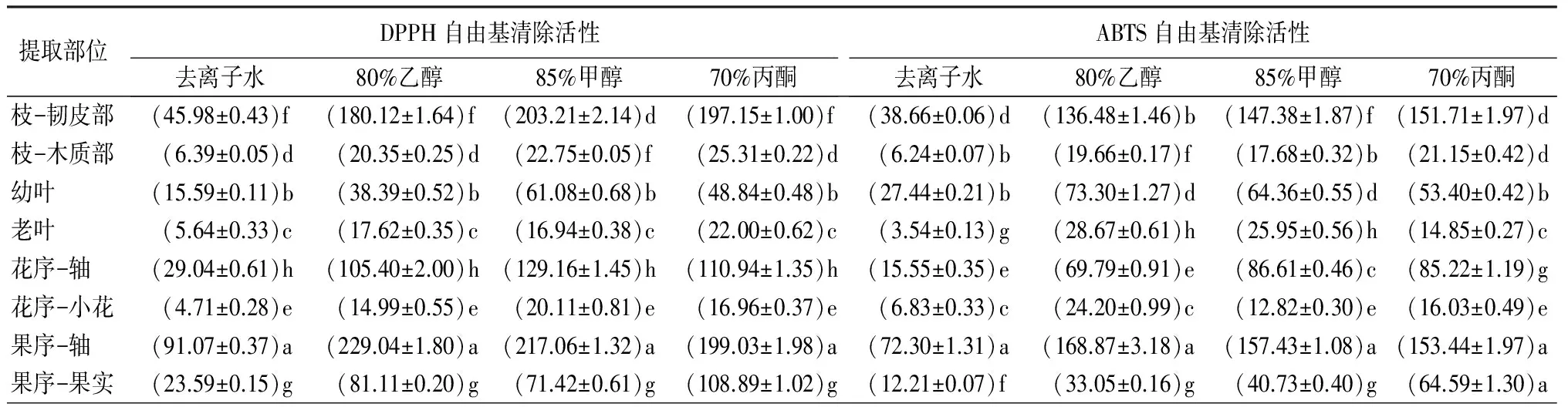
表1 不同溶剂提取下石楠各部位的抗氧化活性 mg·g-1

提取部位铁离子还原能力去离子水80%乙醇85%甲醇70%丙酮铜离子还原能力去离子水80%乙醇85%甲醇70%丙酮枝-韧皮部(25.27±0.12)f(85.15±0.28)e(111.26±1.18)f(90.14±0.35)b(42.03±0.47)e(129.51±1.52)f(149.79±3.04)d(145.15±4.76)d枝-木质部(4.46±0.05)b(13.02±0.10)d(11.52±0.10)b(13.20±0.07)b(7.07±0.09)d(15.53±0.37)d(16.64±0.16)f(18.58±0.36b)d幼叶(20.50±0.13)d(48.88±0.52)b(40.00±0.28)d(62.32±0.64)e(27.94±0.14)b(68.41±0.93)b(56.37±1.05)b(89.39±1.41)b老叶(5.44±0.11)e(9.51±0.05)g(7.99±0.44)e(12.54±0.07)g(5.21±0.14)g(13.45±0.13)h(7.55±0.19)g(12.67±0.37)g花序-轴(8.61±0.20)e(48.77±0.67)c(58.58±1.20)e(50.89±0.40)d(28.49±0.45)c(58.89±0.50)e(85.49±0.88)c(83.51±1.14)e花序-小花(3.31±0.21)c(7.32±0.13)c(9.78±0.30)c(15.72±0.37)c(3.29±0.23)c(10.26±0.19)c(10.20±0.17)e(15.94±0.51)c果序-轴(46.49±0.60)a(111.56±1.28)a(98.48±0.46)a(98.10±0.70)a(68.99±2.04)a(169.49±1.71)a(151.20±1.76)a(139.24±1.69)f果序-果实(8.36±0.11)g(23.40±0.54)f(28.16±0.27)g(23.45±0.22)f(14.17±0.41)f(26.05±0.64)g(42.76±0.58)a(38.29±1.05)a
注:表中数据为平均值±标准差。同列数据后不同字母表示在0.05水平差异显著。
2.1.2 金属离子还原能力
由表1所示,石楠各部位均表现出较高的金属离子还原能力。相同溶剂提取条件下,石楠不同部位铁离子还原能力和铜离子还原能力由高到低的总体趋势为:果序-轴和枝-韧皮部、幼叶和花序-轴、果序-果实和枝-木质部、老叶和花序-小花。其中,80%乙醇提取条件下,果序-轴的铁离子还原能力是果序-果实的5倍、花序-小花的15倍;80%乙醇提取条件下,果序-轴的铜离子还原能力是果序-果实的7倍、花序-小花的17倍。金属离子还原能力均表现出果序-轴和枝-韧皮部最强,而花序-小花最弱,说明与自由基清除活性相似,石楠不同部位之间还原能力差异较大,该结果可为利用石楠抗氧化强的部位开发新型抗氧化类保健品、化妆品等提供参考。相关性分析表明(表2),铁离子还原能力和铜离子还原能力的相关系数(r)为0.993,说明石楠铁离子还原能力较高的部位,其铜离子还原能力也相应较强。

表2 石楠抗氧化成分质量分数与抗氧化活性的相关性
注:** 表示在0.01水平上呈极显著相关,*表示在0.05水平上呈显著相关。
2.2 石楠抗氧化成分
由表3可见,石楠各部位总原花青素、总酚和总黄酮质量分数均较高,但具有显著性差异。相同溶剂提取石楠不同部位的总原花青素质量分数高于总酚、总黄酮,且三者在果序-轴和枝-韧皮部质量分数较高,与番茄研究结论[16]一致。其中,85%甲醇提取条件下,总原花青素在枝-韧皮部质量分数最高,为(29.31±0.69)%,是枝-木质部的10倍、幼叶的21倍;70%丙酮提取条件下,总酚在果序-轴的质量分数最高,为(7.63±0.54)%,是果序-果实的3倍、幼叶的11倍;同样在70%丙酮提取条件下,总黄酮在果序-轴的质量分数最高,为(7.78±0.06)%,是果序-果实的2倍、枝-木质部的6倍。
由表2可见,石楠总原花青素与总酚、总黄酮之间的相关系数(r)分别是0.925和0.953,总黄酮与总酚的相关系数(r)为0.955,均在0.01水平达到极显著相关,说明石楠总原花青素质量分数较高的部位,总酚、总黄酮质量分数也相应较高。该研究结果可为石楠资源相应部位的深入开发和高效利用提供参考。
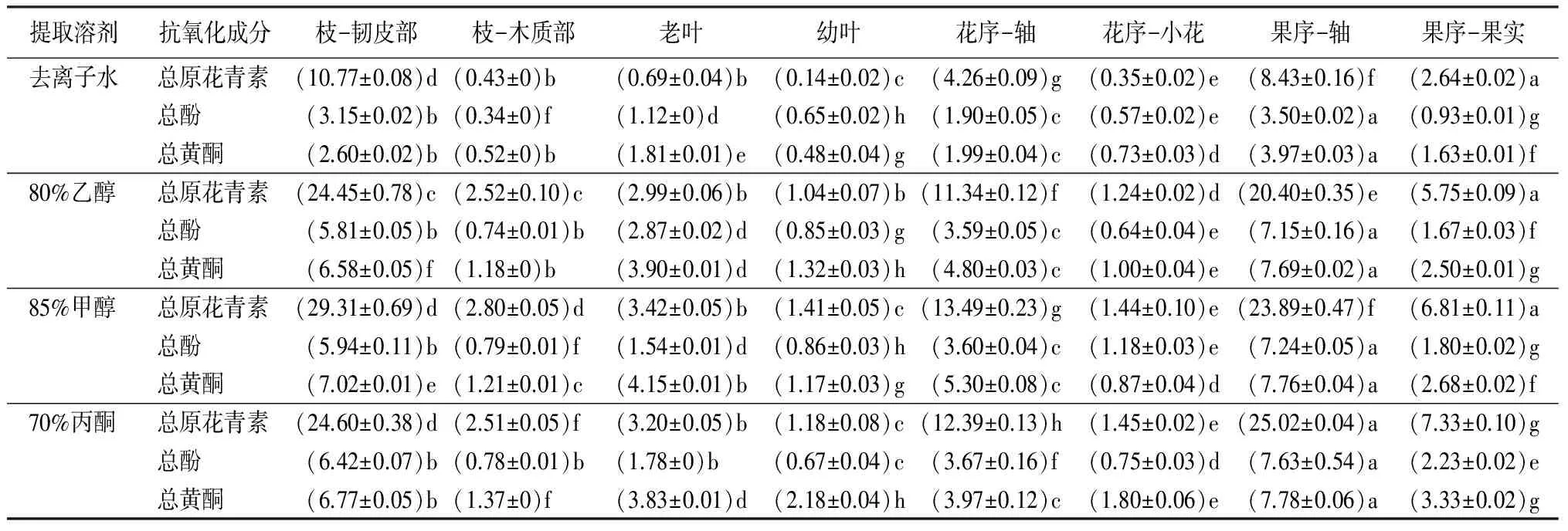
表3 不同溶剂提取条件下石楠抗氧化成分的质量分数 %
注:表中数据为平均值±标准差。同行数据后不同字母表示在0.05水平差异显著。
2.3 提取溶剂对石楠提取效果的影响
2.3.1 对石楠抗氧化成分提取效果的影响
有机溶剂常被用于植物活性成分的提取,根据极性的不同选择合适的提取溶剂,已被广泛应用[17]。研究表明,相比于单独使用有机溶剂而言,含水溶剂具有更高的提取率和更好的抗氧化活性[18]。为考察溶剂对石楠提取效果的影响,选取去离子水、85%甲醇、80%乙醇和70%丙酮[19-21]作为提取溶剂,提取效果结合表3所示。
由表3可知,85%甲醇对枝、叶和花序-轴部位的总原花青素提取效果最好,对枝-韧皮部、花序-轴和老叶部位的总黄酮提取效果最好,对枝-木质部、幼叶、花序-小花和果序-果实部位的总酚提取效果最好;70%丙酮对果序和花序-小花部位的总原花青素提取效果最好,对枝-木质部、幼叶、花序-小花和果序部位的总黄酮提取效果最好,对果序-轴、枝-韧皮部和花序-轴部位的总酚提取效果最好;80%乙醇对老叶的总酚提取效果最好;去离子水对各部位的提取效果均最差,说明不同溶剂对石楠各部位提取效果具有显著性差异。研究结果可为提取石楠不同部位不同成分的选择溶剂提供实验依据,可实现更加充分高效的开发利用石楠资源。
2.3.2 对石楠抗氧化活性的影响
由表1所示,不同溶剂提取石楠相同部位的抗氧化活性具有显著性差异,具体表现为其DPPH自由基清除活性在枝-韧皮部相差4.4倍;ABTS自由基清除活性在果序-果实部位相差5.3倍;铁离子还原能力在花序-轴部位相差6.8倍;铜离子还原能力在枝-韧皮部相差3.6倍,说明溶剂的选择对石楠抗氧化活性具有显著影响,与报道[19-21]一致。
2.4 石楠抗氧化指标的相关性
为深入了解石楠总原花青素、总酚和总黄酮含量与抗氧化活性之间的相关性,对石楠不同部位总原花青素、总酚和总黄酮含量与DPPH自由基的清除活性、ABTS自由基的清除活性、铁离子还原能力和铜离子还原能力之间进行相关性分析,以Pearson相关系数衡量不同指标之间的相关性。由表2所示,各抗氧化指标间均具有极显著的正相关性(P<0.01),说明石楠抗氧化活性高的部位,其总原花青素、总酚和总黄酮质量分数也相应较高,进一步表明石楠总原花青素、总酚和总黄酮可能协同发挥石楠的抗氧化活性。
3 结论与讨论
本研究采用DPPH自由基清除活性、ABTS自由基清除活性、铁离子还原能力和铜离子还原能力4种指标测定了石楠抗氧化能力,这种方法相对于体内方法,花费时间短、经费少,所需仪器设备简单;与ORAC、TEAC、TRAP等其他体外测定法相比,快速简便,与抗氧化成分的抗氧化活性相关性强[22]。本结果表明,石楠具有较强的抗氧化活性,说明石楠可作为较好的抗氧化资源植物而应用于保健品、化妆品等领域;且不同部位差异显著,其中果序-轴和枝-韧皮部抗氧化活性最强,可为石楠各部位的高效利用提供参考依据。
本研究采用DMAC法测定总原花青素质量分数,相比于传统香草醛-盐酸法,测定质量分数低,但检测时间短,反应灵敏,并且不易受到黄酮、花青素等酚性物质干扰[23]。本结果表明,石楠枝-韧皮部和果序-轴总原花青素质量分数高于葡萄籽[24]、莲房[25]、蓝莓[26]、落叶松[27]、山竹[23]和蔓越莓[13]等;总酚质量分数高于桑葚、蓝莓和黑加仑[8];总黄酮质量分数高于草莓、黑莓和蓝莓[28]。结合表3可知,相同溶剂提取石楠相同部位的总原花青素质量分数是总酚的4倍、总黄酮的5倍,而总酚质量分数与抗氧化活性的相关性大于总原花青素质量分数与抗氧化活性的相关性。可能是因为总原花青素质量分数与活性关系较为复杂,其活性与构效关系显示其抗氧化活性与聚合度、羟基的数量及位置、连接方式和空间构型有关,活性强度一般随着聚合度的增加而增加[29]。
由表1可知,石楠果序-轴和枝-韧皮部抗氧化活性最强,幼叶和小花部位抗氧化活性最弱;结合表3可知,石楠果序-轴和枝-韧皮部总原花青素、总酚和总黄酮质量分数最高,而幼叶和花序-小花部位质量分数最低;说明石楠总原花青素、总酚和总黄酮可能协同发挥石楠的抗氧化活性,与常山胡柚果实研究结论[30]一致。
石楠为一种多用途植物,富含抗氧化活性成分,具有保肝、抗炎和抗肿瘤等多种生理功能[31],拥有广阔的市场开发潜力和研究价值。然而目前研究较多的是石楠叶的齐墩果酸和熊果酸等活性成分[2-3],对于石楠黄酮和多酚的研究也局限于单一部位,对于不同部位抗氧化活性之间的比较尚未报道。本研究首次发现,石楠果序-轴和枝-韧皮部比叶具有更强的抗氧化活性,为石楠各部位的有效开发及研制抗氧化药物、化妆品等提供理论依据。但石楠抗氧化成分及相应的生理活性、药理作用尚不明确,还需进一步研究。
[1] 芦建国,陈春芳.石楠属植物研究进展[J].农业科技与信息(现代园林),2009(5):44-47.
[2] 田丽婷,马龙,堵年生.齐墩果酸的药理作用研究概况[J].中国中药杂志,2002,27(12):884-886,901.
[3] 王鹏,张忠义,吴忠.熊果酸在药用植物中的分布及药理作用[J].中药材,2000,23(11):717-722.
[4] 卫强,张国升,刘金旗,等.石楠叶红、绿色素成分比较及抗氧化活性研究[J].化学研究与应用,2014,26(12):1881-1886.
[5] 石碧,狄莹.植物多酚[M].北京:科学出版社,2000.
[6] SIMONETTI P, CIAPPELLANO S, GARDANA C, et al. Procyanidins fromVitisviniferaseeds: in vivo effects on oxidative stress[J]. J Agric Food Chem,2002,50(21):6217-6221.
[7] 范金波,蔡茜彤,冯叙桥,等.桑葚、蓝莓、黑加仑中多酚类物质的抗氧化活性[J].食品与发酵工业,2015,41(2):157-162.
[8] SHARMA O P, BHAT T K. DPPH antioxidant assay revisited[J]. Food Chemistry,2009,113(4):1202-1205.
[9] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radic Biol Med,1999,26(9/10):1231-1237.
[10] BENZIE I, STRAIN J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay[J]. Anal Biochem,1996,239(1):70-76.
[12] FELICIANO R P, SHEA M P, SHANMUGANAYAGAM D, et al. Comparison of isolated cranberry (VacciniummacrocarponAit.) proanthocyanidins to catechin and procyanidins A2 and B2 for use as standards in the 4-(dimethylamino)cinnamaldehyde assay[J]. J Agric Food Chem,2012,60(18):4578-4585.
[13] CHAOVANALIKIT A, WROLSTAD R E. Total anthocyanins and total phenolics of fresh and processed cherries and their antioxidant properties[J]. Food Chemistry and Toxicology,2004,69(1):67-72.
[14] BAO J S, CAI Y Z, SUN M, et al. Anthocyanins, flavonols, and free radical scavenging activity of Chinese bayberry (Myricarubra) extracts and their color properties and stability[J]. J Agric Food Chem,2005,53(6):2327-2332.
[15] 杜国荣.猕猴桃、柿和苹果果实的抗氧化能力及其抗氧化活性成分的分析[D].杨凌:西北农林科技大学,2009.
[16] 齐红岩,李天来,刘海涛,等.番茄不同部位中糖含量和相关酶活性的研究[J].园艺学报,2005,32(2):239-243.
[17] NACZK M, SHAHIDI F. Phenolics in cereals, fruits and vegetables: occurrence, extraction and analysis[J]. J Pharm Biomed Anal,2006,41(5):1523-1542.
[18] SULTANA B, ANWAR F, ASHRAF M. Effect of extraction solvent/technique on the antioxidant activity of selected medicinal plant extracts[J]. Molecules,2009,14(6):2167-2180.
[20] SIDDHURAJU P, BECKER K. Antioxidant properties of various solvent extracts of total phenolic constituents from three different agroclimatic origins of drumstick tree (MoringaoleiferaLam.) leaves[J]. J Agric Food Chem,2003,51(8):2144-2155.
[21] ALOTHMAN M, BHAT R, KARIM A A. Antioxidant capacity and phenolic content of selected tropical fruits from Malaysia, extracted with different solvents[J]. Food Chemistry,2009,115(3):785-788.
[22] 李杨昕,张元湖,田淑芬,等.玫瑰香葡萄生长期酚类物质含量及抗氧化活性的变化[J].园艺学报,2007,34(5):1093-1097.
[23] 黄雪松,黄文烨.对-二甲基氨基肉桂醛法测定山竹原花青素[J].现代食品科技,2013,29(7):1687-1690.
[24] 袁琳,袁春龙,胡立志,等.快速溶剂萃取仪提取葡萄籽中原花青素条件优化[J].食品科学,2013,34(14):157-162.
[25] 汪志慧,孙智达,谢笔钧.响应曲面法优化双酶法提取莲房原花青素[J].食品科学,2011,32(4):64-68.
[26] 战伟伟,司振军,王超萍,等.蓝莓叶原花青素提取工艺研究[J].粮食与油脂,2010,23(6):39-42.
[27] 姜贵全,方桂珍,师振鑫,等.超临界CO2萃取除脂后再经纤维素酶辅助提取落叶松树皮原花青素[J].林产化学与工业,2014,34(2):97-102.
[28] 刘文旭,黄午阳,曾晓雄,等.草莓、黑莓、蓝莓中多酚类物质及其抗氧化活性研究[J].食品科学,2011,32(23):130-133.
[29] 孙芸.葡萄籽原花青素聚合度与功效关系的研究[D].无锡:江南大学,2004.
[30] 方博文,齐睿婷,张英.常山胡柚果实不同部位有效成分含量及其抗氧化活性比较[J].食品科学,2015,36(10):158-163.
[31] 李媛.草珊瑚、紫荆和小叶石楠的化学成分及生物活性研究[D].北京:中国协和医科大学,2006.
Antioxidant Activity of Different Parts ofPhotiniaserrulataExtract//
Li Yan(Northwest A&F University, Yangling 712100, P. R. China); Zhang Zhihai(Fruit Industry Development Council of An’Sai County); Deng Kaihang, Zhang Huan, Liang Zongsuo(Northwest A&F University)//
Journal of Northeast Forestry University,2017,45(5):91-95.
To investigate the relationship between antioxidant activity with total proanthocyanidins (TOPC), total polyphenols (TP) and total flavonoids (TF) ofPhotiniaserrulataLindl., and inspect the influence of solvent against antioxidant activity, different parts were extracted by ultrasonic method with different solvent systems. The contents of TOPC, TF and TP were determined, the antioxidant activity was evaluated with the scavenging rates of DPPH, ABTS free radicals and FRAP, CUPRAC as indexes. The antioxidant activity has a significant difference between different parts ofP.serrulata, whereas branch phloem and infructescence stalk were more potent than the other parts due to their higher contents of TOPC, TP, and TF. There were significant differences among different solvents, which showed that TOPC was ranged from (10.77±0.08)% to (29.31±0.69)%, TF was ranged from (2.60±0.02)% to (7.02±0.01)%, TP was ranged from (3.15±0.02)% to (6.42±0.07)% for branch phloem, 85% methanol was best for TOPC, and 70% acetone was best for TP and TF. A significant linear correlation (P<0.01) between TOPC, TF, TP and antioxidant activity indicated that TOPC, TP and TF were jointly responsible for their antioxidant activity.
PhotiniaserrulataLindl.; Total proanthocyanidins; Total flavonoids; Total polyphenols; Antioxidant activity
1)国家“十二五”科技支撑计划项目(2015BAC01B03)。
李彦,女,1992年5月生,西北农林科技大学生命科学学院,硕士研究生。E-mail:18710440348@163.com。
梁宗锁,西北农林科技大学生命科学学院,教授。E-mail:liangzs@ms.iswc.ac.cn。
2016年11月22日。
S718.43
责任编辑:程 红。

