雷公藤化学成分及其热稳定性研究
刘建群, 伍秋珊, 余昭芬
(江西中医药大学 现代中药制剂教育部重点实验室, 江西 南昌 330004)
雷公藤化学成分及其热稳定性研究

LIU Jianqun
刘建群, 伍秋珊, 余昭芬
(江西中医药大学 现代中药制剂教育部重点实验室, 江西 南昌 330004)
从雷公藤(TripterygiumwilfordiiHook. f.) 的根中分离得到7个化合物,经1H NMR、13C NMR 和MS鉴定为β-谷甾醇(1)、 丁香醛(2)、雷公藤乙素(3)、3-羟基-1-(4-羟基-3-甲氧基苯基)丙酮(4) 、5,5′-二甲氧基落叶松脂素(5) 、新刺五加酚(6)和16-羟基山海棠酸-18-O-β-D-葡萄糖苷(7)。其中化合物2、4、5和6 为首次从雷公藤属植物中分离得到。采用热重和差热分析技术研究了雷公藤乙素(3)、新刺五加酚(6)以及雷公藤活性成分雷公藤内酯甲和去甲泽拉木醛的热稳定性。结果表明:雷公藤乙素、新刺五加酚、雷公藤内酯甲和去甲泽拉木醛的热分解温度均大于200 ℃。结果可为雷公藤质量标准以及雷公藤煨制机理研究奠定基础。
雷公藤;化学成分;热稳定性
类风湿性关节炎是严重危害人们健康的重大疾病之一,素有“不死的癌症”之说[1]。中药雷公藤(TripterygiumwilfordiiHook. f.)对于治疗类风湿性关节炎等自身免疫功能亢进性疾病具有良好的疗效[2]。目前,雷公藤类药品有雷公藤片、雷公藤总萜片、雷公藤多苷片、雷公藤内酯软膏等品种。雷公藤毒性很大,是近年来毒副作用和不良反应报道最多的中药,主要对肝、肾、心、消化系统和生殖系统等产生毒性[3]。雷公藤的主要有效成分有二萜、生物碱、三萜和木脂素类等[4-7]。二萜类成分如雷公藤甲素,生物碱类成分如雷公藤次碱,三萜类成分如雷公藤内酯甲,木脂素类成分如5′-甲氧基(-)松脂素等。雷公藤中上述有效成分多数也是其主要毒性成分,如雷公藤甲素、雷公藤内酯酮和雷公藤红素[8-10]。研究发现,雷公藤经200 ℃煨法炮制后可显著降低毒性并增强疗效[11-12]。为阐明雷公藤煨制减毒增效机理以及建立雷公藤质量标准奠定基础,本研究对雷公藤的化学成分进行了分析并对化合物结构进行了表征;因热分析过程与煨法炮制加热过程类似,故进一步采用热分析法研究了雷公藤4个活性成分的热稳定性,以期了解雷公藤有效成分在炮制过程中的变化规律,从而指导雷公藤的煨制。
1 实 验
1.1 材料
雷公藤的根,2014年10月采自江西省萍乡市,植物标本经鉴定为卫矛科雷公藤属植物雷公藤(TripterygiumwilfordiiHook. f.) 。
1.2 仪器与试剂
Bruker AVANCE III HD 600 MHz型核磁共振波谱仪,瑞士布鲁克公司;Agilent 1100型高效液相色谱仪,美国安捷伦公司;Agilent 1260型高效液相色谱仪,美国安捷伦公司;YMC-Actus ODS-AC18(250 mm×10 mm,5 μm)色谱柱,日本YMC公司;Diamonsil C18(250 mm×4.6 mm,5μm)色谱柱,北京迪马科技公司;中性氧化铝(粒径48~75 μm),上海国药集团化学试剂有限公司;硅胶(粒径48~75μm),青岛海洋化工厂分厂;薄层色谱硅胶板,青岛康鼎硅胶有限公司;Sephadex LH-20凝胶树脂、MCI GEL-CHP 20P树脂,日本三菱株式会社;雷公藤内酯甲和去甲泽拉木醛(结构式见图1),纯度≥98%,郑州丰耀农业科技有限公司;色谱纯甲醇,美国ACS公司;其余试剂均为分析纯。

图1 雷公藤内酯甲和去甲泽拉木醛的结构
1.3 提取与分离
雷公藤干燥根119 kg,切片后用95%乙醇400 L于70 ℃加热回流提取3次(1.5+1.5+1 h)。合并提取液,减压浓缩回收溶剂得浸膏12 kg。浸膏用乙酸乙酯溶解多次,合并乙酸乙酯溶液,减压浓缩回收溶剂得乙酸乙酯部位1.87 kg,乙酸乙酯不溶部位10.13 kg。乙酸乙酯部位经中性氧化铝柱层析(粒径48~75 μm ,22.5 kg),石油醚/乙酸乙酯(1 ∶0、4 ∶1、3 ∶2、2 ∶3,体积比)及乙酸乙酯/甲醇(1 ∶0、3 ∶1、1 ∶1、0 ∶1,体积比)梯度洗脱,得到8个流分(Fr.1~Fr.8)。Fr.2流分析出化合物1,乙酸乙酯重结晶纯化。将Fr.5和Fr.6流分合并得Fr.56(142.2 g),经MCI GEL-CHP 20P色谱柱分离,甲醇/水(0 ∶1、1 ∶3、1 ∶1、3 ∶1、1 ∶0,体积比)梯度洗脱,得到5个流分(Fr.56.1~Fr.56.5)。Fr.56.3流分(13.3 g)进一步经硅胶柱层析(粒径48~75 μm ,270 g),石油醚/乙酸乙酯(1 ∶0、7 ∶2、7 ∶4、1 ∶1、4 ∶7、2 ∶7,体积比)及乙酸乙酯/甲醇(1 ∶0、1 ∶1、0 ∶1,体积比)梯度洗脱,得9个流分(Fr.56.3.1~Fr.56.3.9)。Fr.56.3.2(27 mg)经制备HPLC分离(YMC-Actus ODS-AC18色谱柱,流动相:甲醇/水体积比28 ∶72,检测波长210 nm),得到化合物2(9 mg)。Fr.56.3.4流分析出化合物3,甲醇重结晶纯化。Fr.56.3.4(40 mg)经制备HPLC分离(YMC-Actus ODS-AC18色谱柱,流动相:甲醇/水体积比24 ∶76,检测波长210 nm),得化合物4(15mg)。Fr.56.3.5流分析出化合物5,甲醇重结晶纯化。Fr.56.3.6(500 mg)经制备HPLC分离(YMC-Actus ODS-AC18色谱柱,流动相:甲醇/水体积比27 ∶73,检测波长210 nm),得化合物6(80 mg)。Fr.7流分(15.6g)经MCI GEL-CHP 20P色谱柱分离,甲醇/水(0 ∶1、1 ∶9、3 ∶7、1 ∶1、7 ∶3、9 ∶1、1 ∶0,体积比)梯度洗脱,得7个流分(Fr.7.1~ Fr.7.7)。Fr.7.5经Sephadex LH-20凝胶柱分离,甲醇洗脱,得9个流分(Fr.7.5.1~Fr.7.5.9)。Fr.7.5.6(300 mg)经制备HPLC分离(YMC-Actus ODS-AC18色谱柱,流动相:甲醇/水体积比38 ∶62,检测波长210 nm),得化合物7(10 mg)。化合物1~7经HPLC测定质量分数均大于98%。
1.4 化合物1~7结构鉴定
采用1H NMR、13C NMR 和MS等方法对提取分离得到的化合物1~7进行结构鉴定,经与相关参考文献报道的波谱数据对比确定化合物结构。
1.5 热重和差热分析
热分析样品:化合物3、6、雷公藤内酯甲和去甲泽拉木醛。称取样品约3 mg,于N2气氛,流速10 mL/min,温度范围25~800 ℃,记录升温速率条5 ℃/min件下,样品的热重(TG)、微商热重(DTG)和差热(DTA)变化曲线。
2 结果与分析
2.1 结构鉴定
化合物1:白色针晶(丙酮),熔点140~142 ℃;ESI-MSm/z:[M+H]+415,分子式C29H50O。1H NMR(300 MHz,CD3COCD3)δH:5.32(1H,d,J=4.9 Hz,H- 6),3.40(1H,m,H-3),0.74(3H,s,H-18),1.03(3H,s,H-19),0.98(3H,d,J=6.4 Hz,H-21),0.89(3H,d,J=7.3 Hz,H-26),0.85(3H,d,J=6.2 Hz,H-27),0.86(3H,d,J=6.2 Hz,H-29)。13C NMR(75 MHz,CD3COCD3)δC:38.3(C-1),32.6(C-2),71.7(C-3),43.4(C- 4),142.4(C-5),121.6(C- 6),32.6(C-7),32.8(C- 8),51.2(C-9),37.3(C-10),21.8(C-11),40.7(C-12),43.0(C-13),57.7(C-14),25.0(C-15),29.0(C-16),57.0(C-17),12.3(C-18),19.4(C-19),37.0(C-20),19.2(C-21),34.7(C-22),26.8(C-23),46.7(C-24),29.9(C-25),19.8(C-26),20.1(C-27),23.8(C-28),12.3(C-29)。以上波谱数据与文献[13]基本一致,确定化合物1为β-谷甾醇。
化合物2:白色粉末(甲醇),熔点114~115 ℃;ESI-MSm/z:[M-H]-181,分子式C9H10O4。1H NMR(600MHz,CD3OD)δH:7.20(2H,s,H-2,H- 6),3.89(6H,s,2CH3),9.71(1H,s,CHO)。13C NMR(150MHz,CD3OD)δC:128.9(C-1),108.4(C-2,C- 6),149.9(C-3,C-5),144.7(C- 4),193.0(CHO),56.9(2CH3)。以上波谱数据与文献[14]基本一致,确定化合物2为丁香醛。
化合物3:白色针晶(丙酮),熔点211~212 ℃;ESI-MSm/z:[M+H]+377,分子式C20H24O7。1H NMR(500 MHz,CD3COCD3)δH:1.71(1H,dd,J=13.6,1.0 Hz,H-1a),1.57(1H,dd,J=13.6,5.4 Hz,H-1b),4.50(1H,t,J=5.0 Hz,W1/2=10.2 Hz,H-2),2.76(1H,s,H-5),2.69(1H,ddd,J=13.0,6.2,1.1Hz,H- 6a),2.37(1H,dt,J=13.0,6.0Hz,H- 6b),3.39(1H,m,H-7),4.03(1H,d,J=3.2 Hz,H-11),3.58(1H,d,J=3.2 Hz,H-12),3.40(1H,d,J=9.6 Hz,H-14),2.19(1H,m,J=7.0 Hz,H-15),0.98(3H,d,J=7.0 Hz,H-16),0.86(3H,d,J=7.0 Hz,H-17),4.87(2H,d,J=1.6 Hz,H-19),1.30(3H,s,H-20),4.07(1H,d,J=4.8 Hz,OH-2),3.18(1H,d,J=9.6 Hz,OH-14)。13C NMR(125 MHz,CD3COCD3)δC:40.0(C-1),59.8(C-2),127.1(C-3),163.9(C- 4),41.7(C-5),23.7(C- 6),60.8(C-7),61.8(C- 8),66.8(C-9),36.6(C-10),58.0(C-11),55.3(C-12),66.0(C-13),74.0(C-14),29.2(C-15),18.1(C-16),17.2(C-17),173.0(C-18),70.4(C-19),16.0(C-20)。以上波谱数据与文献[15]基本一致,确定化合物3为雷公藤乙素。
化合物4:白色粉末(甲醇),熔点111~113 ℃;ESI-MSm/z:[M-H]-195,分子式C10H12O4。1H NMR(600 MHz,CD3OD)δH:7.52(1H,d,J=1.4 Hz,H-2),6.83(1H,d,J=8.3 Hz,H-5),7.56(1H,dd,J=8.3,1.4 Hz,H- 6),3.14(2H,t,J=6.2 Hz,H- 8),3.92(2H,t,J=6.2 Hz,H-9),3.88(3H,s,OCH3)。13C NMR(150 MHz,CD3OD)δC:131.0(C-1),111.9(C-2),149.5(C-3),154.5(C- 4),116.2(C-5),125.1(C- 6),199.8(C-7),41.8(C- 8),59.1(C-9),56.5(OCH3)。以上波谱数据与文献[16]基本一致,确定化合物4为3-羟基-1-(4-羟基-3-甲氧基苯基)丙酮。
化合物5:白色颗粒(丙酮),熔点158~159 ℃;ESI-MSm/z:[M-H]-419,分子式C22H28O8。1H NMR(500 MHz,CD3COCD3)δH:6.52(2H,s,H-2,H- 6),2.95(1H,dd,J=13.4,4.9Hz,H-7a),2.53(1H,dd,J=13.4,11.0 Hz,H-7b),2.33(1H,m,H- 8),3.97(1H,dd,J=8.2,6.7 Hz,H-9a),3.87(1H,m,H-9b),6.65(2H,s,H-2′,H- 6′),4.80(H,d,J=6.0 Hz,H-7′),2.72(1H,m,H- 8′),3.73(2H,m,H-9′),3.80(12H,s,OCH3-3,OCH3-5,OCH3- 3′,OCH3-5′),3.73(1H,m,OH-9′),6.88(1H,s,OH- 4),6.96(1H,s,OH- 4′)。13C NMR(125 MHz,CD3COCD3)δC:135.9(C-1),107.1(C-2,C- 6),148.7(C-3,C-5),135.2(C- 4),34.1(C-7),43.4(C- 8),73.2(C-9),132.5(C-1′),104.3(C-2′,C- 6′),148.6(C-3′,C-5′),135.7(C- 4′),83.5(C-7′),54.0(C- 8′),60.6(C-9′),56.7(OCH3-3,OCH3-5,OCH3-3′,OCH3-5′)。以上波谱数据与文献[17]基本一致,确定化合物5为5,5′-二甲氧基落叶松脂素。
化合物6:棕黄色粉末(甲醇),熔点188~189 ℃;ESI-MSm/z:[M-H]-401,分子式C22H26O7。1H NMR(600 MHz,CD3OD)δH:6.58(1H,s,H- 6),2.70(1H,dd,J=15.0,4.7 Hz,H-7a),2.57(1H,dd,J=15.0,11.5 Hz,H-7b),1.62(1H,m,H- 8),3.59(1H,dd,J=10.9,6.1 Hz,H-9a),3.49(1H,m,H-9b),6.38(2H,s,H-2′,H- 6′),4.31(1H,d,J=5.6 Hz,H-7′),1.96(1H,m,H- 8′),3.50(1H,m,H-9′),3.48(1H,m,H-9′),3.85(3H,s,OCH3-3),3.37(3H,s,OCH3-5),3.79(6H,s,OCH3-3′,OCH3-5′)。13C NMR(150MHz,CD3OD)δC:130.3(C-1),126.4(C-2),147.8(C-3),139(C- 4),148.8(C-5),107.9(C- 6),33.7(C-7),41(C- 8),66.9(C-9),139.4(C-1′),106.9(C-2′,C- 6′),149.1(C-3′,C-5′),134.6(C- 4′),42.4(C-7′),49.1(C- 8′),64.2(C-9′),60.3(OCH3-3),56.7(OCH3-5),56.9(OCH3-3′,OCH3-5′)。以上波谱数据与文献[18]基本一致,确定化合物6为新刺五加酚。
化合物7:棕黄色粉末(甲醇),熔点212~213 ℃;ESI-MSm/z:[M-H]-521,分子式C27H38O10。1H NMR(600 MHz,CD3OD)δH:3.22(1H,m,H-1a),2.67(1H,m,H-1b),2.55(1H,m,H-2a),2.34(1H,m,H-2b),2.23(1H,m,H-5),2.40(1H,m,H- 6a),1.55(1H,m,H- 6b),3.38(1H,m,H-7a),3.03(1H,dd,J=16.1,3.8 Hz,H-7b),6.44(1H,s,H-12),3.24(1H,m,H-15),3.85(1H,dd,J=12.1,2.0 Hz,H-16a),3.69(1H,dd,J=12.1,4.9 Hz,H-16b),1.18(3H,d,J=7 Hz,H-17),2.10(3H,d,J=1.4 Hz,H-19),1.16(3H,s,H-20),5.56(1H,d,J=8 Hz,H-1′),3.49(1H,dd,J=10.7,8.0 Hz,H-2′),3.63(1H,dd,J=10.7,6.4 Hz,H-3′),3.44(1H,dd,J=8.7,6.4 Hz,H- 4′),3.40(1H,m,H-5′),3.37(2H,m,H- 6′),3.66(3H,s,OCH3)。13C NMR(150 MHz,CD3OD)δC:33.5(C-1),26(C-2),125.8(C-3),150(C- 4),50.4(C-5),21.1(C- 6),27.6(C-7),131.8(C- 8),132.8(C-9),38.4(C-10),153.9(C-11),113(C-12),136(C-13),150.3(C-14),35.8(C-15),68.8(C-16),18.7(C-17),169.4(C-18),19(C-19),18.4(C-20),95.7(C-1′),74.2(C-2′),79(C-3′),71.2(C- 4′),78.4(C-5′),62.5(C- 6′),61.4(OCH3)。以上波谱数据与文献[19]基本一致,确定化合物7为16-羟基山海棠酸-18-O-β-D-葡萄糖苷。
化合物1~7的结构见图2。
2.2 化合物热分解行为
2.2.1 雷公藤乙素热分解行为 雷公藤乙素(化合物3)为环氧二萜类化合物,结构式见图2,其TG、DTG和DTA曲线见图3(a)。从TG 曲线可以看出雷公藤乙素有一个主要失重平台,从200 ℃到400 ℃,失重率约为58%。DTG 曲线出现277和334 ℃两个主要热失重峰,334 ℃峰失重速率最大,为雷公藤乙素热分解反应最快失重峰。DTA曲线出现228 ℃吸热峰,为熔融峰。从图3(a)可知,在200 ℃加热条件下,雷公藤乙素基本不发生变化。
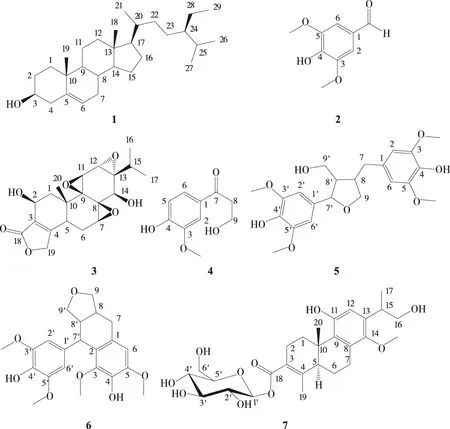
图2 化合物1~7的结构
2.2.2 新刺五加酚热分解行为 新刺五加酚(化合物6)为木脂素类化合物,结构式见图2,其TG、DTG和DTA曲线见图3(b)。从TG 曲线可以看出新刺五加酚的热分解基本为一步完成,从100 ℃到350 ℃,失重率约为78%。DTG 曲线330 ℃峰失重速率最大,此时热分解反应最快。DTA曲线出现188 ℃吸热峰,为熔点。从图3(b)可知,在200 ℃加热条件下,新刺五加酚较稳定。
2.2.3 雷公藤内酯甲热分解行为 雷公藤内酯甲为三萜类化合物,结构式见图1,其TG、DTG和DTA曲线见图3(c)。从TG 曲线可以看出新刺五加酚的热分解有一个主要失重平台,从270 ℃到410 ℃,失重率约为92%。DTG 曲线398 ℃峰失重速率最大。DTA曲线出现3个吸热峰,分别为309、322和399 ℃。从图3(c)可知,在200 ℃加热条件下,雷公藤内酯甲较稳定。
2.2.4 去甲泽拉木醛热分解行为 去甲泽拉木醛为三萜类化合物,结构式见图1,其TG、DTG和DTA曲线见图3(d)。从TG 曲线可以看出去甲泽拉木醛的失重平台有2个,都不明显。DTG曲线有2个主要热失重峰,为291和418 ℃。DTA曲线在291℃有一个不明显吸热峰。从图3(d)可知,在200 ℃加热条件下,去甲泽拉木醛较稳定。
3 结 论
从雷公藤(TripterygiumwilfordiiHook. f.)的根中分离得到7个化合物,经1H NMR、13CNMR和MS等分析鉴定为β-谷甾醇(1)、丁香醛(2)、雷公藤乙素(3)、3-羟基-1-(4-羟基-3-甲氧基苯基)丙酮(4)、5,5′-二甲氧基落叶松脂素(5)、新刺五加酚(6)和16-羟基山海棠酸-18-O-β-D-葡萄糖苷(7)。其中化合物2、4、5和6为首次从雷公藤属植物中分离得到。经TG、DTG和DTA分析表明,雷公藤乙素(3)、新刺五加酚(6)、雷公藤内酯甲和去甲泽拉木醛的热分解温度均大于200 ℃。结果可为雷公藤质量标准以及雷公藤煨制机理研究奠定基础。

图3 雷公藤活性成分热分析图
[1]熊雪婷,许碧莲.Wnt信号通路在类风湿性关节炎发病机制中的研究进展[J].中国药理学通报,2014,30(1):13-16. XIONG X T,XU B L.Research progress of Wnt signaling pathway in pathogenesis of rheumatoid arthritis[J].Chinese Pharmacological Bulletin,2014,30(1):13-16.
[2]万欢.中西药物治疗类风湿性关节炎的研究进展[J].实用心脑肺血管病杂志,2010,18(9):1379-1381. WAN H.Research progress of traditional Chinese and western medicine in rheumatoid arthritis[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2010,18(9):1379-1381.
[3]郭艳红,谭垦.雷公藤的毒性及其研究概况[J].中药材,2007,30(1):112-117. GUO Y H,TAN K.Toxicity and research survey ofTripterygiumwilfordiiHook[J].Journal of Chinese Medicinal Materials,2007,30(1):112-117.
[4]李建友,夏素霞,宋少江.雷公藤二萜类化学成分及在研新药的研究进展[J].沈阳药科大学学报,2012,29(11):901-908. LI J Y,XIA S X,SONG S J.Research progress of diterpenoids fromTripterygiumand the study on new drugs[J].Journal of Shenyang Pharmaceutical University,2012,29(11):901-908.
[5]张茹萍,何昱,石森林,等.雷公藤药材中6种有效成分以及总二萜内酯、总生物碱、总三萜的含量测定[J].中华中医药杂志,2013,28(1):224-229. ZHANG R P,HE Y,SHI S L,et al.Determination of six effective components,total diterpenoids,total alkaloids and total triterpenes inTripterygiumwilfordiiHook.f[J].China Journal of Traditional Chinese Medicine and Pharmacy,2013,28(1):224-229.
[6]田洋,郝淑娟,马跃平,等.雷公藤根化学成分的分离与鉴定[J].沈阳药科大学学报,2010,27(9):715-718,723. TIAN Y,HAO S J,MA Y P,et al.Isolation and identification of chemical constituents of roots ofTripterygiumwilfordiiHook.f[J].Journal of Shenyang Pharmaceutical University,2010,27(9):715-718,723.
[7]林绥,李援朝,刘子皎,等.雷公藤中木脂素类成分的研究[J].中国药学杂志,2000,35(4):15-16. LIN S,LI Y C,LIU Z J,et al.Studies on lignans constituents ofTripterygiumwilfordine[J].Chinese Pharmaceutical Journal,2000,35(4):15-16.
[8]刘泽洲,许可嘉,张天娇,等.雷公藤甲素诱导小鼠急性肝损伤的形态学研究[J].现代生物医学进展,2015,15(17):3207-3211. LIU Z Z,XU K J,ZHANG T J,et al.The morphological study on acute liver injury of mice induced by triptolide[J].Progress in Modern Biomedicine,2015,15(17):3207-3211.
[9]李春杏,李太生,朱珠,等.雷公藤抗炎免疫调节活性单体的研究进展[J].中国中药杂志,2014,39(21):4159-4164. LI C X,LI T S,ZHU Z,et al.Advance in studies on anti-inflammatory and immunoregulatory monomers ofTripterygiumwilfordii[J].China Journal of Chinese Materia Medica,2014,39(21):4159-4164.
[10]许羚,胡玥,丁晓霜,等.雷公藤红素体内与体外急性毒性试验结果的比较[J].环境与职业医学,2015,32(6):535-538,548. XU L, HU Y,DING X S,et al.Comparison on acute toxicity of celastrol derived frominvivoandinvitro[J].Journal of Environmental & Occupational Medicine,2015,32(6):535-538,548.
[11]刘建群,张国华,高俊博.烘箱煨制雷公藤药效毒性及成分变化研究[J].亚太传统医药,2015,11(10):7-9. LIU J Q,ZHANG G H,GAO J B.Effect of oven heating processing on toxicity,efficacy and constituents ofTripteryginumwilfordii[J].Asia-Pacific Traditional Medicine,2015,11(10):7-9.
[12]刘建群,张国华,高俊博.一种雷公藤的炮制方法:CN104306426A[P].2015-01-28. LIU J Q,ZHANG G H,GAO J B.A processing method ofTripteryginumwilfordii:CN104306426A[P].2015-01-28.
[13]LEE S J,KIM H M,LEE J M,et al.Artemisterol,a new steryl ester from the whole plant ofArtemisiaapiacea[J].Journal of Asian Natural Products Research,2008,10(4):281-283.
[14]张怡评,韩顺风,方华,等.互花米草化学成分研究[J].中国海洋药物,2016,35(1):55-59. ZHANG Y P,HAN S F,FANG H,et al.Study on the chemical constituents ofSpartinaalterniflora Loisel[J].Chinese Journal of Marine Drugs,2016,35(1):55-59.
[15]林绥,于贤勇,阙慧卿,等.雷公藤中的二萜内酯类成分[J].药学学报,2005,40(7):632-635. LIN S,YU X Y,QUE H Q,et al.Diterpenes consitutents ofTripteryginumwilfordii[J].Acta Pharmaceutica Sinica,2005,40(7):632-635.
[16]罗川,张万年,杨美灵.米邦塔仙人掌化学成分研究[J].天然产物研究与开发,2011,23(6):1038-1040. LUO C,ZHANG W N,YANG M L.Chemical constituents ofOpuntiamilpaAlta Haw[J].Natural Product Research and Development,2011,23(6):1038-1040.
[17]YUASA K,IDE T,OTSUKI H,et al.Lignan and neolignan glycosides from stems ofAlangiumpremnifolium[J].Phytochemistry,1997,45(3):611-615.
[18]吴立军,阮丽军,郑健,等.刺五加茎叶化学成分研究[J].药学学报,1999,34(11):839-841. WU L J,RUAN L J,ZHENG J,et al.Studies on chemical constituents fromAcanthopanaxsenticosus(Rupr.ETMASIM) Harms[J].Acta Pharmaceutica Sinica,1999,34(11):839-841.
[19]LI H M,WAN D W,LI R T.New abietane-type diterpene glycosides from the roots ofTripterygiumwilfordii[J]. Journal of Asian Natural Products Research,2015,17(7):761-766.
Chemical Constituents fromTripterygiumwilfordiiHook. f.and Their Thermal Stability
LIU Jianqun, WU Qiushan, YU Zhaofen
(Key Laboratory of Modern Preparation of TCM,Ministry of Education,Jiangxi University of Traditional Chinese Medicine,Nanchang 330004,China)
Seven compounds were isolated from the radix ofTripterygiumwilfordiiHook. f.. Their structures were identified asβ-sitosterol(1),syringaldehyde(2),tripdiolide(3),β-hydroxypropiovanillone(4),5,5′-dimethoxylariciresinol(5),neociwujiaphenol (6) and wilfordoside A(7). Compounds 2,4,5 and 6 were isolated from genus ofT.wilfordiifor the first time. Thermal decomposing curves of compounds 3,6,wilforlide A and demethylzeylasteral were obtained in the nitrogen atmosphere by TG-DTG and DTA techniques. The results indicated that the four tested compounds should be stable under 200 ℃. This study could lay a foundation for the quality standard and roasting mechanism ofT.wilfordii.
Tripterygiumwilfordii;chemical constituent;thermal stability
10.3969/j.issn.0253-2417.2017.02.009
2016- 05-30
江西省教育厅科技重点项目(GJJ150832);江西省自然科学基金项目(20151BAB205075)
刘建群(1970— ),男,江西萍乡人,教授,博士,主要从事中药药效物质基础及质量评价研究; E-mail:liu5308@sina.com。
TQ35
A
0253-2417(2017)02- 0072- 07
刘建群,伍秋珊,余昭芬.雷公藤化学成分及其热稳定性研究[J].林产化学与工业,2017,37(2):72-78.

