白粉虱对不同黄瓜材料防御性酶基因相对表达量的影响
谷停停+王艳廷+许建鹏+李田田+刘永月+姜文芝+孙亚玲+杨亚会+曹辰兴


摘要:以本课题组筛选的4个黄瓜自交系(4号、13号、19号、76号)为试材,以不抗白粉虱的大青把黄瓜材料为对照,探讨了不同黄瓜材料接种白粉虱后防御性酶基因相对表达量的变化。结果表明,接种白粉虱后各黄瓜材料5种防御性酶(PPO、HPL、LOX、SOD、APX)基因相对表达量变化差异较大,白粉虱抗性从高到低排序为13号、4号、19号、76号、大青把。因此,13号是下一步培育抗白粉虱黄瓜新品种的首选材料。
关键词:黄瓜;白粉虱;防御性酶基因
中图分类号:S642.2:Q784文献标识号:A文章编号:1001-4942(2017)05-0039-07
Effects of Trialeurodes vaporariorum on Gene Relative Expression
Levels of Defensive Enzymes in Different Cucumber Materials
Gu Tingting, Wang Yanting, Xu Jianpeng, Li Tiantian, Liu Yongyue,
Jiang Wenzhi, Sun Yaling, Yang Yahui, Cao Chenxing
(College of Horticulture Science and Engineering, Shandong Agricultural University/
State Key Laboratory of Crop Biology, Taian 271018, China)
AbstractUsing four cucumber inbred lines (No. 4, 13, 19, 76) as test materials, and the Daqingba cucumber material which was not resistant to Trialeurodes vaporariorum as control, the changes of gene relative expression levels of defensive enzymes were studied before and after inoculation of Trialeurodes vaporariorum. The results showed that five kinds of defensive enzymes of each cucumber material presented obvious gene relative expression level changes after inoculation. The resistance to Trialeurodes vaporariorum showed the descending order as No.13, No.4, No.19, No.76 and Daqingba. So No.13 was the key material to breed new cucumber varieties resistant to Trialeurodes vaporariorum.
KeywordsCucumber; Trialeurodes vaporariorum; Defensive enzyme genes
黃瓜(Cucumis sativus L.)是重要的蔬菜作物之一,被称为世界性蔬菜[1-3]。然而,随着种植面积不断扩大和集约化程度不断提升,黄瓜病虫害的发生越发严重[4],尤其以白粉虱危害最为常见,严重影响黄瓜产量和品质[5]。而以化学防治为主的防治措施给黄瓜集约化、规模化生产造成了巨大的负面影响。因此,培育抗白粉虱黄瓜新品种就显得尤为重要,其中,研究其抗性机理是育种的前提和关键。
酶是具有生物催化功能的高分子物质,几乎所有细胞活动进程都离不开相关酶的参与,诸多研究也表明酶活性的高低与植物抗虫、抗逆性有密切关系[6-12]。如苯丙氨酸解氨酶(PAL)是苯丙烷类代谢途径的重要催化酶,是连接初级代谢和苯丙烷类代谢的关键酶和限速酶,其活性的高低与次生代谢速度和次生代谢产物如酚类、单宁、木质素、黄酮等积累相关,从而间接增强植物抗虫性[13,14];多酚氧化酶(PPO)可通过催化植物体内酚类物质氧化生成醌,使植物汁液对害虫具有毒害作用而提高植物抗性[15];脂氢过氧化物裂解酶(HPL)和脂加氧酶(LOX)可催化不饱和脂肪酸经过脂质生化代谢途径形成C6、C9的醛、醇、酯类绿叶挥发物质,从而提高植物抗逆性[16];而超氧化物歧化酶(SOD)可以通过清除超氧阴离子自由基反应生成H2O2,过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸氧化酶(APX)则又具有分解H2O2的能力。正是各种酶之间的彼此协调、相互作用, 使细胞内的活性氧物质(reactive oxygen species,ROS)保持在适当水平, 从而减轻ROS对植物造成的毒害,提高植物的抗逆能力[17]。另外,APX 还是AsA-GSH(抗坏血酸—谷胱甘肽)循环中的关键酶之一,与植物H2O2清除、抗衰老、抗病性及抗蚜性密切相关[18-21]。目前植物中关于各种酶与抗性关系的研究更多的集中于各相关酶的活性研究,对各种酶相关基因表达量方面的探讨并不多见,黄瓜白粉虱抗性响应研究方面更是至今未见报道。为此,本试验以本课题组筛选的4种对白粉虱具有抗性的黄瓜自交系(4号、13号、19号、76号)为试材,以不抗的大青把黄瓜材料为参照,分别测定了接种白粉虱后多酚氧化酶(PPO)、脂氢过氧化物裂解酶(HPL)、脂加氧酶(LOX)、超氧化物歧化酶(SOD)和抗坏血酸氧化酶(APX)5种防御性酶基因的相对表达量,探讨了不同黄瓜材料接种白粉虱后各防御性酶基因相对表达量的变化,旨在加强对黄瓜抗白粉虱机理的研究,进一步为抗白粉虱黄瓜材料的筛选、新品种的培育提供理论依据。
1材料与方法
1.1试材
试材为本课题组筛选出的4份抗白粉虱黄瓜自交系:4号、13号、19号、76号和1份感白粉虱材料:大青把。
供试白粉虱虫源采自山东农业大学园艺试验站9号日光温室内黄瓜植株,并在山东农业大学温室中笼罩盆栽黄瓜植株上连续饲养多代(扩大虫源)。
1.2试验设计
试验于2015年8月在山东农业大学园艺试验站9号日光温室中进行。选取颗粒饱满的黄瓜种子进行浸种催芽处理,然后播种于塑料育苗钵(直径10 cm,高8 cm)内,每育苗钵1株,生长至三叶一心时每份材料选取生长健壮、长势一致的20株黄瓜幼苗,每株接种温室白粉虱60头,接种后每株用自制80目防虫网隔开。
1.3样品采集
接种白粉虱后,于第0、1、3、5、7 d取整片叶片,立即用铝箔纸包好放入液氮罐中,并迅速带回实验室置于-40℃超低温冰箱内保存。
1.4防御性酶基因相对表达量测定方法
1.4.1防御性酶基因序列确定首先在拟南芥基因库(http://www.arabido psis.org/)中查找苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、多酚氧化酶(PPO)、脂氢过氧化物裂解酶(HPL)、脂加氧酶(LOX)、超氧化物歧化酶(SOD)、抗坏血酸氧化酶(APX)7种酶的基因序列,然后在黄瓜基因库(http://cucumber.genomics. org.cn/page/ cucumber/index.jsp)中进行比对,比对出其中5种,分别为多酚氧化酶(PPO)、脂氢过氧化物裂解酶(HPL)、脂加氧酶(LOX)、超氧化物歧化酶(SOD)及抗坏血酸氧化酶(APX),具体为 PPO(CsPPO,Csa5M184820.1)、HPL(CsHPL,Csa7M041960.1)、LOX(CsLOX,Csa2M023850.1),SOD(CsSOD,Csa1M573600.2)和APX(CsAPX,Csa1M479610.2)。
1.4.2引物设计采用Beacon Designer 7软件,以5种酶相关基因序列为模板设计引物,具体见表1。
1.4.3相关基因的实时荧光定量分析采用TIANGEN RNAprep Pure Plant Kit(离心柱型)试剂盒提取黄瓜叶片RNA,操作严格按照说明书进行。采用TransGen Biotech公司生产的TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒合成cDNA,于-20℃保存备用。荧光定量PCR仪型号为Bio-Rad CFX96(USA),荧光定量PCR反应体系按SYBR Green PCR Master Mix说明书配制,每个样品设3个重复,反应体系和反应条件参考许海峰等[22]的方法。其中,以UBI为内参,每个基因扩增均有内参同时扩增,默认条件下读取Ct值,采用2-ΔΔCT方法分析[23]:△△CT=(CT,Target-CT,UBI)(待测样本)-(CT,Target-CT,UBI)(校准样本)。
1.5数据处理
试验数据为3次重复平均值,用Microsoft Excel 2010和DPS 7.05软件进行统计分析,用邓肯氏法进行多重比较。
2结果与分析
2.1大青把黄瓜材料接种白粉虱后5种酶基因相对表达量的变化
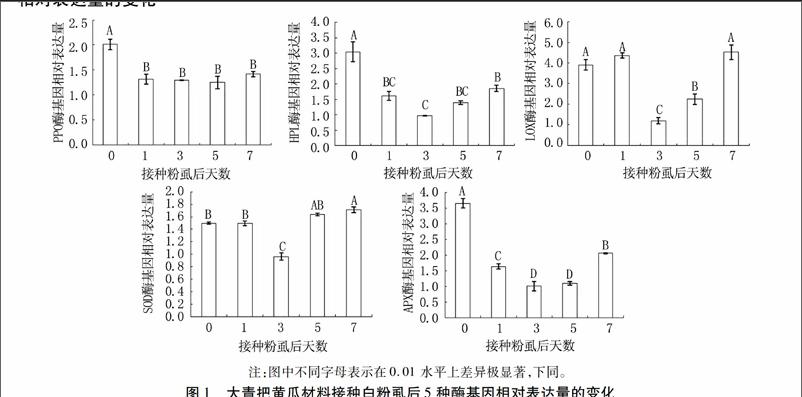
不抗白粉虱大青把黄瓜材料接种白粉虱后5种酶基因相对表达量测定结果见图1。可以看出,各种酶基因相对表达量对白粉虱侵害的反应不同。接种1 d后LOX、SOD酶基因相对表达量无明显变化,而PPO、HPL、APX三种酶基因迅速做出反应,其表达量极显著降低。接种3 d后,5种酶基因相对表达量均极显著低于接种前水平。随后PPO酶基因表达量一直维持在较低水平;HPL、APX酶基因表达量虽然显著回升,但接种7 d后仍极显著低于接种前水平;LOX酶基因相对表达量恢复到接种前水平;仅SOD酶基因相对表达量在接种7 d后超过接种前水平。这表明大青把黄瓜材料对白粉虱的侵害未做出有利反应,即未增加能产生阻止昆虫接近的挥发性物质相关酶(HPL、LOX)基因相对表达量,又未增加产生对虫害有毒害作用的次生代谢物相关的酶(PPO)基因相对表达量,对消除逆境环境的酶(APX)基因表达量也产生了不利的影响,对能消除逆境伤害的酶(SOD)基因表达量也是到白粉虱侵害7 d后才明显升高。这些结果均说明大青把黄瓜材料对白粉虱侵害无积极反应,因而不抗白粉虱。
2.24号黄瓜材料接种白粉虱后5种酶基因相对表达量的变化
4号黄瓜材料接种白粉虱后5种酶基因相对表达量测定结果见图2。可知,5種酶基因相对表达量在接种白粉虱后第1 d均极显著高于接种白粉虱前,而在第3 d普遍下降,在第5~7 d,PPO、HPL、LOX、SOD酶基因相对表达量又上升,总体各种酶基因相对表达量的变化趋势为先上升后下降再上升趋势。除APX酶基因外,接种白粉虱后1~7 d PPO、HPL、LOX、SOD酶基因平均相对表达量均高于接种白粉虱前,为接种白粉虱前的1.33、1.88、4.43、1.29倍(均值)。
与对照大青把相比,4号黄瓜材料5种酶基因相对表达量在接种白粉虱1~7 d,除APX外均高于接种前,其中,在接种1 d后表达量差异均达到极显著水平,可见4号黄瓜材料对白粉虱的侵害非常敏感,反应迅速,能及时合成大量的次生代谢物质,从而阻止或者减缓白粉虱的进一步侵害,并对白粉虱的危害进行及时地修复。
2.313号黄瓜材料接种白粉虱后5种酶基因相对表达量的变化
13号黄瓜材料接种白粉虱后5种酶基因相对表达量测定结果见图3。可知,接种白粉虱后5种酶基因相对表达量总体为上升-下降-上升的趋势,其中,接种白粉虱1 d后PPO、HPL、LOX、SOD极显著高于接种白粉虱前,而在第3 d又普遍下降,但仍高于接种前水平。接种1~7 d PPO、HPL、LOX、SOD、APX酶基因相对表达量均高于接种前,差异多数达到极显著水平,平均为接种前的1.52、1.96、4.09、1.62、1.05倍。
同对照大青把相比,5种酶基因相对表达量均对白粉虱的侵害有明显的积极响应,13号黄瓜材料对白粉虱的侵害极为敏感,比4号黄瓜材料敏感性更强。
2.419号黄瓜材料接种白粉虱后5种酶基因相对表达量的变化
19号黄瓜材料接种白粉虱后5种酶基因相对表达量测定结果见图4。可知,接种白粉虱后除APX外,PPO、HPL、LOX、SOD 4种酶基因相对表达量总体为上升-下降-上升的趋势,其中PPO表达量接种前后变化不明显,HPL、LOX、SOD表达量接种白粉虱1 d后都极显著高于接种白粉虱前,在接种3~5 d内只有HPL酶基因表达量较接种前高,而APX表达量在接种白粉虱后1~7 d内均极显著低于接种前。
由上可知,5种酶中只有HPL、LOX、SOD 3种酶基因对白粉虱的侵害有比较明显的响应,可见19号黄瓜材料对白粉虱的侵害敏感性一般,比4号、13号材料弱。
2.576号黄瓜材料接种白粉虱后5种酶基因相对表达量的变化
76号黄瓜材料接种白粉虱后5种酶基因相对表达量测定结果见图5。可知,接种白粉虱1 d后LOX表达量与接种前相比极显著增加,PPO、HPL、SOD 3种酶基因相对表达量有所增加,但差异不显著,而APX表达量极显著降低,第3 d才极显著高于接种前;在接种后5~7 d,除SOD明显增加外,PPO、LOX酶基因表达量与接种前一致,而HPL、APX酶基因表达量变化规律不明显。
由上可知,5种酶基因表达量变化对白粉虱侵害响应不明显,可见76号黄瓜材料对白粉虱的侵害敏感性较差,仅比对照大青把反应强一些。
综上对5个黄瓜材料接种白粉虱后5种酶基因相对表达量的测定结果可知,白粉虱抗性能力排序为13号>4号>19号>76号>对照。因此,13号为进一步重点培育的抗白粉虱黄瓜新材料。
3讨论与结论
研究表明,同种寄主植物的不同品种如烟草、番茄、辣椒、豇豆等对白粉虱的抗性不同[24-27],这与植株叶片内防御性酶活性变化有密切联系[28,29]。孔海龙等[28]研究发现,烟粉虱成虫侵害导致辣椒叶片内POD、SOD防御酶活性上升,而且品种抗性越强,上升幅度越大;陈奕磊等[29]研究表明,烟粉虱侵害番茄不同品种后,落虫量多的防御酶活性变化显著,落虫量少的防御酶活性变化不显著;王涛等[30]对不同黄瓜材料白粉虱侵害后研究发现,POD、PAL、PPO 等酶的活性普遍升高,并認为三种酶活性的增强与无毛黄瓜突变体对白粉虱的抗性紧密相关。本研究对5个黄瓜材料接种白粉虱后5种酶基因相对表达量的研究发现,4号、13号、19号多数酶表达量在接种白粉虱1 d后就极显著增加,1~7 d总体为上升-下降-上升的变化趋势。其中,4号黄瓜材料除APX外,接种白粉虱后1~7 d PPO、HPL、LOX、SOD酶基因平均相对表达量均高于接种白粉虱前;13号接种1~7 d PPO、HPL、LOX、SOD、APX 5种酶基因相对表达量均高于接种前,差异多数达到极显著水平;但19号5种酶中只有HPL、LOX、SOD 3种酶基因对白粉虱的侵害有较明显的响应;而76号接种白粉虱1 d后仅有LOX表达量与接种前相比极显著增加,PPO、HPL、SOD 3种酶基因相对表达量增加不显著,APX表达量却极显著降低,在接种5~7 d后,PPO、HPL、LOX、APX 4种酶基因表达量变化规律不明显,总体与接种前相比为降低;对照材料接种1~7 d发现,总体上,与接种前相比PPO、HPL、LOX、APX等酶基因相对表达量均为下降。综合分析认为白粉虱抗性排序为13号>4号>19号>76号>对照,这与本课题组许建鹏对这5种黄瓜材料抗白粉虱研究得到的PPO酶活性1~7 d变化趋势及各材料抗性顺序基本一致[31]。对于更深入的抗性机理有待借助分子生物学、基因克隆等手段进一步深入研究,以期为黄瓜抗白粉虱育种提供更加深入可靠的理论指导和理论支撑。
参考文献:
[1]王涛.温室白粉虱危害对无毛黄瓜次生代谢的影响[D].泰安:山东农业大学,2011.
[2]马荣金.黄瓜抗蚜材料筛选及其抗蚜机理的研究[D]. 泰安:山东农业大学,2015.
[3]马荣金,李田田,刘桂军,等.不同黄瓜材料抗蚜性与部分次生代谢物及其相关酶活力的关系[J].中国农学通报,2015,31(19):80-86.
[4]石勇强,惠伟,陈川,等.国内温室白粉虱的生物学习性与防治研究综述[J].陕西农业科学,2002(9):19-22.
[5]李家旺,凌云昕,王继洲.黄瓜栽培科技示范户手册[M].北京:中国农业出版社,2008:259-261.
[6]Mohammadi M, Kazemi H. Changes in peroxidase and polyphenol oxidase activities in susceptible and resistant wheat heads inoculated with Fusarium graminearum and induced resistance[J].Plant Science,2002,162(4):491-498.
[7]Mondal A, Dutta S, Nandi S, et al. Changes in defence-related enzymes in rice responding to challenges by Rhizoctonia solani[J].Archives of Phytopathology & Plant Protection,2012,45(15):1-12.
[8]袁庆华,桂枝,张文淑.苜蓿抗感褐斑病品种内超氧化物歧化酶、过氧化物酶和多酚氧化酶活性的比较[J].草业学报,2002,11(2):100-104.
[9]秦秋菊,高希武.昆虫取食诱导的植物防御反应[J].昆虫学报,2005,48(1): 125-134.
[10]宋瑞芳,丁永乐,宫长荣,等.烟草抗病性与防御酶活性间的关系研究进展[J].中国农学通报,2007,23(5):309-314.
[11]谭永安,柏立新,肖留斌,等.绿盲蝽危害对棉花防御性酶活性及丙二醛含量的诱导[J].棉花学报,2010,22(5):479-485.
[12]王西存,于毅,周洪旭,等.苹果绵蚜对不同苹果品种春梢生长期生理指标的影响[J].生态学报,2012,32(7):2075-2081.
[13]Mauchmani B, Slusarenko A J. Production of salicylic acid precursors is a major function of phenylalanine ammonia-lyase in the resistance of arabidopsis to peronospora parasitica[J].Plant Cell,1996,8(2):203-212.
[14]王敬文,薛应龙.植物苯丙氨酸解氨酶的研究—Ⅲ.玉米小斑病菌Helminthosporium maydis T 小种和大斑病菌Helminthosporium turcicum毒素对苯丙氨酸解氨酶(PAL)的刺激作用[J].植物生理学报,1982,8(3):237-244.
[15]海蒂弗斯R,威廉斯P H.植物病理生理学[M].朱有红,宋佑衡,傅淑云,译.北京:中国农业出版社,1991:165-167.
[16]陈书霞,陈巧,王聪颖,等.绿叶挥发物代谢调控及分子机理研究进展[J].中国农业科学,2012,45(8):1545-1557.
[17]张金锋,薛庆中.稻飞虱为害胁迫对水稻植株内主要保护酶活性的影响[J].中国农业科学,2004,37(10):1487-1491.
[18]陈青,张银东.3种氧化酶与辣椒抗蚜性的相关性[J].热带作物学报,2004,25(3): 42-46.
[19]郭团玉,刘招龙.亚硒酸钠对梨叶片感染轮纹病菌后APX、SOD、GPX 和GR活性的影响[J].杭州师范学院学报(自然科学版),2007,6(1):47-50.
[20]徐健容,叶华智.抗坏血酸氧化酶与小麦抗赤霉病关系的研究[J].四川农业大学学报,1998,16(3): 319-321.
[21]余泽高,乔丽雅.小麦抗坏血酸氧化酶活性与抗病性关系的初步探讨[J].湖北农业科学,2003(1):31-33.
[22]許海峰,王楠,姜生辉,等.新疆红肉苹果杂种一代4个株系类黄酮含量比较及其合成相关基因表达分析[J].中国农业科学, 2016,49(16):3174-3187.
[23] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method[J].METHODS, 2001,25:402-408.
[24]王艳秋,林华峰,金鹏,等.Q型烟粉虱对20个烟草品种的选择性[J].植物保护,2016,42(2):84-88.
[25]胡荣利,乔辰云,孔海龙,等.Q型烟粉虱对不同番茄品种的适生性[J].植物保护学报,2015,42(5):734-740.
[26]吕敏,吴琳,苏建坤,等.Q型烟粉虱为害对不同辣椒品种叶绿素及营养物质的影响[J].江苏农业学报,2014,30(6):1316-1320.
[27]杜予州,孙伟,张莉,等.B型烟粉虱对不同豇豆品种的选择及适生性研究[J].中国农业科学,2006,39(12):2498-2504.
[28]孔海龙,吕敏,吴琳,等.Q型烟粉虱为害对不同品种辣椒保护酶活性及次生物质含量的影响[J].应用昆虫学报,2014,51(6):1553-1560.
[29]陈奕磊,崔旭红,蔡冲,等.B型烟粉虱对番茄不同品种光合特征和防御酶活性的影响[J].中国农业科学,2011,44(17):3547-3556.
[30]王涛,雷关红,曹辰兴,等.温室白粉虱对无毛黄瓜叶片PAL、PPO、POD活性的影响[J].山东农业科学,2011,43(9): 84-87.
[31]许建鹏.黄瓜抗粉虱材料筛选及其对烟粉虱抗性机理的研究[D].泰安:山东农业大学,2016.

