肺胸区上皮样血管内皮瘤2例临床病理观察
张 娜,王志敢,朱德茂,赵 林,罗海军,蒋莎莉,谢晋予,周华山,刘爱凤
肺胸区上皮样血管内皮瘤2例临床病理观察
张 娜,王志敢,朱德茂,赵 林,罗海军,蒋莎莉,谢晋予,周华山,刘爱凤
目的 探讨肺胸区上皮样血管内皮瘤(epithelioid hemangioendothelioma, EHE)的临床病理学特点、治疗及预后。方法 回顾性分析2例EHE的临床病理学资料,并复习相关文献。结果 男性和女性患者各1例,年龄分别为21岁和52岁,影像学示左侧胸膜增厚、乳腺包块或左上肺结节影。组织学特征性地出现异型的嗜酸性上皮样瘤细胞、空泡状假脂肪母细胞,含单个红细胞的原始血管腔。免疫组化至少1项血管内皮标记阳性。例1瘤细胞中度异型,见瘤巨细胞,核分裂象多,组织结构多样,伴有肿瘤坏死,未行放、化疗,短期内死亡。例2纤维支气管镜活检示瘤细胞轻度异型,核分裂少,未见坏死,行放疗及2个疗程化疗,带瘤生存。结论 EHE根据其临床病理学特点,结合免疫表型可确诊。需与结核病、上皮样血管肉瘤、腺癌、恶性间皮瘤、黑色素瘤等鉴别。单发的经典型EHE者预后较好,而核分裂象多与肿瘤直径>3 cm的恶性EHE、胸膜起源、多中心或多脏器发生者预后差。
软组织肿瘤;上皮样血管内皮瘤;肺;胸膜;乳腺
上皮样血管内皮瘤(epithelioid hemangioendothelioma, EHE)是一种血管内皮起源罕见的低至中度恶性软组织肿瘤,发生率仅占所有脉管肿瘤的1%[1]。1975年Dial等[2]最初报道为血管内皮支气管肺泡肿瘤。后经免疫组化和电镜检查证实其起源于内皮,1982年Weiss和Enzinger将其更名为EHE[3]。EHE可发生于任何年龄和部位,以成年女性多见,好发于软组织、肺、肝和骨,少数发生于胸膜,乳腺罕见。由于缺乏特异的临床表现,极易误诊[4]。本文回顾性分析2例肺胸区EHE的临床病理学特征并复习相关文献,旨在加深对该病的认识水平。
1 材料与方法
1.1 材料 收集长沙市中心医院病理科诊断的2例EHE,均具有完整的临床及病理资料。例1女性,21岁,因咳嗽、咳痰、活动后气促2个月在当地医院行胸部CT检查,考虑炎症?结核?胸膜活检未发现恶性病变,经抗感染、抗痨治疗后仍间断胸痛、气促、体重下降,于2016年3月来我院进一步诊治。体检:消瘦体貌,全身浅表淋巴结无肿大。左侧胸廓塌陷,同侧乳房深部可扪及一质硬无痛鹌鹑蛋大小肿块。左肺呼吸音低,双肺无啰音。辅助检查:血常规正常,结核与肿瘤标志物检测阴性。彩超示左侧乳房多个低回声包块,最大径3.5 cm者位于胸大肌处,形态欠规则,可见融合声像及点状条索状血流信号,考虑纤维腺瘤?乳腺癌?行左侧乳腺肿块活检。例2男性,52岁,因体检发现左肺肿块1个月。CT示左上肺门区单发高密度略分叶结节影,最大径2.4 cm,边界较清楚。考虑为良性结节?肺癌?
1.2 方法 标本均经10%中性福尔马林固定,常规包埋、石蜡切片,行HE和免疫组化染色。经两位高级职称专科病理医师分别阅片诊断,并申请远程病理会诊。免疫组化染色采用EnVision法。所用抗体vimentin、CD34、CD31、FⅧRAg、D2-40、CK、PR、Ki-67等均购自丹麦Dako公司,操作步骤严格按试剂盒说明书进行。
2 结果
2.1 眼观 例1:左侧乳腺肿块活检组织:碎组织,直径共3.0 cm,灰白、灰褐色,质地软韧不一。例2:左上肺纤维支气管镜活检组织5粒,灰白、灰褐色,直径共0.3 cm。
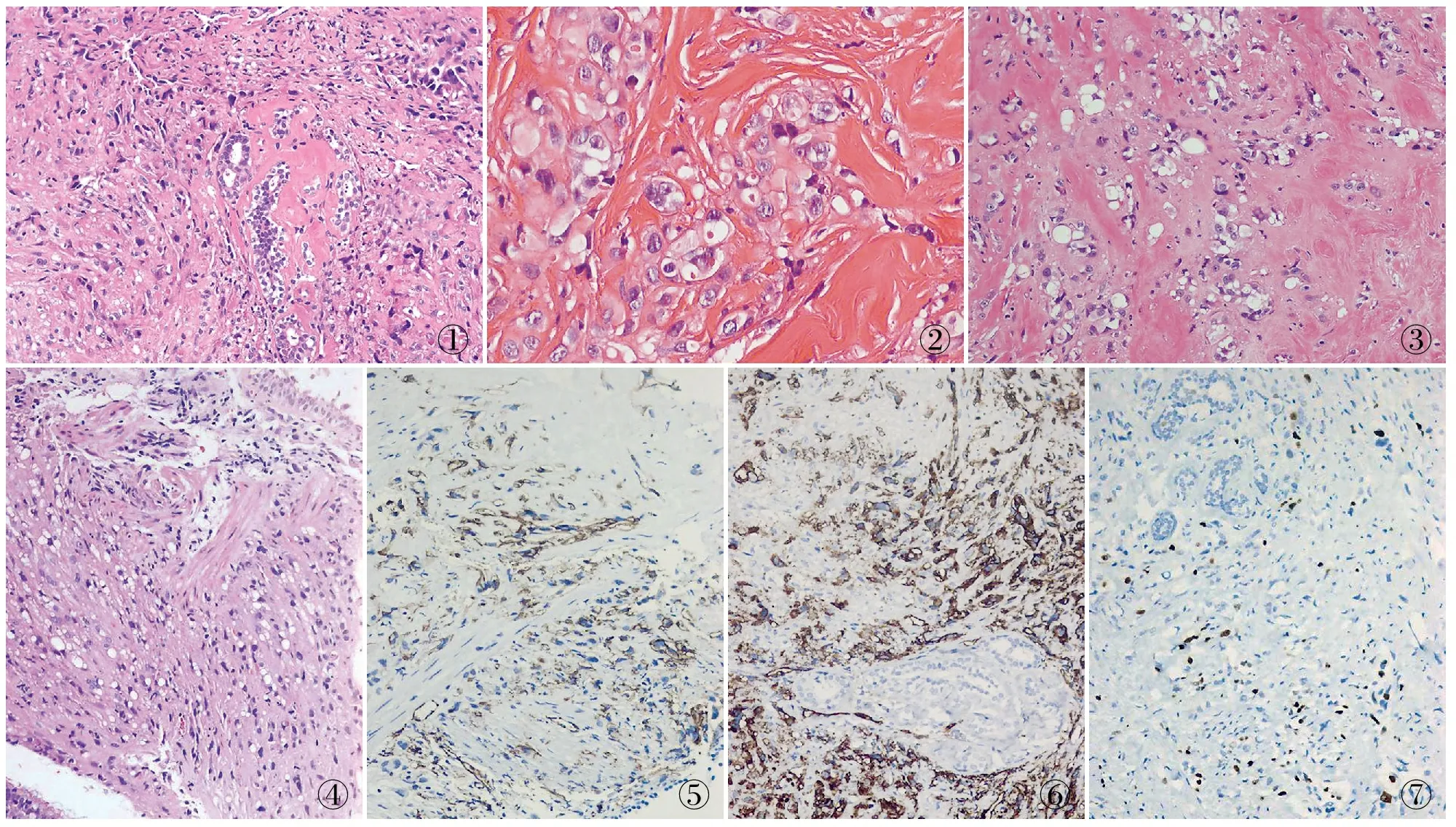
2.2 镜检 例1、2均可见散在、小巢状、条索状排列的轻~中度异型细胞浸润(图1),瘤细胞上皮样/组织细胞样和梭形,胞质嗜酸性或空泡状,可见含单个红细胞的原始血管腔(图2)及单泡或多泡假脂肪母细胞(图3)。胞核圆形、卵圆形或胖梭形,染色质深浅不一,可见泡状核和核仁。有玻璃变硬化的纤维间质。例1瘤细胞异型性更大,见散在瘤巨细胞,核分裂象3~5/50 HPF,呈小叶癌样靶环状排列,局灶癌栓样,可见梭形瘤细胞席纹状排列,伴有多灶肿瘤性坏死,肿瘤侵犯纤维腺瘤。例2纤维支气管镜活检可见肿瘤细胞侵犯黏膜下支气管壁平滑肌束(图4),核分裂象1~2/50 HPF,未见肿瘤坏死。
2.3 免疫表型 2例肿瘤细胞vimentin、CD31、CD34均弥漫强阳性(图5、6),Ki-67增殖指数分别为10%(图7)和5%。例1:FⅧRAg、D2-40、CK、S-100、PR不同程度阳性,CK5、p63、desmin、CR、WT1、HMB-45、ER、HER-2均阴性;例2:FⅧRAg、CK、CK7、CEA、TTF-1、Napsin A、p63、S-100均阴性。
2.4 病理诊断 例1:(左侧乳腺)EHE,伴有恶性EHE,侵犯纤维腺瘤。例2:(左上肺纤维支气管镜活检)EHE,经典型。
①②③④⑤⑥⑦
图1 例1:乳腺间质中异型细胞散在、小巢状、条索状或实性片状排列 图2 例1:上皮样瘤细胞胞质嗜酸性或空泡状,可见含单个红细胞的原始血管腔,间质玻变纤维样 图3 例1:单泡或多泡假脂肪母细胞 图4 例2:EHE瘤细胞呈空泡状,肿瘤侵犯支气管平滑肌 图5 例2:支气管黏膜下瘤细胞CD31阳性,EnVision法 图6 例1:乳腺导管周EHE中CD34阳性,EnVision法 图7 例1:EHE中Ki-67增殖指数较高,EnVision法
2.5 随访 电话随访时间1~3个月不等。例1未行放、化疗,确诊后第22天死亡;例2行放疗+2个疗程化疗(吡柔比星+洛铂+重组人血管内皮抑制素)后带瘤生存。复查CT肿瘤无进展。
3 讨论
EHE临床罕见,病因不清,可能与血管发育不良、外伤、口服避孕药、雌激素水平异常等因素有关。EHE可发生于任何年龄、任意部位,常累及软组织、骨、肺、肝,胸膜发生少见,乳腺罕见。成年女性好发,本病发生于骨或软组织时,无性别差异,而发生于肝、肺男女比例约为1 ∶4。生物学行为介于血管瘤和血管肉瘤之间,分为经典型和非典型/恶性型,对应于组织学分级G1和G2。后者在临床上具有更高的侵袭性和明显的异型性[5]。EHE肿瘤细胞上皮样/组织细胞样,胞质嗜酸或透明,可呈梭形、蜕膜样、脊索瘤样、印戒细胞样[6],小巢状、条索状或弥漫片状排列,胞质内空泡形成是EHE的特征性结构。间质呈黏液软骨样,或玻变纤维样,可伴钙化。其内皮细胞起源可由电镜(细胞周围可见发育完好的基膜、胞饮囊泡或内含红细胞的原始血管腔,可见胞质内Weibel-Palade小体)和免疫组化证实。CD31、CD34、FⅧRAg等血管内皮标记至少1项阳性。由于存在某种血管内皮标记表达的缺失,使用多项内皮标记可提高诊断准确率。血管肿瘤中CK阳性率约42%。本组2例肿瘤组织排列和细胞形态基本与上述特点相符,vimentin、CD31、CD34均弥漫阳性,Ki-67增殖指数5%~10%,支持诊断。其中例1还表达FⅧRAg、D2-40、CK、PR,且Ki-67增殖指数较高,瘤细胞异型性较大、核分裂象多,有肿瘤坏死,符合恶性EHE。有学者认为D2-40阳性提示预后不佳[7],例1与其相符。新近发现染色体移位t(1;3)(p36;q25)导致WWTR1-CAMTA1融合基因形成,可作为诊断EHE的一种有用的分子诊断工具[8-10],在良性上皮样血管瘤、上皮样血管肉瘤(epithelioid angiosarcoma, EAS)中均未检测到该移位。
经PubMed检索仅见2例乳腺EHE的相关报道[9,11]。其中1例患者为30岁女性,组织学表现为大圆形、多边形或略呈梭形的内皮细胞在黏液样基质中生长,有原始血管腔形成,及胞质内空泡,且乳腺导管周围生长的肿瘤细胞CK阳性。另1例为52岁女性,肿瘤累及软组织、腹壁及双侧乳腺,被诊断为恶性EHE,随访15个月带瘤生存。尽管例1取材部位为深部乳腺肿块并确诊为EHE,回顾病史,会诊患者既往胸膜活检切片,发现空泡化及嗜酸性异型上皮样瘤细胞及肿瘤性坏死,其本质为EHE,并推断其原发部位为左侧胸膜,乳腺EHE为继发侵犯。原单位诊断为坏死组织与增生活跃的间皮细胞,存在诊断不足。
肺EHE多为双肺散在多发性结节,少数为单发结节,直径一般<2 cm,肿瘤边界清,无包膜,切面质韧软骨样,灰白色或黄褐色。除了前述EHE经典的组织排列方式、细胞形态及间质改变外,还可见瘤细胞多以血管为中心,不规则离心性、浸润性生长,肿瘤结节分带明显,结节周边细胞丰富,呈舌状、乳头状或肾小球样增生[8]。肿瘤细胞可沿肺泡壁生长,或浸润支气管壁,坏死和出血少见,肿瘤周围可见淋巴细胞、浆细胞聚集。例2可见多空泡假脂肪母样瘤细胞,有一定特征,核分裂象少见,未见肿瘤坏死,符合经典型EHE。在纤维支气管镜活检标本中,尤其是伴有挤压伤时,肺EHE肿瘤细胞形似腺癌细胞,特别是其表达上皮标记时要仔细甄别。Julita等[12]总结200例肺EHE,其中仅27例被分类为胸膜EHE,平均发病年龄为45.7岁,男女之比为2.375 ∶1,平均生存期仅9.6个月。会诊例1外院胸膜活检病理切片,证实为原发性胸膜EHE。从起病到死亡时间短于1年,与报道相符。
EHE需与以下肿瘤鉴别:(1)EAS:组织学分级为G3,预后最差。常伴随脉管形成特征,毛细血管样腔隙,血湖、乳头状生长,明显细胞核的非典型性和高核分裂率[13]。(2)黑色素瘤:皮肤黏膜多发,与黑色素痣相关、瘤细胞胞质中可见黑色素颗粒,HMB-45、Melan-A和S-100标记常阳性,可资鉴别。(3)腺癌或肉瘤样癌:呈腺腔样、乳头状或微乳头或梭形细胞片状排列,腺癌细胞质嗜碱性黏液空泡状,非嗜酸性,腺上皮和器官相关标记CEA、TTF-1、Napsin A、ER、PR、GCDFP-15等标记常阳性,而内皮标记阴性。(4)恶性间皮瘤:有长期石棉接触或粉尘吸入史,影像学显示胸膜增厚或多结节状外观,常无实质脏器占位,无瘤细胞质内空泡及原始血管腔形成,电镜检查瘤细胞表面有细长的微绒毛;且间皮标记CK5/6、CR常阳性,内皮标记阴性。(5)肺结核:复习例1既往史,在临床表现、影像学改变与病理形态上与肺结核、结核性胸膜炎极为相似,但胸膜活检的坏死组织实为肿瘤性坏死,非干酪样坏死,且结核相关检查阴性,无结核结节,抗痨治疗无效均不支持结核。
EHE尚无标准的治疗方案。一般以手术完整切除病灶治疗为主。病灶弥漫无法切除者,可行介入栓塞、微波射频消融、氩氦刀冷冻消融、伽玛刀放射治疗、全身静脉化疗,病灶增长缓慢者,也可随访观察。不同患者应视具体情况个体化治疗。有研究认为新型抗肿瘤血管生成药物治疗对EHE有效[14]。例1免疫组化标记PR阳性,提示内分泌激素治疗可能有效。确诊为乳腺EHE后,未行放、化疗,仅予对症支持治疗,患者很快出现恶病质,因呼吸衰竭而短期内死亡。例2行放疗+2个疗程化疗后带瘤生存,目前仍在随访中。
Deyrup等[15]根据组织学和临床特点进行EHE死亡危险度分级,认为在众多变量和因素中,核分裂象>3/50 HPF和肿瘤直径>3 cm者预后最差,为高度恶性(高危险度),患者5年生存率为59%,无此两种特质视为低度恶性(低危险度)。本组2例同为EHE,预后迥然不同。参照上述观点,例1应归为高度恶性组。笔者还认为,肿瘤发生于胸膜、多中心和多脏器发生、瘤细胞异型性大或出现瘤巨细胞,有实性梭形细胞肉瘤样区域,伴有肿瘤坏死,均为预后差的因素。
综上所述,EHE为一种少见血管源性低至中度恶性软组织肿瘤,因缺乏特异的临床表现,极易误诊,尽早行病理活检可确诊,使患者受益。缺乏EHE典型组织学特征时,凭小活检诊断EHE是一种挑战,特别是在组织挤压变形及CK等上皮标记阳性时,被误诊为癌或间皮瘤时有发生。此时可加做血管内皮标记及WWTR1-CAMTA1融合基因检测及申请会诊是行之有效的方法。
[1] Omer H J, Bryan H, Smith G. Pleural epithelioid hemangioendothelioma: what started as a liver fluke and ended up being almost mistaken for malignant mesothelioma[J]. Ann Thorac Med, 2015,10(4):289-291.
[2] Dial D H, Liebow A A. Intravascular bronchioloalveolar tumor[J]. Am J Pathol, 1975,78:6a-7a.
[3] Weiss S W, Enzinger F M. Epithelioid hemangioendothelioma: a vascular tumor often mistaken for a carcinoma[J]. Cancer, 1982,50(5):970-981.
[4] Kim M, Chang J, Choi H,etal. Pulmonary epithelioid hemangioendothelioma misdiagnosed as a benign nodule[J]. World J Surg Oncol, 2015,13:107.
[5] 王 坚, 朱雄增. 软组织肿瘤病理学[M]. 北京: 人民卫生出版社, 2008:334-336.
[6] 王龙飞, 张丽华, 刘智荣, 等. 肺孤立性上皮样血管内皮瘤3例临床病理观察[J]. 诊断病理学杂志, 2016,23(4):241-244.
[7] 丁 宜, Marilyn B, 孙 晶, 等. 单中心107例骨原发血管源性肿瘤临床病理分析[J]. 临床与实验病理学杂志, 2016,32(7):766-769.
[8] Fletcher C D M, Bridge J A, Hogendoorm P,etal. WHO classification of tumors of soft tissue and bone[M]. Lyon: IARC Press, 2013:239-294.
[9] Costantino E, Lei Zhang, Sung Y S,etal. A novel WWTR1-CAMTA1 gene fusion is a consistent abnormality in epithelioid hemangioendothelioma of different anatomic sites[J]. Genes Cromosomes Cancer, 2011,50(8):644-653.
[10] Seok J L, Woo I Y, Woo S C,etal. Epithelioid hemangioendothelioma with TFE3 gene translocations are compossible with CAMTA1 gene rearrangements[J]. Oncotarget, 2016,7(7):7480-7488.
[11] Insabato L, Divizio D, Terraccino L M,etal. Epithelioid haemangio-endothelioma of the breast[J]. Breast, 1999,8(5):295-297.
[12] Julita S, Robert W, Amy C,etal. Pleural epithelioid hemangioendothelioma: literature summary and novel case report[J]. J Clin Med Res, 2015,7(7):566-570.
[13] Anderson T, Zhang L, Hameed M,etal. Thoracic epithelioid malignant vascular tumors: a clinicopathologic study of 52 cases with emphasis on pathologic grading and molecular studies of WWTR1-CAMTA1 fusion[J]. Am J Surg Pathol, 2015,39(1):132-139.
[14] Calabro L, Di Giacomo A M, Altomonte M,etal. Primary hepatic epithelioid hemangioendothelioma progressively responsive to interferon-alpha: is there room for novel antiangiogenetic treatments?[J]. J Exp Clin Cancer Res, 2007,26(1):145-150.
[15] Deyrup A T, Tighiouart M, Montag A G,etal. Epithelioid hemangioendothelioma of soft tissue: a proposal for risk stratification based on 49 cases[J]. Am J Surg Pathol, 2008,32(6):924-927.
湖南省长沙市中心医院病理科,长沙 410004
张 娜,女,主管技师。E-mail: 1095694913@qq.com 王志敢,男,副主任医师,通讯作者。E-mail: zhigan2001@sina.com
时间:2017-4-17 18:19
http://kns.cnki.net/kcms/detail/34.1073.R.20170417.1819.024.html
R 738.6
A
1001-7399(2017)04-0450-04
10.13315/j.cnki.cjcep.2017.04.024
接受日期:2016-12-23

