催化槲皮素生成异鼠李素的重组菌构建及其转化条件优化
裴建军,董萍△,徐菲,赵东霞,赵林果*,丁岗,萧伟
(1.南京林业大学化学工程学院,江苏省生物质绿色燃料与化学品重点实验室,南京210037;2.江苏康缘药业股份有限公司,江苏连云港222001)
催化槲皮素生成异鼠李素的重组菌构建及其转化条件优化
裴建军1,董萍1△,徐菲1,赵东霞1,赵林果1*,丁岗2,萧伟2
(1.南京林业大学化学工程学院,江苏省生物质绿色燃料与化学品重点实验室,南京210037;2.江苏康缘药业股份有限公司,江苏连云港222001)
异鼠李素是一种黄酮类化合物,广泛存在于银杏、沙棘、旱柳和枸杞等植物中,具有多种药理作用。植物来源的O-甲基化酶能对槲皮素羟基进行甲基化,因而构建重组菌高效表达O-甲基化酶可应用于催化槲皮素生成异鼠李素。笔者对大豆来源的O-甲基化酶SOMT-9编码基因进行了密码子优化,其密码子适应指数(CAI)从优化前的0.59,提高为0.87。将优化后的基因SysOMT-9插入表达载体pGEX-2T,构建获得重组质粒pGEX-SysOMT。将重组质粒转化大肠杆菌BL21(DE3),通过改变诱导温度及诱导剂浓度,实现了SOMT-9可溶性表达。在此基础上对其转化条件进行了优化,其最佳转化条件为:起始菌量OD600为10,转化温度为30℃,诱导剂IPTG用量为0.01 mmol/L,助溶剂DMSO质量分数为1%,1%甘油,40 μmol/L的S-腺苷基甲硫氨酸和1 mmol/L槲皮素。在此条件下,重组菌在12 h内,可将127 mg/L的槲皮素,转化生成133 mg/L异鼠李素,摩尔转化率为42%,是优化前的7.8倍。
槲皮素;异鼠李素;O-甲基化酶;重组菌;转化条件
异鼠李素是一种黄酮类化合物,广泛存在于银杏、沙棘、旱柳和枸杞等多种植物中[1]。异鼠李素是银杏叶提取物(GBE)重要的功能性化合物,也是其质量控制的标志性化合物之一[2-3]。异鼠李素具有抑制脂质过氧化反应、扩张冠状动脉、抗血栓及抑制血小板聚集等药理作用,因此可用于治疗心血管系统的疾病[4-6]。近年研究还发现,异鼠李素也具有抗氧化、抗肿瘤、抗炎、抗病毒、抗过敏及调节免疫功能等多种生物活性[7-8]。
虽然异鼠李素在植物中分布广泛,但其在植物中的含量较低,同时植物中含有多种黄酮类化合物成分复杂,为高纯度异鼠李素的制备带来了困难[1-3]。另一方面,异鼠李素属脂溶性化合物,极性低,在提取过程需要使用高浓度的醇水溶液,这进一步导致了提取成本的增加[9]。目前,高纯度的异鼠李素价格昂贵。异鼠李素与槲皮素在结构上具有相似性,通过对槲皮素3′位羟基进行甲基化就可得到异鼠李素,且槲皮素可通过水解芦丁大量制备,价格便宜。由此可见,通过对槲皮素3′位羟基进行特异性甲基化生产异鼠李素在一定程度上具有可行性。
在植物体内,黄酮类化合物O-甲基化反应主要是由O-甲基化酶(O-methyltransferase, OMT)来完成,其中S-腺苷基甲硫氨酸(SAM)为反应提供甲基,转移到黄酮类化合物上,生成各种黄酮的甲基化衍生物[10]。植物来源的O-甲基化酶根据分子质量和底物特异性可分为两类[11]:1)分子质量为23~25 ku的O-甲基化酶,主要参与木质素的合成,其催化作用需要Mg2+的参与[12-13];2)分子质量为38~43 ku的O-甲基化酶,主要参与咖啡酸、黄酮及其他酚类化合物的甲基化,其催化活性不需要金属离子存在[14]。最近又有一类分子质量为29 ku的O-甲基化酶被报道,虽然该酶的分子质量与第一类甲基化酶相似,但该酶主要参与黄酮类化合物的甲基化[15]。目前,一些植物来源O-甲基化酶基因被报道。如大豆(Glycinemax)来源的SOMT-9甲基化酶可对槲皮素的3′位羟基进行甲基化[15],生成异鼠李素;而SOMT-2甲基化酶只可对槲皮素的4′位羟基进行甲基化[16]。拟南芥(Arabidopsisthaliana)来源的AtOMT1甲基化酶可对黄酮类化合物的3′位羟基进行甲基化[17]。长春花(Catharanthusroseus)来源的CrOMT2甲基化酶可对黄酮类化合物的3′和5′位羟基进行甲基化[14]。
虽然一些植物来源的O-甲基化酶已经被克隆、表达及定性,但对于利用O-甲基化酶构建重组菌,转化槲皮素生产异鼠李素还没有相关报道。笔者将对大豆来源的SOMT-9甲基化酶基因按照大肠杆菌的优势密码子进行全基因优化,并对其可溶性表达进行研究。在此基础上对重组菌转化槲皮素生产异鼠李素的关键因子进行研究。
1 材料与方法
1.1 菌种及质粒
pGEX-2T购于GE公司,重组质粒pGEX-SysOMT由本次实验构建。大肠杆菌JM109和BL21(DE3)本实验室保存。重组菌BL21-SysOMT是由重组质粒pGEX-SysOMT转化大肠杆菌BL21(DE3)而获得,由本研究构建。
1.2 酶和化学试剂
Ex-Taq DNA聚合酶、限制性内切酶、T4 DNA连接酶、DNA标准分子量Marker均购自大连TaKaRa生物公司;实验所使用的酵母粉(yeast extract)和蛋白胨(Tryptone)购自Oxoid公司;蛋白质分子量标准购自Promega公司;琼脂糖购自BBST公司;其他常规试剂均为国产分析纯,购自大光明生物试剂有限公司。全基因合成由上海捷瑞生物工程有限公司合成,引物由上海生工生物工程有限公司合成。
1.3 基因操作
质粒的提取,DNA片段的分离纯化,感受态细胞的制备等均按照分子克隆技术[18]。优势密码子采用在线分析软件(http:∥gcua.schoedl.de/)进行相关分析。
1.4 重组质粒pGEX-SysOMT的构建
以全基因优化后的SysOMT-9基因序列为模板,设计引物如下:SysOMT-1:CCC GGATCCATGGCGAACGAAGAAGAAC,SysOMT-2:CCCGAATTCTTAGATGATACGA CGGCACAGAG,下划线分别表示BamH I和EcoR I的限制性酶切位点。以全基因合成的序列(pUC-18-SysOMT-9)为模板,进行PCR扩增,PCR产物割胶回收后用BamH I/EcoR I双酶切克隆到pGEX-2T,得到重组质粒pGEX-SysOMT。
1.5 培养基
LB培养基:蛋白胨 10 g/L,酵母粉5 g/L,NaCl 10 g/L。培养时添加100 μg/mL氨苄青霉素(Amp)。
转化培养基:M9培养基(NH4Cl 0.5 g/L,Na2HPO43 g/L,KH2PO41.5 g/L,1 mmol/L MgSO4,50 mmol/L CaCl2,1%葡萄糖)。培养时按照要求添加100 μg/mL氨苄青霉素、诱导剂和底物。
1.6 SOMT-9可溶性表达研究
挑重组菌BL21-SysOMT的单菌落到5 mL LB试管(100 μg/mL Amp),37℃培养至OD600=0.8左右,添加不同浓度的诱导剂(0,0.01,0.05,0.1,0.2,0.5 mmol/L IPTG)在不同温度下诱导(20,30,37℃)12 h,收集菌体,超声波破碎细胞。以超声破碎后的细胞样品为全细胞蛋白,10 000 g离心后取上清的样品为可溶性蛋白。通过SDS-PAGE分析SOMT-9在大肠杆菌中的可溶性表达情况。
1.7 SOMT-9酶活测定
100 μL反应体系为:1 μmol/L槲皮素,5 mmol/L维生素C,1 mmol/L二硫苏糖醇,150 μmol/L MgCl2,100 μmol/L的S-腺苷甲硫氨酸,50 mmol/L柠檬酸-磷酸氢二钠(pH 7.0),加入适量的酶液,35℃反应1 h后加300 μL甲醇终止反应,过0.22 μm的滤膜,HPLC分析其转化产物[15]。
1.8 转化条件的研究
挑重组菌BL21-SysOMT的单菌落到5 mL LB试管(100 μg/mL Amp),37℃培养过夜,转接至100 mL LB培养基(100 μg/mL Amp)中,37℃培养至OD600=0.8左右,添加0.1 mmol/L IPTG,30℃培养12 h,收集菌体待用。
1.8.1 起始菌量对转化的影响
将收集的菌体按照OD600为1,2,3,4,5,10,15的起始菌量,利用M9培养基(20 mL),添加1.5 mmol/L槲皮素,0.1 mmol/L诱导剂(IPTG),30℃转化24 h,转化结束后取0.5 mL转化液并添加0.5 mL甲醇,离心取上清进行HPLC检测。
1.8.2 转化温度对转化的影响
将收集的菌体按照OD600为10的起始菌量,利用M9培养基(20 mL),添加1.5 mmol/L槲皮素,0.1 mmol/L诱导剂(IPTG),分别20,25,30,37,40℃转化24 h,转化结束后取0.5 mL转化液并添加0.5 mL甲醇,离心取上清进行HPLC检测。
1.8.3 IPTG浓度对转化的影响
将收集的菌体按照OD600为10的起始菌量,利用M9培养基(20 mL),添加1.5 mmol/L槲皮素,0至0.2 mmol/L诱导剂(IPTG),30℃转化24 h,转化结束后取0.5 mL转化液并添加0.5 mL甲醇,离心取上清进行HPLC检测。
1.8.4 二甲基亚砜(DMSO)对转化的影响
将收集的菌体按照OD600为10的起始菌量,利用M9培养基(20 mL),添加1.5 mmol/L槲皮素,0.01 mmol/L诱导剂(IPTG),并分别添加0.3%,0.5%,1%,1.5%,2%的DMSO,30℃转化24 h,转化结束后取0.5 mL转化液并添加0.5 mL甲醇,离心取上清进行HPLC检测。
1.8.5 不同碳源及添加量对转化的影响
将收集的菌体按照OD600为10的起始菌量,利用M9培养基(20 mL),添加1.5 mmol/L槲皮素,0.01 mmol/L诱导剂(IPTG),1% DMSO,并分别添加0.5,1,2,5,10 g/L葡萄糖或甘油,30℃转化24 h,转化结束后取0.5 mL转化液并添加0.5 mL甲醇,离心取上清进行HPLC检测。
1.8.6 槲皮素及S-腺苷基甲硫氨酸对转化的影响
将收集的菌体按照OD600为10的起始菌量,利用M9培养基(20 mL),葡萄糖为碳源,分别添加0.5,0.8,1.0,1.2和1.5 mmol/L槲皮素,0.01 mmol/L诱导剂(IPTG),30℃转化24 h,转化结束后取0.5 mL转化液并添加0.5 mL甲醇,离心取上清进行HPLC检测。
将收集的菌体按照OD600为10的起始菌量,利用M9培养基(20 mL),葡萄糖为碳源,添加1.5 mmol/L槲皮素,0.01 mmol/L IPTG,并分别添加0,20,40,60,80 μmol/L的S-腺苷基甲硫氨酸,30℃转化24 h,转化结束后取0.5 mL转化液并添加0.5 mL甲醇,离心取上清进行HPLC检测。
1.9 HPLC测定槲皮素及异鼠李素条件
槲皮素及异鼠李素的测定采用HPLC法测定[3],HPLC测定的条件为:Agilent 1260 Infinity;DAD检测器检测波长为368 nm,柱温为40℃,流动相流速为0.8 mL/min[A(甲醇)∶B(1%甲酸水)=55∶45;20 min]。
2 结果与分析
2.1 大豆SOMT-9基因的分析、优化及重组质粒构建
目前报道的能对槲皮素3′位羟基进行特异性甲基化的O-甲基化酶主要有,Glycinemax的SOMT-9基因[15]、Oryzasativa的SOMT-9基因[19]及Mesembryanthemumcrystallinum的PFOMT基因[20]等。根据已经报道的催化特性进行分析,发现Glycinemax来源的SOMT-9对槲皮素的催化能力最优(表1),米氏常数(Km)和最大反应速率(Vmax)分别为72 μmol/L和300 nmol/(mg·min),酶的催化性能越强,单位时间能生成的产物就越多。因此本研究以Glycinemax的O-甲基化酶SOMT-9为研究对象。Glycinemax的SOMT-9基因全长741,编码246个氨基酸,分子质量为27 ku,能对黄酮类化合物3′位羟基进行甲基化,且该酶对Mg2+没有依赖性。

表1 不同植物来源的O-甲基化酶催化特性比较Table 1 Comparison of the properties of O-methyltransferases from different plants
以SOMT-9基因为研究对象,构建重组大肠杆菌催化槲皮素生成异鼠李素,需要实现SOMT-9基因的异源高效表达。植物来源的外源基因由于其密码子偏好性等与大肠杆菌差异较大,难以获得高效表达。因此本研究将对Glycinemax的SOMT-9基因的密码子进行优化,并由生物技术公司进行全基因合成,优化后的基因序列与原基因序列的比对如图1所示。原基因序列相对于大肠杆菌表达系统的密码子适应指数(CAI)0.59,而优化后基因序列的CAI值为0.87。由此可见,优化后基因的密码子能有效适应大肠杆菌的表达系统。

注:SOMT-9表示原基因;SysOMT表示优化后的基因。图1 优化后的基因序列与原基因序列的比对Fig. 1 Comparison between the optimized gene and the original gene
另一方面,植物来源的基因在大肠杆菌中表达时,经常形成包涵体而无法得到可溶性表达,因此本研究选择pGEX-2T为表达载体,该载体在N端融合了谷胱甘肽转移酶(GST)标签,GST标签有助于植物蛋白在大肠杆菌中的可溶性表达。以合成的序列为模板,扩增获得优化后的O-甲基化酶基因SysOMT-9,并将其克隆到pGEX-2T获得重组质粒pGEX-SysOMT。
2.2SOMT-9的可溶性表达及酶活分析
将重组质粒pGEX-SysOMT转化大肠杆菌BL21(DE3),获得重组菌BL21-SysOMT。重组菌BL21-SysOMT在37℃、0.1 mmol/L IPTG诱导条件下实现了表达,因重组蛋白融合了GTS标签,所以其理论分子质量为53 ku,但表达的蛋白基本都以包涵体形式存在,在上清中几乎没有可溶性表达的蛋白,如图2所示。植物来源的外源基因在大肠杆菌中表达经常形成包涵体,无法获得可溶性表达。形成包涵体的主要因素有:1)蛋白在大肠杆菌中无法正确折叠;2)大肠杆菌缺少合适的分子伴侣;3)无法糖基化导致蛋白形成包涵体等[21]。目前解决大肠杆菌包涵体的主要方法是通过改变诱导温度和IPTG的浓度使重组蛋白以合适的表达速度进行表达,使其能有效地进行折叠,从而达到目的蛋白的可溶性表达。研究发现在0.1 mmol/L IPTG诱导条件下,降低培养温度能有效减少包涵体的形成。因为温度的降低使重组蛋白的转录和翻译速度降低,有助于重组蛋白的正确折叠。另一方面,虽然在20℃下诱导表达时几乎没有包涵体形成,但其整体表达量低于30℃诱导条件下表达量,造成可溶性蛋白的表达量也低于30℃诱导条件下表达量。
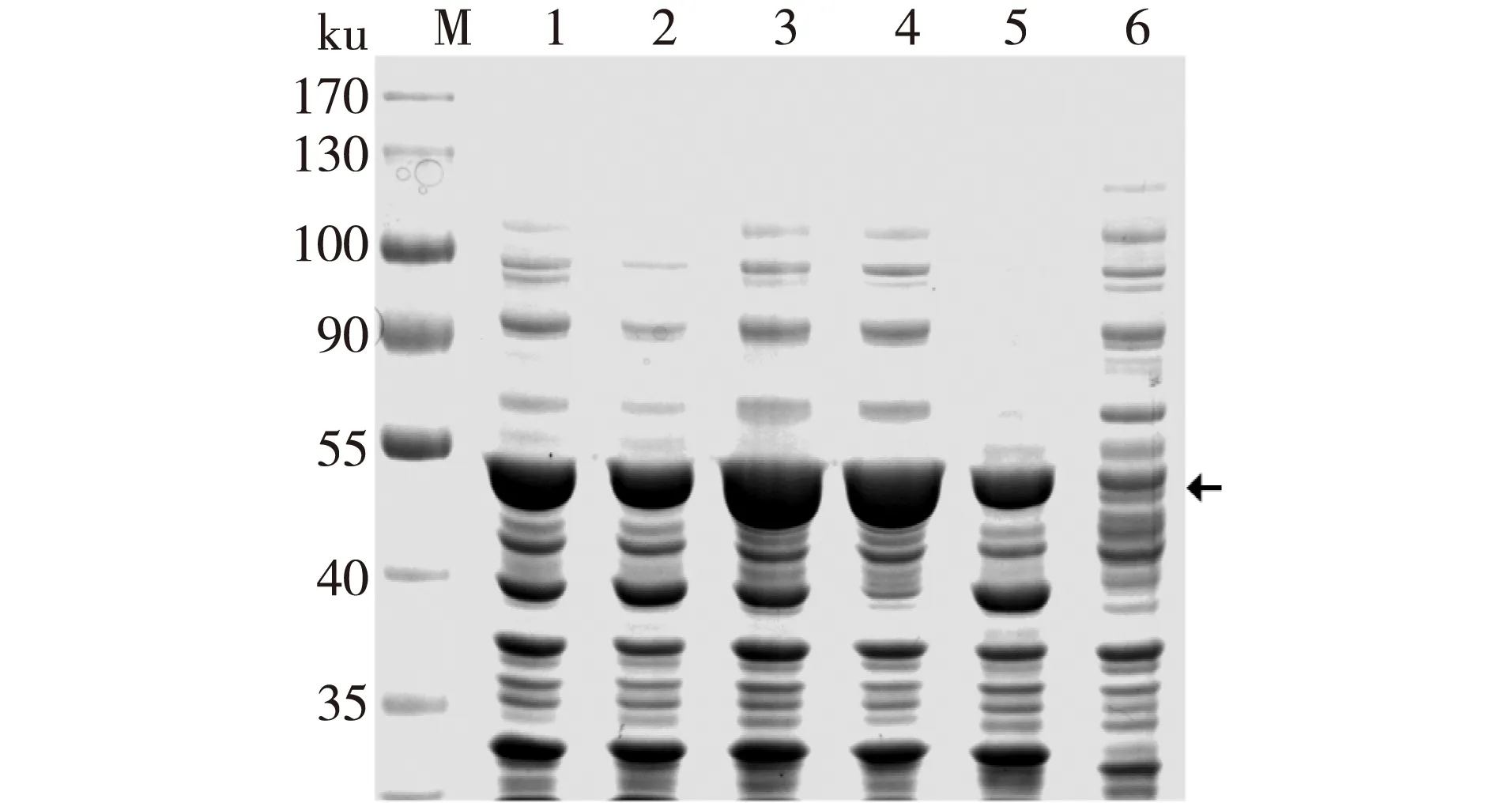
注:M表达蛋白Marker;1,3,5分别表示20,30和 37℃诱导的全细胞蛋白;2,4,6分别表示20,30和 37℃诱导的可溶性蛋白;箭头表示重组SOMT-9。图2 诱导温度对SOMT-9可溶性表达的影响Fig. 2 Effect of temperature on the soluble expression of SOMT-9
随后选择30℃诱导条件,考察不同IPTG浓度下SOMT-9的可溶性表达,研究发现0.1 mmol/L IPTG诱导效果最佳,高浓度的IPTG非但不能提高可溶性蛋白量,而且影响重组菌整体蛋白的表达量,这可能与OMT蛋白对细胞的毒性有关(图3)。诱导剂的添加量也能影响重组蛋白的翻译速度,低浓度的诱导剂有助于重组蛋白的可溶性表达。
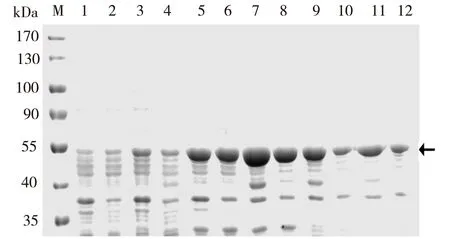
注:M表达蛋白Marker;1,3,5,7,9,11分别表示0,0.01,0.05, 0.1,0.2,0.5 mmol/L IPTG诱导的全细胞蛋白;2,4,6,8,10,12 分别表示0,0.01,0.05,0.1、0.2,0.5 mmol/L IPTG诱导的 可溶性蛋白;箭头表示重组SOMT-9。图3 IPTG对SOMT-9可溶性表达的影响Fig. 3 Effect of IPTG on the soluble expression of SOMT-9
取最佳诱导条件的重组菌,破细胞测定粗酶酶活,发现最佳诱导条件下重组酶的酶活为75 U/L,而携带空载质粒的重组菌没有测到任何酶活,由此可见重组酶实现了活性表达。由于O-甲基化酶的Vmax都比较低,SOMT-9的仅为300 nmol/(mg·min),所以虽然实现了高效表达,但酶活仍然较低。进一步提高酶活,需要对酶分子进行改造,提高其催化效率。
2.3 转化条件的确定
重组菌BL21-SysOMT转化槲皮素生成异鼠李素采用分步转化法,第一步主要是以LB为培养基,培养重组菌诱导产生重组酶SOMT-9;第二步是重组菌转化槲皮素生成异鼠李素,以M9为基本培养基,通过条件优化实现高效转化。
2.3.1 起始菌量对转化的影响
起始菌体量即转化起始阶段单位体积内的重组菌BL21-SysOMT的量,对转化槲皮素生成异鼠李素起重要作用。据报道,槲皮素等黄酮类化合物会影响大肠杆菌DNA拓扑异构酶和解旋酶的活性[22],而在前期研究中,笔者也发现槲皮素及生成的异鼠李素确实对大肠杆菌生长具有强烈的抑制作用。虽然在转化培养中不以菌体量增加为目标,但转化过程中还是需要菌体提供重组酶、ATP及S-腺苷基甲硫氨酸等,因此一定量的起始菌量对转化效率起重要作用。据此通过尝试发现提高起始菌量有助于解决槲皮素的抑制作用。研究发现最佳起始菌量OD600为10左右,过低的菌量不利于重组菌转化生成异鼠李素(图4)。
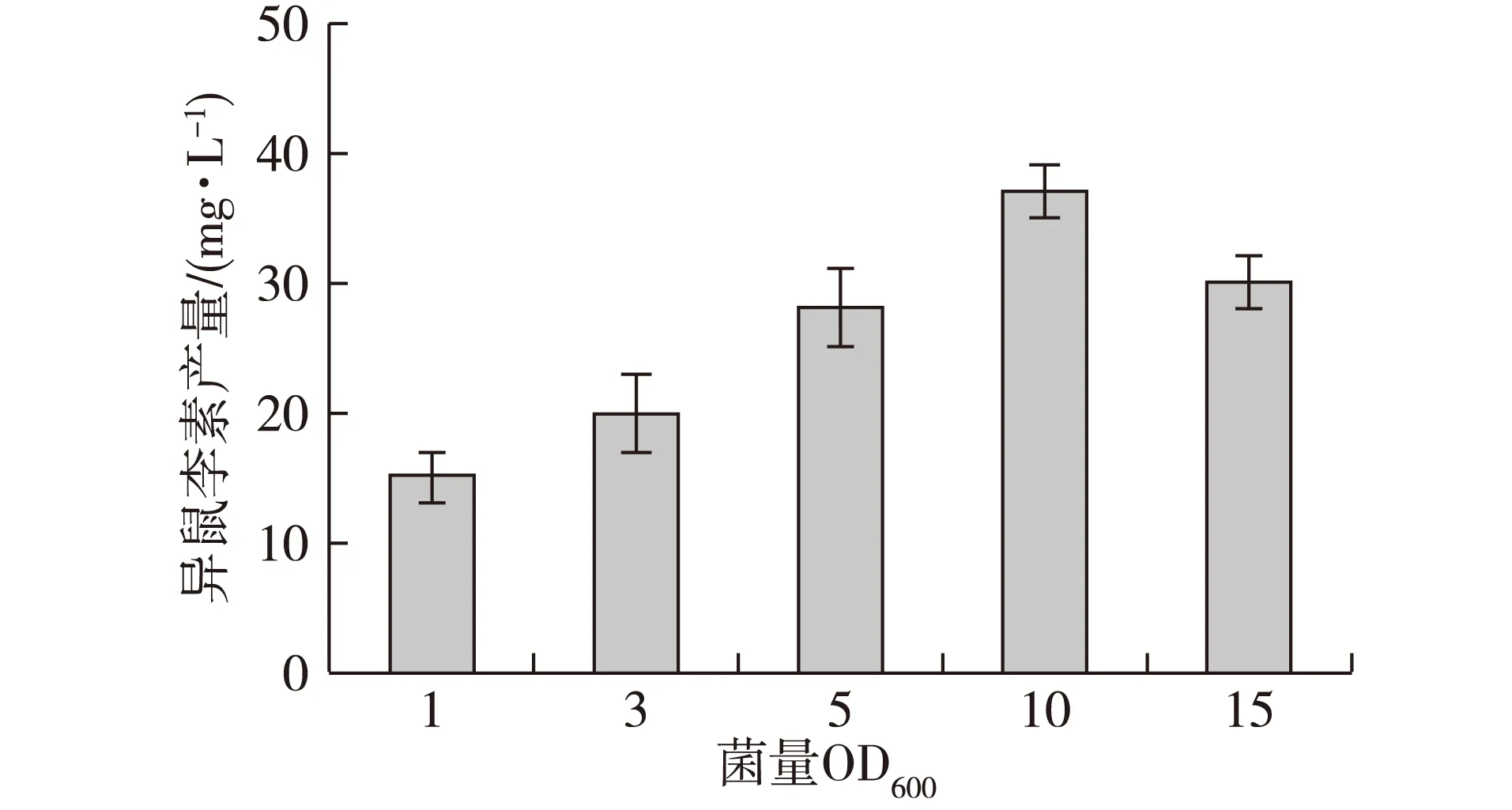
图4 起始菌量对转化的影响Fig. 4 Effect of initial OD600 on bioconversion
2.3.2 转化温度及IPTG对转化的影响
温度对酶催化反应和重组菌的生长是一个关键因素。在一定范围内酶的催化活性随温度升高而升高,但低温有利于酶保持稳定性。因此选择合适的转化温度对异鼠李素的制备具有重要意义。研究发现,最佳转化温度为30℃,过低的转化温度对于产物的生成有抑制作用(图5a),分析可能的原因:1)低温条件下槲皮素溶解度更低,更不利于槲皮素进入细胞;2)低温不利于重组酶SOMT-9进行催化反应。添加一定量的IPTG可持续诱导重组菌产生重组酶SOMT-9,可有效补充因失活而损失的重组酶,对重组菌保持催化能力非常重要,研究发现,最佳的诱导剂用量是0.01 mmol/L(图5b)。
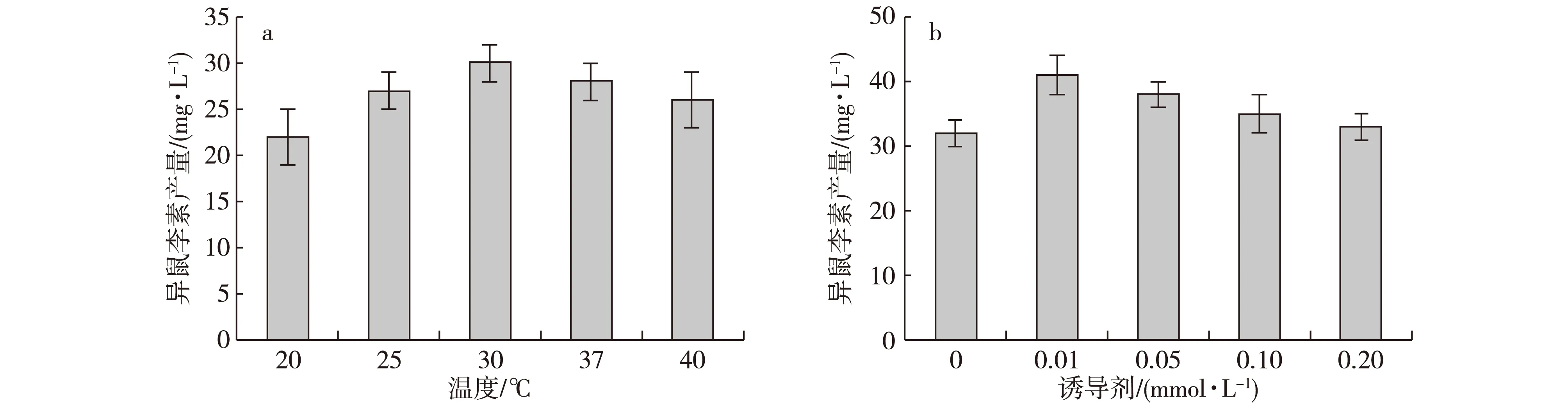
图5 转化温度及IPTG浓度对转化的影响Fig. 5 Effects of temperature and IPTG concentration on bioconversion
2.3.3 二甲基亚砜(DMSO)对转化的影响
由于该转化反应中底物槲皮素和产物异鼠李素在水溶液中的溶解度很低。溶解度低一方面造成催化效率降低,另一方面因为槲皮素和异鼠李素溶解度很低,在胞内积累会影响DNA拓扑异构酶和解旋酶的活性,抑制大肠杆菌DNA的合成,进而影响槲皮素转化生成异鼠李素[22]。添加一定浓度的助溶剂DMSO,可提高底物和产物的溶解度,但高浓度的DMSO会抑制大肠杆菌的生长,DMSO添加量超过5%,会抑制大肠杆菌的生长速率。研究发现DMSO添加量为1%时,异鼠李素产量最高;继续增加DMSO的量,则会严重抑制异鼠李素的产量(图6)。
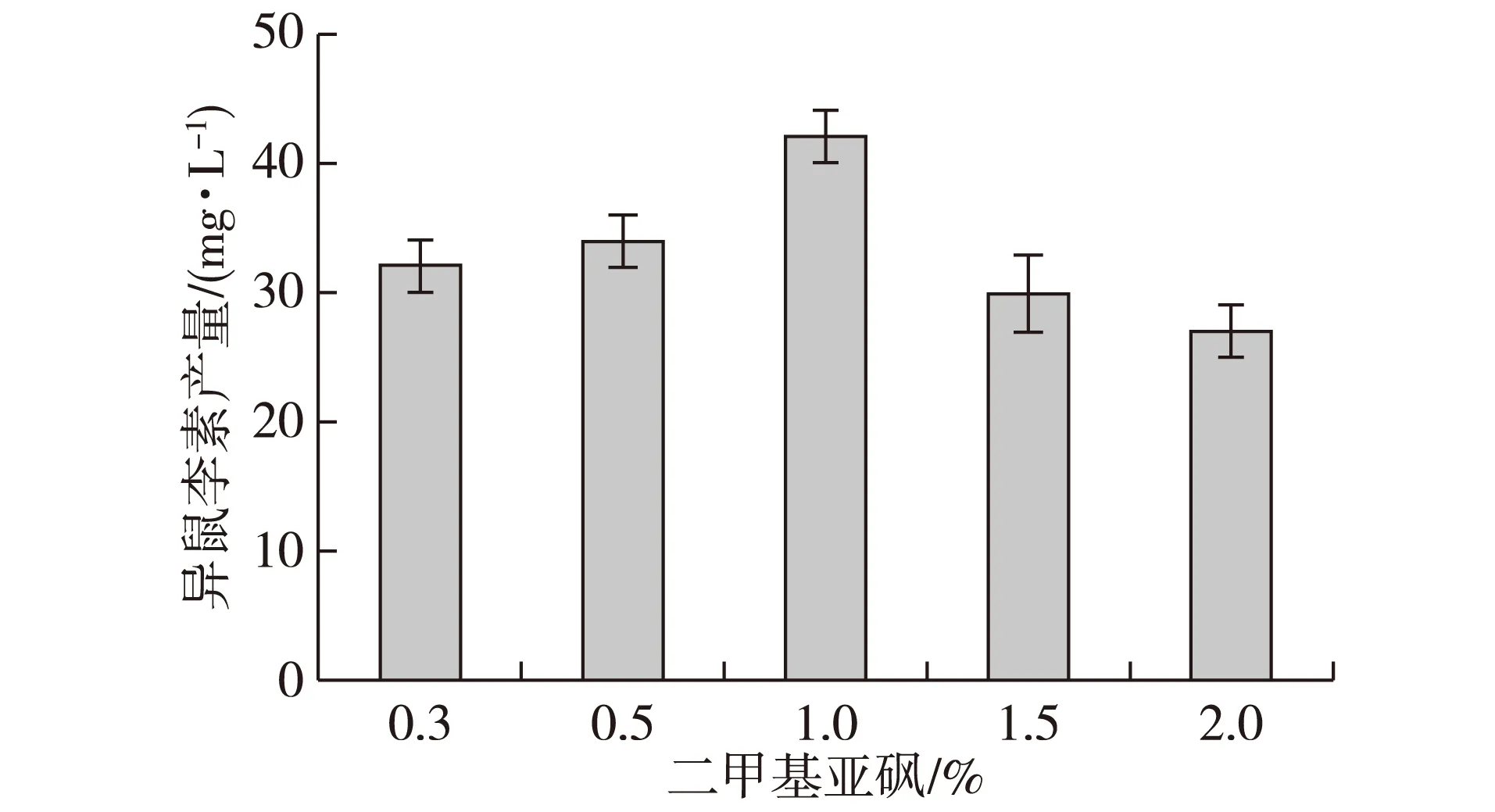
图6 二甲基亚砜(DMSO)对转化的影响Fig. 6 Effect of DMSO on bioconversion
2.3.4 不同碳源及添加量对转化的影响
转化过程中碳源主要为细胞生长提供能源及用于各种转化所需因子的合成,如重组酶,ATP及S-腺苷基甲硫氨酸等。研究发现葡萄糖作为碳源时,最佳添加量为5%,异鼠李素的产量为54.6 mg/L;而甘油作为碳源时,最佳添加量为1%,异鼠李素的产量为81.1 mg/L。由图7可见,添加低浓度的碳源时,甘油比葡萄糖更加有利于异鼠李素的生成;而添加高浓度的碳源时,葡萄糖的效果更佳。分析可能的原因,低浓度的甘油有助于重组菌减少酸的产生,更有利于菌体合成各种所需的转化因子,从而提高了转化效率;而添加高浓度的碳源时,甘油并不能有效减少重组菌产酸。
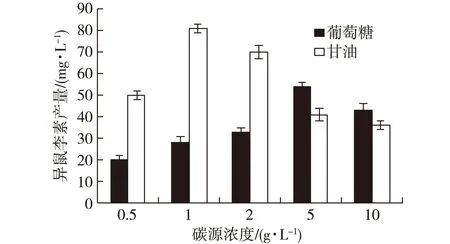
图7 不同碳源及添加量对转化的影响Fig. 7 Effects of carbon source and concentration on bioconversion
2.3.5 S-腺苷基甲硫氨酸及槲皮素对转化的影响
S-腺苷基甲硫氨酸作催化反应中甲基的供体,极大地影响着槲皮素的转化效率,而大肠杆菌内源的S-腺苷基甲硫氨酸生成量受多种因素调控,产量有限,可能会成为催化反应进行的限制因素。研究发现添加40 μmol/L的S-腺苷基甲硫氨酸时,催化效率最佳(图8a)。大肠杆菌通过S-腺苷甲硫氨酸合成酶催化甲硫氨酸生成S-腺苷基甲硫氨酸,因此通过代谢工程提高甲硫氨酸的供应量及提高S-腺苷甲硫氨酸合成酶的酶活,有望解除S-腺苷基甲硫氨酸对重组菌转化槲皮素生成异鼠李素的限制作用。槲皮素是重组菌转化的底物,高浓度的槲皮素对重组菌的生长有抑制作用,而低浓度的槲皮素不利于重组菌发挥最佳催化效果,研究发现异鼠李素的产量随着底物添加量的增加而增加,当底物添加量达到1 mmol/L时,异鼠李素产量最高,达到72.7 mg/L(图8b)。
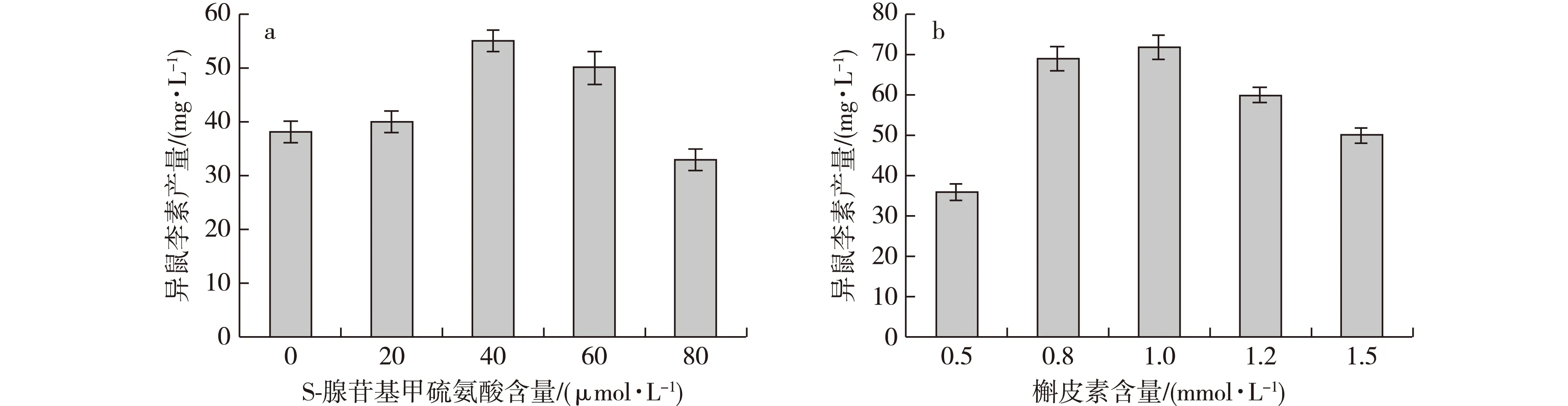
图8 槲皮素及S-腺苷基甲硫氨酸对转化的影响Fig. 8 Effects of quercetin and s-adenosyl methionine on bioconversion
2.4 最优条件下重组菌转化槲皮素生成异鼠李素的研究
以最优条件对重组菌转化槲皮素生成异鼠李素的时间曲线进行了研究。研究发现,重组菌前6 h内的单位生产率为19 mg/(L·h),转化后期随着产物量的增加,生产速率大幅下降,后6 h内的单位生产率为3.2 mg/(L·h),12 h后由于菌体转化环境的改变,异鼠李素产量开始降低,这预示转化结束的时间不能超过12 h(图9、图10)。重组菌在12 h内,可将127 mg/L的槲皮素,转化生成133 mg/L异鼠李素,产量是优化前的7.8倍,摩尔转化率为42%。这是目前报道的槲皮素转化生成异鼠
李素的最高产量[15,17,19]。
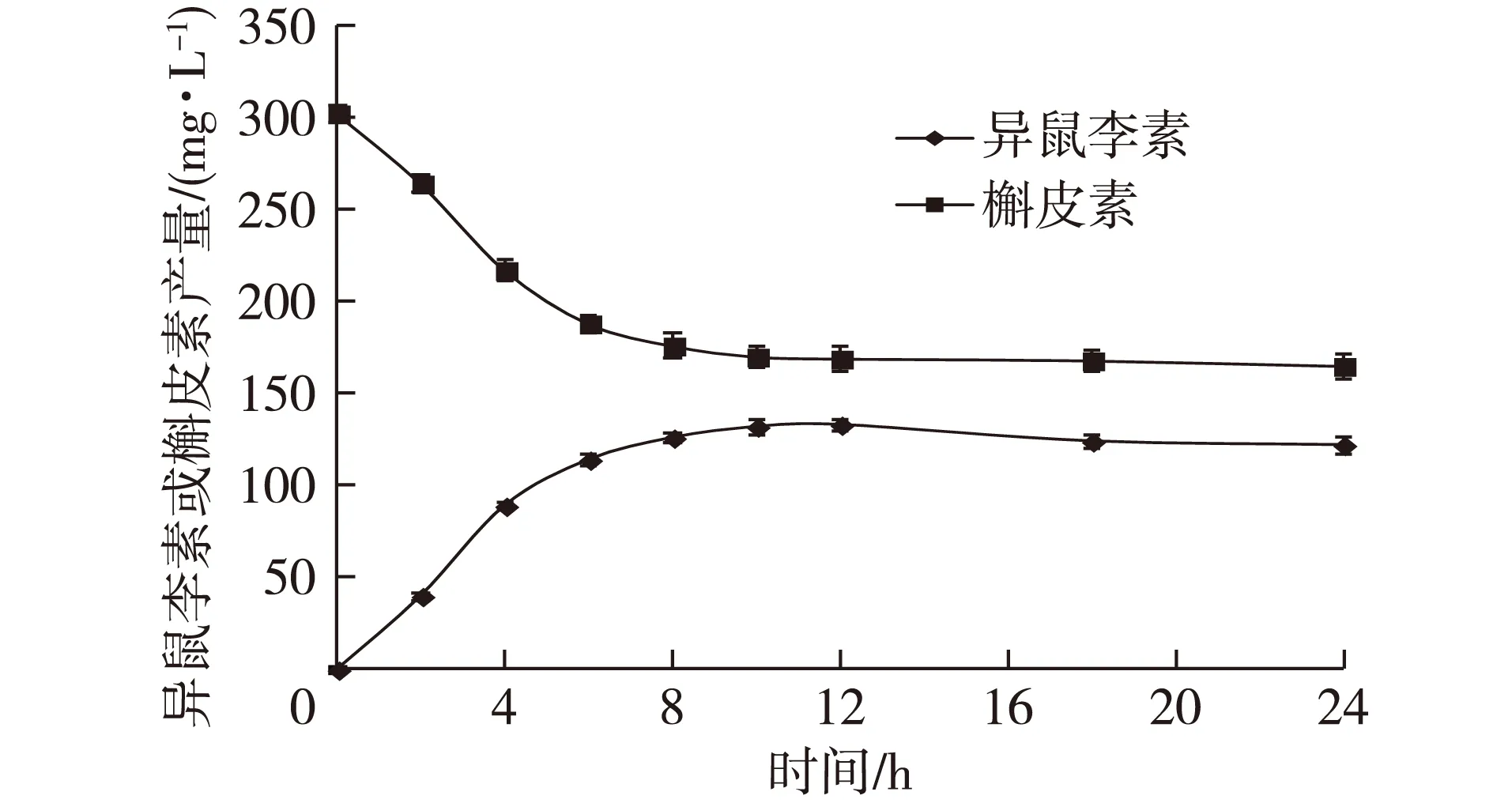
图9 重组菌转化槲皮素生成异鼠李素的时间曲线Fig. 9 Time course of conversion quercetin toisorhamnetin by the recombinant strain
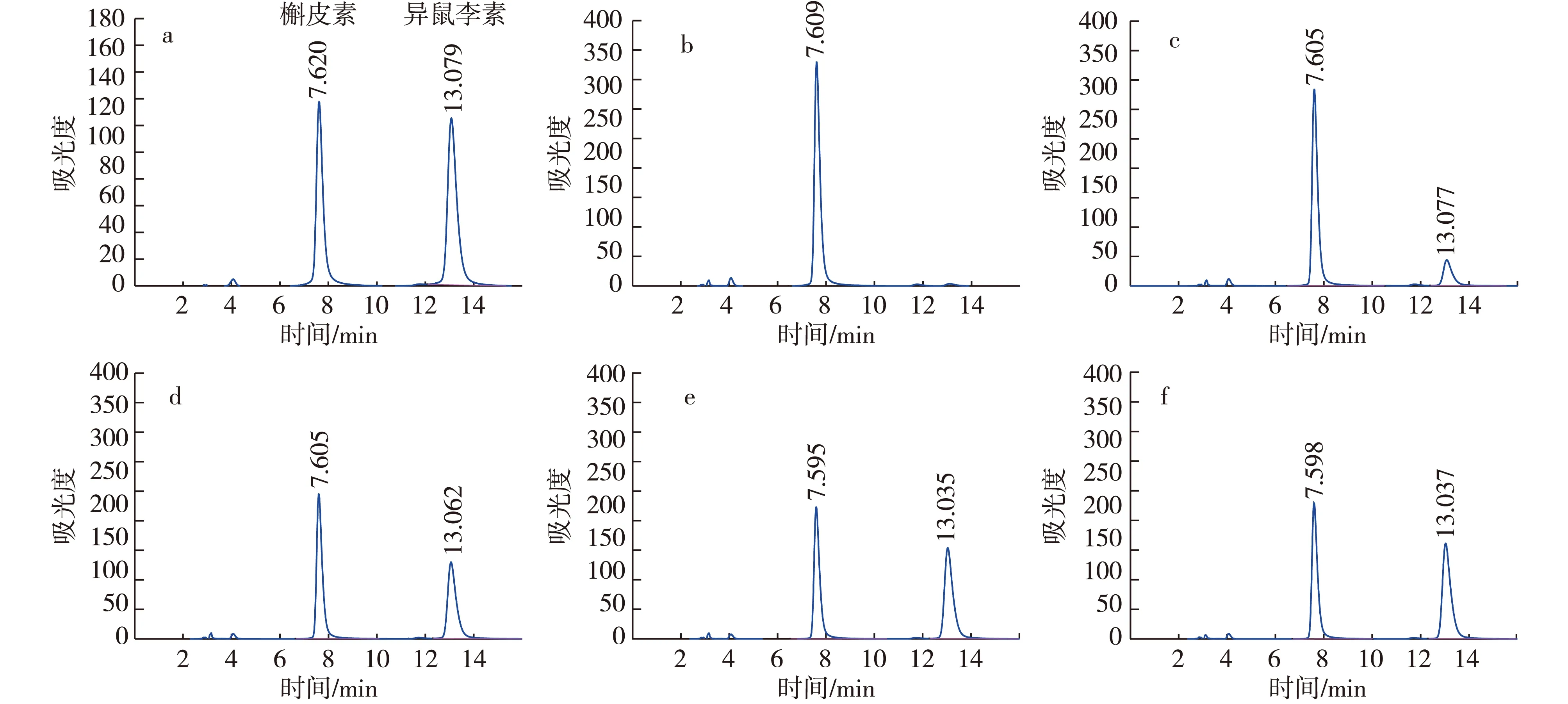
注:a表示标样;b、c、d、e、f分别表示0,2,6,12,24 h样品。图10 重组菌转化槲皮素生成异鼠李素HPLC检测图Fig. 10 HPLC analysis of conversion quercetin to isorhamnetin by the recombinant strain
虽然本研究通过基因优化和转化条件的优化,大幅提高了重组菌转化槲皮素生成异鼠李素的产量,但该产量离工业化生产仍存在很大的差距。如何进一步提高转化率及异鼠李素的产量是后续研究的关键。目前制约重组菌转化槲皮素生成异鼠李素的关键问题是:
1)甲基化酶的催化效率,目前报道性能最佳的酶是大豆来源的O-甲基化酶,但该酶的转化效率还是远远不能满足实际应用需求,如何筛选性能更优异的O-甲基化酶或对该酶进行分子改造是提高异鼠李素产量的关键;
2)槲皮素和异鼠李素对重组菌生长的抑制作用,虽然通过提高起始菌量在一定程度上减轻了这种生长抑制作用,但还无法从根本上解决该问题,有研究表明对黄酮苷元进行糖基化能大幅度降低黄酮对重组菌的抑制作用[22],而且通过糖基化有助于提高其溶解度[9],从而有利于产物从胞内分泌至胞外,通过对异鼠李素进行糖基化生成其他高附加值的产物(如异鼠李素-3-O-葡萄糖[23])是解决抑制作用的有效方法。
3 结 论
以大豆来源的O-甲基化酶SOMT-9为研究对象,通过全基因密码子优化和诱导条件的优化,在大肠杆菌中实现了SOMT-9可溶性高效表达。并通过对该重组菌催化槲皮素生成异鼠李素的转化条件进行优化,使异鼠李素产量达到133 mg/L,是优化前的7.8倍,摩尔转化率为42%。这是目前报道的槲皮素转化生成异鼠李素的最高产量。
[1]马养民, 姜少娟, 史清华. 沙棘果渣中异鼠李素和槲皮素的提取与分离[J]. 西北林学院学报, 2009, 24(5):121-124. MA Y M, JIANG S J, SHI Q H. Extraction and isolation of isorhamnetin and quercetin from Marc of sea buckthorn fruit[J]. Journal of Northwest Forestry University, 2009, 24(5):121-124.
[2]刘丹, 贾晓斌, 萧伟. 基于“组分结构”理论对不同厂家银杏叶提取物中黄酮类活性成分的对比研究[J]. 中草药, 2013, 44(2):170-173. LIU D, JIA X B, XIAO W. Comparison on active flavonoids inGinkgobilobaextract from different manufactories based on “component structure” theory[J]. Chinese Traditional and Herbal Drugs, 2013, 44(2):170-173.
[3]林佳媛, 张鹏, 蔡卫民, 等. 银杏叶提取物注射液中槲皮素、山柰酚、异鼠李素及总黄酮醇苷的HPLC法测定[J]. 中国医药工业杂志, 2012, 43(12):1016-1019. LIN J Y, ZHANG P, CAI W M, et al. Determination of quercetin, kaempferol, isorhamnetin and their total flavonol glycosides inGinkgobilobaextract injection by HPLC[J]. Chinese Journal of Pharmaceuticals, 2012, 43(12):1016-1019.
[4]刘瑞, 孟芳, 刘宇, 等. 异鼠李素及橙皮甙抑制LDL氧化修饰作用的研究[J]. 中药材, 2007, 30(6):677-681. LIU R, MENG F, LIU Y, et al. Inhibitory effect of isorhamnetin and heperidin on LDL oxidation induced by Cu2+[J]. Journal of Chinese Medicinal Materials, 2007, 30(6):677-681.
[5]赵增光, 刘应才. 异鼠李素的心血管保护作用[J]. 医学综述, 2008, 14(15):2321-2323. ZHAO Z G, LIU Y C. Cardiovascular protective effect of isorhamnetin[J]. Medical Recapitulate, 2008, 14(15):2321-2323.
[6]BAO M, LOU Y. Isorhamnetin prevent endothelial cell injuries from oxidized LDL via activation of p38MAPK[J]. European Journal of Pharmacology, 2006, 547(1):22-30.
[7]朱玲. 异鼠李素体内外抗肿瘤作用及其机制的研究[D]. 成都:四川大学, 2005. ZHU L. The inhibiting effect and its mechanism of isorhamnetin on cancer in vitro or in vivo [D]. Chengdu:Sichuan University, 2005.[8]滕丹, 栾新尧. 异鼠李素的药效学研究进展[J]. 中医药临床杂志, 2016, 28(4):593-596. TENG D, LUAN X Y. Research progress of isorhamnetin in pharmacodynamics [J]. Clinical Journal of Traditional Chinese Medicine, 2016, 28(4):593-596.
[9]许明淑, 邢新会. 一种利用酶反应提高异鼠李素极性的方法:200510011540.0[P]. 2005-10-26. XU M S, XING X H. The method of improving polar of isorhamnetin:200510011540.0[P]. 2005-10-26.
[10]KIM B G, SUNG S H, CHONG Y, et al. Plant flavonoidO-methyltransferases:substrate specificity and application[J]. Journal of Plant Biology, 2010, 53(5):321-329.
[11]ZUBIETA C, HE X Z, DIXON R A, et al. Structures of two natural product methyltransferases reveal the basis for substrate specificity in plantO-methyltransferases[J]. Nature Structural & Molecular Biology, 2001, 8(3):271-279.
[12]FERRER J L, ZUBIETA H, DIXON R A, et al. Crystal structures of alfalfa caffeoyl coenzyme A 3-O-methyltransferase[J]. Plant Physiology, 2005, 137(3):1009-1017.
[13]JOSHI C P, CHIANG V L. Conserved sequence motifs in plant S-adenosyl-L-methionine-dependent methyltransferases[J]. Plant Molecular Biology, 1998, 37(4):663-674.
[14]CACACE S, SCHRÖDER G, WEHINGER E, et al. A flavonolO-methyltransferase from Catharanthus roseus performing two sequential methylations[J]. Phytochemistry, 2003, 62(2):127-137.
[15]KIM B G, LEE H J, PARK Y, et al. Characterization of anO-methyltransferase from soybean[J]. Plant Physiology and Biochemistry, 2006, 44(4):236-241.
[16]KIM D H, KIM B G, LEE Y, et al. Regiospecific methylation of naringenin to ponciretin by soybeanO-methyltransferase expressed inEscherichiacoli[J]. Journal of Biotechnology, 2005, 119(2):155-162.
[17]MUZAC I, WANG J, ANZELLOTTI D, et al. Functional expression of anArabidopsiscDNA clone encoding a flavonol 3’-O-methyltransferase and characterization of the gene product[J]. Archives of Biochemistry and Biophysics, 2000, 375(2):385-388.
[18]萨姆布鲁克 J, 拉塞尔 D W. 分子克隆实验指南[M]. 黄培堂, 译. 北京:科学出版社, 1992. SAMBROOK J, RUSSELL D W. Molecular cloning:a laboratory manual [M]. HUANG P T, translated. Beijing:Science Press, 1992.
[19]KIM B G, LEE Y, HUR H G, et al. Flavonoid 3′-O-methyltransferase from rice:cDNA cloning, characterization and functional expression[J]. Phytochemistry, 2006, 67(4):387-394.
[20]IBDAH M, ZHANG X H, SCHMIDT J, et al. A novel Mg2+-dependentO-methyltransferase in the phenylpropanoid metabolism ofMesembryanthemumcrystallinum[J]. Journal of Biological Chemistry, 2003, 278(45):43961-43972.
[21]SEVASTSYANOVICH Y R, ALFASI S N, COLE J A. Sense and nonsense from a systems biology approach to microbial recombinant protein production[J]. Biotechnology and Applied Biochemistry, 2010, 55(1):9-28.
[22]PLAPER A, GOLOB M, HAFNER I, et al. Characterization of quercetin binding site on DNA gyrase[J]. Biochemical and Biophysical Research Communications, 2003, 306(2):530-536.
[23]KONG C S, KIM J A, QIAN Z J, et al. Protective effect of isorhamnetin 3-О-β-D-glucopyranoside fromSalicorniaherbaceaagainst oxidation-induced cell damage[J]. Food and Chemical Toxicology, 2009, 47(8):1914-1920.
Optimization of transformation conditions and construction ofrecombinant bacteria for conversion quercetin to isorhamnetin
PEI Jianjun1, DONG Ping1△, XU Fei1, ZHAO Dongxia1, ZHAO Linguo1*,DING Gang2, XIAO Wei2
(1. College of Chemical Engineering, Nanjing Forestry University; Jiangsu Key Lab. of Biomass Based Green Fuels and Chemicals,Nanjing 210037, China;2. Jiangsu Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, Jiangsu, China)
As a kind of important flavonoids, isorhamnetin exists widely in many plants such asGinkgobiloba,Seabuchthorn,SalizmatsudanaandMatrimonyvine. Isorhamnetin has many pharmacological activities. The hydroxyl group in quercetin can be methylated by O-methyltransferases from plants. Thus, the construction of bioconversion engineering bacteria that could catalyze the quercetin into isorhamnetin was considered as an effective approach to produce isorhamnetin. In order to improve the expression of O-methyltransferase SOMT-9, the gene of O-methyltransferaseSOMT-9 was designed, optimized and synthesized based on the synonymous condon bias ofEscherichiacoli, and the codon adaptation index (CAI) increased from 0.59 to 0.87. The recombinant plasmid pGEX-SysOMT was constructed by inserting the optimal gene into pGEX-2T. The recombinant O-methyltransferase SOMT-9 was over-expressed inE.coliBL21 (DE3) by different strategies such as changing induction temperature and concentration of isopropy-β-D-thiogalactoside (IPTG). Based on that, the optimal transformation conditions were determined. The optimal of initial OD600value was 10; the optimal concentration of IPTG was 0.01 mmol/L; the optimal concentration of dimethyl sulphoxide (DMSO) was 1%; the optimal carbon source was glycerol with 1% concentration; the optimal concentration of S-adenosyl methionine was 40 μmol/L; and the optimal concentration of the substrate, i.e., quercetin, was 1 mmol/L. The recombinant strain was at 30℃ for 12 h. Under the optimal transformation conditions, 127 mg/L quercetin was transformed into 133 mg/L isorhamnetin within 12 h by the recombinant strain and the molar conversion rate was 42%, which was eight times higher than that before the optimization.
quercetin; isorhamnetin; O-methyltransferase; recombinant bacteria; optimization
2016-07-26
2016-11-25
国家林业公益性行业科研专项(201404601);江苏省自然科学基金(BK20131423);江苏省“青蓝工程”项目;江苏高校优势学科建设工程资助项目(PAPD)。
裴建军,男,副教授,研究方向为代谢工程。董萍为并列第一作者。通信作者:赵林果,男,教授。E-mail:lg.zhao@163.com
Q819
A
2096-1359(2017)03-0050-08

