126例子宫内膜癌中Lynch综合征的初步筛查
杨通印,易 韦,褚明亮,张著学,林永顺
126例子宫内膜癌中Lynch综合征的初步筛查
杨通印,易 韦,褚明亮,张著学,林永顺
目的 探讨hMSH2、hMSH6、hMLH1、hPMS2蛋白缺失情况和hMLH1基因启动子甲基化状态及Lynch综合征患者的家系分析,初步进行Lynch综合征相关子宫内膜癌筛查。方法 采用免疫组化SP法检测126例子宫内膜癌中hMSH2、hMSH6、hMLH1、hPMS2蛋白表达,并用甲基化特异性PCR检测hMLH1蛋白表达缺失病例的hMLH1基因启动子甲基化状态。结果 免疫组化结果显示22%(28/126)的病例出现MMR蛋白缺失表达,其中12例hMLH1-/hPMS2-、6例hPMS2-、4例hMSH2-/hMSH6-,hMSH6-和hMLH1-各3例,以hMLH1和hPMS2蛋白缺失表达为主。甲基化特异性PCR检测有hMLH1蛋白表达缺失的15例子宫内膜癌中hMLH1基因启动子甲基化状态,证实9例存在hMLH1基因启动子甲基化,提示其为子宫内膜癌的散发性病例。结论 对子宫内膜癌患者行MMR蛋白免疫组化SP法染色,结合甲基化特异性PCR检测hMLH1基因启动子甲基化状态,是初步筛查Lynch综合征的有效策略。
子宫内膜肿瘤;Lynch综合征;错配修复基因;免疫组织化学
Lynch综合征是一种由碱基错配修复(mismatch repair, MMR)基因缺陷引起的常染色体显性遗传病,具有较高的癌症倾向。肿瘤的发生主要与hMSH2、hMSH6、hMLH1及hPMS2的DNA MMR基因胚系突变有关。在女性Lynch综合征患者中,恶性肿瘤的高发部位主要为子宫内膜,称之为Lynch综合征相关子宫内膜癌,MMR基因的种系突变决定该病的诊断,Lynch综合征相关子宫内膜癌占子宫内膜癌的比率较少(<5%)[1]。目前,诊断Lynch综合征相关性子宫内膜癌的最可靠方法是分析四种常见的MMR基因,即应用hMLH1、hMSH2、hMSH6和hPMS2基因的胚系突变来诊断Lynch综合征[2]。由于MMR基因突变的异质性,突变分析花费高、费时费力,且预期的阳性率较低;因此对高危患者在进行MMR基因突变分析前进行预筛查非常重要。本文着重探讨四种常见的MMR基因在Lynch综合征相关子宫内膜癌中筛查的有效性。
1 材料与方法
1.1 临床资料 收集贵州省人民医院2013年1月1日~2015年6月30日确诊为子宫内膜癌标本126例,其中包括子宫内膜样癌82例、21例浆液性癌、14例透明细胞癌及9例肉瘤样癌。
1.2 主要试剂 兔抗人hMLH1、hMSH2、hMSH6和hPMS2抗体购自北京中杉金桥公司,工作浓度为1 ∶50;SP试剂盒及DAB显色剂均购自北京中杉金桥公司。DNA提取试剂盒购自德国QIAGEN公司,甲基化修饰试剂盒及甲基化阳性(阴性)对照均购自美国ZYMO公司,甲基化特异性PCR反应试剂ROX购自日本TaKaPa公司,Mix购自上海辉睿生物公司。核酸蛋白质浓度测量仪B-500购自上海创萌生物公司,Mx3000P定量PCR扩增仪购自美国Stratagene公司。
1.3 HE及免疫组化染色 新鲜标本均用10%中性福尔马林固定,常规脱水,石蜡包埋,4 μm厚连续切片,常规HE染色及免疫组化SP法染色。免疫组化SP法染色主要操作步骤:切片脱蜡水化,经3%H2O2溶液37 ℃水浴浸泡20 min;经高压锅加热煮沸4 min,冷却至室温;正常羊血清封闭,37 ℃水浴浸泡15 min;滴加一抗,4 ℃过夜,37 ℃ 1 h;滴加二抗,37 ℃水浴放置30 min;加入辣根过氧化物酶,37 ℃水浴放置30 min,PBS冲洗3次,每次5 min;DAB显色6~8 min,苏木精复染,常规脱水、透明、封固。以PBS代替一抗作为阴性对照。
1.4 结果判断 hMLH1、hMSH2、hMSH6和hPMS2蛋白在癌细胞的表达,细胞核被染成强弱不等的棕黄色,出现全核着色、核异质性或亚克隆性着色(癌细胞巢中呈核着色或无着色)和全核无着色的3种表达模式[3-4];以全细胞核不着色判断为阴性,另2种为阳性。
1.5 基因组DNA提取 按照TIANGEN组织DNA提取试剂盒说明书进行DNA提取,提取后经紫外分光光度计法检测DNA的浓度及纯度,-20 ℃条件下保存备用。
1.6 DNA亚硫酸氢钠修饰及纯化回收 按照EZDNA Methylation-GoldTM kit试剂盒(D5005)说明书的操作要求对DNA进行修饰及纯化,回收纯化的DNA。
1.7 甲基化特异性PCR 取修饰后的DNA进行PCR扩增反应,具体步骤参照试剂盒说明书进行。hMLH1甲基化及非甲基化引物:反应总体积25 μL,上、下游引物各1 μL,已修饰的DNA模板2 μL,10×Buffer 3 μL,2.5 mmol/L dNTPs 2 μL,TransTaqTMHiFi DNA Polymerase 0.3 μL,ddH2O 15.7 μL。PCR反应条件:95 ℃预变性7 min,95 ℃ 10 s,55 ℃ 10 s,72 ℃ 8 s,合计40个循环,最后72 ℃延伸1 min。取扩增后的PCR产物行1.5%琼脂糖凝胶电泳,用凝胶成像分析仪观察并分析结果、拍照。
1.8 家系分析 以MMR蛋白表达丢失的结直肠癌患者为核心绘出家系图,并用系谱分析法确认每个家系的遗传方式,尽可能获得每例患者详尽的临床及病理学资料。以AmsterdamⅡ标准和中国人遗传性非息肉病性结直肠癌(hereditary nonpolyposis colorectal cancer, HNPCC)家系筛检标准,了解不同筛检标准间的差异。AmsterdamⅡ标准:(1)家族中至少有两代垂直传递的结直肠癌;(2)家族中至少有3名或3名以上成员经病理证实为结直肠癌或相关恶性肿瘤;(3)家族中至少有一名结直肠癌患者发病年龄小于50岁。中国人HNPCC家系筛检标准:家系中至少有2例组织学证实的结直肠癌患者,其中2例为父母与子女或同胞兄弟姐妹的关系,且符合以下任一条:至少1例为多原发结直肠癌者(包括腺瘤);至少1例结直肠癌发病早于50岁;家系中至少1例患HNPCC相关肠外恶性肿瘤(胃、子宫内膜癌、小肠癌、肾盂输尿管癌、卵巢癌、肝胆系统癌)。
1.9 统计学处理 采用SPSS 17.0软件进行统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 MMR蛋白在子宫内膜癌中的表达 hMSH2、hMSH6、hMLH1、hPMS2蛋白表达定位于细胞核,细胞核被染成浅棕色至深棕色;细胞核全着色、异质性或亚克隆性着色,为MMR蛋白表达;若细胞核全无着色,则为MMR蛋白表达缺失(图1~4)。126例子宫内膜癌中hMSH2、hMSH6、hMLH1、hPMS2蛋白表达结果显示22%(28/126))的病例出现MMR蛋白表达缺失,其中12例hMLH1-/hPMS2-、6例hPMS2-、4例hMSH2-/hMSH6-,hMSH6-和hMLH1-各3例,以hMLH1和hPMS2蛋白表达缺失为主,其中15例hMLH1蛋白表达缺失。
2.2 甲基化特异性PCR检测 15例hMLH1蛋白表达缺失患者中9例有hMLH1基因甲基化(图5),提示其为散发性子宫内膜癌。余下的19例可能存在MMR基因的胚系突变。
2.3 MMR蛋白表达缺失与子宫内膜癌临床病理特征的关系 MMR蛋白表达缺失多数为60岁以下患者,发生在子宫下段居多,且多数有丰富的淋巴细胞浸润(P<0.05);MMR蛋白表达缺失与子宫内膜癌的组织学类型、淋巴结转移、TNM分期无关(P>0.05,表1)。

表1 MMR蛋白表达缺失与子宫内膜癌临床病理特征的关系
2.4 家系分析 19例MMR蛋白缺失患者中,符合AmsterdamⅡ标准的家系有3例,2例为hMLH1-/hPMS2-,1例为hMSH2-/hMSH6-。符合中国人HNPCC家系筛检标准的家系有5例,1例为hMLH1-,2例为hMLH1-/hPMS2-,2例为hMSH2-/hMSH6-。按中国人HNPCC家系筛检标准,可确诊5例为Lynch综合征相关的子宫内膜癌,最后余下的14例为高危MMR基因突变患者,可进行MMR基因的胚系突变分析确定是否为Lynch综合征相关的子宫内膜癌,且最大程度缩小高昂费用的MMR基因突变分析的检测病例数。

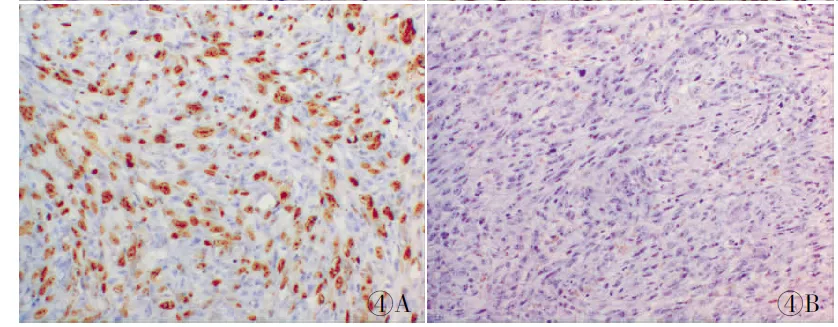
图1 MMR蛋白在同一例子宫内膜样腺癌中的表达,SP法:A.胞核呈棕黄色;B.胞核不着色,散在淋巴细胞和间质细胞阳性 图2 MMR蛋白在同一例子宫低级别浆液性腺癌中的表达,SP法:A.胞核呈棕黄色;B.胞核不着色散在淋巴细胞和间质细胞阳性 图3 MMR蛋白在同一例子宫透明细胞癌中的表达,SP法:A.胞核呈棕黄色;B.胞核不着色,散在淋巴细胞和间质细胞阳性 图4 MMR蛋白在同一例子宫肉瘤样癌中的表达,SP法:A.胞核呈棕黄色;B.胞核不着色,散在淋巴细胞和间质细胞阳性

图5 子宫内膜癌组织hMLH1基因甲基化结果
P.阳性对照;M.甲基化条带;U.非甲基化条带;1~15.hMLH1蛋白表达阴性标本
3 讨论
Lynch综合征是一种由MMR基因缺陷引起的常染色体显性遗传病,具有较高的癌症发生倾向。肿瘤的发生主要与4种MMR基因的胚系突变有关,即hMSH2、hMSH6、hMLH1、hPMS2。该病患者首先遗传了MMR突变基因,从而获得肿瘤易感性,随后另一等位基因后天获得性异常,则DNA复制错误无法恢复进而发生肿瘤,且患者可同时或异时发生多种肿瘤,子宫内膜和结直肠是最常发生肿瘤的部位[5]。发生在子宫内膜的肿瘤称为Lynch综合征相关的子宫内膜癌,在遗传学上特征表现为MMR基因的胚系突变,致使hMSH2、hMSH6、hMLH1、hPMS2等蛋白1种或多种表达缺失。利用特异性抗体通过免疫组化检测hMSH2、hMSH6、hMLH1和hPMS2蛋白表达,能预测引起MMR蛋白表达缺失的基因突变(如无义突变、移码突变、大的基因组片段重排等),其敏感度较高[6]。然而,并不是所有的MMR蛋白表达缺失均由MMR基因突变引起,hMLH1基因启动子的过度甲基化也可引起MMR蛋白表达缺失[7],且并不是所有的基因突变均引起MMR蛋白表达缺失,因此对免疫组化法检测结果的解释应谨慎。MMR蛋白的表达只能用来筛选Lynch综合征,并不是一项诊断性检验。子宫内膜癌出现MMR蛋白表达缺失多见于两种情况:(1)散发性子宫内膜癌发生甲基化表观遗传学改变,即hMLH1基因启动子超甲基化导致基因沉默发生hMLH1蛋白表达缺失,甚至hPMS2蛋白表达缺失;(2)Lynch综合征患者出现MMR基因的胚系突变,致hMSH2、hMSH6、hMLH1、hPMS2中的1个或多个蛋白表达缺失。本组应用国外普遍公认的筛查方法——免疫组化法[8],检测126例子宫内膜癌,有28例出现hMSH2、hMSH6、hMLH1、hPMS2蛋白表达缺失,缺失率为22%(28/126),远高于实际Lynch综合征相关的子宫内膜癌所占子宫内膜癌的比率(<5%),但明显排除不是Lynch综合征相关子宫内膜癌的患者。28例中有MMR蛋白表达缺失的病例中,hMLH1蛋白表达缺失的有15例,通过甲基化特异性PCR检测,发现9例有hMLH1基因甲基化,提示其为散发性子宫内膜癌,余下的19例可能存在MMR基因的胚系突变。获取19例患者的详细病史,再应用中国人HNPCC家系筛检标准评判,明确5例为Lynch综合征相关的子宫内膜癌,剩下14例通过MMR基因胚系突变分析,明确是否可诊断Lynch综合征相关的子宫内膜癌,最大程度地明确高危Lynch综合征相关子宫内膜癌患者人群,缩小了费用高昂、费时费力的MMR基因胚系突变分析的检测范围。
本实验与既往报道Lynch综合征相关子宫内膜癌特征性的临床病理结果一致[9-10],如发病年龄多低于60岁,高发于子宫上段,肿瘤间质见较多淋巴细胞反应,差异有统计学意义。肿瘤在组织学上具有多形性,即Ⅰ型(子宫内膜样癌)和Ⅱ型(包括透明细胞癌、浆液性癌、未分化癌/癌肉瘤)子宫内膜癌。本实验收集126例子宫内膜癌均包含上述亚型,并分为4组,实验发现每种类型子宫内膜癌均出现MMR蛋白的表达缺失;肿瘤在组织学上具有异质性,收集的病例中由子宫内膜样腺癌与浆液性腺癌组成的混合性癌1例和浆液性腺癌与透明细胞癌组成的混合性癌1例,但未出现MMR蛋白表达缺失。本实验发现MMR蛋白表达缺失在多形性和异质性的子宫内膜癌病例中表达差异无统计学意义,即四种子宫内膜癌的表达缺失率差异无统计学意义;也可能由于各类肿瘤病例数均较少,以期收集更多病例进一步分析。
Lynch综合征家族是MMR基因突变的携带者,其女性发生子宫内膜癌的概率为60%,其子女发生突变的概率为50%,且发病年龄早,平均46.4岁[11-13];Lynch综合征相关子宫内膜癌患者初次发病后,10年内再次患癌率为25%,15年内再次患癌率50%[14]。因此,筛查Lynch综合征家族具有重要意义。国外多数肿瘤中心已开始应用免疫组化检测所有子宫内膜癌的MMR蛋白表达情况[15],对Lynch综合征家族进行筛查,最终通过基因测序检测MMR基因胚系突变情况,确诊Lynch综合征家族。有学者[16]建议对确诊为遗传性MMR突变携带者进行终生随访,一旦发现结直肠腺瘤及时行摘除术,从而预防结直肠癌的发生。男性携带者应从25岁开始,每两年行肠镜检查1次,35岁后改为每年1次,直至70岁。女性携带者应从30岁开始,每年行1次HE4及CA125检测、妇科检查及阴道超声检查,必要时行阴道镜检查和子宫内膜活检。
Lynch综合征相关子宫内膜癌有发病率高、发病时间早等临床特点。发病初期应重视Lynch综合征相关的子宫内膜癌女性妇科癌症的筛查和临床预防工作,采取预防妇科手术能有效防止Lynch综合征相关妇科肿瘤的发生。临床医师和患者应根据手术的益处、风险、不良反应以及肿瘤筛查的有效性等方面综合分析做出决策。我国人口基数大、患病人数多,但Lynch综合征相关子宫内膜癌家庭的报道较少,遗传测试仍在试验阶段,户籍和跟踪系统不完善。因此,我们迫切需要建立Lynch综合征相关子宫内膜癌注册随访制度,有利于了解其在我国的发生率,分析其表型和MMR基因的突变特点,探讨适合我国国情的分子遗传学诊断方法和预防性治疗,从而进一步提高我国Lynch综合征相关子宫内膜癌的筛选方法和诊治水平。
[1] Larissa A, Meyer M D, Russell R,etal. Endometrial cancer and Lynch syndrome: clinical and pathologic considerations[J]. Cancer Control, 2009,16(1):14-22.
[2] Lych H T, Lynch P M, Lanspa S J,etal. Review of the Lynch syndrome: diagnosis, and medicolegal ramifications[J]. Clin Genet, 2009,76(1):1-18.
[3] Pai R K, Plesec T P, Abdul-karim F W,etal. Abrupt Loss of MLH1 and PMS2 expression in endometrial carcinoma[J]. Am J Surg Pathol,2015,39(7):993-999.
[4] Watkins J C,Nucci M R,Ritterhouse L L,etal. Unusual mismatch repair immunohistochemical patterns in endometrial carcinoma[J]. Am J Surg Pathol, 2016,40(7):909-916.
[5] Oktay A, Alpay S N, Sahin I H. Risks of colorectal and other cancers after endometrial cancer for women with Lynch syndrome[J]. J Natl Cancer Inst, 2013,105(4):274-279.
[6] Long Q, Peng Y, Tang Z, Wu C. Role of endometrial cancer abnormal MMR protein in screening Lynch-syndrome families[J]. Int J Clin Exp Pathol, 2014,7(10):7297-7303.
[7] Buchanan D D,Tan Y Y, Walsh M D,etal. Tumor mismatch repair immunohistochemistry and DNA MLH1 methylation testing of patients with endometrial cancer diagnosed at age younger than 60 years optimizes triage for population-Level germline mismatch repair gene mutation testing[J]. J Clin Oncol, 2014,32(2):90-100.
[8] Frolova A I, Babb S A, Zantow E,etal. Impact of an immunohistochemistry-based universal screening protocol for Lynch syndrome in endometrial cancer on genetic counseling and testing[J]. Gynecol Oncol, 2015,137(1):7-13.
[9] Buchanan D D,Tan Y Y, Walsh M D,etal. Tumor mismatch repair immunohistochemistry and DNA MLH1 methylation testing ofpatients with endometrial cancer diagnosed at age younger than 60 years optimizes triage for population-level germline mismatch repairgene mutation testing[J]. J Clin Oncol, 2014,32(2):90-100.
[10] Kwon J S,Sun C C, Peterson S K,etal. Cost-effectiveness analysis of prevention strategies for gynecologic cancers in Lynch syndrome[J]. Cancer, 2008,113(2):326-335.
[11] Ligtenberg M J, Kuiper R P, Geurts van Kessel A,etal. EPCAM deletion carriers constitute a unique subgroup of Lynch syndrome patients[J]. Fam Cancer, 2013,12(2):169-174.
[12] Tan Y Y, McGaughran J, Ferguson K,etal. Improving identification of lynch syndrome patients: a comparison of research data with clinical records[J]. Int J Cancer, 2013,132(12):2876-2883.
[13] Garg K, Leitao M M Jr, Kauff N D,etal. Selection of endometrial carcinomas for DNA mismatch repair protein immunohistochemistry using patient age and tumor morphology enhances detection of mismatch repair abnormalities[J]. Am J Surg Pathol, 2012,33(6):925-933.
[14] Lécuru F, Huchon C, Metzger U,etal. Contribution of ultrasonography to endometrial cancer screening in patients with hereditary nonpolyposis colorectal cancer/Lynch syndrome[J]. Int J Gynecol Cancer, 2010,20(4):583-587.
[15] Mills A M, Liou S, Ford J M,etal. Lynch syndrome screening should be considered for all patients with newly diagnosed endometrial cancer[J]. Am J Surg Pathol, 2014,38(11):1501-1509.
[16] Moore R G, Brown A K, Miller M C,etal. Utility of a novel serum tumor biomarker HE4 in patients with endometrioid adenocarcinoma of the vterus[J]. Gynecol Oncol, 2008,110(2):196-201.
Screening for lynch syndrome in endometrial carcinoma
YANG Tong-yin, YI Wei, CHU Ming-liang, ZHANG Zhu-xue, LIN Yong-shun
(DepartmentofPathology,GuizhouProvincialPeople’sHospital,Guiyang550002,China)
Purpose To evaluate the application of mismatch repair (MMR) genes proteins expression and methylation-specific to screen for Lynch syndrome patients. Methods 126 endometrial carcinoma patients were tested the protein expression of hMSH2, hMSH6h, hMLH1, hPMS2 by immunohistochemically of SP, and the methylation status of hMLH1 genes by the methylation-specific PCR. Results The result of MMR immunocytochemistry showed that 22% (28/126) cases lacked MMR protein expression, including hMLH1-/hPMS2-in 12 cases, 4 hMSH2-/hMSH6-, 6 hPMS2-, 3 hMLH6-and 3 hMLH1-. Meanwhile, the methylation-specific PCR test showed that 9 cases was methylation status of hMLH1 genes in 15 cases hMLH1-, and suggested the patients might be sporadic endometrial carcinoma. Conclusion Immunohistochemical of SP staining for MMR proteins in endometrial carcinoma patients, accompanied by testing for the methylation status of hMLH1 genes, may be an effective approach to screen for Lynch syndrome.
endometrial neoplasm; Lynch syndrome; mismatch repair genes; immunohistochemically
时间:2017-3-16 14:23
http://kns.cnki.net/kcms/detail/34.1073.R.20170316.1423.009.html
贵州省人民医院青年基金[GZSYQN(2016)18号]
贵州省人民医院病理科,贵阳 550002
杨通印,男,硕士,主治医师。E-mail: yw9873@sina.com 易 韦,女,主任医师,通讯作者。E-mail: yiwei6252@sina.com
R 735.33
A
1001-7399(2017)03-0273-05
10.13315/j.cnki.cjcep.2017.03.009
接受日期:2017-01-01

