窖泥中产丁酸菌的筛选、鉴定及生长性能研究
袁华伟,赵 猛,蒋 君,刘光钱,胡永奇,3,沈才洪,3,吴重德,周荣清3,,宋 川,3
(1.宜宾学院生命科学与食品工程学院,四川宜宾644000; 2.泸州老窖股份有限公司,四川泸州646000;3.国家固态酿造工程技术研究中心,四川泸州646000; 4.四川大学轻纺与食品学院,四川成都610065)
窖泥中产丁酸菌的筛选、鉴定及生长性能研究
袁华伟1,赵 猛1,蒋 君1,刘光钱2,胡永奇2,3,沈才洪2,3,吴重德4,周荣清3,4,宋 川2,3
(1.宜宾学院生命科学与食品工程学院,四川宜宾644000; 2.泸州老窖股份有限公司,四川泸州646000;3.国家固态酿造工程技术研究中心,四川泸州646000; 4.四川大学轻纺与食品学院,四川成都610065)
通过对川南某酒厂的老窖泥富集培养、分离纯化,经丁酸发酵实验,筛选出1株高产丁酸的梭菌。经16Sr DNA鉴定,该菌为丁酸梭状芽孢杆菌(Clostridium butyricum),命名为丁酸菌YD-4。经对该菌株生长性能条件研究,其最适生长温度为37℃,最适pH值为7.0,最适接种量为2%,菌体浓度达1.64×108个/mL,产丁酸量可达到3.44 g/L。
窖泥; 丁酸菌; 筛选; 鉴定; 生长性能
以泸州老窖为典型代表的浓香型白酒发酵过程是在窖池内进行的,窖池的窖泥中富集了大量对浓香型白酒酿造有益的微生物,窖龄越长,所富集的微生物越多。老窖泥中存在大量的厌氧芽孢杆菌特别是梭状芽孢杆菌,除己酸菌外,还存在较多的丁酸菌[1-3]。在浓香型白酒的香味物质形成方面,窖泥中栖息的己酸菌、丁酸菌、甲烷菌等窖泥功能菌在发酵过程中吸收营养,生长繁殖并代谢生成己酸、丁酸等有机酸,渗透到糟醅体系中与乙醇缩合生成酯类芳香物质,其中己酸乙酯被确定为浓香型白酒的主体香味物质;丁酸菌的代谢产物丁酸能与乙醇酯化形成丁酸乙酯,这是浓香型白酒中一种重要的香味成分,它与己酸乙酯形成的复合香气则是浓香型白酒的典型香气[4-7]。丁酸菌可以配合己酸菌用于制作新窖泥和养护窖池,对浓香型白酒酿造的窖池维护起着十分重要的作用[8-10]。丁酸菌的应用能促进丁酸乙酯的生成,全面提升和协调浓香型白酒的香味成分,从而提高浓香型白酒的质量[11-12]。因此丁酸菌是窖泥中相对重要的一类产酸菌,丁酸菌在养窖护窖和提高酒质方面具有很强的应用价值,筛选窖泥中产丁酸菌和研究其生长性能对于提高浓香型白酒的整体质量具有重大意义。本研究中,从窖泥中经厌氧培养分离筛选得到1株性能优良的产丁酸梭菌,运用16Sr DNA序列分析鉴定了其种属关系,研究了其生长性能,测定了其生长曲线。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 实验材料
窖泥样品采集自川南某酒厂酿酒基地的窖池,为多点采样的混合样品。
1.1.2 培养基
①梭菌增殖培养基:酵母膏0.3%,牛肉浸膏1%,胰蛋白胨1%,葡萄糖0.5%,可溶性淀粉0.1%,氯化钠0.5%,三水合乙酸钠0.3%,半胱氨酸盐酸盐0.05%,调节pH 7.1±0.1,121℃灭菌20 min备用[13]。
②分离培养基:胰蛋白胨2%,牛肉浸膏1%,酵母膏0.6%,葡萄糖0.4%,磷酸氢二钾0.2%,磷酸二氢钾0.1%,硫酸镁0.04%,氯化钙0.02%,硫酸亚铁0.01%,盐酸半胱氨酸0.05%,琼脂1.8%,pH7.2~7.4,121℃灭菌20 min。
③发酵培养基:葡萄糖3%,蛋白胨0.5%,酵母膏0.5%,硫酸铵0.3%,硫酸镁0.03%,磷酸二氢钾0.1%,盐酸半胱氨酸0.05%,pH值自然,在沸水浴中煮沸除氧,培养基在121℃下灭菌20 min。
1.1.3 试剂和仪器
色谱分析用丁酸等标准品均为色谱纯,天津光复精细化工研究所;蛋白胨,酵母膏,牛肉膏,北京奥博星生物有限公司;其他试剂均为分析纯,成都科龙化工试剂厂。
YQX-II型厌氧培养箱,上海跃进医疗器械厂;Spectrumlab22PC型可见分光光度计,美国Perkin Elmer TM公司;PowerPac Basic型电泳仪,美国Bio-Rad公司;Gel Doc XR型凝胶成像仪,美国Bio-Rad公司;TGL16M型高速冷冻离心机,湘麓离心机仪器有限公司;Trace DSQⅡ型气相色谱-质谱联用仪,美国Thermo Fisher公司,配备DB-WAX(30 m× 250µm×0.25µm,Agilent,美国)毛细管色谱柱。
1.2 产丁酸细菌分离及筛选
富集培养:取10 g窖泥样品加入到100 mL无菌水中,置于80℃热水浴中处理10 min,杀灭非芽孢菌,转入梭菌增殖液体培养基中,以37℃厌氧培养48 h。
稀释分离:将培养液置于80℃水浴中10 min,取热处理培养液1 mL,加入盛有100 mL无菌水及玻璃珠的三角瓶中,振荡5 min,吸取菌液1 mL加入到无菌培养皿中,然后用融化好的培养基倒平板。将平板置于厌氧培养箱,以37℃恒温培养48 h。
液体培养:从培养皿中挑取菌落观察菌体形态,如为梭状芽孢杆菌且显微镜观察形态与丁酸菌相符,则用接种环挑取1环接种于发酵培养基中,37℃厌氧培养箱中培养48 h,GC-MS测定培养液中的丁酸等代谢产物含量。
1.3 代谢产物GC/MS分析
培养液在4℃下10000 r/min离心5 min,收集上清液,加入5倍量的乙醚及一定量的2-乙基丁酸(内标),经分液漏斗分离得到有机相,重复提取2次。向有机相中加5 g无水Na2SO4脱水,过滤,在水浴中经氮气吹扫浓缩至0.5 mL供GC-MS检测分析。
色谱条件:进样口温度为250℃,初始温250℃;分流模式,分流比10∶1;升温程序,初始温度60℃,保持5 min,以5℃/min升到150℃,再以8℃/min升到220℃,保持5 min;载气:高纯氦气,流速为1 mL/min。质谱条件:连接口温度:250℃;电离方式:EI;电子能量:70 eV;离子源温度:200℃;扫描范围:40~500 amu,检出物经GC-MS标准谱库(NIST05)检索及标准品的保留时间进行鉴定。
1.4 菌株鉴定
1.4.1 菌落及菌体形态观察
筛选出的菌株,将其菌悬液梯度稀释后,涂布于分离培养基琼脂平板上,于37℃厌氧培养96 h,观察菌落形态;挑产丁酸量最高的单个菌落分别用光学显微镜及扫描电子显微镜观察个体形态。
1.4.2 菌种16S rDNA鉴定
选取培养特征、菌落形态和显微形态均符合丁酸梭菌培养特征且产丁酸量最高的菌株进行16S rDNA序列分析鉴定。离心收集液体培养至对数生长期的菌体,采用Bacterial DNA Kit试剂盒提取总DNA。提取得到的总DNA采用0.6%琼脂糖凝胶电泳检测其纯度。采用细菌通用引物(27f:5'-AGAGTTTGATCCTGGCTCAG-3';1492r:5'-GGCTACCTTGTTACGACTT-3')对总DNA进行PCR扩增,送至上海生工公司进行测序。将测序得到的16S rDNA序列在eztaxon上进行BLAST比对后,与GenBank数据库做相似性分析。
1.5 丁酸菌生长性能研究
1.5.1 培养温度对菌体生长的影响
发酵培养基初始pH7.0,接种后分别于30℃、34℃、37℃、40℃和45℃温度下厌氧静置培养24 h,用血球计数法测定菌体浓度,研究培养温度对菌体生长的影响。
1.5.2 初始pH值对菌体生长的影响
分别用6 mol/L的HCl和40%的NaOH溶液将发酵培养基起始pH值调节为5.0、5.5、6.0、6.5、7.0、7.5和8.0,接种后以37℃厌氧静置培养24 h,用血球计数法测定菌数,研究培养基初始pH值对菌体生长的影响。
1.5.3 接种量对菌体生长的影响
调节发酵培养基的初始pH值为7.0,按0.5%、1.0%、1.5%、2.0%、2.5%和3.0%的接种量接种,以37℃厌氧静置培养24 h,用血球计数法测定菌数,研究接种量对菌体生长的影响。
1.5.4 生长曲线的测定
以2%接种量接种灭菌后的发酵培养基,将接种后的培养基分装于40支培养管中,15 mL/支,37℃温度下厌氧静置培养。每2 h取出2个样品,立即放入冰箱中贮存,最后用未接种的发酵培养基作空白对照,于波长600 nm处测量吸光值(A600),重复测量3次取平均值。以时间为横坐标,A600的均值为纵坐标绘制丁酸菌的生长曲线。
2 结果与讨论
2.1 产丁酸菌株筛选
通过对窖泥中产丁酸细菌的分离培养后共挑取94株单菌落。根据《伯杰细菌鉴定手册》,丁酸梭菌为严格厌氧杆菌,内生孢子卵圆,偏心或次端生,培养过程中发酵产酸产气[14]。依据菌株的培养特征和显微形态,对结果不符合要求的不再进行下一步实验,对于可能存在不确定结果的继续进行下一步实验,初筛出9株个体形态、菌落特征符合条件的菌株。对得到的9株菌进一步进行丁酸发酵实验。测定发酵液中的丁酸等代谢产物的含量,其结果见表1。得到4株产丁酸梭状芽孢杆菌,其中菌株YD-4有较好的产丁酸能力,以产丁酸为主,有少量乙酸生成,因此选择YD-4菌株作为优选菌株。
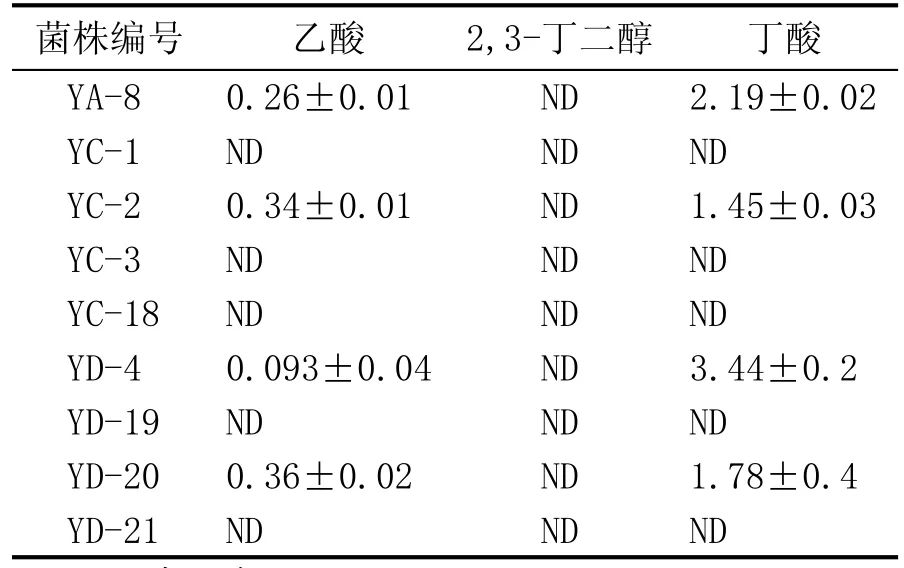
表1 分离菌株的产酸实验结果 (g/L)
2.2 菌株鉴定
2.2.1 菌落及细胞形态观察
菌株YD-4经进一步纯化后,进行个体形态、菌落特征观察。菌体形态的电镜图和在牛肉膏蛋白胨琼脂培养基上的菌落形态见图1。菌落表面黏稠,边缘处形成白色或乳白色一圈突起,呈不规则圆形形态,稍突。菌体形态为直杆状,单生,革兰氏阳性,产芽孢,芽孢中生。
2.2.2 细菌16S rDNA基因序列测定结果
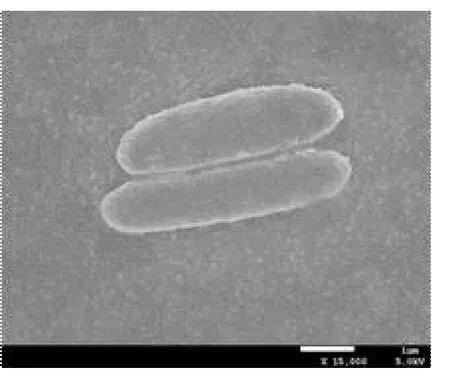
A 扫描电镜下菌株个体形态

图1 菌株YD-4的形态特征
YD-4菌株的16S rDNA核苷酸序列结果为:TCTCGCTAGCGTGACCATGCAGTCGAGCGATG AAGCTCCTTCGGGAGTGGATTAGCGGCGGACG GGTGAGTAACACGTGGGTAACCTGCCTCATAG AGGGGAATAGCCTTTCGAAAGGAAGATTAATA CCGCATAAGATTGTAGTACCGCATGGTACAGCA ATTAAAGGAGTAATCCGCTATGAGATGGACCCG CGTCGCATTAGCTAGTTGGTGAGGTAACGGCT CACCAAGGCGACGATGCGTAGCCGACCTGAGA GGGTGATCGGCCACATTGGGACTGAGACACGG CCCAGACTCCTACGGGAGGCAGCAGTGGGGA ATATTGCACAATGGGGGAAACCCTGATGCAGC AACGCCGCGTGAGTGATGACGGTCTTCGGATT GTAAAGCTCTGTCTTTAGGGACGATAATGACG GTACCTAAGGAGGAAGCCACGGCTAACTACGT GCCAGCAGCCGCGGTAATACGTAGGTGGCAAG CGTTGTCCGGATTTACTGGGCGTAAAGGGAGC GTAGGTGGATATTTAAGTGGGATGTGAAATACC CGGGCTTAACCTGGGTGCTGCATTCCAAACTG GATATCTAGAGTGCAGGAGAGGAAAGGAGAAT TCCTAGTGTAGCGGTGAAATGCGTAGAGATTA GGAAGAATACCAGTGGCGAAGGCGCCTTTCTG GACTGTAACTGACACTGAGGCTCGAAAGCGTG GGGAGCAAACAGGATTAGATACCCTGGTAGTC CACGCCGTAAACGATGAATACTAGGTGTAGGG GTTGTCATGACCTCTGTGCCGCCGCTAACGCAT TAAGTATTCCGCCTGGGGAGTACGGTCGCAAG ATTAAAACTCAAAGGAATTGACGGGGGCCCGC ACAAGCAGCGGAGCATGTGGTTTAATTCGAAG CAACGCGAAGAACCTTACCTAGACTTGACATC TCCTGAATTACTCTGTAATGGAGGAAGCCACTT CGGTGGCAGGAAGACAGGTGTTGCATGGTTGT CGTCAGCTCGTGTCGTGAGATGTTGGGTTAAG TCCCGCAACGAGCGCAACCCTTATTGTAGTTG CTACCATTTAGTTGAGCACTCTAGCGAGAC
测序结果在NCBI使用BLASTN比对初步确定为丁酸梭状芽孢杆菌,从GenBank数据库中获得有关种的公认标准序列数据,使用ClustalX1.8对齐后使用MEGA 2.1计算序列相似性并作系统发育分析,结果见图2。系统发育树中筛选出的产丁酸菌株与Clostridium butyricum属同一分枝,确定筛选出的产丁酸菌株为Clostridium butyricum,暂命名为丁酸菌YD-4。
2.3 丁酸菌的生长特性
2.3.1 培养温度对菌体生长的影响
不同温度条件下培养24 h的菌体浓度见表2。由表2可以看出,丁酸菌的适宜培养温度为30~45℃,培养温度为37℃时菌体浓度最高,为1.56× 108个/mL。因此丁酸菌YD-4的最适培养温度应为37℃。
2.3.2 初始pH值对菌体生长的影响
培养基的初始pH值对菌体生长的影响,结果见表3。由表3可以看出,当培养基的初始pH值为5.0~6.0时,菌体浓度没有明显变化;当pH值大于7.0时,菌体浓度开始下降;当pH值为7.0时,菌体浓度最大,为1.45×108个/mL。因此培养基的初始pH值应为7.0。培养基的pH值对微生物的生命活动有较大影响,pH值会影响细胞膜所带的电荷,引起细胞对营养物质的吸收状况发生变化。另外pH值还可以通过改变培养基中有机化合物离子化作用的程度,对丁酸菌细胞施加间接的影响[15]。

图2 菌株YD-4系统发育树

表2 不同培养温度对菌体生长的影响

表3 初始pH值对菌体生长的影响
2.3.3 接种量对菌体生长的影响
接种量的大小对发酵液的菌体数量具有一定的影响。过小的接种量会使菌体增殖缓慢,延长延滞期和培养时间。过大的接种量由于带入较多的种子培养时期的代谢产物,会使菌体前期生长过快,影响最终的菌体数量[16]。接种量对丁酸菌YD-4菌体生长的影响结果见表4。由表4可以看出,丁酸菌YD-4的菌体浓度随着接种量的增加而增加,当接种量为0.5%时菌体浓度最低;接种量2%与 3%比较菌体浓度并无显著差异,因此选取2%为最佳接种量,此时菌体浓度为1.64×108个/mL。

表4 接种量对菌体生长的影响
2.3.4 丁酸菌的生长曲线
丁酸菌YD-4生长曲线见图3。

图3 丁酸菌YD-4的生长曲线
由图3可以看出,丁酸菌YD-4在发酵培养基中培养12 h后进入对数生长期,菌体浓度急剧上升,培养24 h后进入稳定期,菌体浓度达到最大值,此后菌体数不再增加。由于培养过程中消耗营养物质,生长环境也会发生相应的改变,变得不再适合其生长,大部分菌体由营养体生长状态逐渐向芽孢状态转化,同时芽孢生长速率加快,随着培养时间的增加,菌体浓度呈下降趋势[17]。培养到34 h后菌体浓度略有降低。
3 结论
从川南某酒厂的老窖泥中经严格厌氧培养分离出94株菌种,从中筛选得到符合丁酸梭菌属个体形态、菌落特征的菌株9株,对其进行发酵能力试验,得到4株产丁酸细菌。选出产丁酸量最高的菌株进行16S rDNA鉴定,确定为Clostridium butyricum,暂命名为丁酸菌YD-4。丁酸菌YD-4的最适培养温度为37℃、初始pH值为7.0、最适的接种量为2%。丁酸菌YD-4在发酵培养基培养48 h,以产丁酸为主,有少量乙酸生成,丁酸产酸量可达到3.44 g/L。
[1] 周恒刚.老窖泥培养[M].北京:中国计量出版社,1998.
[2] 施思,王海英,张文学,等.浓香型白酒不同窖泥的微生物群落特征分析[J].酿酒科技,2011(5):29-32.
[3] 胡承,应鸿,许德富,等.窖泥微生物群落的研究及其应用[J].酿酒科技,2005(3):34-38.
[4] 吴衍庸.浓香型曲酒微生物技术[M].成都:四川科学技术出版社,1987.
[5] 雷光电,姚万春,唐玉明,等.泸州老窖窖泥中重要功能菌群分布及代谢产物研究[J].酿酒科技,2012(11):54-57.
[6] 沈怡方.白酒中四大乙酯在酿造发酵中形成的探讨[J].酿酒科技,2003(5):28-31.
[7]ZHANG W X,QIAO Z W,SHIGEMATSU T,et al. Analysis of the bacterial community in Zaopei during production of Chinese Luzhou-flavor liquor[J].Journal of the institute of brewing,2005,113(2):215-222.
[8] 任道群,唐玉明,姚万春,等.多菌株共酵培养优质窖泥的研究[J].中国酿造,2013,32(6):61-64.
[9] 任剑波,姚万春,唐玉明,等.窖泥复合功能菌液培养配方研究[J].酿酒,2014,41(5):47-50.
[10] 杜礼泉,王远成,饶家权,等.窖泥复合功能菌液培养及应用的研究[J].酿酒,2009,36(5):35-36.
[11] 徐立新,徐开成,王春梅.产酸菌的分离纯化[J].酿酒科技,2001(5):23-24.
[12] 陈翔,王亚庆,邵海燕.己酸菌纯种培养与混合培养技术在窖泥生产中的应用[J].酿酒,2009,36(3):35-37.
[13] 杜连祥,路福平.微生物实验技术[M].北京:中国轻工业出版社,2006:110-112.
[14] HOLT J G.Bergey's manual of determinative bacteriology[M].9th ed.Philadelphia:Lippincott Williams&Wilkins,1993.
[15] 李贤宇,张蕊,周博.酪酸菌培养条件的优化[J].天津化工,2010(1):22-24.
[16] 王刚.酪酸梭状芽孢杆菌活菌制剂的研制[D].天津:天津科技大学,2002.
[17]DÜRRE P,HOLLERGSCHWANDNER C.Initiation of endospore formation in Clostridium acetobutylicum[J]. Anaerobe,2004,10(2):69-74.
Isolation and Identification of a Butyric Acid-Producing Strain from Pit Mud and Study on Its Growth Performance
YUAN Huawei1,ZHAO Meng1,JIANG Jun1,LIU Guangqian2,HU Yongqi2,3, SHEN Caihong2,3,WU Chongde4,ZHOU Rongqing3,4and SONG Chuan2,3
(1.College of Life Science and Food Engineering,Yibin University,Yibin,Sichuan 644000;2.Luzhou Laojiao Co.Ltd.,Luzhou, Sichuan 646000;3.National Engineering Technology Research Center of Solid-state Brewing,Luzhou,Sichuan 646000; 4.College of Light Industry,Textile and Food Engineering,Sichuan University,Chengdu,Sichuan 610065,China)
A Clostridium strain with high yield of butyric acid was isolated through cumulation cultivation,isolation,purification,and butyric acid fermentation from aged pit mud in a distillery in south Sichuan.16Sr DNA identification suggested that such strain is Clostridium butyricum and it was named YD-4.The research on its growth performance indicated that its optimum growth temperature was at 37℃,its optimum pH value was about 7.0,its best inoculating quantity was 2%.As the total number of bacteria reached up to 1.64×108个/mL,the yield of butyric acid was 3.44 g/L.
pit mud;butyric acid-producing bacteria;isolation;identification;growth performance
TS262.3;TS261.4;TS261.1
A
1001-9286(2017)05-0035-06
10.13746/j.njkj.2017023
四川省科技厅科技计划重点项目《基于风味指纹图谱的微生物强化共培技术研究及应用》(2014SZ0129);四川省科技成果转化项目《浓香型白酒智能化与自动化生产关键技术集成及产业化示范》(2016CC0032)。
2017-02-13
袁华伟(1967-),男,四川安岳人,高级工程师,博士,主要研究方向为白酒微生物发酵,发表论文数篇。
周荣清(1960-),男,教授,博导,研究方向:现代发酵技术及酶应用技术,E-mail:rqzhou@163.com。
优先数字出版时间:2017-03-15;地址:http://kns.cnki.net/kcms/detail/52.1051.TS.20170315.1637.005.html。

