孟鲁司特抑制RSV感染人支气管上皮细胞所致炎症作用研究
江敏时 檀卫平 郭奕文 邹志浩
孟鲁司特抑制RSV感染人支气管上皮细胞所致炎症作用研究
江敏时 檀卫平 郭奕文 邹志浩
目的以呼吸道合胞病毒(RSV)感染人支气管上皮细胞株(16HBECs)为模型, 探讨孟鲁司特在抑制炎症过程中的药理作用机制。方法建立RSV感染的16HBECs的炎症模型, 给予不同滴度的RSV作用, 收集上清液, 用酶联免疫吸附试验(ELISA)两次检测细胞上清液中炎症因子的表达。CCK-8法检测药物对16HBECs的生长影响。结果造模过程中随RSV感染滴度的增多, 16HBECs分泌的白细胞介素(IL)-1β、肿瘤坏死因子-α(TNF-α)、IL-6越多(P<0.05);同一感染滴度RSV作用时间越长,炎症因子的分泌量持续升高。12 mg/L及以下药物浓度的孟鲁司特和1∶320及以下稀释倍的利巴韦林对细胞增殖没有抑制作用。与感染RSV组相比, 高中剂量孟鲁司特组较利巴韦林组抑制炎症因子的作用明显(P<0.05)。结论孟鲁司特能抑制RSV感染人支气管上皮细胞所致炎症作用。
孟鲁司特;人支气管上皮细胞;呼吸道合胞病毒;炎症
支气管哮喘是一种由T淋巴细胞、嗜酸性粒细胞等众多因素共同介导的呼吸道炎症疾病。RSV容易感染婴幼儿、老年人等, 引起毛细支气管炎症和肺炎。孟鲁司特是一种选择性半胱氨酰白三烯受体(CysL1Rs)拮抗剂, 在国内外临床上都是治疗哮喘的首选药物。有研究发现孟鲁司特具有非CysL1Rs依赖性的更加广谱的抗炎性, 可作用于免疫活性细胞如嗜酸粒细胞、嗜碱粒细胞、中性粒细胞等[1], 其作用机制不太明确, 更需广大科研人员的深入研究探讨。
1 材料与方法
1. 1 实验试剂与设备细胞和病毒:人喉鳞癌上皮细胞株(HEp-2细胞)、16HBECs、RSV-Long毒株A2型;药物和试剂:孟鲁司特钠、利巴韦林注射液(1 ml∶100 mg)。高糖DMEM培养基、胎牛血清;CCK-8试剂;IL-1β、TNF-α、IL-6、ELISA 试剂盒;设备:低温高速离心机;Thermo酶标仪。
1. 2 实验方法
1. 2. 1 建立RSV感染的16HBECs的炎症模型Hep-2细胞、16HBECs生长培养采用高糖DMEM培养基, 细胞生长环境为37℃、5% CO2、95%湿度培养箱下培养。每隔2~3 d传代一次, 取对数期生长的细胞试验。
1. 2. 2 RSV 培养及组织培养感染量(TCID50)测定用Hep-2细胞对RSV进行扩增。当细胞病变(cytopathic effect, CPE)总数达到80%时收集细胞, 于-80℃/37℃的条件中反复冻融3次, 最后一次冻融尽量最大程度的收集细胞, 使之释放病毒。将收集得来的细胞悬液在低温离心机上2500 r/min, 离心10 min, 收集上清液, 采用0.22 μm滤膜过滤, 得到病毒悬液,沉淀则弃之。然后分装后于-80℃保存。按依Reed-Muench两氏法计算TCID50。
1. 2. 3 RSV诱导16HBECs炎症模型的建立不同滴度的病毒的培养基作为RSV 感染组, 设不含滴度病毒培养基的正常细胞对照组。收集12~72 h内被感染不同滴度的RSV的16HBECs上清液, 待测炎症因子。
1. 2. 4 孟鲁司特对RSV所致16HBECs炎症的影响CCK-8法检测孟鲁司特对细胞的毒性:细胞存活率=药物作用孔的OD值/正常对照组的OD值。确定各药物的最大无毒浓度。ELISA按试剂盒说明书进行检测炎症因子IL-1β、IL-6、TNF-α。
1. 3 统计学方法 采用SPSS19.0统计学软件进行统计分析。计量资料以均数±标准差表示, 多组比较采用单因素方差分析, 多组组间对比采用LSD检验。P<0.05表示差异具有统计学意义。
2 结果
2. 1 RSV毒力测定每50 μl的原液含104.7TCID50, 病毒滴度为104.7TCID50/50 μl。
2. 2 RSV诱导16HBECs炎症模型的建立随着RSV感染滴度的增多, IL-1β、TNF-α、IL-6的分泌量呈上升趋势(P<0.05),随感染时间延长, 相同滴度水平下IL-1β、TNF-α、IL-6的分泌量与12 h相比较也持续增多(P<0.05)。
2. 3 孟鲁司特对RSV所致16HBECs炎症的影响
2. 3. 1 药物毒性测定24 mg/L及48 mg/L的孟鲁司特、1∶320以上稀释倍数利巴韦林对16HBECs是有一定的抑制作用的, 12 mg/L及以下浓度的孟鲁司特、1∶320及以下的稀释倍数利巴韦林对细胞的生长均无明显的抑制作用。
2. 3. 2 孟鲁司特对RSV所致16HBECs炎症的影响高中低三个剂量的孟鲁司特钠组、利巴韦林组与模型组比较, 三个炎症因子的表达水平都有显著的降低(P<0.05);高中剂量组分泌的IL-1β、IL-6、TNF-α的含量比利巴韦林组分泌的量低(P<0.05)。见表1。
表1 孟鲁司特对RSV所致16HBECs炎症因子的影响
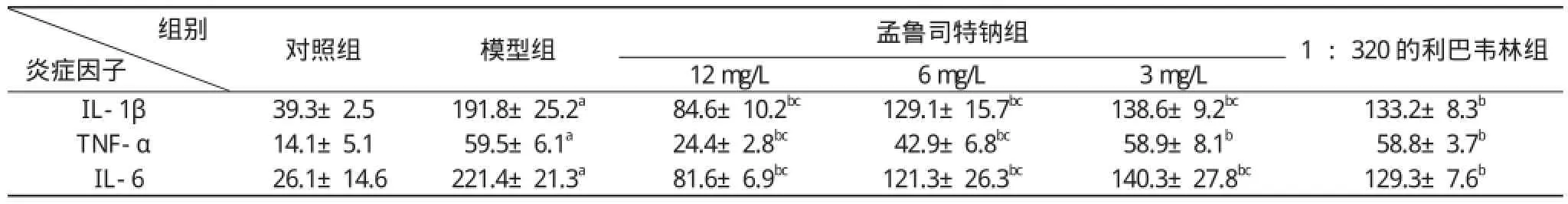
表1 孟鲁司特对RSV所致16HBECs炎症因子的影响
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与利巴韦林组比较,cP<0.05
3 讨论
该实验成功建立了永久性RVS感染人支气管上皮细胞的模型并开展后续的研究。有体内外研究表明, RSV感染的气道上皮细胞分泌高水平的IL-6、IL-1β、IL-8能调节刺激正常T细胞的表达, 调节活化正常T细胞表达以及其他促炎症因子和趋化因子[2-6]。
孟鲁司特是我国临床上用于治疗小儿支气管哮喘的指南, 作为一种新型的非甾体类抗炎药, 还具有一系列CysLT1Rs非依赖性的次级抗炎性, 抑制嗜酸性粒细胞在气道血管内皮的粘附于迁移活动[1,7-9]。孟鲁司特单用对轻度持续性哮喘小儿有较好的治疗效果, 并且副作用小[10-12]。
研究表明, 造模过程中随RSV感染滴度的增多, 16HBECs分泌的IL-1β、TNF-α、IL-6越多(P<0.05);同一感染滴度RSV作用时间越长, 炎症因子的分泌量持续升高(P<0.05)。12 mg/L及以下药物浓度的孟鲁司特和1∶320及以下稀释倍的利巴韦林对细胞增殖没有抑制作用。与感染RSV组相比,高中剂量孟鲁司特组较利巴韦林组抑制炎症因子的作用明显(P<0.05)。孟鲁司特对炎症因子IL-1β、TNF-α、IL-6这三个指标都能明显的改善。但孟鲁司特抑制炎症反应机制目前为止尚未十分明确, 阐明其对炎症反应的影响对支气管哮喘的治疗具有深远的意义。
[1] 钟慧, 洪建国. 半胱氨酰白三烯受体拮抗剂孟鲁司特的研究进展. 中国哮喘杂志, 2011, 5(5):362-366.
[2] Asada M, Yoshida M, Suzuki T, et al. Macrolide antibiotics inhibit respiratory syncytial virus infection in human airway epithelial cells. Antiviral Research, 2009, 83(2):191-200.
[3] 王金华. 呼吸道合胞病毒感染启动气道重塑的机制研究. 广州医学院, 2010.
[4] 蓝丹. RSV感染对人支气管上皮细胞TSLP合成的影响及痰热清的干预研究. 中山大学, 2010.
[5] 刘筱蔼. RSV感染对人支气管上皮细胞炎症和基质粘附功能的影响. 中南大学, 2013.
[6] 夏虎, 骆利敏, 于化鹏, 等. 不同因素对RSV感染人支气管上皮细胞表达胸腺基质淋巴细胞生成素的影响. 南方医科大学学报, 2010, 30(3):519-522.
[7] 秦岭. RSV感染支气管上皮细胞致Th细胞亚群漂移作用研究.中南大学, 2011.
[8] 赵茜叶, 孙乾, 丁铁梅, 等. 孟鲁司特对呼吸道合胞病毒毛细支气管炎后气道炎症的干预作用. 中国妇幼保健, 2011, 26(20): 3083-3085.
[9] 于艳艳, 刘继贤. 孟鲁司特钠对呼吸道合胞病毒毛细支气管炎后气道炎症的作用. 临床儿科杂志, 2009, 27(12):1177-1180.
[10] 郑爱英. 孟鲁司特钠佐治小儿毛细支气管炎的疗效及其对机体免疫学指标的影响. 中国临床研究, 2015, 28(6):723-726.
[11] 邓宇红, 李莉. 孟鲁司特钠治疗儿童呼吸道合胞病毒毛细支气管炎的临床评价. 药物评价研究, 2015, 38(6):664-667.
[12] 彭秋莹, 叶宇明, 彭燕丽. 布地奈德联合孟鲁司特防治RSV下呼吸道感染疗效与后续喘息的研究. 广州医药, 2014, 45(6):26-29.
10.14164/j.cnki.cn11-5581/r.2017.08.074
2017-03-21]
510800 广州市中西医结合医院(江敏时 郭奕文邹志浩);中山大学孙逸仙纪念医院(檀卫平)

