益气活血通络解毒方对小鼠肺缺血/再灌注损伤的作用及其机制*
宋 冬, 郝卯林, 项冰倩, 罗梓垠, 石 璐, Wu Yiming, 王万铁△
(1. 温州医科大学缺血/再灌注损伤研究所, 浙江 温州 325035; 2. 四川省宜宾卫生学校生理教研室, 宜宾 644000; 3. Division of Cardiovascular Medicine University of Iowa Carver College of Medicine, Iowa City 52242, USA; 4. 南京医科大学康达学院病理学与法医学教研室, 连云港 222000)
益气活血通络解毒方对小鼠肺缺血/再灌注损伤的作用及其机制*
宋 冬1,4, 郝卯林1+, 项冰倩1, 罗梓垠1, 石 璐2, Wu Yiming3, 王万铁1△
(1. 温州医科大学缺血/再灌注损伤研究所, 浙江 温州 325035; 2. 四川省宜宾卫生学校生理教研室, 宜宾 644000; 3. Division of Cardiovascular Medicine University of Iowa Carver College of Medicine, Iowa City 52242, USA; 4. 南京医科大学康达学院病理学与法医学教研室, 连云港 222000)
目的:探讨益气活血通络解毒方(YHTJF)对小鼠的肺部缺血/再灌注(I/R)损伤,及对I/R引起的氧化应激反应的作用。方法:成年雄性10~12周龄C57BL/6J小鼠70只,体重(21~25)g,采用在体左肺门夹闭法复制缺血/再灌注损伤模型。随机分为7组:正常对照组(C),羧甲基纤维素钠carboxyl methyl cellulose-Na(CMC-Na)+正常对照组(CC),羧甲基纤维素钠+假手术组(CS),羧甲基纤维素钠+I/R模型组(CIR),羧甲基纤维素钠+YHTJF低、中、高浓度干预组(CYL、CYM、CYH)。CN、CS、CIR组术前连续7 d腹腔注射CMC溶液,CYL、CYM、CYH组术前连续7 d腹腔注射低、中、高浓度的YHTJF溶液。术毕,取左肺测定肺组织干湿比(W/D)及总肺含水量(TLW),行肺组织损伤评估(IQA),光镜观察肺组织形态学结构改变。TUNEL测组织细胞凋亡指数(AI)。检测血清超氧化物歧化酶(SOD)、丙二醛(MDA)、髓过氧化物酶(MPO)。结果:相比C组,CC组和CS组所有检测指标均无明显差异,CIR组的W/D、TLW、IQA、AI明显升高(P<0.01),肺组织形态学破坏显著;MDA含量、MPO活力明显升高,SOD活性显著降低。与CIR组比较,CYL组、CYM组、CYH组W/D、TLW、IQA、AI的表达均明显下降(P<0.01),组织损伤明显减轻,CYM组各项指标数值改善最明显,组织损伤最轻;3个用药组的MDA含量、MPO活力明显下降,SOD活性显著升高,其中中剂量用药组氧化应激指标变化最突出。结论:YHTJF可有效减轻小鼠缺血/再灌注性肺损伤,以中剂量效果为最佳,其机制可能与其抑制体内氧化应激反应、减轻肺组织细胞凋亡有关。
益气活血通络解毒方;小鼠;肺缺血/再灌注损伤;氧化应激;细胞凋亡
【DOI】 10.12047/j.cjap.5450.2017.038
肺缺血/再灌注损伤(lung ischemia-reperfusion injury,LI/RI)是导致急性肺损伤的主要原因之一,其发生与活性氧(reactive oxygen species,ROS)的形成、内皮细胞的损伤、血管通透性增加、中性粒细胞和血小板的活化、细胞因子和补体系统的改变息息相关。目前已有大量报道,具有益气、活血、通络等功效的中药对心、脑、肾等脏器在缺血/再灌注过程中的损伤有明显的减轻作用[1-6],但对这些中药在肺脏缺血/再灌注方面的作用研究却极少,故本实验通过应用益气活血通络解毒方(yiqi huoxue tongluo jiedu fang,YHTJF)对C57BL/6J小鼠左肺模拟缺血/再灌注模型进行干预,观察比较不同组别的肺组织损伤、细胞凋亡及氧化应激的相关指标,研究YHTJF对LI/RI有无影响以明确治疗效果,并阐明药物作用是否与干预氧化应激有关。
本研究将为深化、丰富中医病络理论体系提供科学依据,奠立“毒邪”损络、“病络”生成的病理生理基础,为从“毒损肺络” 论治再灌注肺组织细胞凋亡,以及中医药提高肺移植存活率提供新的思路和方法。本课题研究尤其在弘扬祖国传统医学、发展中西医结合上具有重大的社会意义,不仅为临床实践提供有效的、易行的防治LI/RI的手段,而且将拓展YHTJF的临床应用,具有非常广泛的应用前景,并将产生较大的经济效益。
1 材料与方法1.1 动物和主要试剂
SPF级C57BL/6J成年雄性小鼠,体重(21~25)g,由温州医科大学实验动物中心提供,动物使用许可证号为SYXK(浙)2012-075。
YHTJF(北京中医药大学组方,黄芪甲苷和虎杖苷购于成都思科华生物技术有限公司,三七总皂苷购于广西梧州制药集团股份有限公司,混合后呈黄白色状粉末,纯度>98%),经文献[7-11]、蒸发散射检测仪及高效液相色谱仪分析,将3种单体依低(0.8 mg/ml 黄芪甲苷+3 mg/ml 三七总皂苷 +0.8 mg/ml 虎杖苷)、中(1.6 mg/ml 黄芪甲苷+6 mg/ml 三七总皂苷 +1.6 mg/ml 虎杖苷)、高(3.2 mg/ml 黄芪甲苷+12 mg/ml 三七总皂苷+3.2 mg/ml 虎杖苷)配比溶于含3%羧甲基纤维素钠(carboxyl methyl cellulose-Na,CMC-Na)的PBS无菌溶液中,超声震荡使之完全溶解;超氧化物歧化酶(superoxide dismutase,SOD) 试剂盒、丙二醛(malondialdehyde,MDA)测定试剂盒、髓过氧化物酶(myeloperoxidase,MPO)试剂盒 (南京建成生物工程研究所)。
1.2 动物分组与处理
随机分为7组,每组10只,分别记为:正常对照组(Control, C),羧甲基纤维素钠+正常对照组(CMC-Na+Control,CC),羧甲基纤维素钠+假手术组(CMC-Na+sham,CS),羧甲基纤维素钠+I/R模型组(CMC-Na+I/R,CIR),羧甲基纤维素钠+ YHTJF低、中、高浓度干预组(CMC-Na+YHTJF-Low、CMC-Na+YHTJF-Middle、CMC-Na+YHTJF-High, CYL、CYM、CYH)。术前,C组不做任何处理,CC、CS、CIR各组术前7 d连续腹腔注射CMC-Na溶液,CYL、CYM、CYH各组术前7 d连续每日分别腹腔注射低 中、高浓度的YHTJF溶液0.2 ml/ 10 g。手术当日,C、CC组直接安乐死处死小鼠取标本;CS组只开胸,不夹闭肺门,3.5 h后安乐死处死小鼠取标本;其余4组均开胸夹闭肺门30 min,再松开动脉夹使得左肺再灌注3 h,颈动脉取血约0.8 ml术毕均安乐死处死小鼠留取肺组织。
1.3 肺W/D及TLW值测定
术毕,取小鼠左肺上叶经漂洗、吸除表面血液和水分、称重,记为湿重(wet weight,W),置于70℃恒温烤箱48 h, 称重,记为干重(dry weight,D)。W/D比值表示肺干湿比(wet weight to dry weight of lung tissue,W/D),计算 (W-D)/D 得总肺水含量(total lung water content,TLW)。
1.4 光镜观察及肺泡损伤定量指标的评估
取约0.5 cm×0.5 cm×0.5 cm小鼠左肺下叶组织,漂洗并固定。石蜡包埋、切片,经H&E染色后封片,光镜(×200)下观察肺组织的形态学变化。随机取50个视野观察,将肺泡内红细胞和(或)白细胞数目大于2个或肺泡内水肿有液渗出者视为损伤细胞,每视野内损伤肺泡数在总肺泡数中的百分比记作肺泡损伤定量指标(index of quantitative evaluation for alveolar damage,IQA)。
1.5 血清中 SOD、MDA、MPO 测定
再灌注结束后取小鼠颈动脉血约0.8 ml,注入空白离心管中,于4℃ 3 000 r/min 离心10 min 后取上清即为血清。分别按照试剂盒提供的说明书进行各物质含量的测定。
1.6 TUNEL法检测肺组织的细胞凋亡情况
依试剂盒说明书操作,光镜(×400)下观察计数,胞核棕褐色者记为凋亡细胞。观察约500个细胞/片,计每100个细胞内的阳性细胞数为凋亡指数(apoptotic index,AI)。
1.7 统计学处理
2 结果
2.1 各组肺W/D、TLW及IQA的变化
较之C组,CC组、CS组各项指标与C组无明显差异,而CIR组肺W/D、TLW、IQA的值明显升高(P<0.01);较CIR组,CYL组、CYM组、CYH组的W/D、TLW及IQA值下降,以CYM组下降显著,差异有统计学显著性(P<0.01,表1)。
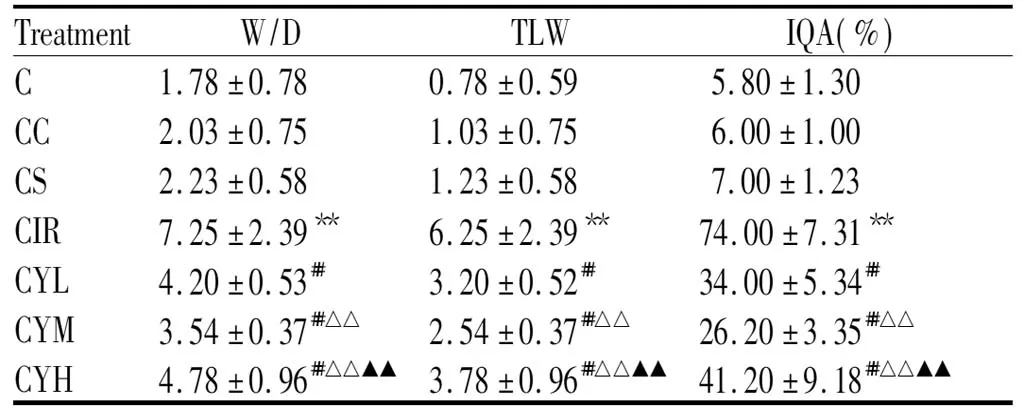
Treat-mentW/DTLWIQA(%)C1.78±0.780.78±0.595.80±1.30CC2.03±0.751.03±0.756.00±1.00CS2.23±0.581.23±0.587.00±1.23CIR7.25±2.39**6.25±2.39**74.00±7.31**CYL4.20±0.53##3.20±0.52##34.00±5.34##CYM3.54±0.37##△△2.54±0.37##△△26.20±3.35##△△CYH4.78±0.96##△△▲▲3.78±0.96##△△▲▲41.20±9.18##△△▲▲
W/D: Wet weight to dry weight of lung tissue; TLW: Total lung water content; IQA: Index of quantitative evaluation for alveolar damage; C: Control; CC: CMC-Na+Control; CS: CMC-Na+sham; CIR: CMC-Na+I/R; CYL: CMC-Na+YHTJF-Low; CYM: CMC-Na+YHTJF-Middle; CYH: CMC-Na+YHTJF-High; CMC-Na: Carboxyl methyl cellulose-Na
**P<0.01vsCS group;?##P<0.01vsCIR group;?△△P<0.01vsCYL group;?▲▲P<0.01vsCYM group
2.2 光镜下各组肺组织形态学变化
C组、CC组和CS组的肺泡结构完整,肺泡细胞无肿胀,肺间质无水肿、增厚,未见炎症细胞浸润。CIR组的肺泡细胞肿胀、结构紊乱,肺泡间质水肿、增厚,肺泡腔渗出,肺泡内水肿渗出、红细胞漏出及炎性细胞漏出。与CIR组相比,CYL组、CYM组、CYH组的肺泡结构相对较完整,肺间质水肿及炎症细胞浸润不同程度减轻,以CYM组减轻明显(图1,Alv=肺泡腔;ED=水肿,方框里标注的为肺不张)。
2.3 各组血清中SOD、MDA、MPO 测定
与 C 组相比,CC组和CS组指标均无明显变化,而I/R 组血清 SOD和CAT活性显著降低(P<0.05),MDA 含量、MPO 活力显著升高(P<0.05);与 I/R组相比,用药组的MDA 含量、MPO 表达明显降低,SOD、CAT活性明显升高(P<0.05);中剂量组与其它组比较,以上数值变化最为显著(P>0.05,表2)。

Fig. 1 The structure of the lung under light microscope (HE ×200) ALV: Alveolus; ED: Edema; □: Atelectasis A: C group; B: CC group; C: CS group; D: CIR group; E: CYL group; F: CYM group; G: CYH group
2.4 各组肺组织细胞凋亡观察及AI的改变
C组、CC组和CS组细胞凋亡数量较少,与之相比,CIR组细胞凋亡数量明显增多,细胞凋亡以肺血管内皮细胞、肺泡上皮细胞为主,AI亦均明显升高,差异有统计学显著性(P<0.01);与CIR组相比,CYL组、CYM组、CYH组细胞凋亡减少,AI均降低,以CYM组下降明显,差异有统计学显著性(P<0.01, 表2、图2,箭头标注的颗粒为被染色的阳性细胞)。
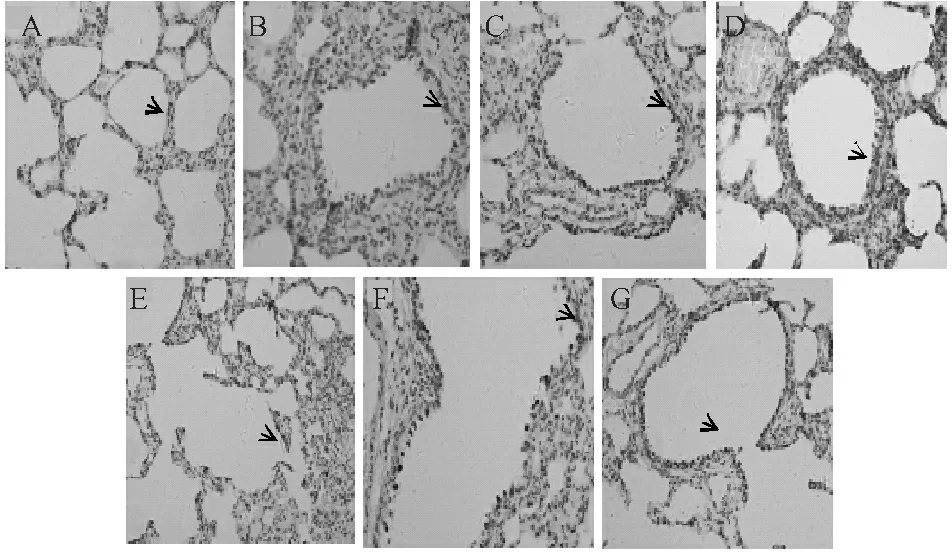
Fig. 2 The apoptosis of the lung tissues under light microscope (POD ×400) A: C group; B: CC group; C: CS group; D: CIR group; E: CYL group; F: CYM group; G: CYH group

Tab. 2 Changes of the content of MDA and the activities of MPO and SOD in serum of rat in different ±s, n=5)
SOD: Superoxide dismutase; MDA: Malondialdehyde; MPO: Myeloperoxidase; AI: Apoptotic index
*P<0.05vsCS group;?##P<0.01vsCIR group;?△P<0.05vsCYL group;?▲P<0.05vsCYM group
2.5 相关性分析
肺组织的AI与MDA、MPO的活性、W/D、TLW、IQA之间呈显著正相关关系(r分别为0.887、0.943、0.907、0.825、0.911,P均<0.01),与SOD的活性呈负相关(r=-0.939,P<0.01)。
3 讨论
本实验中,我们将小鼠随机分到C、CC、CS、CIR、CYL、CYM、CYH组,每组10只。组别设置思路为控制变量:CC组和C组比较,检测结果无明显差异,说明羧甲基纤维素钠作为药物溶剂载体,对本实验无影响;CS组和CC组比较,所测值无明显差异,说明我们手术操作对实验基本不会产生影响,因CC组和C组无明显差异,故也可直接将CS组和C组进行比较;CIR组和CS组比较,有明显差异,表明我们缺血/再灌注损伤模型造模较成功。以上结果成立时,说明本实验中仅缺血/再灌注这一操作是影响小鼠肺部损伤程度的外因变量。用药组和CIR组比较,有明显差异,说明药物对LI/RI模型有显著的干预作用;将用药组两两比较,有显著统计学差异,表明不同用药剂量对模型的干预作用不同,进而可筛选较为理想的用药剂量。
研究证明,LI/RI 的一个重要的机制就是多种细胞释放出的ROS增加的复杂的级联反应。ROS 在肺缺血/再灌注损伤中起主要作用可以引起组织的脂质过氧化损伤并释放弹性蛋白酶、溶酶体酶等损伤和破坏肺组织结构导致肺水肿。目前,临床上常用血清中SOD、MDA、MPO的含量作为诊断肺组织细胞氧化损伤程度的常用指标。肺组织中SOD 水平能够反映其抵抗氧自由基损伤能力,脂质过氧化终产物 MDA和MPO含量能够间接反映细胞氧化应激损伤程度。本实验中,与 C 组相比,CC组和CS组的氧化应激相关指标均无明显变化,而I/R 组血清 SOD活性显著降低(P<0.05),MDA 含量、MPO 活力显著升高(P<0.05),表明 LI/RI 发生后,体内OFR 骤增,清除能力不足,导致脂质过氧化损伤,削弱组织抗氧化应激的能力。通过相关性分析,肺组织的AI与MDA、MPO的活性呈显著正相关关系(r分别为0.887、0.943,均P<0.01),与SOD的活性呈负相关(r=-0.939,P<0.01),说明小鼠肺缺血/再灌注损伤造成的细胞凋亡和氧化应激机制密切相关。
多项研究均证实,中医药具有较佳的防治LI/RI的作用,已取得一定的成果[8-11]。但由于中药复方和单味中药其成分复杂、重整体而轻微观的特性、药理作用多样以及作用机制复杂,故将中医药更多地应用在临床患者身上,还需要克服很多难题。本实验表明,在W/D、TLW检测中,较之CIR组,经YHTJF处理后的各用药组标本的水肿数值指标明显降低,中剂量用药组标本水肿指标数值减低最为显著,表明YHTJF可有效减轻缺血/再灌注对其造成的肺水肿,起到保护肺脏的功效,且中剂量用药对缺血/再灌注情况下的肺保护效果最佳;通过光镜检测,用药组肺泡结构紊乱情况较CIR组较大程度改善,肺泡中水肿不明显,肺间质增宽较CIR组减轻,红细胞渗漏减少,炎性浸润亦减少,表明YHTJF具有改善缺血/再灌注损伤状态下肺组织受损结构和功能的功能,对受损的肺有良好的保护作用;而中剂量组数据的统计结果显示IQA低于低剂量和高剂量组(P<0.01),进一步表明,使用中剂量YHTJF时,小鼠受损的肺部结构相对最完好,说明中剂量YHTJF对肺的保护效果最好;经电镜检测,用药组标本切片的肺泡内核遭到破坏情况较CIR组显著减轻,核染色质的分布较CIR组相对均匀,板层小体的数量接近正常且形态尚完好,线粒体轻微肿胀,以上说明用药组肺组织微观结构和功能相对完好,进一步说明YHTJF具有良好的保护肺组织的功能;由TUNEL检测发现,用药组的细胞凋亡量明显少于CIR组,且3个用药组中CYM组标本的凋亡细胞最少,结合相关性分析结果AI与W/D、TLW、IQA之间呈显著正相关关系(r分别为0.907、0.825、0.911,均P<0.01),表明YHTJF用药组可有效减少因缺血/再灌注而凋亡的肺泡细胞,且使用中剂量药物能最大程度地减少肺泡细胞凋亡。分析用药组里中剂量组对再灌注损伤的肺保护效果最好,而高剂量组的保护作用却降低,考虑可能的原因为随着用药浓度增加,其毒副作用同步增加,高剂量组起保护作用的同时,由于药物毒副作用随着浓度升高而加强,高浓度YHTJF会较大程度毒害肺脏。
氧化应激实验结果显示,与 I/R组相比,用药组的MDA 含量、MPO 表达明显降低,SOD活性明显升高(P<0.05);中剂量组与低剂量和高剂量组比较,MDA、MPO、SOD的数值变化最为显著(P>0.05),表明YHTJF的应用可有效抑制组织细胞的氧化应激,且中剂量用药时抑制作用最佳。经相关性分析,AI与MDA、MPO的活性呈显著正相关关系(r分别为0.887、0.943,P均<0.01),与SOD的活性呈负相关(r=-0.939,P<0.01),进一步说明YHTJF在肺再灌注时减少OFR产生,并使内源性对OFR 的清除功能增强,使组织的脂质过氧化反应减轻,可有效抑制氧化应激造成的组织细胞凋亡,对缺血/再灌注损伤的肺有良好的保护作用。
综上所述,YHTJF可有效减轻小鼠肺缺血/再灌注损伤,以中剂量效果为最佳,其作用机制可能与抑制体内氧化应激反应、减轻肺组织细胞凋亡有关。因本药只在数量有限的小鼠体内做实验,可能出现的一些副作用和其它问题尚未可知,对于将药物应用于临床尚需进一步研究。
[1] Papadopoulos D, Siempis T, Theodorakou E,etal. Hepatic ischemia and reperfusion injury and trauma current concepts[J].ArchTraumaRes, 2014, 2 (2): 63-70.
[2] Wang YH, Tian JH, Qiao X,etal. Intermedin protects against renal ischemia-reperfusion injury by inhibiting endoplasmicreticulum stress[J].BMCNephrol, 2015,16: 169.
[3] Gui DK, Huang JH, Liu W,etal. Astragaloside IV prevents acute kidney injury in two rodent models by inhibiting oxidative stress and apoptosis pathways [J].Apoptosis, 2013, 18(4): 409-422.
[4] Endo M, Oyadomari S, Suga M,etal. The ER stress pathway involving CHOP is activated in the lungs of LPS-treated mice[J].JBiochem, 2005, 138(4): 501-507.
[5] 张松涛, 王 徽, 张权宇, 等. 虎杖苷通过PKC对大鼠离体缺血再灌注心肌的保护作用[J]. 心脏杂志, 2010, 22(3): 354-356.
[6] 周俊辉, 王良荣, 郝卯林, 等. 靶向小干扰RNA对小鼠肺缺血/再灌注损伤时细胞凋亡及CCAAT/增强子结合蛋白同源蛋白的作用[J]. 中华实验外科杂志, 2013, 30(8): 1608-1611.
[7] 熊 平, 蒋灵芝, 廖秀清. 黄芪甲苷保护大鼠肺缺血再灌注肺损伤的形态学研究[J]. 南方医科大学学报, 2010, 30(8): 1864-1867.
[8] 王方岩, 徐正礻介, 张晓隆, 等. 虎杖甙抗肺缺血/再灌注损伤作用及其机制初探[J]. 中国应用生理学杂志,2008, 24(1): 62-65.
[9] 邱晓晓, 宋张娟, 戴雍月, 等. 三七总皂苷对肺缺血/再灌注损伤时细胞凋亡及c-Jun氨基末端激酶的影响[J]. 生理学报, 2012, 64(2): 135-141.
[10]谭 华, 黄小平, 邓常清. 黄芪总苷和三七总皂苷配伍对小鼠缺血/再灌注脑组织氧化应激的影响[J]. 中西医结合学报, 2010, 8(5): 448-452.
[11]祝 辉, 罗自力, 顾建文, 等. 红景天苷衍生物的合成及其抗氧化作用研究[J]. 解放军药学学报, 2013, 29(4): 290-292, 296.
*【基金项目】河南省科技厅基础与前沿技术研究项目(132300410270)
The effects of YHTJF on lung ischemia/reperfusion injury in mice
SONG Dong1,4, HAO Mao-lin1+, XIANG Bing-qian1, LUO Zi-yin1, SHI Lu2, Wu Yiming3, WANG Wan-tie1△
(1. Ischemia/Reperfusion Injury Research Institute,Wenzhou Medical University,Wenzhou 325035,China; 2. Department of Physiology of Yibin Health School, Yibin 644000,China; 3. Division of Cardiovascular Medicine University of Iowa Carver College of Medicine, Iowa City 52242,USA;4.Department of Pathology and Forensic Medicine of KangDa College of Nanjing Medical University, Lianyungang 222000, China)
Objective: To explore whether yiqi huoxue tongluo jiedu fang (YHTJF, Traditional Chinese Medicine) alleviates the injury during lung ischemia/reperfusion (I/R) in mice through inhibiting oxidative stress or not. Methods: C57BL/6J male mice (n=70) were randomly divided into 7 groups: control (C), carboxyl methyl cellulose-Na(CMC·Na)+normal control (CC), carboxyl methyl cellulose-Na+ sham (CS), carboxyl methyl cellulose-Na+I/R (CIR), carboxyl methyl cellulose-Na+YHTJF-Low, CMC-Na+YHTJF-Middle, CMC-Na+YHTJF-High (CYL, CYM, CYH). The mice in CYL, CYM and CYH group were treated with YHTJF by intraperitoneal injection every day, while the carboxyl methyl cellulose-Na was administered with the same volume of CYL in CC, CS and CIR group. After 3 h-reperfusion, the left lung tissues were harvested to determine the lung wet/ dry weight (W/D), the total lung water content (TLW), and the index of quantitative evaluation for alveolar damage (IQA). Morphological observation and terminal-deoxynucleoitidyl transferase mediated nick end labeling (TUNEL) were applied to evaluate the structural changes and the apoptosis index (AI) of the lung tissues. The expressions superoxide of dismutase(SOD), malondialdehyde(MDA) and myeloperoxidase(MPO) in the lung tissues were detected by kits. Results: Compared with group C, the W/D, TLW, IQA, AI, lung tissue structural changes, and the expressions of MDA and MPO in group I/R were increased obviously (P<0.01), and the expression of SOD was decreased, while there was no significant difference between group CC and CS. Compared with group I/R, the parameters of these experiments in group CYL, CYM, CYH were all decreased, and the expression of SOD was increased, while the reduction in group CYM was the most remarkable among them (P<0.01). Conclusion: YHTJF may attenuate the I/R injury of the lung by the inhibition of apoptosisviaROS pathway.
YHTJF; lung ischemia/reperfusion injury; reactive oxygen species(ROS); apoptosis; mice
浙江省中医药重点研究计划(2013ZZ011);四川省宜宾市重点科技项目(2015SF035)
2016-04-28
2016-12-07
R363
A
1000-6834(2017)02-151-05
△【通讯作者】Tel: 0577-86689817; E-mail: wwt@wmu.edu.cn+:为共同第一作者

