2017年3月FDA批准新药概况
2017年3月,FDA批出4个新分子实体药品和3个新生物制品(表1),为治疗乳腺癌药物Kisqali(ribociclib)、治疗帕金森病药物Xadago(沙芬酰胺)、治疗便秘药物Symproic(naldemedine)、治疗癌症药物Zejula(尼拉帕尼)、治疗罕见型皮肤癌药物Bavencio(avelumab)、治疗多发性硬化症药物Ocrevus(ocrelizumab)和治疗湿疹药物Dupixent(dupilumab)。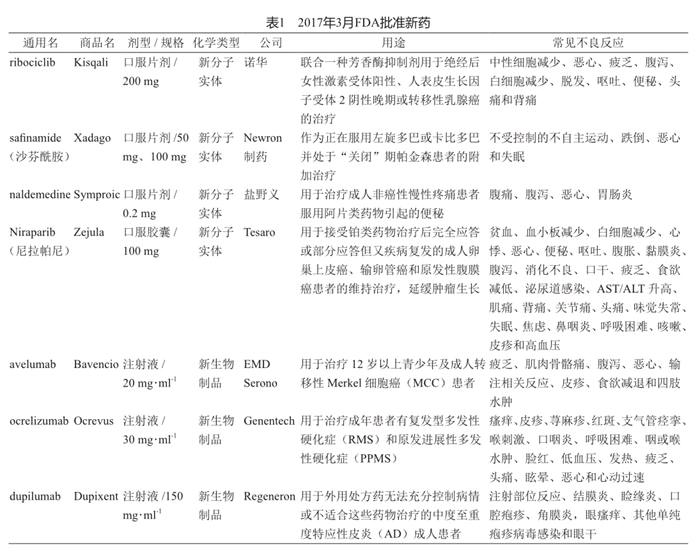
1 Kisqali(ribociclib)
Kisqali获“突破性治疗药物”指定和“优先审评”地位,被批准与芳香化酶抑制剂联合用于绝经后激素受体阳性(HR+)、人类表皮生长因子受体-2阴性(HER2-)的晚期或转移性乳腺癌女性患者的初始治疗。乳腺癌是美国妇女第二常见的癌症。据美国癌症学会估计,2017年约有25万多妇女将被诊断为浸润性乳腺癌,而且高达1/3的早期乳腺癌患者将随后发展进入转移阶段。 Kisqali是一种口服靶向性细胞周期蛋白依赖性激酶4和6(DK4/6)抑制剂,恢复细胞周期控制,阻断肿瘤细胞增殖。CDK4/6是细胞周期的关键调节因子,能够触发细胞周期从生长期(G1期)向DNA复制期(S1期)转变。细胞周期失控是癌症的一个标志性特征,CDK4/6在许多癌症中均过度活跃,导致细胞增殖失控。
Kisqali成为继辉瑞靶向抗癌药Ibrance之后FDA批准的第2款CDK4/6抑制剂。Kisqali的获批,是基于3期临床研究MONALEESA-2的数据。数据显示,与来曲唑(一种芳香酶抑制剂)单药治疗相比,Kisqali联合来曲唑使疾病进展或死亡风险显著降低了44%。在中期分析时,该研究就提前达到了主要终点。额外随访11个月后开展的分析显示,Kisqali联合来曲唑治疗组中位无进展生存期为25.3个月,来曲唑单药治疗组为16.0个月,此外Kisqali联合来曲唑治疗组有超过53%的患者其肿瘤体积缩至少30%。
2 Xadago(沙芬酰胺)
Xadago被批准辅助治疗正在服用左旋多巴或卡比多巴并处于“关闭”期帕金森患者。Xadago也是美国抗帕金森病新药市场十多年来首个批准的药物。帕金森病是继阿尔兹海默症后全球第二常见的老年慢性神经退行性疾病,是由大脑中分泌多巴胺的细胞受损或死亡所致,该病的早期症状不易察觉、逐渐进展,某些患者的疾病进展较其他患者更快。据美国国立卫生研究院统计,每年约有50 000美国人被确诊患有帕金森病。据估计,全世界65岁以上的老年人中,约有1%~2%的人患有帕金森病。而“关闭”期是指患者服用的药物疗效不佳,使帕金森症状加重,如震颤或行走困难。相对应的“开启”期是指症状减轻,没有运动功能障碍。Xadago属于可逆的单胺氧化酶B(MAO-B)和多巴胺再摄取抑制剂,正是一款能应对关闭期的药物,能选择性地抑制MAO-B。MAO-B会降解多巴胺,而多巴胺能够在脑区传递信号,对于流畅的自主运动非常重要。
在两项分别有645名和549名帕金森病患者参与的临床试验中,Xadago的疗效得到了证实。与服用安慰剂的患者相比,服用Xadago的患者,开启期得到显著延长,关闭期则有所缩短。此外在开启期,患者们的运动能力评分也更高,并没有出现不受控制的运动。严重肝病患者以及服用了右美沙芬来治疗感冒和咳嗽的患者不应服用Xadago。在服用单胺氧化酶抑制剂的患者也不能服用Xadago,会有导致血压急剧升高的风险。此外,服用阿片类药物贯叶连翘、某些抗抑郁药物(如5-羟色胺/去甲肾上腺素再摄取抑制剂、三环类和四环类药物)或环苯扎林的患者也不能使用Xadago,因为它可能诱发危及生命的5-羟色胺综合征。
3 Symproic(naldemedine)
Symproic被批准用于治疗成人慢性非癌性疼痛患者阿片类药物引起的便秘(opioid-induced constipation, OIC)。便秘是阿片类药物的最常见副作用之一。当阿片类药物与胃肠道中的阿片受体结合时,可能会诱发便秘。在慢性非癌性疼痛患者中,便秘患病率为40%~50%。
Symproic是外周作用μ阿片受体拮抗剂,其上市批准是基于Compose临床项目,该项目属于在慢性非癌性疼痛患者以及阿片类药物引起的便秘患者中开展的全球综合性的临床开发研究。研究人员对受试者进行了2~4周的筛查,然后随机分配参与者接受安慰剂或0.2 mg Symproic,1次/d,共12周。研究人员对参与者进行了为期4周的随访,并在16周后进行了额外的评估,以首次剂量后4~24 h内自发排便(SBM)或完全SBM(CSBM)的患者比例和首剂量后开始SBM或CSBM的时间为探索性疗效终点分析,研究者定义积极应答为在1周内有3次或以上的SBM。Compose I中使用Symproic治疗的患者中47.6%有应答,安慰剂组为34.6%;Compose II使用Symproic治疗的患者有52.5%应答,安慰剂组为33.6%。Symproic组首次开始SBM或CSBM的时间比安慰剂组短,并且Symproic的效果在整个12周的治疗期间是持续的,使用Symproic治疗的患者中首次剂量后24 h内有1次或多次SBM的患者比例明显高于安慰剂组,CSBM率也同样高于安慰剂组,而不良事件率相似。
4 Zejula(尼拉帕尼)
Zejula获“孤儿药”和“突破性治疗药物”指定以及“优先审评”地位,通过快速审批程序批准用于接受铂类药物治疗后完全应答或部分应答但又疾病复发的成人卵巢上皮癌、输卵管癌或原发性腹膜癌患者的维持治疗,延缓肿瘤生长。卵巢上皮癌、输卵管癌或原發覆膜癌都是覆盖在卵巢组织或者输卵管内膜或腹壁的一种癌。卵巢癌是全球女性第5大易患的癌症,美国国家癌症研究所估计每年有约22 000名女性经诊断患有卵巢癌,超过14 000将死于这些疾病。由于卵巢癌早期并无明显症状,有将近80%的患者在确诊时,病情已经发展到了晚期,给治疗带来了极大难度。目前以铂类药物为基础的化疗是治疗卵巢癌的标准治疗,但经治疗后,有90%的患者会在2年内出现病情复发。Zejula是一种多聚二磷酸腺苷核糖聚合酶(PARP)抑制剂,主要针对的是BRCA1/2基因突变的癌症,PARP是一种涉及修复受损的DNA酶。Zejula通过阻断此酶,在癌细胞中的DNA便被更少地修复,从而导致细胞死亡,进而可能减缓或者停止肿瘤的发展。
Zejula的批准是基于一项553名患者的随机试验中确定了安全性和有效性,结果显示在生殖细胞系BRCA突变的患者中位无进展生存时间(治疗后肿瘤不生长所持续的时间长度,PFS)为21个月,而安慰剂组为5.5个月;而无BRCA突变的患者,Zejula组无进展生存时间为9.3个月,安慰剂组为3.9个月。
5 Bavencio(avelumab)
Bavencio获“孤儿药”和“突破性治疗药物”指定以及“优先审评”地位,授权加快批准用于12岁以上青少年及成人转移性Merkel细胞癌(Merkel cell carcinoma, MCC)患者的治疗。Bavencio是全球第4个上市的PD-1/PD-L1类药物,也是第1个获批治疗这种转移性Merkel细胞癌患者的药物。转移性MCC是一种罕见的侵袭性皮肤肿瘤,确诊后1年生存率低于50%,5年生存率低于20%。按照美国癌症研究所,在美国每年约1 600人被诊断有MCC。而患者的大多数存在有可用手术切除的局部化肿瘤,约半数将会复发,超过30%最终将发生转移疾病。Bavencio靶向PD-1/PD-L1途径,通过阻断这些相互作用,Bavencio可能帮助机体免疫系统袭击癌症细胞。
Bavencio的批准是基于一项88例有转移MCC患者的单臂试验,患者以前曾用至少1种化疗方案治疗过。试验测量他们的肿瘤经历完全或部分缩小患者的百分率(总应答率)和肿瘤被控制的时间长度(应答持续期),结果显示总应答率为33%,其中11%为完全缓解,22%为部分缓解。产生应答的患者中,有86%可持续6个月以上,45%可持续12个月以上,应答持续期为2.8~23.3个月。
6 Ocrevus(ocrelizumab)
Ocrevus获“突破性治疗药物”指定和“优先审评”地位,通过快速审批程序批准用于治疗复发型多发性硬化症(relapsing multiple sclerosis, RMS)和原发进展性多发性硬化症(primary progressive multiple sclerosis, PPMS)的成年患者,这是第一个FDA批准治疗PPMS的药物。多发性硬化症(multiple sclerosis, MS)是一种慢性、炎症性、脱髓鞘的中枢神经系统疾病,可引起各种症状,包括感觉改变、视觉障碍、肌肉无力、精神忧郁等,但现有的治疗方案只能阻止该疾病的复发,而无法逆转其病理状况。MS主要分为复发缓解性MS(RRMS)、继发进展型MS(SPMS)、原发进展型MS(PPMS)、复发进展性MS(PRMS)四种类型,其中,PPMS临床没有缓解复发过程,疾病呈缓慢进行性加重。该病发病率多为青、中年,女性较男性多见。Ocrevus是一款人源化单克隆抗体,被设计用于选择性靶向CD20阳性B细胞,这一特定类型的免疫细胞被认为是造成有支持神经细胞功能的髓磷脂和轴突(神经细胞)损伤的关键性因素;而这类神经细胞损伤可导致MS患者的残疾。Ocrevus结合到某些表达CD20表面蛋白的B细胞上,但不结合干细胞或浆细胞,因此也保护了免疫系统的重要功能。
Ocrevus治疗RMS的疗效基于涉及1 600多名患者两项长达96周的3期临床试验。Ocrevus均表现出较好的疗效。而在有732名患者参加的PPMS研究中,受试者进行了至少120周的用药,与安慰剂相比,接受Ocrevus的患者显著延长了残疾恶化的时间。Ocrevus是目前为止最长效的MS治疗药物。
7 Dupixent(dupilumab)
Dupixent獲“突破性治疗药物”指定和“优先审评”地位,被批准用于外用处方药无法充分控制病情或不适合这些药物治疗的中度至重度特应性皮炎成人患者的治疗。特应性皮炎是一种严重的慢性炎症性皮肤病,往往被称为“湿疹”,主要表现为剧烈的瘙痒、明显的湿疹样变和皮肤干燥、鳞片化导致皮肤的变粗糙和增厚。特应性皮炎常常自婴幼儿发病,部分患者延续终生。特应性皮炎影响1 800万~2 500万美国人,其中婴儿和儿童占8%~18%,大约30万成人亟需创新治疗方案。Dupixent是一种人源化的单克隆抗体,被设计用于特异性抑制白细胞介素-4(IL-4)和白细胞介素-13(IL-13)的过度信号传导,这两种关键性蛋白分子被认为是特应性皮炎病理中持续性炎症的主要驱动因素。
Dupixent的安全性和有效性在3项安慰剂对照临床试验中得到验证,有总共2 119名外用药物无法有效控制病情的中度至重度特应性皮炎成年患者参加试验,参加者接受Dupixent有更显著的疗效反应,治疗16 周后瘙痒减轻、皮肤症状清除或几乎清除。Dupixent的剂型为注射液,预装于注射器中,皮下注射,其推荐剂量是一个初始剂量600 mg,在不同注射部位2次300 mg注射,接着每隔1周皮下注射300 mg/次,可自行注射和单独使用,也可与外用皮质甾体药物联合使用。
(张建忠)

