葡萄籽原花青素提取物对糖尿病小鼠的保护作用
王芳,王俊,胡博,任美萍
(1.西南医科大学药学院,四川泸州646000;2.西南医科大学药物与功能性食品研究中心,四川泸州646000)
葡萄籽原花青素提取物对糖尿病小鼠的保护作用
王芳1,王俊1,胡博1,任美萍2,*
(1.西南医科大学药学院,四川泸州646000;2.西南医科大学药物与功能性食品研究中心,四川泸州646000)
研究葡萄籽原花青素提取物对链脲佐菌素(Streptozotocin,STZ)致糖尿病小鼠的作用及影响,并探讨相关机制。通过高脂饲喂结合腹腔注射STZ造糖尿病小鼠模型,将造模成功的糖尿病小鼠随机分为模型组,格列本脲组(250 mg/kg),葡萄籽原花青素(Grape seed proanthocyanidin extract,GSPE)高剂量组(400 mg/kg)、中剂量组(200 mg/kg)、低剂量组(100 mg/kg),连续灌胃8周后通过断尾取血测定糖尿病小鼠空腹血糖;摘眼球取血,分离血清,测定血清中甘油三脂(Triglyceride,TG)、总胆固醇(Total cholesterol,TC)、高密度脂蛋白胆固醇(High density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇的含量(Lowdensitylipoproteincholesterol,LDL-C);采用试剂盒测定血清白细胞介素6(Interleukin-6,IL-6)含量、C反应蛋白(C reactive protein,CRP)含量、超氧化物歧化酶(Superoxide dismutase,SOD)活性、胰岛素(Insulin,INS)含量,丙二醛(Malonaldehyde,MDA)含量;分离胰腺,组织切片法观察胰腺组织学改变。实验结果显示GSPE高、中剂量组能显著降低STZ所导致的糖尿病小鼠的血糖;GSPE高、中剂量组的TG、TC含量比模型组的显著降低(P<0.05);GSPE高剂量组的HDL-C比模型组显著提高(P<0.05);GSPE高、中剂量组能显著降低血清中IL-6和CRP含量(P<0.05);GSPE高剂量组的INS含量与模型组比较显著性增加(P<0.05);GSPE高、中剂量组的SOD活性与模型组相比显著性增高(P<0.05),GSPE高剂量组的MDA含量与模型组比较显著性降低(P<0.05);糖尿病小鼠胰腺病变组织得到修复。综上所述,葡萄籽提取物原花青素对STZ所导致的糖尿病小鼠有明显的降低血糖和改善血脂,修复胰脏病变组织的作用,其作用机制可能与其能提高糖尿病小鼠机体抗氧化能力、降低炎症因子含量有关。
葡萄籽原花青素提取物;糖尿病;血糖;抗氧化作用;炎症因子
糖尿病是一种严重危害人类健康的内分泌代谢疾病,其并发症已成为继心脑血管疾病和肿瘤之后人类第三大致死原因[1]。目前糖尿病尚无有效根治方法,临床上常用于糖尿病治疗的西药虽然对血糖有较好的控制,但毒副作用大。因此研究安全、有效的天然降糖活性成分用以开发降血糖药物及功能食品具有重要意义。
葡萄籽原花青素(Grape seed proanthocyanidin extract,GSPE)提取物是从葡萄籽中分离出的多酚类混合物,其具有抗氧化、清除自由基、调节血脂、抗肿瘤等作用[2]。近年有报道原花青素具有调节血糖的作用,为进一步研究GSPE的抗糖尿病作用及机制,本研究建立了2型糖尿病小鼠模型,观察GSPE对糖尿病小鼠血糖、血脂、炎症因子及抗氧化作用的影响,并探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
昆明种小白鼠:雄性,体重(20±2)g,清洁级,由西南医科大学实验动物中心提供,生产许可证号SCXK(川)2013-17。
1.1.2 主要试剂及药品
葡萄籽原花青素提取物(纯度大于95%):陕西慧科植物开发有限公司;格列本脲(批号:20150330):山西云鹏制药有限公司;链脲佐菌素(Streptozotocin,STZ)(批号:617D031):sigma公司;柠檬酸钠;白细胞介素-6(Interleukin-6,IL-6)试剂盒、C反应蛋白(C reactive protein,CRP)试剂盒、超氧化物歧化酶(Superoxide dismutase,SOD)试剂盒、丙二醛(Malonaldehyde,MDA)试剂盒、小鼠胰岛素(Insulin,INS)试剂盒:上海岚派生物科技有限公司。
1.1.3 主要仪器
血糖仪(附加血糖试纸):艾康生物技术有限公司;SpectraMax M3多功能读板机:Molecular Devices公司;全自动生化分析仪:美国贝克曼DXC800;FC104型电子天平:上海精密科学仪器有限公司。
1.2 方法
1.2.1 糖尿病小鼠模型的制备及分组
将100只健康小鼠适应性普通饲料喂养1周后,随机留取10只作为正常对照组动物继续给予普通饲料喂养,其余90只小鼠高脂饲料(88%基础饲料,10%猪油,1%胆固醇,1%胆酸钠)喂养4周,禁食不禁水12 h后按90 mg/kg腹腔注射用0.1 mol柠檬酸-柠檬酸钠缓冲溶液配成的浓度为12 mg/mL的STZ溶液。(0.1 mol柠檬酸-柠檬酸钠缓冲溶液的配制:精密称取柠檬酸2.1 g加入双蒸水100 mL配成A液,精密称取柠檬酸三钠2.4 g加入双蒸水100 mL配成B液,将A、B液按体积比1∶1混合,调pH值为4.4,混合后过滤取滤液即得。)上述小鼠经过一周自由饮食后,断尾采血测定小鼠空腹血糖,选取血糖值大于11.1 mmol/L的小鼠作为糖尿病小鼠[4]。
将60只造模成功的糖尿病小鼠随机分为5组,模型组,格列本脲组,GSPE高、中、低剂量组,每组12只。
1.2.2 给药剂量及方法
从造模第7天开始每天灌胃(ig)给药1次,连续给药8周。正常对照组及模型对照组按10 mL/kg体重ig蒸馏水,格列本脲组按250 mg/kg体重ig给药,GSPE高、中、低剂量组依次按(400、200、100 mg/kg体重)给药。每隔1周称量体重,根据体重调整给药剂量。
1.2.3 观察指标与方法
实验期间每天观察小鼠体态特征变化,记录死亡率;分别于给药的第0天、28天、56天于小鼠断尾取血,用血糖仪测小鼠的空腹血糖值;给药结束后,小鼠摘眼球取血,离心分离血清,用全自动生化分析仪测定血清中甘油三脂(Triglyceride,TG)、总胆固醇(Total cholesterol,TC)、高密度脂蛋白胆固醇(High density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇的含量(Low density lipoprotein cholesterol,LDL-C),并按试剂盒方法测定IL-6、CRP、INS、MDA含量和SOD活性。取血后迅速处死动物,分离并取出胰腺,滤纸吸干水分后置于4%多聚甲醛中固定过夜,进行石蜡包埋、切片,HE染色,光镜观察。
1.2.4 统计学处理定量指标
用Excel建立数据库,用SPSS17.0统计分析软件进行数据分析,定量资料采用±s表示,组间比较采用ANOVA检验,以P<0.05有统计学意义。
2 结果
2.1 一般情况
整个实验期间,正常对照组小鼠饮食、饮水及活动行为正常。糖尿病小鼠造模成功后,明显出现多饮、多食、多尿、消瘦等症状,并出现精神萎靡,皮毛粗糙,活动减少。灌胃给药后,格列本脲组、GSPE组小鼠糖尿病症状缓解,一般状况有所改善。
2.2 GSPE对实验性糖尿病小鼠空腹血糖的影响
GSPE对实验性糖尿病小鼠空腹血糖的影响见表1。
如表1所示,与正常组比较,模型组小鼠的空腹血糖明显升高;与模型组比较,格列本脲组,GSPE高、中剂量组小鼠的空腹血糖显著降低(P<0.05)。结果表明,GSPE对STZ诱导的糖尿病小鼠具有降低血糖的作用,且降糖作用与给药剂量有关。
表1 GSPE对STZ致糖尿病小鼠空腹血糖的影响Table 1Effect of GSPE on fasting blood glucose of STZ diabetic mice(±s)

表1 GSPE对STZ致糖尿病小鼠空腹血糖的影响Table 1Effect of GSPE on fasting blood glucose of STZ diabetic mice(±s)
注:-为蒸馏水;△与模型组比较P<0.05。
血糖/(mmol/L)0 d28 d56 d正常-105.27±0.445.35±0.425.08±0.30模型-924.07±5.7523.40±5.6424.56±5.87格列本脲2501020.8±5.8219.49±5.4917.50±5.47△GSPE高4001023.75±3.9620.88±4.7418.11±6.06△GSPE中200922.83±6.0122.27±4.9219.34±7.33△GSPE低100821.54±4.0720.37±4.3319.81±3.02组别剂量/(mg/kg)动物数/只
2.3 GSPE对实验性糖尿病小鼠INS的影响
GSPE对实验性糖尿病小鼠INS的影响见表2。
表2 GSPE对STZ致糖尿病INS的影响Table 2Effect of GSPE on INS in STZ induced diabetic mice(±s)
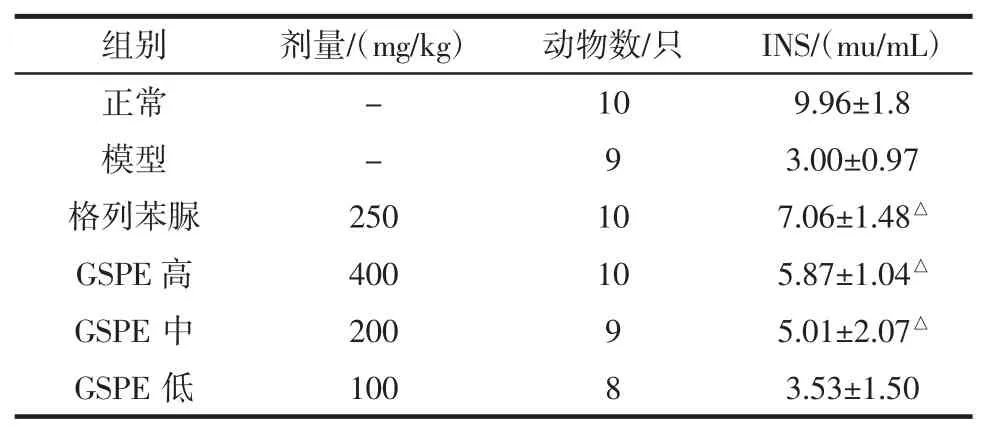
表2 GSPE对STZ致糖尿病INS的影响Table 2Effect of GSPE on INS in STZ induced diabetic mice(±s)
注:-为蒸馏水;△与模型组比较P<0.05。
组别剂量/(mg/kg)动物数/只INS/(mu/mL)正常-109.96±1.8模型-93.00±0.97格列苯脲250107.06±1.48△GSPE高400105.87±1.04△GSPE中20095.01±2.07△GSPE低10083.53±1.50
如表2所示,与正常组比较,模型组小鼠INS显著下降(P<0.05),与模型组比较格列本脲组、GSPE高剂量组的小鼠的血清INS含量明显增加(P<0.05),GSPE中剂量组INS含量增加但无显著性差异。结果表明,GSPE可提高糖尿病小鼠血清的胰岛素水平。
2.4 GSPE对实验性糖尿病小鼠血脂的影响
GSPE对实验性糖尿病小鼠血脂的影响见表3。
表3 GSPE对STZ致糖尿病小鼠血脂的影响Table 3Effect of GSPE on blood lipids of STZ diabetic mice(±s)

表3 GSPE对STZ致糖尿病小鼠血脂的影响Table 3Effect of GSPE on blood lipids of STZ diabetic mice(±s)
注:-为蒸馏水;△与模型组比较P<0.05。
组别剂量/(mg/kg)动物数/只TG/(mmol/L)TC/(mmol/L)HDL-C/(mmol/L)LDL-C/(mmol/L)正常-101.17±0.262.64±0.323.05±0.450.84±0.10模型-92.32±0.184.29±0.342.23±0.341.22±0.21格列本脲250101.36±0.13△3.63±0.55△3.02±0.31△0.87±0.13△GSPE高400101.38±0.12△3.21±0.42△2.94±0.42△1.10±0.19 GSPE中20091.66±0.14△3.89±0.58△2.49±0.441.13±0.25 GSPE低10082.15±0.374.15±0.302.59±0.231.16±0.24
如表3所示,与正常组比较,模型组小鼠血清TG、TC、LDL-C含量显著升高,而HDL-C含量显著降低(P<0.05)。与模型组比较,GSPE高剂量组、中剂量组及格列本脲组小鼠的血清TG、TC的含量显著下降(P< 0.05),GSPE高剂量组及格列本脲组小鼠的血清HDLC含量显著升高。结果表明,GSPE对糖尿病小鼠血脂具有一定促进恢复的作用。
2.5 GSPE对实验性糖尿病小鼠IL-6、CRP的影响
GSPE对实验性糖尿病小鼠IL-6、CRP的影响见表4。
表4 GSPE对STZ致糖尿病小鼠IL-6、CRP的影响Table 4Effect of GSPE on IL-6,CRP of STZ diabetic mice(±s)
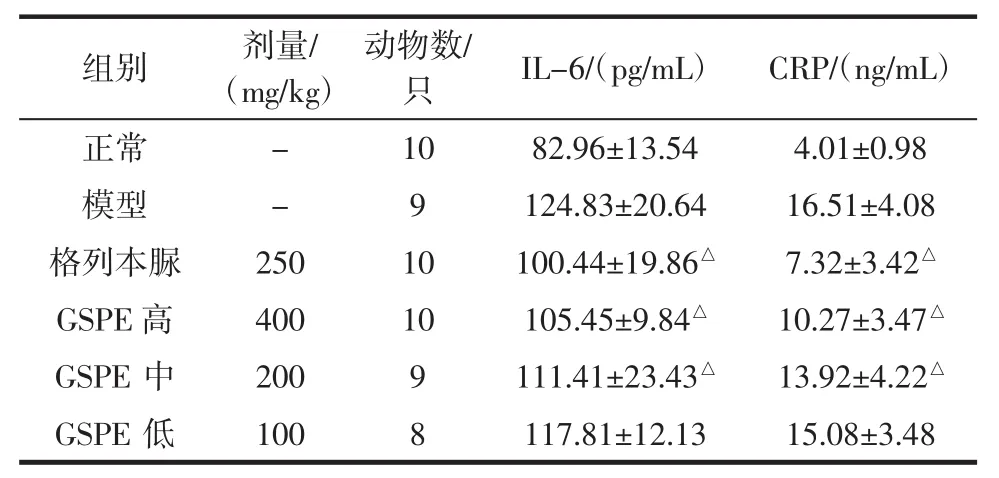
表4 GSPE对STZ致糖尿病小鼠IL-6、CRP的影响Table 4Effect of GSPE on IL-6,CRP of STZ diabetic mice(±s)
注:-为蒸馏水;△与模型组比较P<0.05。
组别剂量/(mg/kg)动物数/只IL-6/(pg/mL)CRP/(ng/mL)正常-1082.96±13.544.01±0.98模型-9124.83±20.6416.51±4.08格列本脲25010100.44±19.86△7.32±3.42△GSPE高40010105.45±9.84△10.27±3.47△GSPE中2009111.41±23.43△13.92±4.22△GSPE低1008117.81±12.1315.08±3.48
如表4所示,与正常组比较,模型组小鼠血清中IL-6、CRP的含量明显升高(P<0.05)。与模型组小鼠比较,格列本脲组和GSPE高、中剂量组小鼠的血清IL-6、CRP含量显著降低(P<0.05),结果表明,GSPE能降低糖尿病小鼠炎症因子的含量。
2.6 GSPE对实验性糖尿病小鼠SOD、MDA的影响
GSPE对实验性糖尿病小鼠SOD、MDA的影响见表5。
表5 GSPE对STZ致糖尿病小鼠SOD、MDA的影响Table 5Effect of GSPE on SOD,MDA of STZ diabetic mice(±s)

表5 GSPE对STZ致糖尿病小鼠SOD、MDA的影响Table 5Effect of GSPE on SOD,MDA of STZ diabetic mice(±s)
注:-为蒸馏水;△与模型组比较P<0.05。
组别剂量/(mg/kg)动物数/只SOD/(U/mL)MDA/(ng/mL)正常-101.90±0.3311.53±4.73模型-91.07±0.2720.47±4.08格列本脲250102.00±0.64△12.40±1.08△GSPE高400102.00±0.68△16.38±2.84△GSPE中20091.74±0.22△18.14±3.74 GSPE低10081.44±0.2020.17±4.48
如表5所示,与正常组相比,模型组小鼠血清的SOD活性显著降低,MDA含量显著增加(P<0.05)。与模型组比较,格列本脲组、GSPE高剂量组和中剂量组的小鼠血清SOD活性与模型组相比显著性增加(P< 0.05);格列本脲组、GSPE高剂量组的小鼠血清MDA含量显著性降低(P<0.05)。结果表明,GSPE对提高糖尿病小鼠机体的抗氧化能力有显著性的意义。
2.7 胰腺形态学观察
胰腺形态学观察见图1。

图1 糖尿病小鼠胰脏组织病理切片(HE染色,400×)Fig.1Pathologys of pancreas the tissue of diabetic mice(HE staining,400×)
正常组小鼠的胰岛形态和数目均大于糖尿病模型组,分布均匀、边界清晰,与正常组小鼠比较,模型组小鼠胰岛数目减少,形状不规则,边界不清,部分胰腺外分泌细胞破裂,胰岛细胞与周围组织混合,难以识别;GSPE高、中剂量组小鼠胰脏组织显示出现好转,小鼠胰岛数目逐渐增多,形态逐渐恢复,并且逐渐恢复均匀分布,且这种改变与剂量呈正相关,典型图片见图1。说明GSPE对糖尿病小鼠损伤的胰岛组织具有保护和修复作用。
3 结论与讨论
合适的糖尿病模型是糖尿病研究的重要前提。利用STZ对胰岛β细胞的选择性破坏作用,本实验通过高脂饲喂及对小鼠腹腔注射STZ使实验动物产生糖尿病[3-4],在STZ诱导小鼠糖尿病模型摸索过程中发现,STZ腹腔注射后需喂养一周,才能评价出是否造模成功,若喂养时间太短,小鼠的空腹血糖值还未能达到稳定,此时评价造模成功率,容易造成漏判。
本实验中,糖尿病小鼠与正常组比较,其血糖值显著升高,血清INS减少,小鼠出现明显的“三多一少”的症状,实验结果显示,GSPE能缓解小鼠糖尿病一般症状,且对STZ所致糖尿病小鼠有明显的降血糖,提高血清INS水平的作用,提示GSPE的降血糖机制,可能与修复胰岛受损β细胞,提升血清INS水平有关。
糖尿病患者大多存在脂代谢紊乱,特别是2型肥胖糖尿病患者[5-6]。本实验结果显示,GSPE可以显著地降低糖尿病小鼠血清的甘油三脂、总胆固醇和升高高密度脂蛋白,表明GSPE能够改善糖尿病小鼠的血脂水平。
炎症因子在糖尿病的发生及发展过程中有着重要作用,现已证明一些炎症因子包括TNF、IL-6、CRP等在多种组织中能影响血糖浓度[7],炎症因子与脂肪内分泌、氧化应激、免疫系统等相互作用而引起胰岛素抵抗和β细胞结构和功能的障碍[8-9]。本实验结果显示,GSPE可降低血清中炎症因子的含量,表明GSPE降低血糖作用可能与其降低炎症分子含量缓解胰岛细胞受到其攻击有关。
糖尿病及其并发症的发病机制复杂,有研究发现其发生机制可能与机体的氧化应激水平有关[10-11]。本实验结果显示,GSPE能够提升糖尿病小鼠体内的SOD活性,降低MDA含量,表明GSPE可通过改善机体抗氧化系统的功能,清除机体氧自由基,进而预防糖尿病并发症的发生,与文献结果相似[12]。
葡萄籽提取物原花青素对STZ所导致的糖尿病小鼠有明显的降低血糖和改善血脂,修复胰脏病变组织的作用,其作用机制可能与其能提高糖尿病小鼠机体抗氧化能力、降低炎症因子含量有关。
[1]孙琳.糖尿病并发症研究进展[J].中国民康医学,2012,24(2):228-238
[2]周坦洋,罗芙蓉,白彬.葡萄籽原花青素生物药理活性的研究进展[J].哈尔滨医科大学学报,2012,2(1):94-96
[3]黄桂红,陈薇,罗昱澜.链脲佐菌素稳定性对诱导糖尿病小鼠模型的影响[J].华夏医学,2009,22(2):201-203
[4]穆松牛,高云,万福生.链尿佐菌素加高糖高脂饮食复制大鼠2型糖尿病模型[J].中国比较医学杂志,2008,18(2):19-22
[5]张俐勤,戚向阳,陈维军,等.罗汉果皂苷提取物对糖尿病小鼠血糖、血脂及抗氧化作用的影响[J].中国药理学通报,2006,22(2):237-240
[6]王翠英,任丽萍,王战建.2型糖尿病血管并发症与血脂和脂质比值的关系[J].临床荟萃,2009,24(23):2049-2052
[7]叶丹,李红.炎症反应相关因子与2型糖尿病[J].国外医学内分泌分册,2003,23(5):312-314
[8]房振,宋书凯,李敬田.2型糖尿病合并冠心病患者血浆hs-CRP、IL-6与颈动脉内中膜厚度的相关性[J].山东医药,2016,56(14):50-53
[9]盛志新,谢丹红.炎症与2型糖尿病的关系[J].新乡医学,2008,39 (5):345-347
[10]唐国全.Ⅱ型糖尿病患者血清中超氧化物歧化酶含量变化的临床实验观察[J].广西医学,2003,25(5):687-688
[11]彭朝胜,曹悦鞍,丁海燕,等.2型糖尿病患者血糖波动与血清丙二醛、超氧化物歧化酶的关系[J].海军总医院学报,2011,24(3):156-158
[12]王颖,张桂芳,徐丙政,等.葡萄籽原花青素提取物对糖尿病小鼠血糖的影响[J].天然产物研究与开发,2012,24(9):1191-1195
Protective Effect of Grape Seed Proanthocyanidin Extract on Diabetic Mice Induced by Streptozotocin
WANG Fang1,WANG Jun1,HU Bo1,REN Mei-ping2,*
(1.Pharmacy College of Southwest Medical University,Luzhou 646000,Sichuan,China;2.Research Center for Drug and Functional Food of Southwest Medical University,Luzhou 646000,Sichuan,China)
To study the impact of grape seed extracton diabetic mice induced by Streptozotocin(STZ).Diabetic mice model was induced by high fat diet combined with intraperitoneal injection of STZ in this paper.Diabetic mouse were randomly divided into model group,Glibenclamide group(250 mg/kg),GSPE high-dose group(400 mg/kg),middle-dose group(200 mg/kg)and low-dose group(100 mg/kg).Fasting blood glucose was measured after continuous intragastric administration 8 weeks.Blood samples were taken out from the tail of diabetic mice to measure fasting blood glucose;then blood samples were taken out from the eyeball to measure the triglyceride(TG),total cholesterol(TC),high density lipoprotein cholesterol(HDL-C)and low density lipoprotein cholesterol(LDL-C);IL-6 content,CRP content,activity of superoxide dismutase(SOD),INS content,MDA content were analyzed by using comercial kits.The experiments show that GSPE high and middle-dosegroup can significantly lower the blood glucose level in STZ induced diabetic mice;TG,TC in GSPE high and middle-dose group were lower than the model group significantly;HDL-C content in GSPE high-dose group was higher than the model group significantly(P<0.05);IL-6、CRP content in GSPE high and middle-dose group were lower than the model group significantly;INS content in GSPE high-dose group was higher than the model group significantly(P<0.05);SOD activity in GSPE high and middle-dose group was higher than the model group significantly(P<0.05),MDA content in GSPE high-dose group was lower than the model group significantly(P<0.05);diabetic mice pancreatic tissue were repaired.In summary,the grape seed extract had a significant effect on reducing blood glucose,improving blood lipid level,repair of pancreatic tissue.The mechanism might be related to improving the antioxidant capacity and reducing the content of inflammatory factors in diabetic mice.
grape seed proanthocyanidin extract;diabetes;blood glucose;antioxidation;inflammatory
10.3969/j.issn.1005-6521.2017.09.042
2016-11-30
四川省教育厅资助项目(14ZB0154)
王芳(1980—),女(汉),讲师,硕士,从事药物分析教学与科研。
*通信作者:任美萍(1978—),女(汉),副研究员,硕士,从事药物研发。

