响应面法优化金柚核中类柠檬苦素的提取工艺
张声源,邹浩元,杨宇辉,周铭,陈一村,罗铝铿,李春泉,聂华,*
(1.嘉应学院医学院,广东梅州514031;2.汕头大学医学院,广东汕头515041;3.广东汇群中药饮片股份有限公司,广东汕头515041)
响应面法优化金柚核中类柠檬苦素的提取工艺
张声源1,邹浩元1,杨宇辉1,周铭1,陈一村2,罗铝铿1,李春泉3,聂华1,*
(1.嘉应学院医学院,广东梅州514031;2.汕头大学医学院,广东汕头515041;3.广东汇群中药饮片股份有限公司,广东汕头515041)
在单因素试验的基础上,选择超声时间、超声温度和料液比为自变量,柚核中柠檬苦素类物质的提取率为响应值,进行Box-Benhnken中心组合试验设计,运用响应面分析法优化梅州金柚核柠檬苦素类物质的提取工艺。结果表明,梅州金柚核柠檬苦素类物质超声提取最佳工艺为提取温度50℃,料液比1∶20(g/mL),超声时间20 min。此工艺下柠檬苦素类物质提取率为0.491mg/g(RSD=1.13%,n=3),与理论值0.487mg/g偏差很小。
柚核;超声波辅助提取;柠檬苦素;响应面法
梅州金柚为芸香科柑橘属植物柚[Citrus grandis(L.)Osbeck]的果实,其营养价值丰富、便于储藏,有“天然水果罐头”之称,同时作为药用具有止咳平喘、清热化痰、健脾消食、解酒除烦等功效[1-2]。柚核为柚成熟果实的核(种子),据《岭南采药录》记载,柚核性平、温,味苦,归肝经,具有疏肝理气、宣肺止咳的功效,临床上可治疗疝气、肺寒咳嗽、呃逆等病症[3]。柠檬苦素类物质是一类三萜类化合物,主要存在于柑橘类果实中。研究发现,在柚果不同药用部位中,柠檬苦素类物质主要存在于柚核中,为柚核主要活性成分,同时也是引起柚果果汁苦味的主要原因之一[4-5]。现代药理学研究表明,柠檬苦素类物质具有显著的抗癌、抗氧化、抗菌、镇痛等生理活性,其提取工艺及功能活性产品的研制与应用已引起了医学界和食品界的广泛关注[5-9]。
梅州是我国最大的金柚种植生产基地,1995年被国家首批百家中国特产之乡组委会命名为“金柚之乡”,2006年梅州金柚通过国家地理标志产品保护认证,2016年梅州金柚地理标志证明商标获国家工商总局商标局正式注册,是广东“十件宝”之一。据报道,目前梅州市柚果种植面积已超过53万亩,产量超过70.3万t,是全世界最大的金柚商品生产基地[10-11]。梅州金柚因其品质独特,其鲜果及其加工品远销国内外,而作为金柚产品加工过程的副产物柚核来源丰富、价格低廉,可作为提取生理活性物质或药品、食品开发的原料,进行多级加工和深度加工,提高金柚综合利用力度。然而,针对梅州金柚这一丰富、优良的地方特色资源的研究多集中于栽培技术、成分分析、产品开发等方面[12-14],对柚核中柠檬苦素类物质的提取工艺研究鲜见报道。本研究以梅州金柚柚核为原料,在单因素试验的基础上,通过Box-Benhnken中心组合试验设计-响应面法优化梅州金柚核中柠檬苦素类物质的超声提取条件,以期为梅州金柚核中柠檬苦素类物质的开发与利用提供参考。
1 材料与方法
1.1 材料与仪器
梅州金柚:采摘自广东省梅州市阴那山自然保护区梅州金柚种植基地;柠檬苦素标准品(批号MB5042,纯度>98%):大连美仑生物技术有限公司;无水乙醇、浓硫酸、二氯甲烷、香草醛等试剂均为分析纯。
UV-1800型紫外-可见分光光度计:日本岛津公司;JP-100S型超声波清洗器:深圳市洁盟清洗设备有限公司;BT125D型电子分析天平、BS110s型电子分析天平:德国Sartorius公司;N-1100V型旋转蒸发仪:日本东京理化器械株式会社;WJX-A1000型高速多功能粉碎机:浙江省永康市红太阳机电有限公司;DHG-9123A型数显鼓风干燥箱:上海精宏实验设备有限公司。
1.2 方法
1.2.1 样品前处理
将干燥的柚核粉碎后过20目筛,加10倍量石油醚于50℃回流3次,每次60 min,脱脂后经烘箱45℃干燥至恒重,得脱脂柚核粉末,保存于干燥器中(常温)备用。
1.2.2 柠檬苦素类物质的含量测定
1.2.2.1 标准品溶液制备
精密称取干燥至恒重的柠檬苦素对照品10.0 mg,置于50 mL容量瓶中,加二氯甲烷溶解并定容至刻度,摇匀,得标准储备溶液。
1.2.2.2 供试品溶液制备
精密称取脱脂柚核粉10.0 g置于200 mL具塞锥形瓶中,加入一定体积分数乙醇适量,按设定的功率、温度、时间进行超声提取,提取液经抽滤、浓缩后,吸取二氯甲烷溶解、过滤并定容于25 mL容量瓶中,即得。
1.2.2.3 显色剂配制
参照文献[15]方法,准确称取2.0 g香草醛,用无水乙醇溶解并定容于10 mL容量瓶中。使用时往10 mL香草醛乙醇溶液(0.02 mg/mL)中加入15 mL浓硫酸,振荡混匀,现配现用。
1.2.2.4 显色方法
吸取样品溶液1.4 mL于试管中,加入1.0 mL显色剂,振荡混匀,迅速振荡10 s,加入2.5 mL甲醇溶液,混匀显色,静置10 min。
1.2.2.5 线性关系考察
分别精密吸取柠檬苦素对照品溶液1.0、2.0、3.0、4.0、5.0 mL于10 mL容量瓶中,用二氯甲烷定容,得质量浓度分别为0.02、0.04、0.06、0.08、0.10(mg/mL)的柠檬苦素标准溶液,按1.2.2.4中方法显色后,于547 nm波长处测定吸光度[15],以吸光度为纵坐标,柠檬苦素质量浓度为横坐标,绘制标准曲线。
1.2.2.6 柠檬苦素类物质提取得率的计算
准确吸取样品溶液适量,按照柠檬苦素标准曲线制作方法测定吸光度,根据回归方程计算质量浓度(C),再根据质量浓度计算出柚核中柠檬苦素类物质的提取得率(mg/g),计算公式如下:
式中:T为柠檬苦素化合物提取率,mg/g;C为提取液中柠檬苦素质量浓度,mg/mL;V为样品溶液体积,mL;N为稀释倍数;W为样品质量,g。
1.2.2.7 单因素试验考察
考察超声时间、提取温度、提取次数、乙醇体积分数和料液比5个因素对柠檬苦素类物质提取含量的影响。各组试验重复3次,结果取平均值。
1.2.2.8 响应面试验设计
根据单因素试验结果,确定3个因素的3个水平,以柠檬苦素类物质提取率为评价指标,进行响应面优化试验的中心组合设计,见表1。

表1 Box-Behnken中心组合设计的因素和水平表Table 1Factors and levels of Box-Behnken central composite design
自变量因素编码及水平见表1,-1、0、1分别代表各因素的低、中、高3个水平。
1.3 数据处理
采用SPSS 22软件进行方差显著性检验;采用Design Expert 8.0对所得数据进行回归分析;采用Origin 8.0软件作图。
2 结果与分析
2.1 柠檬苦素标准曲线
柠檬苦素标准曲线见图1。
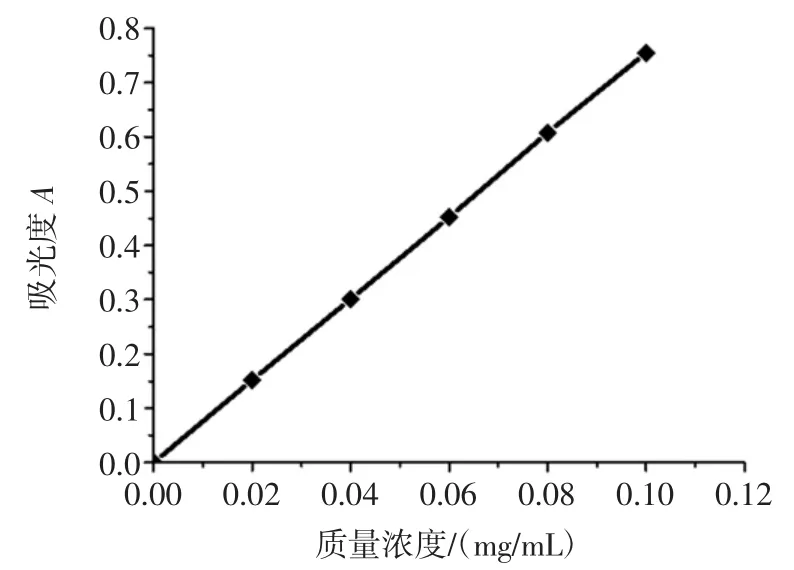
图1 柠檬苦素标准曲线Fig.1Standard curve of limonin
由图1可看出,柠檬苦素含量(X)与吸光度(Y)呈线性关系。其回归方程为Y=7.563X+0.024(R2=0.999 9),线性范围0.020 mg/mL~0.100 mg/mL。
2.2 单因素试验
2.2.1 超声时间
准确称取4份脱脂柚核粉末,每份10.0 g,固定超声温度30℃,料液比1∶10(g/mL),超声波功率300 W和乙醇体积分数60%,提取次数为1次,提取时间选择10、20、30、40 min。各提取液依次按1.2.2.2项方法处理,1.2.2.4项方法显色和1.2.2.5项方法测定吸光度,计算柠檬苦素类物质提取率,试验重复3次,结果取平均值。不同超声时间下柠檬苦素类物质提取率分别为(0.27±0.02)%、(0.41±0.02)%、(0.24±0.02)%和(0.21±0.02)%,故选择超声时间为10 min~30 min。
2.2.2 提取温度
准确称取4份脱脂柚核粉末,每份10.0 g,固定料液比1∶10(g/mL),超声波功率300 W,提取时间30 min和乙醇体积分数60%,提取次数1次,提取温度选择30、40、50、60℃。各提取液依次按1.2.2.2项方法处理,1.2.2.4项方法显色和1.2.2.5项方法测定吸光度,计算柠檬苦素类物质提取率,试验重复3次,结果取平均值。不同提取温度下柠檬苦素类物质提取率分别为(0.23±0.02)%、(0.41±0.02)%、(0.42±0.01)%和(0.17±0.02)%,故选择提取温度为35℃~50℃。
2.2.3 料液比
准确称取4份脱脂柚核粉末,每份10.0 g,固定超声温度30℃,超声波功率300 W,提取时间30 min和乙醇体积分数60%,提取次数为1次,料液比选择1∶10、1∶15、1∶20、1∶25(g/mL)。各提取液依次按1.2.2.2项方法处理,1.2.2.4项方法显色和1.2.2.5项方法测定吸光度,计算柠檬苦素类物质提取率,试验重复3次,结果取平均值。不同料液比下柠檬苦素类物质提取率分别为(0.13±0.01)%、(0.44±0.02)%、(0.45±0.02)%和(0.43±0.01)%,故选择料液比为1∶10(g/mL)~1∶20(g/mL)。
2.2.4 乙醇体积分数
准确称取5份脱脂柚核粉末,每份10.0 g,固定超声温度30℃,料液比1∶10(g/mL),超声波功率300 W和提取时间30 min,提取数1次,选择乙醇体积分数分别为40%、50%、60%、70%、80%。各提取液依次按1.2.2.2项方法处理,1.2.2.4项方法显色和1.2.2.5项方法测定吸光度,计算柠檬苦素类物质提取率,试验重复3次,结果取平均值。不同乙醇体积分数下柠檬苦素类物质提取率分别为(0.07±0.01)%、(0.12±0.01)%、(0.35±0.01)%、(0.41±0.02)%和(0.42±0.02)%。试验结果显示乙醇体积分数>60%时,提取率趋于平缓,对柠檬苦素类物质的提取率影响小,故选择乙醇体积分数为70%。
2.2.5 提取次数
精密称取4份脱脂柚核粉末,每份10.0 g,固定超声温度30℃、料液比1∶10(g/mL),超声波功率200W、提取时间30 min和乙醇体积分数60%,提取次数分别为1、2、3、4次。各提取液依次按1.2.2.2项方法处理,1.2.2.4项方法显色和1.2.2.5项方法测定吸光度,计算柠檬苦素类物质提取率,试验重复3次,结果取平均值。不同提取次数下柠檬苦素类物质提取率分别为(0.37±0.01)%、(0.41±0.01)%、(0.41±0.01)%和(0.42±0.01)%,结果显示提取数>2次时,提取率增大趋于平缓,提示提取次数对提取率的影响小,故确定提取数2次。
2.3 响应面分析试验
根据Box-Benhnken中心组合设计原理,综合单因素试验考察结果,选取液料比、提取温度、超声时间为自变量,以原料中柠檬苦素得率为响应值,称取脱脂柚核粉末10.0 g,共17份,设计三因素三水平共17个试验点的响应面分析试验,其中12个析因试验,5个中心试验,试验设计与结果见表2。
表2中试验数据采用响应面分析软件Design-Expert 8.0进行方差分析和响应面3D图和等高线图绘制。因子经过回归拟合,得到回归方程:Y=0.474 8+0.005 6A+0.006 425B+0.009 225C-0.004 4AB-0.001 55AC+0.004 75BC-0.003 3A2-0.003 1B2-0.004 95C2。方差分析见表3。
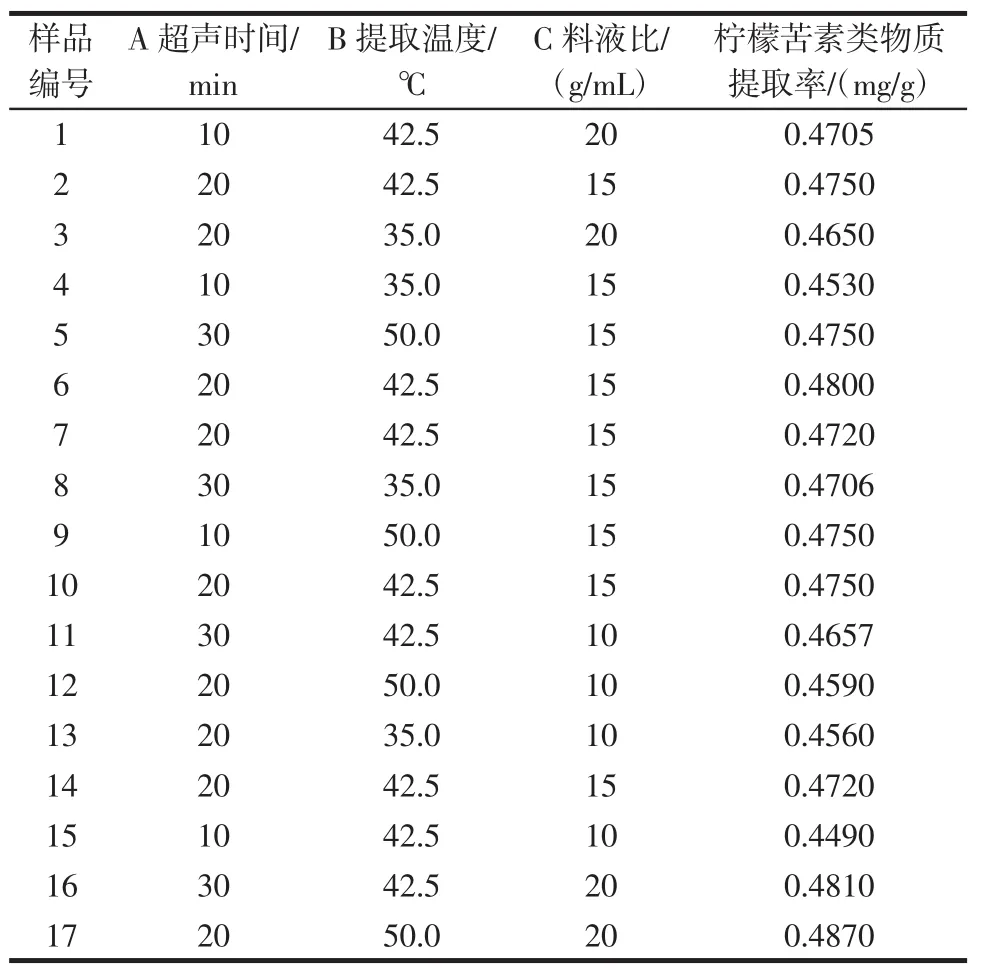
表2 金柚柚核中柠檬苦素类物质提取工艺响应面试验安排Table 2Responsive surface test analysis of extraction process of limonins from Pomelo seeds
由方差分析可知,回归方程模型高度显著,决定系数R2=96.80%,说明响应值的变化有96.80%来源于所选自变量;模型的变异系数0.594 7%,说明该模型精密度良好;失拟项不显著,说明回归方程在整个回归区域的拟合情况良好,可用该回归模型代替试验真实点对结果进行分析。各因素中一次项A、B、C对响应值的影响高度显著(P<0.01),依次为:C>B>A,说明试验中各参试因子对得率的影响均达到极显著水平;二次项AB、BC、A2、C2对响应值的影响显著(P<0.05),依次为:C2>BC>AB>A2,说明A与B、B与C之间存在显著的交互效应。
图2直观的给出了各因系交互作用的3D图和等高线图。
从响应面3D图的最高点和等高线图可以看出在所选的范围内存在极值,既是响应面的最高点,同时也是等高线图中最小椭圆的中心点。此外,根据3D图和等高线图可以看出,固定其他条件不变,超声时间对柠檬苦素类物质提取率影响呈现先增大后减小的趋势,而随着料液比和提取温度的增大,柠檬苦素类物质提取率逐渐增大,并逼进极值,这与单因素考察的结果基本吻合。
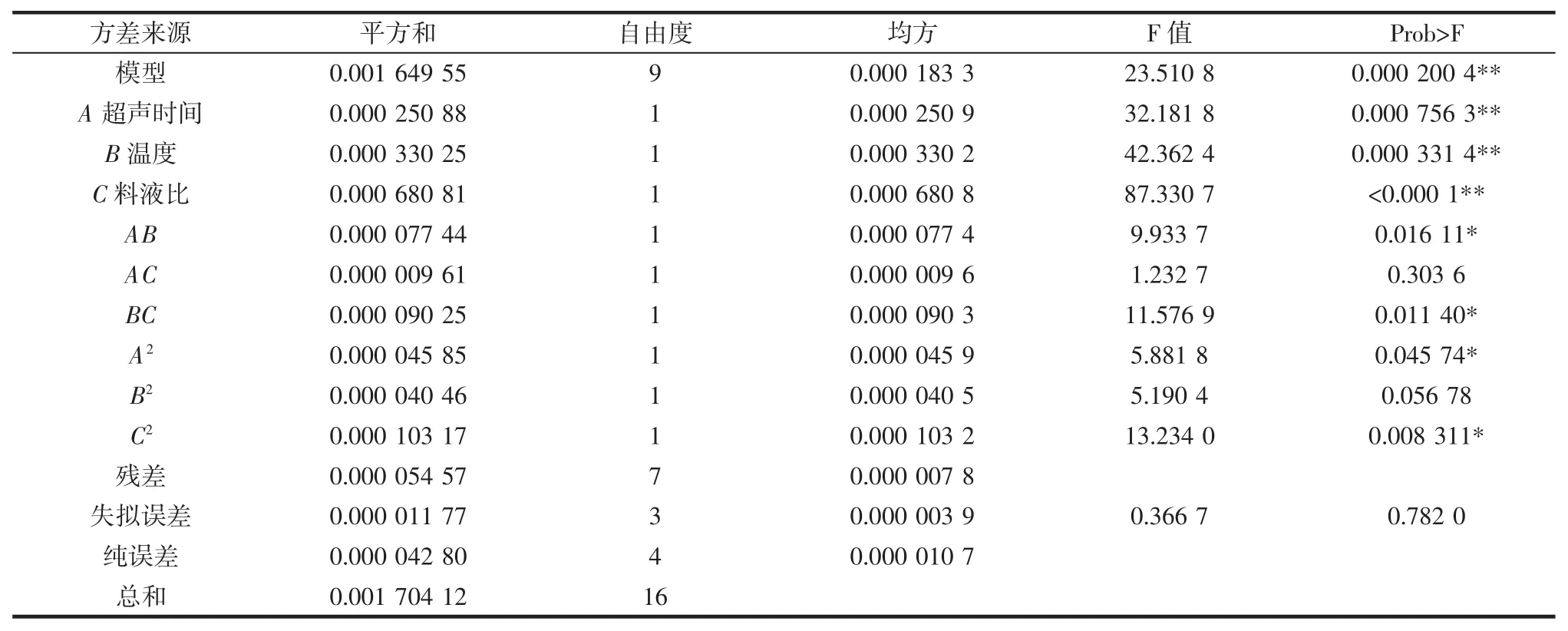
表3 柠檬苦素类物质提取率方差分析Table 3Variance analysis on extraction yield of limonins
2.4 验证试验
通过响应面分析软件得到回归模型预测的柠檬苦素最优提取工艺条件为提取温度49.92℃,料液比1∶19.92(g/mL),超声时间19.98 min,在该条件下响应面模型预测的柠檬苦素提取率为0.487%。为使实际操作更方便,最终确定柠檬苦素最优提取工艺条件为50℃,料液比1∶20(g/mL),超声时间20 min。为验证试验的可靠性,采用上述最优提取工艺条件提取柠檬苦素。称取脱脂后柚核粉末3份,每份10.0 g,按预测的最优工艺条件进行验证试验,各提取液依次按1.2.2.2项方法处理,1.2.2.4项方法显色和1.2.2.5项方法测定吸光度,计算柠檬苦素平均提取率为0.491%,RSD为1.13%,与理论值偏差很小,表明采用响应面法优选柠檬苦素类物质的提取条件具有可行性。
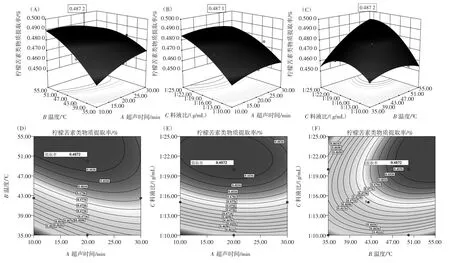
图2 各试验因素对柠檬苦素类物质提取率影响的响应面和等高线图Fig.2Responsive surface and contour of Effects of each factor on extraction yield of limonins
3 结论
在单因素试验的基础上,将响应面法应用于优化梅州金柚柚核中柠檬苦素类物质的超声辅助提取条件,结果表明,提取温度,料液比和超声时间对柠檬苦素类物质提取率影响显著。柠檬苦素类物质提取率响应方程的方差分析和验证试验表明此方法合理可行,得到柚核中柠檬苦素类物质提取最佳条件为:以脱脂柚核粉为原料,用提取温度50℃,料液比1∶20(g/mL),超声时间20 min。在此条件下柠檬苦素类物质的提取率为0.491%(RSD=1.13%,n=3),与理论预测值0.487%偏差很小。本研究得到的提取工艺操作简便,提取条件温和,环保经济,可为柚核中提取柠檬苦素类物质的工业化生产提供试验参考,同时对梅州金柚柚核的进一步开发利用具有一定的理论指导意义。
[1]Matheyambath A C,Padmanabhan P,Paliyath G.Citrus Fruits, Reference Module in Food Science,from Encyclopedia of Food and Health[M].Amsterdam:Elsevier Ltd,2016:136-140
[2]王标诗,吴艺华,杜建中,等.沙田柚活性成分的提取及其生理功能的研究进展[J].食品研究与开发,2014,35(10):129-132
[3]钟红兰,苏潮品,林云斌,等.中药柚核(种子)研究进展[J].亚太传统医药,2014,10(15):38-40
[4]MAIER V P,BENNETT R D,HASEGAWA S.Limonin and other limonoids[J].Citrus Science and Technology,1977(1):355-396
[5]朱春华,李菊湘,周先艳,等.柑橘果实中柠檬苦素及类似物功能活性研究进展[J].保鲜与加工,2015,15(6):78-82
[6]韩学青,朱启华,王少驰,等.柠檬苦素类似物的生物活性和构效关系研究进展[J].药学进展,2015,39(10):775-780
[7]李彪,施蕊,熊智,等.柚子皮中柠檬苦素提取工艺及其抑菌活性研究[J].食品工业科技,2012,33(5):198-200
[8]Jasleen K,Gurpreet K.An insight into the role of citrus bioactives in modulation of colon cancer[J].J Funct Foods,2015,13:239-261
[9]Amit R,Shailendra S.Limonoids:Overview of significant bioactive triterpenes distributed in plants kingdom[J].Yakugaku Zasshi,2006, 29(2):191-201
[10]钟进良.梅州市金柚协会2014年年度总结大会在梅县区城东木子金柚合作社顺利召开[EB/OL].http://www.mznks.com/zx/ 2015/600.html,2015-4-13
[11]艾贤,李国礼,肖铭浩.中国金柚航母梅州起航[N].广东科技报, 2012-9-7(004)
[12]谢婧,钟锋.梅州金柚深加工产品的研究进展[J].食品研究与开发,2014,35(10):133-136
[13]丁宝,张立舒,张琼,等.梅州金柚的生产技术及采收工艺[J].安徽农学通报,2014,20(21):53-54
[14]黎婕,陈中,林伟锋.梅州金柚果肉中多酚氧化酶特性的研究[J].食品工业科技,2013,35(21):180-182
[15]黎继烈,张慧,曾超珍,等.超声波辅助提取金橘柠檬苦素工艺研究[J].中国食品学报,2009,9(4):96-102
Optimization of Extraction Process for Limonins from Gold Pomelo Seeds by Response Surface Methodology
ZHANG Sheng-Yuan1,ZOU Hao-yuan1,YANG Yu-hui1,ZHOU Ming1,CHEN Yi-cun2,LUO Lü-keng1,LI Chun-quan3,NIE Hua1,*
(1.Medical College,Jiaying University,Meizhou 514031,Guangdong,China;2.Medical College,Shantou University,Shantou 515041,Guangdong,China;3.Traditional Chinese Medicine Company of Huiqun,Shantou 515041,Guangdong,China)
Based on the experiment of single factor,ultrasonic time,ultrasonic temperature,and solid-liquid ratio were selected to design Box-Behnken central composite.The optimum extraction conditions confirmed by the response surface methodology.Optimum extraction conditions were as follows:extraction time of 20 min,solid/liquid ratio of 1∶20(g/mL)and temperature of 50℃.Under these conditions,yield of total limonins was 0.491(mg/g)(RSD=1.13%,n=3),whose deviation was small by comparing with the theoretical value of 0.487(mg/g).
pomelo seeds;ultrasound-assisted extraction;limonin;response surface methodology
10.3969/j.issn.1005-6521.2017.09.015
2016-08-03
广东省科技计划项目(2014A020221061,2015A090905019);广东省医学科研基金项目(A2015629,A2015354);梅州市产业技术研究与开发资金计划项目(201411)
张声源(1983—),男(汉),讲师,博士,主要从事药食两用植物活性成分研究。
*通信作者:聂华(1979—),男(汉),讲师,博士,主要从事药物新剂型及功能食品开发。

