Cu2+/Ce4+ TiO2可见光催化降解活性艳红X-3B
高立新
(上海电力学院 环境与化学工程学院, 上海 200090)
Cu2+/Ce4+TiO2可见光催化降解活性艳红X-3B
高立新
(上海电力学院 环境与化学工程学院, 上海 200090)
采用溶胶凝胶法合成了掺杂Cu2+和Ce4+的TiO2可见光催化剂,用活性艳红X-3B降解脱色为模型反应,结合紫外-可见光谱法、XRD和SEM等表征手段,考察了制备条件与光催化活性的关系.实验结果表明:适量掺杂稀土元素Ce4+较单独掺杂Cu2+能更加有效地提高催化剂在可见光下的催化活性,掺杂后使催化剂的吸收带边位置发生红移,晶型结构为锐钛矿和金红石的混合晶型.掺杂Ce4+量为1.5%时,0.4 g催化剂对30 mL浓度为5 mg/L的活性艳红X-3B模拟印染废水降解率达到61.1%.
溶胶-凝胶法; 二氧化钛; 活性艳红X-3B
二氧化钛(TiO2)是光催化降解水中有机、无机污染物质最受重视的光催化剂之一.但由于它的带隙较宽为3.2 eV,只能吸收波长小于400 nm的紫外光,不能吸收可见光,而太阳光谱中紫外光仅占4%左右,因此对太阳能的利用率很低.同时,由于光激发产生的电子(e-)和空穴(h+)的复合,导致光量子效率很低.针对以上问题,人们采用了多种手段对TiO2进行改性.TiO2光催化剂的掺杂改性能够影响光生电子与空穴的分离,提高光催化效率,而且可使TiO2吸收边带发生红移,使其吸光范围向可见光拓展,实现对太阳光的有效利用.邱林海等人[1]指出,掺杂稀土元素可以显著提高TiO2催化剂光降解的能力,特别是CeO2的掺杂,2 h有机物降解率达到91.0%,是单独使用TiO2的3.3倍.CAREY J H[2]通过氨蒸发诱导法制备了掺Cu的TiO2催化剂,发现掺杂会使光吸收发生红移.OLLIS D F[3]认为Cu元素与Ti元素离子半径类似,Cu元素可掺杂进入TiO2晶格,形成新的掺杂能级,使吸收带边红移,反应活性提高.
本文采用较简便的溶胶凝胶法,合成了同时掺杂Cu2+和Ce3+的TiO2光催化剂,研究了改性后TiO2在可见光下对活性艳红X-3B模拟印染废水的降解效果.并对催化机理进行了初步探讨.
1 实验部分
1.1 主要仪器与试剂
主要仪器有:数显智能控温磁力搅拌器H01-1B;紫外可见光分光光度计UV1700PC;陶瓷纤维马弗炉TM-0612P;X射线衍射仪DHG-9078A;电镜扫描仪FA2004;台式离心机TDL-40B.
实验试剂有钛酸丁酯C16H36O4Ti,硝酸铈Ce(NO3)3·6H2O,硝酸铜Cu(NO3)2,无水乙醇CH3COOH,冰乙酸C2H6O.以上试剂均为分析纯,购于国药集团试剂有限公司.水为二次去离子水.配制浓度为5 mg/L的活性艳红X-3B溶液,作为实验的模拟印染废水.
1.2 催化剂的制备
钛酸丁酯是溶胶凝胶法制备纳米二氧化钛的常用原料,因其水解太剧烈,故常加入乙醇、冰醋酸、二乙醇胺等减缓水解速率[4-5].
钛酸四丁酯在乙醇介质中水解是主要步骤,其反应如下:

Ti(O·Bu)3(OH)+C4H9OH
(1)

Ti(O--Bu)2(OH)2+C4H9OH
(2)

Ti(O--Bu)(OH)3+C4H9OH
(3)

Ti(OH)4+C4H9OH
(4)
总反应式如下:

Ti(OH)4+4C4H9OH
(5)
步骤1 取30mL无水乙醇,加入10mL钛酸四丁酯和10mL正硅酸乙酯,制成试剂A;
步骤2Cu(NO2)2用少量无水乙醇配成溶液,制成试剂B;
步骤3Ce(NO3)3·6H2O用少量无水乙醇配成溶液,制成试剂C;
步骤4 取B+C适量(B的用量为1.4%TiO2,C用量分别为0,0.3%,0.6%,1.0%,1.3%,1.5%,1.8%TiO2计算),加入去离子水(水醇比为4∶1),用浓盐酸调制成pH值为1.0的试剂D;将D以5~8滴/min的速率滴加到试剂A中,控制反应温度为40~50 ℃,陈化数日;
步骤5 将凝胶块置于恒温干燥箱中恒温干燥,直到有机溶剂全部挥发,得到灰色粉末,将其研磨成超细粉末;
步骤6 将粉末置于马弗炉中煅烧,得到催化剂粉末.
1.3 催化剂的表征
1.3.1 X射线衍射法
X射线衍射法(XRD)是对晶体进行定性物相分析的方法,在催化剂研究中主要用于测定催化剂表面晶体的物相组成、晶胞常数和晶粒大小,也可用于比表面积、平均孔径及晶粒大小分布的辅助测定,是负载型催化剂表征的重要方法.衍射峰形与晶粒大小之间的关系满足Scherrer方程,一般 X 射线衍射宽化法测定纳米粒子的平均粒径就采用Scherrer公式:
式中:D——纳米粒子的粒径,nm;θ——布拉格 Bragg 衍射角;λ——X射线波长(0.154 18 nm,Cu靶做射线源);
K——Scherrer 常数;
β——衍射峰(hkl)半高度[1].
当β取衍射峰的半高宽时,K=0.89,当β取衍射峰的积分宽度时,K=1.
本试验采用Cu和Ka进行X射线衍射(XRD)分析,仪器是德国布鲁克公司BRUKER-D8 X-射线衍射仪,扫描范围(2θ)为10°~90°.
1.3.2 漫反射UV-Vis光谱
漫反射紫外可见光谱是检测非单晶材料的有效方法,常用于研究过渡金属离子及其化合物的结构,以及活性组分与载体间的相互作用.
1.3.3 SEM扫描
采用TESCAN公司的VEGA-XMH型扫描电子显微镜(SEM)观察样品的表观形貌及大小分布,放大倍数分别为2 000倍,10 000倍和20 000倍,加速电压为20 kV.
1.4 催化剂光催化活性评价
光催化反应是在自然光条件下测试,以太阳光为光源.活性艳红X-3B溶液浓度为5 mg/L,体积为30 mL.在进行光催化反应之前,先将悬浮液搅拌均匀,待催化剂在暗室中达到吸附平衡后,再拿到自然条件下进行光催化反应.每天定时取样品,用722可见分光光度计在540 nm处测定上层清液的吸光度值.根据样品吸光值的变化求得活性艳红的降解率(即脱色率)为:
式中:ω——降解率;A0——活性艳红溶液光催化反应前吸光度值;
A——反应一段时间后活性艳红的吸光度值.
2 结果与讨论
2.1 催化剂的表征
2.1.1 XRD表征分析
二氧化钛有3种不同的晶体结构:锐钛矿结构、金红石结构、板钛矿结构.具有光催化作用的主要是锐钛矿结构和金红石结构,其中以锐钛矿结构的催化活性最高.对两种样品进行XRD表征,结果如图1所示.
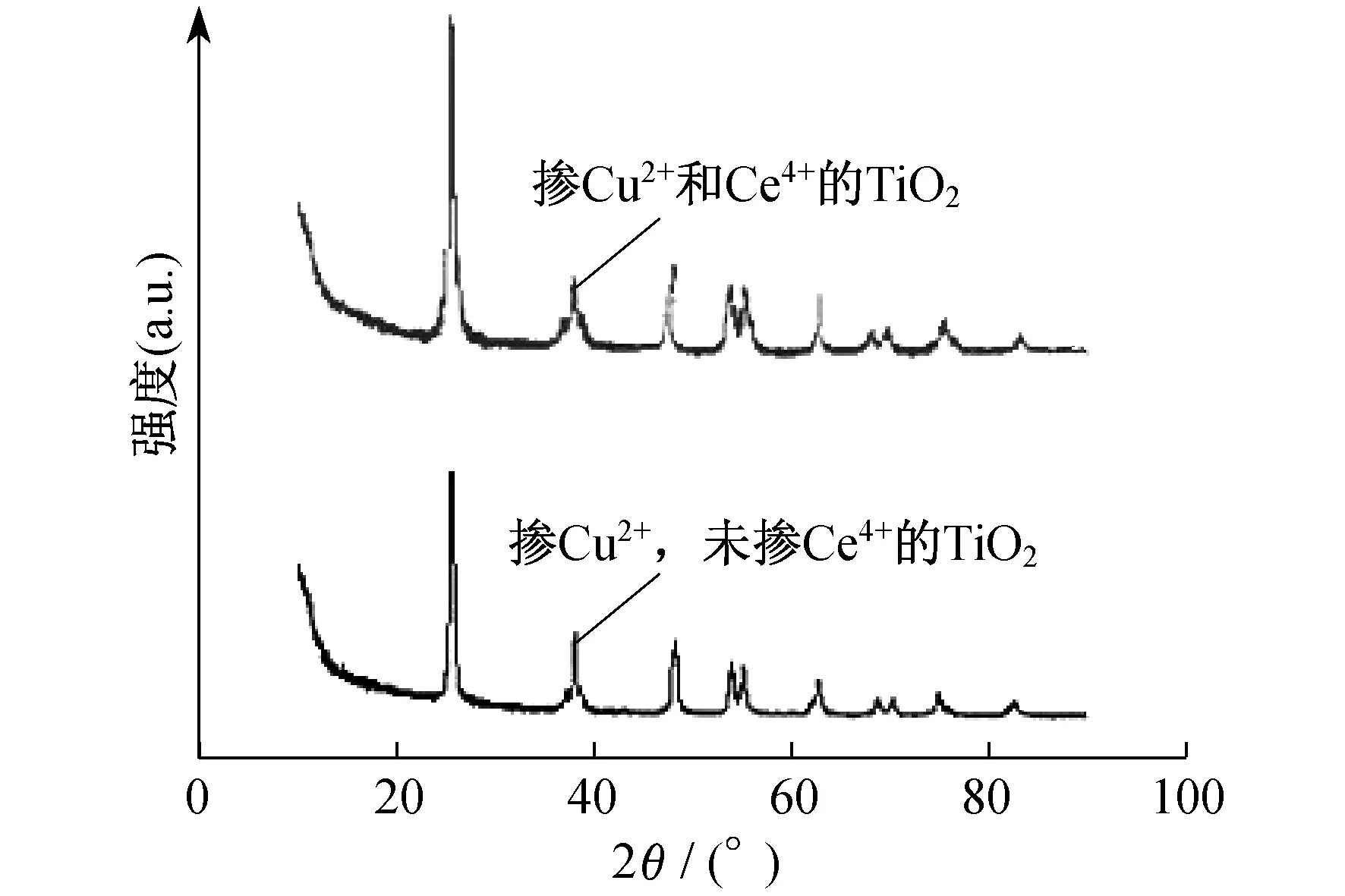
图1 两种样品的XRD图
由图1可以看出,添加Ce4+后衍射峰增强,更有利于形成锐钛矿型.掺铜(未加Ce4+)后主峰位置由TiO2的25.40°降到25.36°,这是由于Cu2+半径(73 pm)大于Ti4+半径(60.5 pm),难以嵌入TiO2晶格中,但主峰位置左移说明部分Cu2+进入TiO2晶格中导致晶胞膨胀,Cu2+起到了一定的分散作用,拟制了TiO2晶型向金红石相的转变,从而使光催化效果增强.由于Ce4+半径(102 pm)更大,难以嵌入TiO2晶格中,主峰位置进一步左移至24°,拟制了TiO2晶型向金红石相的转变,从而使光催化效果增强.由于图谱并未变粗糙,这说明掺杂后晶体结构规整性没有受到破坏.两种样品的XRD图谱中均未出现相应的掺杂元素的特征峰,这可能是由于其含量较低的缘故.
掺杂了铈的光催化剂试样衍射峰的半高宽增加,说明铈掺杂使TiO2的晶格发生了膨胀,引起了晶格畸变,使得掺杂后TiO2的粒径减小,而在掺杂量较大时,多余的金属离子在催化剂表面发生堆积而使得其粒径增大.一般认为,催化剂的粒径越小,其比表面积就越大,在光催化过程中,与目标物的接触面积就会越大,从而能更好地发挥光催化效应[2].此外,Ce/TiO2光催化剂产生可捕获光生电子或空穴的陷阱更多,因而能更加有效地抑制载流子的复合,使Ce/TiO2表现出更高的光催化活性.
2.1.2 UV-Vis表征分析
不同配比的催化剂在紫外光谱下的测定结果如图2所示.
TiO2是一种常见的n型半导体,半导体光吸收的阙值λg和带隙Eg之间具有以下关系:
Eg=1 240/λg
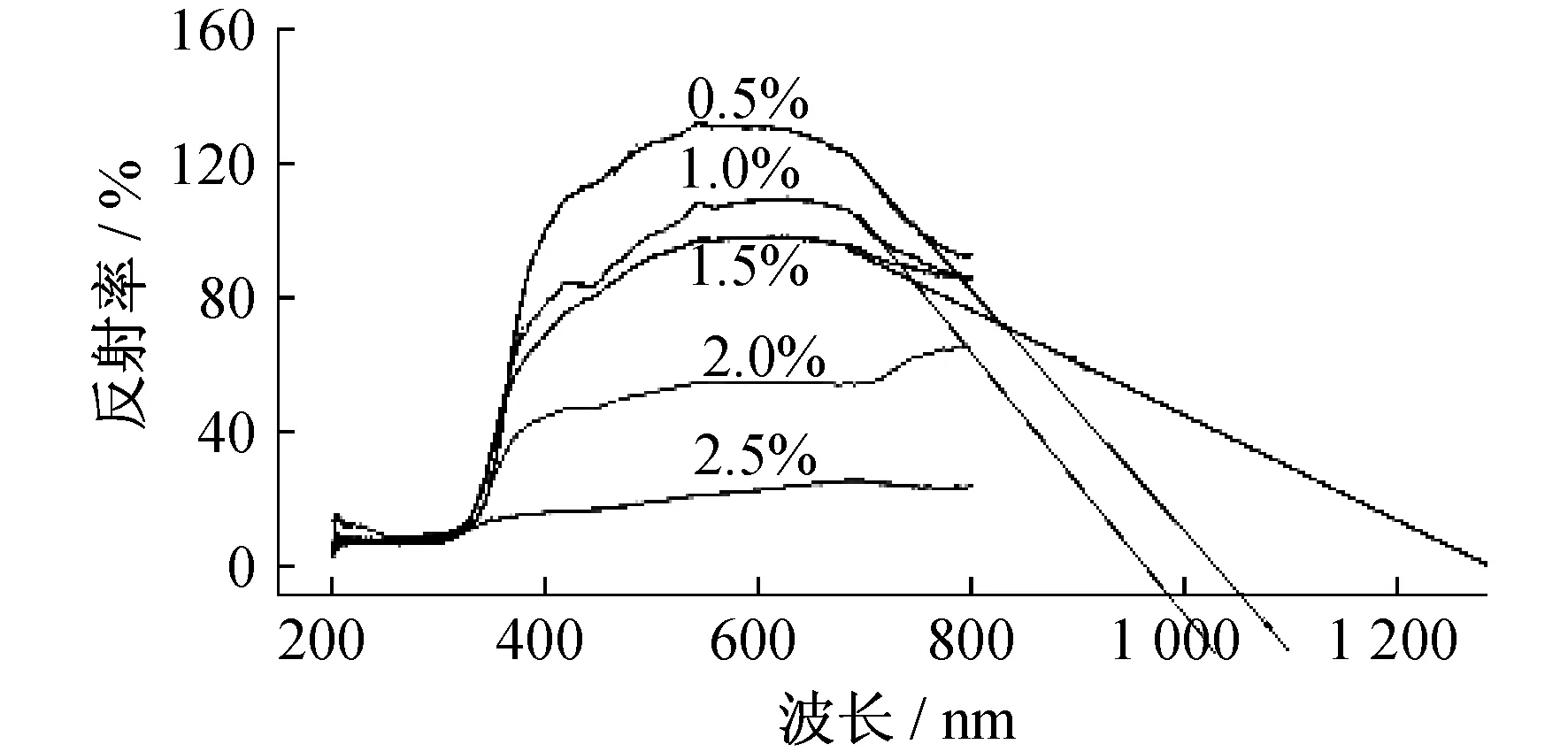
图2 不同配比的催化剂在紫外光谱下的测定结果
锐钛型TiO2的Eg=3.2 eV,λg=387.5 nm;金红石型TiO2的Eg=3.0 eV,λg=413.3 nm[3].从图2可以看出,与TiO2相比,掺杂金属离子后均发生了光谱吸收带边不同程度红移的现象.含不同掺杂量的Ce4+的催化剂带边红移更明显,带隙Eg=0.95~1.24 eV,因此在可见光照射下也具有较好的光催化效果.从图2还可以看出,Ce4+的掺杂量对反射阈值有明显影响.由于金红石型的TiO2带隙宽度(3.0 eV)比锐钛矿的TiO2(3.2 eV)窄,红移的结果说明掺杂后开始出现含金红石型的混合晶型,由于锐钛矿和金红石的带宽不同,这样两相之间形成一定的电势差,进而形成异相结,有助于光生电子-孔穴在两相间进行有效的分离,因此其光催化活性要比纯相的锐钛矿或金红石都好.
2.1.3 SEM分析
选择添加铈样品进行电镜扫描测定其粒度形貌,测试结果(放大10 000倍)如图3所示.由图3可以看出,TiO2粉末是粗糙、多孔的结构,且有些颗粒发生了团聚,这在很大程度上会影响其光催化性能,但其粒度较小,在活性艳红中的分散程度较好.

图3 Cu2+/Ce4+_TiO2的 SEM图(10 000倍)
2.2 可见光催化活性评价
活性艳红(MB)水溶液的定量分析采用分光光度法,实验测得MB的最大吸收波长为540 nm.为保证数据的精确性,以下吸光度的测定均在该波长下进行.
2.2.1 催化剂的吸附性能测定
取0.3 g催化剂(掺Ce量为1.5%,400 ℃下煅烧2 h),在没有光照的情况下,于30 mL浓度为5 mg/L的活性艳红X-3B溶液中测定吸附性能的影响,测定结果如图4所示.

图4 吸附试验测定结果
由图4可以看出,尽管没有光照,吸光度也会随着时间的延长而减小,这是由于催化剂的颗粒较细,对染料分子有一定的吸附作用.在第3次测量时,吸光度变化已经很小,接近吸附平衡,因此以下实验均在没有光照情况下放置3天后测定,以排除吸附对光降解的干扰.
2.2.2 掺铈量对催化效果的影响
不经过马弗炉煅烧,每个样品中的Ce/TiO2质量百分比分别为0,0.5%,1.0%,1.5%,2.0%,2.5%,分别取0.3 g样品做催化实验.测试结果如图5所示.
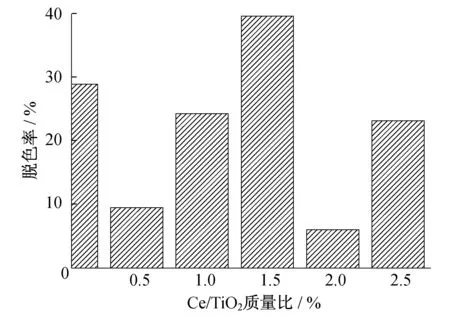
图5 掺铈量对活性艳红的脱色率
从图5可以看出:掺Ce4+后与单独掺Cu2+(即掺铈量为零)相比,当掺铈量达到1.5%时催化效果明显增强.掺铈对TiO2结晶结构有明显影响,过多或过少均不利于催化效果的提高,这与漫反射紫外可见光谱(图2)得到的结论相一致.
2.2.3 催化剂煅烧温度对降解效果的影响
理论上说,煅烧温度会影响催化剂的晶型结构和比表面积,进而影响其光催化效果[3],测试结果如图6所示.
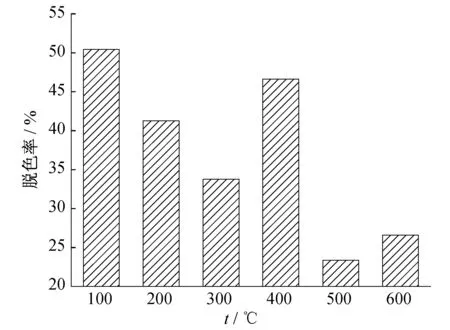
图6 马弗炉煅烧温度对催化效果的影响
从图6可知,当煅烧温度为400 ℃时降解率较大.这可能是由于煅烧温度过低,多孔结构中一些挥发性小分子不易去除干净,对催化剂的比表面积产生了影响.温度过高时比表面积会增大,同时晶体生长带来的表面缺陷结构增多,使得活性提高.但温度高于400 ℃后,晶粒的生长和比表面积的降低,使得其表面活性中心数量减少,活性降低.未在马弗炉中煅烧,而仅在100 ℃烘箱中烘制的催化剂的催化效率却最高,这可能是由于低温下烘制形成的晶型更加完整.
2.2.4 100 ℃下煅烧最佳时间的测定
在温度为100 ℃的条件下,烘培时间对脱色率的影响如图7所示.
由图7可以看出,随着煅烧时间的增加,所制得样品的光催化活性呈先增大后下降的趋势.煅烧时间为2 h 时,样品的光催化活性最好.这是因为煅烧时间过短会导致样品的晶体颗粒表面被一些残留有机物覆盖,减少参与反应的活性点位,降低样品的光催化活性和吸附性能;而煅烧时间过长则会破坏多孔结构,降低样品的比表面积,也会降低其光催化活性和吸附性能.

图7 烘培时间对脱色率的影响
2.2.5 活性艳红初始浓度对降解效果的影响
活性艳红的初始浓度不同时,降解效果也不相同,实验结果如图8所示.

图8 活性艳红最佳初始浓度实验结果
由图8可以看出,当活性艳红初始浓度为20 mL/g时,降解率达到最高.一般认为,反应物的初始浓度越高,降解率就越低,这是因为高浓度的艳红溶液在自然光照下的透光率不是很理想.但初始浓度过低,尽管溶液色度去除很快,污染物去除总量仍较低,难以充分发挥光催化降解效力.
3 结 论
(1) 适量掺杂铈Ce4+较单独掺杂Cu2+能更加有效地提高催化剂的催化性能.掺杂Ce4+量为1.5%时,TiO2的催化效果最好.
(2) 催化剂的最佳制备条件为:100 ℃烘箱中烘制2 h,取该条件制备的催化剂0.4 g,对30 mL浓度为5 mg/L的活性艳红X-3B模拟印染废水的脱色率达到61.1%,对20 mg/L模拟废水的脱色率达到72.2%.
(3) 通过掺Cu2+和Ce4+的TiO2催化剂的XRD图谱及漫反射紫外可见光谱分析可以看出,掺杂金属离子Cu2+和Ce4+会导致晶格畸变,形成锐钛矿型和金红石型混合晶型.含不同掺杂量的Ce4+催化剂带边也均有不同程度的红移.
(4) 从SEM图中可以看出,该催化剂颗粒粗糙,比表面积较大,有一定的吸附效果.
[1] 邱林海,水淼,徐铸德,等.稀土掺杂TiO2的相变和光催化活性[J].浙江大学学报:理学版,2000,27(1):69-74.
[2] CAREY J H.Photodechlorination of PCB’s in the presence of titanium dioxide in aqueous suspensions[J].Bull Environ Contam Toxic,1976(6):49-53.
[3] OLLIS D F.Contamination degradation in water[J].Environ Sci. Technology,1985(6):312-321.
[4] LINSEBIGLER A L,LU G Q,JOHN T,etal.Photocatalysis on TiO2surfaces:principles,mechanisms and selected results[J].Chem.Rev.,1995(3):735-758.
[5] 赵伟荣,奚海萍.Cu掺杂TiO2纳米管可见光催化降解矿化甲苯[J].物理化学学报,2013,29(10):2 232-2 238.
(编辑 白林雪)
Cu2+/Ce4+TiO2for Visible-light Photocatalytic Decolorization of Active Brilliant Red X-3B
GAO Lixin
(SchoolofEnvironmentalandChemicalEngineering,ShanghaiUniversityofElectricPower,Shanghai200090,China)
Cu,Ce-doped TiO2photocatalysts are prepared using the sol-gel method.Its influence of preparation condition and photocatalytic activity is characterized by means of UV-VIS spectrometry,XRD,SEM technique.These samples are also performed as photocatalysts in the degradation and decolorization of active brilliant red X-3B.Experimental results show that the Ce-doped TiO2photocatalyst performs a better photocatalytic activity than that of separate Cu-doped photocatalytic under natural light.Because both rutile phase and anatase phase are formed in Cu,Ce-doped TiO2and the band edges show a red shift compared with Cu -doped TiO2.Cu,Ce-doped TiO2shows the highest photocatalytic activity when mass fraction of Ce in TiO2is 1.5%.The decolorization rate of 5 mg/L active brilliant red X-3B reaches 61.1% when the dosage of catalyst is 13 g/L.
sol-gel method; TiO2; active brilliant red X-3B
10.3969/j.issn.1006-4729.2017.02.010
2015-09-30
高立新(1967-),女,副教授,河南开封人.主要研究方向为高分子材料,环境材料等. E-mail:glx2010@shiep.edu.cn.
O643.361;X703
A
1006-4729(2017)02-0157-05
——以金红石为例

