余甘子提取物对小鼠急性酒精肝损伤的保护作用研究
张志毕,张 媛,于浩飞,胡炜彦,张兰春,杨 晖,*,张荣平,,*
(1.昆明医科大学生物医学工程研究中心,云南昆明 650500;2.昆明医科大学药学院暨云南省天然药物药理重点实验室,云南昆明 650500;3.昆明医科大学实验动物学部,云南昆明 650500)
余甘子提取物对小鼠急性酒精肝损伤的保护作用研究
张志毕1,张 媛1,于浩飞2,胡炜彦2,张兰春3,杨 晖1,*,张荣平1,2,*
(1.昆明医科大学生物医学工程研究中心,云南昆明 650500;2.昆明医科大学药学院暨云南省天然药物药理重点实验室,云南昆明 650500;3.昆明医科大学实验动物学部,云南昆明 650500)
研究余甘子提取物(extractum phyllanthus emblica,EPE)对小鼠急性酒精肝损伤的预防保护作用和机制。方法:60只雄性小鼠随机分为空白组、模型组、药物对照组(美他多辛胶囊-欣立得,200 mg/kg·d)和EPE高、中、低剂量组(400、160、80 mg/kg·d),灌胃给药30 d,末次给药后1 h灌胃56%乙醇造急性酒精肝损伤模型。12 h后检测血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)、肿瘤坏死因子α(TNF-α)、白介素6(IL-6)、白介素10(IL-10)浓度,检测肝脏丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、乙醇脱氢酶(ADH)含量,实时荧光定量PCR(real time PCR)检测肝脏脂肪酸合成酶(FAS)、脂肪分化相关蛋白(ADRP)、细胞色素P450 2E1(CYP2E1)、过氧化酶体增殖激活α受体(PPARα)和半胱氨酸天冬氨酸蛋白酶3(Caspase3)mRNA的表达,HE染色观察肝脏组织病理变化。结果表明:EPE能显著降低小鼠血清ALT、AST、TG浓度,减轻肝脏病理损伤;EPE显著提高肝脏乙醇代谢酶ADH、CAT活性,下调CYP2E1 mRNA表达水平,缩短小鼠醒酒时间;EPE显著下调脂肪酸合成酶FAS和转运酶ADRP基因表达,抑制脂肪酸合成和向肝脏转运;EPE显著提高肝脏抗氧化酶SOD、GSH-Px活性,降低MDA浓度,发挥抗氧化活性保护肝脏损伤;EPE显著降低炎性因子TNF-α和IL-6浓度,减轻肝脏炎症损伤,但对IL-10浓度没有显著影响;EPE显著下调Casepase3基因表达,降低肝脏细胞凋亡水平;EPE显著上调PPARα基因表达来减轻肝脏氧化和炎症损伤。结论:EPE通过乙醇代谢酶活性调节、脂代谢调控、抗氧化损伤、抗炎和抗细胞凋亡来保护小鼠急性酒精肝损伤,具有开发为解酒护肝保健食品的前景。
余甘子,急性酒精肝,氧化损伤,炎症,脂代谢
酒精性肝病(alcoholic liver disease,ALD)是由于长期大量饮酒所致的肝脏损伤性疾病,我国近年来酒精性肝病发病率逐年上升,是导致肝病的第二大因素[1-3]。研究表明长期过量饮酒会引起肝脏、肠胃、心血管、内分泌、中枢神经系统等人体重要器官损伤,其中酒精代谢诱发的氧化应激、炎症等是酒精性肝病发病的主要原因[4]。
余甘子(PhyllanthusemblicaL.),又名滇橄榄、庵摩勒、油甘子等,系大戟科叶下珠属落叶小乔木的果实[5],产于我国南方各省和东南亚、南亚等地[6]。余甘子中富含超氧化物歧化酶[7]、维C、多酚类物质及多糖等活性物质[8-9],除了具有强烈的抗氧化活性[10-11]外,还具有抗炎症[12]、抗流感[13]、抗高血压、抗肿瘤、护肝等功效[14],在滇西民间,有用余甘子泡酒的传统,认为其有解酒护肝的功效。基于前人的研究基础,本研究用小鼠急性酒精肝损伤模型研究余甘子对急性酒精肝损伤的保护作用,并从乙醇代谢、脂代谢、氧化应激、炎症、细胞凋亡几个方面来探讨其作用机制,为余甘子解酒护肝的机制研究提供一定的实验基础。
1 材料与方法
1.1 材料与仪器
余甘子精粉(主要成分为多酚,含量40%) 西安维特生物科技有限公司生产,生产流程:余甘子原料水提→浓缩→浸膏→喷雾干燥→粉碎→包装。美他多辛胶囊-欣立得(批号:141201) 浙江震元制药有限公司。丙氨酸氨基转移酶(ALT)试剂盒(批号:20151209)、天冬氨酸氨基转移酶(AST)试剂盒(批号:20151210)、甘油三脂(TG)试剂盒(批号:20151209)、丙二醛(MDA)试剂盒(批号:20151201)、过氧化物歧化酶(SOD)试剂盒(批号:20151205)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(批号:20151130)、乙醇脱氢酶(ADH)试剂盒(批号:20151215)、过氧化氢(CAT)试剂盒(批号:20160913) 南京建成生物工程研究所;Mouse TNF-α试剂盒(批号:228260134)、Mouse IL-6试剂盒(批号:220241234)、Mouse IL-10试剂盒(批号:220362143) 杭州联科生物技术股份有限公司;AxyPrep总RNA制备试剂盒,(批号:12113KD1) 美国Axygen公司;RevertAid First Strand cDNA Synthesis Kit,(批号:00310953) 美国Thermo Scientific公司;TAKARA荧光定量试剂盒,(批号:AK8603)宝生物工程有限公司。
ICR小鼠,雄性,昆明医科大学实验动物学部提供,生产许可证号:SCXK(滇):2015-0004。
Synergy2多功能酶标仪 美国BIOTEK;Centrifuge5804R冷冻离心机 德国Eppendorf;CHB-100恒温金属浴 杭州博日科技有限公司;ND-1000核酸蛋白检测仪 美国BDT;显微镜、切片机、EG1160包埋机 德国Leica;QuantStudioTM 6 Flex实时荧光定量PCR仪 美国Thermo Fisher。
1.2 实验方法
1.2.1 动物分组及给药、造模、取样 成年ICR小鼠60只,体质量(20±2) g,饲养条件:室温(20±2) ℃,相对湿度(60%~70%)。适应饲养1周后按体质量随机分为6组,每组10只,分别为:空白组、模型组、药物组(欣立得,200 mg/kg·d)、EPE各剂量组(EPE,80、160、400 mg/kg·d)。EPE和欣立得溶于0.5%羧甲基纤维素钠,每天按剂量灌胃1次,共给药30d,空白组和模型组每天灌胃等剂量溶剂。末次给药后1 h,按参考文献[15],除空白组外按13 mL/kg 一次性灌胃56%乙醇,禁食不禁水饲养,12 h后眼球取血,脱臼处死小鼠后取肝脏-80 ℃保存。
1.2.2 小鼠醉酒和醒酒时间记录 醉酒指标:翻正反射消失,小鼠背部向下保持30 s以上;醒酒指标:翻正反射恢复,小鼠活动自如,灵活。醉酒时间=翻正反射消失时间-给酒时间;醒酒时间:翻正反射恢复时间-翻正反射消失时间[16]。
1.2.3 病理学组织观察 取肝右叶,4%甲醛溶液固定,经脱水、石蜡包埋、切片,常规HE染色,显微镜40倍物镜观察肝脏组织病理改变。
1.2.4 血清ALT、AST、TG、TNF-α、IL-6、IL-10含量检测 血样室温放置20 min后3500 r/min 4 ℃离心10 min,取血清,按试剂盒操作说明检测ALT、AST、TG、TNF-α、IL-6、IL-10含量。

表1 目的基因的引物序列
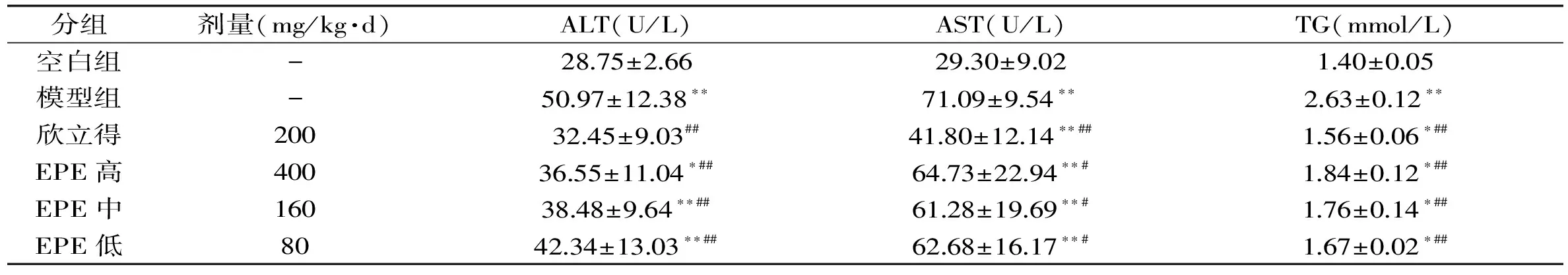
表2 EPE对小鼠血清ALT、AST、TG含量的影响(x±s,n=10)
1.2.5 肝脏MDA、SOD、GSH-Px、ADH、CAT含量测定 取小鼠肝脏左叶约0.10 g加入生理盐水制成10%肝组织匀浆,3500 r/min 4 ℃离心,取上清,按照试剂盒操作说明检测MDA、SOD、GSH-Px、ADH、CAT含量。
注:与空白组比较:*p<0.05;**p<0.01;与模型组比较:#p<0.05;##p<0.01,表3同。
1.2.6 Real time PCR检测肝脏FAS、ADRP、CYP2E1、PPARα、Caspase3基因表达 每组随机选4只小鼠,取小鼠左叶肝脏约30 mg,根据RNA提取试剂盒操作说明提取RNA,检测RNA浓度和纯度,通过逆转录试剂盒逆转录合成cDNA,-80 ℃保存备用。根据NCBI 数据库相关基因CDs序列设计引物,并进行Blast检索确定引物的特异性,引物序列如表1所示。Real time PCR检测相关基因表达,反应条件:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环,反应体系20 μL。以β-actin为内参基因,采用2-ΔΔCt法[17]计算基因表达的相对变化。
2 结果与分析
2.1 EPE对小鼠急性酒精肝损伤保护作用
由表2和图1B可知,与空白组相比,模型组小鼠血清中ALT、AST、TG含量均极显著升高(p<0.01),肝脏细胞肿大,细胞界限模糊,包浆成空泡状,表明肝组织脂滴较多,肝细胞完整性被破坏,存在严重脂肪变性,表明小鼠急性酒精肝模型建立成功。
与模型组相比,欣立得对急性酒精肝损伤起良好的保护作用,极显著降低血清中ALT、AST、TG含量(p<0.01);EPE高、中、低剂量组对急性酒精肝损伤也具有一定的预防作用,能显著降低血清中ALT、AST、TG浓度(p<0.01,p<0.05),各剂量组对ALT和TG的影响呈剂量关系,对AST影响无显著差异。
病理切片显示,空白组(图1A)小鼠肝脏细胞形态正常完整,肝组织结构清晰,肝细胞索排列整齐,肝细胞内无脂肪变性。欣立得组(图1C)和EPE高、中、低剂量组(图1D、图1E、图1F)肝细胞肿胀程度较模型组减轻,组织结构清晰,肝脏细胞完整,胞浆内空泡减少,脂肪变性程度得到缓解,EPE高剂量组护肝效果较中、低剂量组更明显。结果表明EPE对肝脏脂肪变性具有改善作用。

图1 EPE对急性酒精肝损伤 小鼠肝脏组织病理学影响(HE,×400)Fig.1 Efect of EPE on acute alcohol-induced liver tissue lesions(HE,×400)注:A.空白组;B.模型组;C.欣立得; D.EPE-高;E.EPE-中;F.EPE-低。
2.2 EPE对小鼠乙醇代谢的影响
由表3可知,各组小鼠醉酒时间差异无统计学意义(p>0.05),结果表明余甘子并不能调节对酒精的吸收和酒精麻痹神经中枢过程。与模型组比较,EPE高、中、低剂量组能显著缩短醒酒时间(p<0.05),但无剂量关系;欣立得组能极显著缩短小鼠醒酒时间(p<0.01)。乙醇进入体内后由ADH、CAT和CYP2E1三套系统代谢。与空白组相比,模型组小鼠摄入乙醇后ADH 浓度极显著增加(p<0.01),表明乙醇能对ADH的表达起正向调节作用。与模型组相比,欣立得能极显著增加ADH浓度(p<0.01),EPE各剂量组能显著增加ADH浓度(p<0.01、p<0.05),且呈剂量关系。乙醇浓度过高时,体内需要借助CAT辅助乙醇代谢,结果表明,与空白组相比,模型组CAT活性极显著下降(p<0.01)。乙醇底物浓度增加,辅助代谢酶CAT浓度应该升高,但是CAT也是体内重要的清除过氧化氢的酶,乙醇代谢时会产生大量的过氧化氢过,对肝脏组织进行CAT活性检测时,由于清除过氧化氢对CAT的消耗,所以用试剂盒检测时表现为CAT活性下降,该结果与文献报道一致[18]。与模型组相比,EPE各剂量组能显著提高CAT活性(p<0.01、p<0.05),呈剂量关系,欣立得对CAT活性无显著影响。CYP2E1也是乙醇代谢的重要基因,但其代谢通路会产生严重的氧化损伤,由图2可知,与空白组相比,模型组CYP2E1表达极显著增加(p<0.01),表明乙醇的摄入激活了CYP2E1的表达,这与前人的研究结果一致[14]。与模型组比较,欣立得能显著降低CYP2E1的表达(p<0.05),EPE剂量组都能极显著降低CYP2E1的表达(p<0.01),EPE各剂量组之间无差异,表明EPE不会通过上调CYP2E1表达来提高乙醇代谢速率,反而下调其表达水平,减轻由其介导的乙醇代谢毒性。

表3 EPE对小鼠醉酒和醒酒时间、肝脏ADH和CAT活性的影响(x±s,n=10)
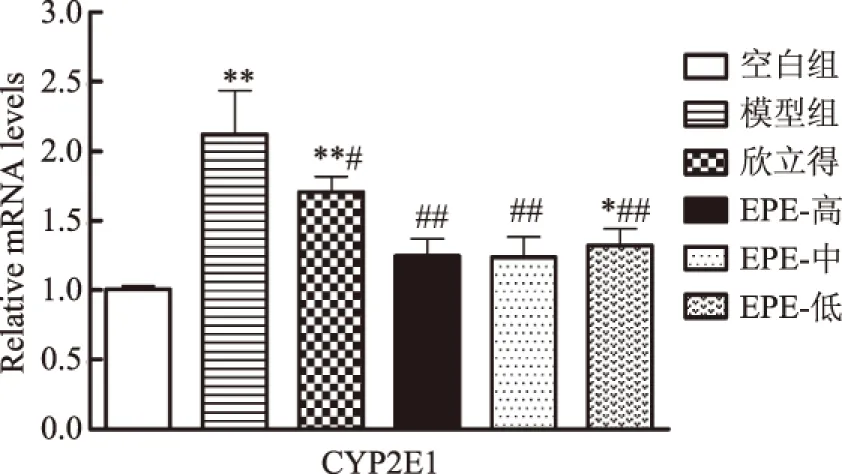
图2 EPE对CYP2E1基因 mRNA表达的影响(n=4)Fig.2 Effect of EPE on the expression of CYP2E1 mRNA(n=4)
2.3 EPE对肝脏中脂肪代谢相关基因mRNA表达的影响
FAS是脂肪酸合成的关键酶,ADRP介导血浆中游离脂肪酸向肝细胞内转移[19-20],二者过表达时能加速脂肪酸的合成和刺激肝脏细胞吸收脂肪酸并合成TG,导致脂肪肝的发生。由图2可知,与空白组相比,模型组小鼠肝脏中FAS和ADRP基因表达都极显著增加(p<0.01),与模型组相比,EPE高剂量能显著降低FAS和ADRP基因的表达(p<0.05、p<0.01),EPE中剂量能显著降低ADRP基因表达(p<0.05),欣立得对FAS和ADRP的表达没有显著影响(p>0.05)。结果可知,EPE(高剂量)通过降低脂肪酸合成酶FAS和转移酶ADRP(高、中剂量)的表达,减轻肝脏细胞中脂肪酸浓度,从而降低肝脏TG的含量,减轻急性酒精肝损伤。

图3 EPE对肝脏FAS和ADRP 基因mRNA表达的影响(n=4)Fig.3 Effect of EPE on the expression of hepatic FAS and ADRP mRNA(n=4)
2.4 EPE对肝脏氧化应激保护作用
MDA是脂质过氧化反应链式终止阶段产生的小分子产物,其含量可以间接反应自由基的产生情况和机体过氧化程度[21]。由表4可知,与空白组比较,模型组小鼠肝脏组织中MDA含量升高,表明小鼠体内过氧化程度较高;SOD和GSH-Px含量极显著降低(p<0.01),表明乙醇导致小鼠肝脏组织存在严重的氧化损伤,消耗了氧化损伤保护酶SOD和GSH-Px,细胞抵御氧化损伤能力下降。与模型组比较,欣立得组MDA极显著降低(p<0.01),SOD和GSH-Px显著升高(p<0.05、(p<0.01));EPE高、中、低剂量组MDA浓度极显著降低(p<0.01),SOD和GSH-Px极显著升高(p<0.01),各剂量组无剂量关系。结果表明,EPE通过抗氧化损伤保护小鼠急性酒精肝损伤,降低了肝脏氧化应激水平。

表4 EPE对小鼠肝脏SOD、GSH-Px和MDA含量的影响(x±s,n=10)

表5 EPE对小鼠血清TNF-α、IL-6、IL-10含量的影响(x±s,n=10)
2.5 EPE抗炎护肝作用
酒精刺激肝脏kupffer细胞,激活NF-κB信号通路,NF-κB激活后刺激致炎因子TNF-α大量表达,导致炎症发生。kupffer细胞功能受损,血液中内毒素含量上升,刺激单核细胞和血管内皮细胞过量分泌IL-6,引起肝细胞变性、坏死和纤维增生等。IL-10是一种与Th2免疫应答有关密切的细胞因子,也是一种重要的免疫抑制性因子,可抑制Th2细胞增殖及Th1细胞介导的细胞免疫应答[22]。由表5可知,与空白组相比,模型组小鼠血清致炎因子TNF-α和IL-6浓度极显著升高(p<0.01),而抗炎因子IL-10浓度极显著下降,表明小鼠体内存在着炎症损伤。与模型组相比,欣立得能显著降低致炎因子TNF-α和IL-6(p<0.05,p<0.01),EPE高、低剂量组能显著降低TNF-α浓度(p<0.05,p<0.01),EPE各剂量组能显著降低IL-6浓度(p<0.01,p<0.05),但无剂量关系,表明小鼠服用欣立得和EPE能通过降低致炎因子TNF-α和IL-6的浓度,降低炎症损伤。欣立得和EPE对抗炎因子IL-10的浓度无显著影响(p>0.05),表明EPE和欣立得缓解抗炎作用并不是通过提高抗炎因子IL-10来调控的,可能是通过其它因素来调节,如氧化应激,乙醇细胞毒性等。
2.6 EPE抗细胞凋亡作用
酒精对肝细胞的毒性作用会诱发细胞凋亡,Caspase3是细胞凋亡通路中重要的蛋白酶,Caspase3的激活是细胞遭受各种损伤后凋亡发生的最终共同通路[23]。由图4可知,与空白组相比,模型组小鼠肝脏中Caspase3基因mRNA表达显著增加(p<0.05)。与模型组相比,欣立得能显著下调Caspase3基因表达(p<0.05),EPE高剂量能显著降低Caspase3基因的表达(p<0.05),降低肝脏细胞凋亡水平,EPE中剂量和低剂量对Caspase3表达无显著影响(p>0.05)。
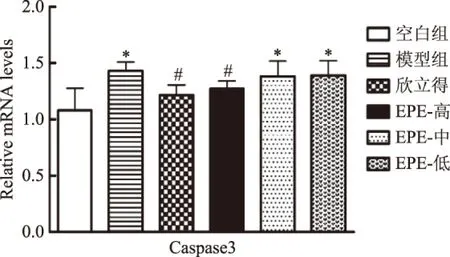
图4 EPE对Caspase3基因mRNA表达的影响(n=4)Fig.4 Effect of EPE on the expression of Caspase3 mRNA(n=4)
2.7 EPE对PPARα基因mRNA表达的影响
乙醇会影响PPARα,而PPARα被抑制参与ALD的形成[24]。由图5可知,与空白组相比,模型组PPARα表达显著降低(p<0.05),与文献报道一致[24]。与模型组相比,EPE高剂量组能显著上调PPARα表达(p<0.05),而欣立得和EPE中、低剂量组对PPARα的表达无显著影响((p>0.05)。

图5 EPE对肝脏PPARα基因mRNA表达的影响(n=4)Fig.5 Effect of EPE on the expression of hepatic PPARα mRNA(n=4)
3 讨论
人体摄入的酒精约90%都是在肝脏内分解代谢,酒精在肝脏内被乙醇脱氢酶(ADH)、细胞色素P4502E1(CYP2E1)和过氧化氢酶(CAT)三套代谢系统氧化为乙醛,然后在线粒体中通过乙醛脱氢酶将乙醛催化为乙酸,乙酸以乙酰CoA进入三羧酸循环代谢,分解为H2O和CO2[25],酒精代谢酶检测对评价机体对酒精代谢功能具有重要的意义。当人体长期或大量饮酒时,酒精代谢过程中产生的乙醛影响三羧酸循环的正常进行,使脂肪酸β氧化受阻,体内脂肪酸来源增加,脂肪酸向肝脏转运积累,最终导致肝脏脂肪性病变[19]。ALD的发病机制比较复杂,目前广泛接受的是“二次打击学说”,该学说认为ALD形成的起重要作用的因素有脂质过氧化、氧化应激和多种炎症细胞因子的释放等[26]。氧化应激诱导细胞线粒体功能受损,膜通透性增高,使线粒体细胞色素C释放进入包浆,激活Caspase凋亡信号通路,最终诱导细胞凋亡[27]。在肝脏细胞氧化应激和炎症发生过程中,PPARα发挥着重要的作用,PPARα是一种磷酸化蛋白,能够调节脂肪细胞的分化,增强机体对胰岛素的敏感性,抑制炎症因子的生成以及炎症的形成,参与调节脂肪代谢相关基因的表达,其低表达会加剧炎症和氧化应激的发生,而乙醇摄入和CYP2E1激活会抑制PPARα的表达[24,28]。
本研究结果显示,EPE能降低急性酒精肝损伤小鼠血清转氨酶ALT、AST和TG浓度,减轻肝脏脂肪变性程度,对急性酒精肝损伤具有很好的保护作用。结合ALD的发病机制和EPE前期的研究基础,对EPE保护急性酒精肝损伤机制研究发现,首先,EPE通过提高肝脏乙醇代谢酶ADH、CAT活性,加速乙醇在小鼠体内的分解,缩短小鼠醒酒时间,提高乙醇分解速率来减少酒精对肝脏的毒性作用时间可能是EPE对ALD的最初的保护机制;其次,EPE通过下调脂肪酸合成酶基因FAS和转运基因ADRP,使脂肪酸合成和向肝脏转移的速率降低,这可能是EPE降低肝脏脂肪变性的机制之一;第三,氧化应激损伤是ALD发生的主原因之一,EPE通过提高肝脏细胞抗氧化酶SOD和GSH-Px活性,降低急性酒精肝损伤小鼠肝脏氧化应激水平,抗氧化作用可能是EPE保护肝脏的主要功效;第四,EPE通过减少致炎细胞因子TNF-α和IL-6的释放,减轻了肝脏炎症损伤,进一步研究发现,EPE对氧化应激和炎症的调控作用与PPARα基因有关,EPE通过上调PPARα基因的表达,降低肝脏氧化应激水平和抑制炎症因子的释放;最后,EPE高剂量组能下调Caspase3基因的表达,降低肝脏组织的凋亡水平,保护肝脏细胞功能完整。总的来说,EPE通过抗氧化、抗炎和抗凋亡作用保护了肝脏细胞,肝脏细胞功能保持完整,有利于肝脏对乙醇及其代谢的有毒物质的分解,降低细胞毒性。
4 结论
本研究结果表明,EPE能通过提高乙醇代谢酶活性,加速乙醇代谢,并通过脂代谢调控、抗氧化、抗炎症、抗细胞凋亡和调控PPARα基因表达几方面,减轻小鼠急性摄入过量酒精导致的肝损伤,发挥解酒和护肝的功效,具有开发为解酒护肝保健食品的潜能,但本实验所用EPE为粗提物,其解酒护肝的有效成分和作用机制还需要更进一步的研究。
[1]梁树才,宗自卫,于海英,等.荷叶总黄酮对小鼠酒精肝损伤的保护作用[J].食品工业科技,2014,35(9):347-350.
[2]赵云霞,陶明煊,陈光宇,等.鸡枞菌多糖对急性酒精肝损伤小鼠超微结构病理结构及ADH2、ALDH2 mRNA表达的影响[J].食品科学,2015,36(5):195-199.
[3]张师,陈建,孙爱东,等.竹叶总黄酮对CCL4所致小鼠肝细胞损伤的保护作用[J].食品工业科技,2013,34(6):353-356.
[4]Cederbaum A I,Lu Y,Wu D. Role of oxidative stress in alcohol induce liver injury[J].Archives of Toxicology,2009,83(6):519-548.
[5]Morton J F. The Emblica(PhyllanthusemblicaL.)[J]. Econom Bot,1960,14:119-128.
[6]刘延泽,李海霞,许利嘉,等.药食兼用余甘子的现代研究概述及应用前景分析[J].中草药,2013,44(12):1700-1705.
[7]Jena K J,Kuttan R,Antioxidant activity of Emblica officinalis[J]. Journal of clinical biochemistry and nutrition,1995,19(2):63-70.
[8]Bart hakur N N. Chemical analysis of the emblica(Phyllanthus emblica)and its potential as a source[J]. Scientia horticultural,1991,47(2):99-105.
[9]Singh H K,Mishra N,Srivastava A K,et al. Pollination and fruit set behavior of anonla(Emblica officinalis)[J].Indian journal of agricultural sciences,2001,71(1):65-66.
[10]刘晓丽,赵谋明,杨宝,等.余甘子活性成分含量与抗氧化性研究[J].天然产物研究与开发,2007,19:189.
[11]章江生,吴婷,唐琪晶,等.余甘子提取物对大鼠缺血再灌注损伤的保护作用及机制[J].中草药,2014,45(24):3590-3593.
[12]俞宏斌,朱炜,戴闯,等.余甘子对大鼠酒精性脂肪肝的炎症抑制作用研究[J]. 中国现代医生,2012,50(4):9-11.
[13]何晓敏.余甘子药理作用研究进展[J].中国中医药科技,2014,21(5):593-595.
[14]陈洋洋,曾涛,谢克勤. 细胞色素P4502E1在酒精性脂肪肝发病中作用的研究进展[J]. 中华劳动卫生职业病杂志,2014,32(11):877-880.
[15]杜正彩,邓家刚,黄慧学,等.芒果叶醇提取物对小鼠急性酒精肝损伤的影响[J].中国实验方剂学杂志,2013,19(22):250-253.
[16]高学清,汪何雅,钱和,等.葛根和葛花对急性酒精中毒小鼠的解酒作用[J].食品与生物技术学报,2012,31(6):62-627.
[17]易健明,屈武斌,张成岗.实时荧光定量PCR的数据分析方法[J].生物技术通讯,2015,26(1):140-145.
[18]向乐进,李晨露,郭帅,等.红枣醋对慢性酒精肝损伤的保护作用[J]. 现代食品科技,2015,31(10):40-44.
[19]Yellen P,Foster D A. Inhibition of fatty acid synthase induces pro-survival Akt and ERK signaling in K-Ras-driver cancer cells[J]. Cancer Lett,2014,353(2):258-263.
[20]Chang BH,Li L,Paul A,et al. Protection against fatty liver but normal adipogenesis in mice lacking adipose differentiation-related protein[J]. Mol Cell Biol,2006,26:1063-1076.
[21]Masalk PD,Abhang SA. Oxidative stress and antioxidant status in patients with alcoholic liver disease[J]. Clin Chim Acta,2005,355(1):61-65.
[22]Tang Xs,Liao Yh,Chen ZJ,et al. Expression of IL-6 and IL-10 in acute myocarditis[J]. Chin J Emerg Med,2007,16(2):174-176.
[23]李延宏,杨同群,王秉义.慢性脊髓损伤后caspase3及凋亡细胞的研究[J].甘肃医药,2013,32(3):161-163.
[24]陶妍,吴高峰,杨建成,等.PPARα在酒精性脂肪肝发生中的作用研进展[J]. 动物医学进展,2012,33(2):71-74.
[25]Gao B,Bataller R. Alcoholic liver disease:pathogenesis and new therapeutic targets[J]. Gastroenterology,2011,141(5):1572-1585.
[26]侯丽,汪秋宽,何云海,等. 牡蛎多糖提取物及其对小鼠急性酒精肝损伤的保护作用[J]. 食品工业科技,2014,35(22):356-359.
[27]Xiong Y,Ye Th,Wang MY,et al. A novel cinnamide ylt26 induces brease cancer cells apoptpsos via rosmitochondrial apoptosis pathwayinvitroand inhibits lung metastasisinvivo[J]. Cell Physiol Biochem,2014,34:1863-1876.
[28]习雪峰,崔节荣,王勇.余甘子对胰岛素抵抗大鼠过氧化物酶体增生物激活受体γ表达的影响[J]. 食品科学,2009,30(5):253-253.
Protection and mechanism of extractumphyllanthusemblicaon acute alcohol-induced liver injury in mice
ZHANG Zhi-bi1,ZHANG Yuan1,YU Hao-fei2,HU Wei-yan2,ZHANG Lan-chun3,YANG Hui1,*,ZHANG Rong-ping1,2,*
(1.Biomedical Engineering Research Center,Kunming Medical University,Kunming 650500,China;2.School of Pharmaceutical Science & Yunnan Key Laboratory of Pharmacology for Natural Products,Kunming Medical University,Kunming 650500,China;3.Department of Laboratory Animal,Kunming Medical University,Kunming 650500,China)
To study the preventive protection effects and mechanisms of extractum phyllanthus emblica(EPE)on acute alcoholic liver injury in mice. 60 ICR male mice were randomly divided into 6 groups,including blank group,model group,medicine contrast group(Metadoxine Capsules,200 mg/kg·d),EPE group(80、160、400 mg/kg·d). Medication groups were given with EPE or Metadoxine Capsules respectively by intragastric administration for 30 days. Then,acute alcoholic liver injury model was established by intragastric administration of 56% alcohol(13 mg/kg)to the medication and model groups 1 h later after the last administration. 12 h later,the activities of serum ALT,AST,TG,TNF-α,LI-6,IL-10,the content of hepatic MDA,SOD,GSH-Px,ADH,the mRNA levels of FAS,ADRP,CYP2E1,PPARαand Caspase3 in liver were measured. HE staining was performed for observing pathological changes of the liver tissues. The results showed that EPE can significantly reduce the level of serum ALT,AST,TG and the liver pathological damage. EPE can significantly reduce the sober time by improving the activities of hepatic alcohol metabolism enzyme ADH,CAT,meanwhile EPE reduce CYP2E1 mRNA expression. EPE significantly suppress the synthesis and transport of fatty acid by inhibiting the expression of FAS and ADRP. EPE significantly increased the activities of SOD and GSH-Px,lower MDA concentration to protect liver injury by antioxidant activity. EPE significantly reduced the content of inflammatory factor TNF-αand IL-6 to relieve liver inflammatory lesions,but EPE had no significant effects on the IL-10 content. EPE significantly reduced the level of liver cell apoptosis by down regulating the expression of Caspase3. EPE significantly relieved liver oxidative damage and inflammatory lesions by up regulating the expression of PPARα. Conclusion:EPE by ethanol metabolic enzyme activity regulation,lipid metabolic control,resistance to oxidation damage,anti-inflammatory and anti cell apoptosis can protect acute alcoholic liver injury in mice. EPE has the prospect of development to avoid hangover and be liver protection health food.
Phyllanthusemblica;acute alcoholic liver;oxidative damage;inflammation;lipid metabolism
2016-08-26
张志毕(1986-),男,硕士,助理实验师,研究方向:天然药物药理,E-mail:zhang_zhibi@163.com。
*通讯作者:杨晖(1979-),女,硕士,讲师,研究方向:药理学,E-mail:358900939@qq.com。 张荣平(1962-),男,博士,教授,研究方向:天然药物化学与药理学,E-mail:zhrp@163.com。
云南省高校协同创新中心-南药研究协同中心项目(NY2014002)。
TS201.4
A
1002-0306(2017)05-0351-06
10.13386/j.issn1002-0306.2017.05.058

