模拟常温物流下大菱鲆菌相变化规律与优势腐败菌鉴定
唐 荣,张彩丽,孙博文,刘尊英
(中国海洋大学食品科学与工程学院,山东青岛 266003)
模拟常温物流下大菱鲆菌相变化规律与优势腐败菌鉴定
唐 荣,张彩丽,孙博文,刘尊英*
(中国海洋大学食品科学与工程学院,山东青岛 266003)
以大菱鲆为研究对象,将传统选择性培养基法和16S rDNA序列分析法相结合,并通过系统发育树分析,探索模拟常温物流下大菱鲆的菌相变化规律及优势腐败菌。结果表明:模拟常温物流下,传统分析与16S rDNA序列分析均表明,大菱鲆初始菌相与贮藏末期菌相明显不同。经16S rDNA序列、NCBI数据库比对以及系统发育树的构建表明,大菱鲆末期菌相主要有气单胞菌(Ameromonassp.)、肠杆菌(Enterobacteriaceaesp.)、红杆菌(Rhodobacteraceaesp.)、发光杆菌(Photobacteriumsp.)、变形杆菌(Gammaproteobacteriasp.)、希瓦氏菌(Shewanellasp.)、拟杆菌(Bacteroidalessp.)和腈基降解菌(Nitriliruptoraceaesp.),其中气单胞菌(Aeromonassp.)和肠杆菌中的柠檬酸杆菌(Citrobactersp.)和哈夫尼氏菌(Hafniasp.)为大菱鲆模拟常温物流下的优势腐败菌。
大菱鲆,优势腐败菌,16S rDNA,选择性培养基
水产品在养殖、加工、贮藏等过程中容易受到物理、化学、微生物等因素的影响而腐败变质。其中,微生物生长和代谢是导致水产品腐败的主要原因。由于生长环境、加工过程和贮藏过程的不同,优势腐败菌能较好地生长并逐渐占优势,导致食品的腐败[1-2]。因此优势腐败菌对于预测产品货架期、控制产品腐败变质具有重要作用。
大菱鲆(Psetta maxima)属海底层肉食性的鲆鲽鱼类[3],1992年,我国开始引进并进行了工厂化养殖[4]。大菱鲆胶质蛋白含量高,味道鲜美,营养丰富。近年来随着大菱鲆产量的不断增加,大菱鲆物流保鲜问题日益突出。本文采用传统分析法和16S rDNA序列分析相结合,探索模拟常温物流下大菱鲆的菌相变化规律与优势腐败菌,以期提高大菱鲆在贮藏过程中的品质,延长大菱鲆的货架期,为常温物流、短途物流提供基础性研究数据。
1 材料与方法
1.1 材料与仪器
鲜活大菱鲆 青岛市南山水产市场,单只重量(747±47) g,有水充氧快速运输至实验室;假单胞菌、气单胞菌与葡萄球菌选择性培养基、铁琼脂培养基、马铃薯葡萄糖琼脂 青岛海博生物技术有限公司;2×Taq PCR Master Mix、ddH2O、引物 27f、1492r、TANamp细菌基因组DNA提取盒、DL2000Marker 上海生物工程有限公司。

表1 感官评分标准
LDZX-40型立式自动电热压力蒸汽灭菌锅 上海申安医疗器械厂;SW-CJ系列医用型洁净工作台 苏州安泰空气技术有限公司;SHP-2500型低温生化培养箱 上海精密宏实验设备有限公司;真空包装机 诸城中佳食品包装机械有限公司;A300基因扩增仪 杭州朗基科学仪器有限公司。

表2 各选择性培养基培养条件
1.2 实验方法
1.2.1 大菱鲆的前处理 鲜活大菱鲆于低温环境下切断脊椎放血,去鳃去内脏,用自来水冲洗血液与残留物,置于0~4 ℃冷风中沥干后,真空包装。将包装好的大菱鲆置于泡沫箱(聚氨酯,隔热系数:0.024 W/M·K,34 cm×30 cm×14 cm)中,每个箱子中放两条鱼,两个冰袋(质量为(428±11) g),按照冰-鱼-鱼-冰的方式排列,泡沫箱置于25±1 ℃恒温培养箱中贮藏50 h,于贮藏初期(0 h)和贮藏末期(50 h)取样进行细菌菌相检测与鉴定,并每隔3~5 h用温度计测量泡沫箱内的温度变化情况。
1.2.2 感官评价 感官评价标准如表1所示。由7名经过标准培训的感官评价人员对大菱鲆的体表粘液、气味、肌肉颜色、肌肉弹性、蒸煮后滋味、蒸煮后汤汁形态进行打分,评分范围为1~5分,其中1分代表品质最差,5分代表品质最好,3分代表感官可接受的临界值。取平均分计入最后结果。
1.2.3 菌落总数、TVB-N值 菌落总数测定方法参照GB 47892-2010;TVB-N值测定方法参照SC/T 3032-2007。
1.2.4 大菱鲆菌相的选择性培养基分析方法 称取大菱鲆背部肌肉25 g,置于225 mL生理盐水中,用灭菌的打浆机均匀打碎,鱼肉悬浮后,取下清液,10倍系列梯度稀释后,用于各菌落计数。各选择性培养基分别用于假单胞菌、乳酸菌、气单胞菌、肠杆菌、葡萄球菌、霉菌酵母菌、菌落总数的测定,其具体培养条件如表2所示。
1.2.5 16S rDNA高通量测序分析 称取大菱鲆背部肌肉25 g,置于225 mL生理盐水中,用灭菌的打浆机均匀打碎。打浆液经4层灭菌纱布过滤后8000 r/min离心5 min,弃上清液。取100 mg沉淀物至2 mL离心管,加入200 μL溶菌酶,漩涡混合均匀后37 ℃水浴40 min。按照试剂盒步骤提取DNA,提取的DNA用于PCR扩增和测序。
1.2.6 16S rDNA单一菌落测序分析 选取贮藏末期菌落数为30~300的平板,根据菌落基本形态特征将平板上的菌落分为若干组,并对每组进行计数。经平板纯化、NB培养基扩大培养至对数期后,离心获得菌体沉淀用于DNA提取、PCR扩增、琼脂糖凝胶电泳和测序。
1.2.7 系统发育树的构建 登录NCBI网站(http://www.ncbi.nlm.nih.gov/),将测序获得的16S rDNA序列通过BLAST与基因库中已有的序列进行比对。选取基因库中与测序片段比对结果相似度大于98%的序列,通过MEGA5.1进行多重序列比对,构建Neighbor-Joining-analysis(近邻结合法)系统发育树。
1.3 统计方法
采用Excel 2010进行数据的记录,采用IBM SPSS Statistics 19软件中的单因素ANOVA进行显著性差异(p<0.05)分析,采用Origin8.5软件作图,采用MEGA5.1进行系统发育树的构建。
2 结果与分析
2.1 模拟常温物流下新鲜度指标的测定
2.1.1 模拟常温物流下温度的变化 用温度计对泡沫箱内温度的变化进行监控,温度变化曲线如图1所示。结果表明,随着时间的延长,温度呈先升高然后平稳最后又升高的趋势。0 h为4 ℃,然后不断升高,30 h达到18 ℃,平稳一段时间后,54 h后继续升高至室温条件。

图1 贮藏过程中温度的变化Fig.1 The change of temperature during storage
2.1.2 模拟常温物流下感官评分的变化 模拟常温物流下的感官评分结果如图2所示。根据感官评分结果可知,随着时间延长,大菱鲆新鲜度逐渐下降,且呈现先缓慢后迅速的趋势。大菱鲆在0、18、30 h时感官评分较高,新鲜度较好,三者之间没有显著性差异(p>0.05);42 h感官评分显著降低(p<0.05),新鲜度有所下降;54 h感官评分进一步降低,感官评分低于感官评分的临界值。因此,选择50 h作为感官可接受的终点。
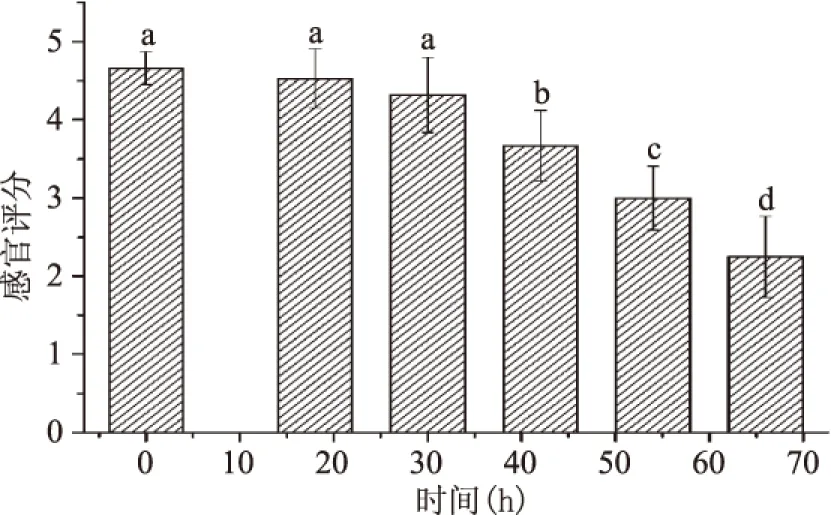
图2 贮藏过程中感官评分的变化Fig.2 The change of sensory score during storage注:标注不同字母表示显著差异(p<0.05)。
2.1.3 模拟常温物流下菌落总数的变化 微生物是导致食品腐败的主要原因[5],每年世界上有三分之一的食品腐败是由于微生物的作用[6]。模拟常温物流下菌落总数变化如图3所示。随着时间的延长,菌落总数呈现逐渐增加的趋势。若以6 logCFU/g为水产品货架期的标准,则大菱鲆在50 h已达到6 logCFU/g,达到货架期,这与2.1.2中的感官评分结果相一致。

图3 贮藏过程中菌落总数的变化Fig.3 The change of total viable counts during storage
2.1.4 模拟常温物流下TVB-N值的变化 TVB-N值的增长与多种因素有关,如核酸和游离氨基酸的降解、微生物活动、自溶反应等[7]。模拟常温物流下TVB-N值如图4所示。随着时间的延长,TVB-N值与为微生物增长趋势一致。以20 mg/100 g 为水产品腐败的标准,则大菱鲆在50 h左右达到产品货架期。

图4 贮藏过程中TVB-N值的变化Fig.4 The change of TVB-N value during storage
总之,感官评分、菌落总数和TVB-N值结果均表明,大菱鲆在模拟常温物流下50 h时达到货架期的终点。因此选用贮藏50 h作为大菱鲆模拟常温物流条件下的末期菌相(腐败菌相)。
2.2 模拟常温物流下大菱鲆的初始菌相与末期菌相
采用选择性培养基分析大菱鲆贮藏过程的菌相变化,结果如图5与图6所示。贮藏初期,肠杆菌比例较高,占到了菌落总数的46.74%,乳酸菌占菌落总数的7.93%,其余四类菌假单胞菌、气单胞菌、霉菌酵母菌、葡萄球菌分别占菌落总数的不足1%。贮藏末期,肠杆菌的比例增长到了69.6%,乳酸菌的种类稍有下降,占菌落总数的6.83%,假单胞菌的比例增大,占菌落总数的16.19%,气单胞菌的比例有所增加,占菌落总数的0.9%,其余菌的比例为6.48%。
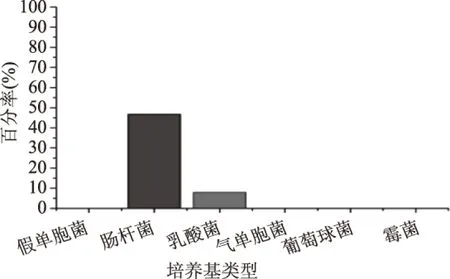
图5 大菱鲆贮藏初期菌相组成Fig.5 Bacterial flora composition in fresh turbot

图6 大菱鲆贮藏末期菌相组成Fig. 6 Bacterial flora composition of turbot at the end of the storage
采用16S rDNA高通量测序分析大菱鲆贮藏过程的菌相变化,结果如表3所示。贮藏初期,肠杆菌、红杆菌、气单胞菌比例较高,分别占总数的50.51%、17.04%、和10.06%。其次是希瓦氏菌、腈基降解菌、拟杆菌和放线菌等;贮藏末期,菌相组成发生了明显变化,气单胞菌和肠杆菌比例较高,分别占总数的30.37%、28.50%。其次为红杆菌、发光杆菌、变形杆菌、希瓦氏菌、拟杆菌和腈基降解菌等。

表3 大菱鲆贮藏过程中的菌相组成
比较选择性培养与16S rDNA高通量测序的方法,在初始菌相中,两种分析方法均表明肠杆菌占据优势,分别占总数的46.74%和50.51%。贮藏末期,两种方法的结果有一定的差异。选择性培养中,肠杆菌和假单胞菌为优势菌,而16S rDNA高通量测序中气单胞菌和肠杆菌比例较高。这些差异可能与传统鉴定方法培养出的生物多样性偏低,致使部分微生物不能够检测出有关[8]。
2.3 模拟常温物流下大菱鲆优势腐败菌鉴定
根据菌落基本形态特征,如:菌落大小、菌落颜色、菌落透明度、菌落隆起程度、菌落边缘形态以及菌落光泽度等的不同,从贮藏末期的平板上共挑取26株菌。经过分离纯化扩大培养后进行PCR扩增,对扩增产物进行1.2%琼脂糖凝胶电泳检测,检测结果如图7所示。由图7可知,PCR产物的电泳条带清晰稳定,重复性好,片段长度约为1600 bp,可以用于16S rDNA的序列分析。

图7 菌株的16S rDNA电泳图谱Fig.7 Elevtrophoresis analysis of PCR amplified products of 16S rDNA gene fragments注:M为Maker DL2000,X1、X2、X3分别为 哈夫尼氏菌、柠檬酸杆菌、气单胞菌。
通过16S rDNA序列分析表明,模拟常温物流下,大菱鲆的优势腐败菌为气单胞菌和肠杆菌,分别占到了腐败末期菌落总数的30.37%、28.50%(表3)。其中肠杆菌经进一步分析,主要菌为柠檬酸杆菌和哈夫尼氏菌,分别占肠杆菌的53%和38%(表4)。

表4 大菱鲆优势腐败菌肠杆菌组成
2.4 大菱鲆优势腐败菌系统发育树的构建
研究认为,同源性≥98%即可认为是同一菌种[9]。由图8可以看出,X1菌株和吉林柠檬酸杆菌(Citrobacter gillenii)(登录号:KM515970.1)的同源性最高,可以达到98%,说明X1与吉林柠檬酸杆菌亲缘关系最近;X2菌株与蜂窝哈夫尼氏菌(Hafnia alvei genomosp.2)(登录号:FM179944.1)同源性最高,可以达到96%,说明X2与蜂窝哈夫尼氏菌亲缘关系最近;X3菌株与温和气单胞菌(Aeromonas sobria)(登录号:JN555613.1)同源性最高,可以达到99%,说明X3菌株与温和气单胞菌亲缘关系最近。说明模拟常温物流下大菱鲆的优势腐败菌为气单胞菌、柠檬酸杆菌和哈夫尼氏菌。

图8 基于16S rDNA序列的系统发育树Fig.8 Phylogenetic tree based on 16S rDNA gene sequences
本研究中的大菱鲆的腐败菌主要为气单胞菌、柠檬酸杆菌和哈夫尼氏菌,这与前人在低温条件下研究的海水鱼的优势腐败菌有所差别。蒋慧亮等[10]研究表明,大菱鲆在0 ℃与25 ℃条件下优势腐败菌分别为假单胞菌与腐败希瓦氏菌。Gram等[11]认为冷藏条件下海水鱼、气调或者真空包装鱼及淡水鱼的优势腐败菌分别为腐败希瓦氏菌、发光杆菌和假单胞菌。Surendran等[12]认为相比于温带水域细菌组成,热带鱼类革兰氏阳性菌与肠杆菌含量偏高。郑振霄等[13]研究表明,冷水鱼冷藏过程中,希瓦氏菌属与肠杆菌属在腐败过程中占主导地位。本研究结果与这些研究差异的原因可能与贮藏原料不同与贮藏条件不同有关。
3 结论
模拟常温物流过程中,泡沫箱加冰环境的温度从0 h的4 ℃逐渐上升到30 h的18 ℃,30 h至50 h贮藏末期温度保持平稳;结合传统分析与16S rDNA序列分析的结果,最终确定模拟常温物流下大菱鲆的优势腐败菌为气单胞菌、柠檬酸杆菌和哈夫尼氏菌。
[1]Dalgarrd P. Qualitative and quantitative characterization of spoilage bacteria from packed fish[J]. Int. J. Food Microbiol,1995(26):319-333.
[2]Ozogul Y,Ozyurt G,Ozogul F,et al. Freshness assessment of European eel(Anguilla anguilla)by sensory,chemical and microbiological methods[J]. Food Chem,2005(92):745-751.
[3]杜佳垠. 世界大菱鲆Scophthalmus maximus(Linnaeus)养殖现状[J].现代渔业信息,2001(2):9-11.
[4]雷霁霖,刘新富,关长涛.中国大菱鲆养殖20年成就和展望-庆祝大菱鲆引进中国20周年[J]. 渔业科学进展,2012(3):123-128.
[5]Mahmoud B,Yamazaki K,Miyashita K,et al. A new technology for fish preservation by combined treatment with electrolyzed NaCl solutions and essential oil compounds[J]. Food Chem,2006,99(4):656-662.
[6]Li T,Li J,Hu W,et al. Quality enhancement in refrigerated red drum(Sciaenops ocellatus)fillets using chitosan coatings containing natural preservatives[J]. Food Chem,2013,138(2-3):821-826.
[7]Hong H,Luo Y,Zhou Z,et al. Effects of low concentration of salt and sucrose on the quality of bighead carp(Aristichthys nobilis)fillets stored at 4 ℃[J]. Food Chem,2012,133(1):102-107.
[8]Fontana C,Sandro CP,Vignolo G. Monitoring the bacterial population dynamics during fermentation of artisanal Argentinean sausages[J]. Int. J. Food Microbiol,2005(103):131-142.
[9]谢丽丹,李蕾蕾,王素英,等. 冰温贮藏中南美白对虾特定腐败菌的分离鉴定及其腐败能力分析[J]. 食品工业科技,2016,37(5):171-176.
[10]蒋慧亮,郭全友,杨宪时,等. 大菱鲆0、25 ℃贮藏的鲜度变化和货架期[J]. 海洋渔业,2011(4):447-454.
[11]Gram L,Dalgaard P. Fish spoilage bacteria--problems and solutions[J]. Curr. Opin. Biotechnol,2002(13):262-266.
[12]Surendran PK,Joseph J,Shenoy AV,et al. Studies on spoilage of commercially important tropical fishes under iced storage[J].Fish. Res.,1989(7):1-9.
[13]郑振霄,周聃,冯俊丽,等. 冷海水保藏下鲐鱼菌相变化规律及优势腐败菌的分离鉴定[J]. 现代食品科技,2016,32(4):81-86.
Changes of bacterial flora composition and identification of the dominant spoilage bacteria in turbot under simulated of room temperature logistics
TANG Rong,ZHANG Cai-li,SUN Bo-wen,LIU Zun-ying*
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
Turbots stored under simulated of room temperature logistics were studied in this essay. Selective medium method and 16S rDNA sequence analysis technology were used to study the change of bacterial flora composition in turbot during simulated of room temperature logistics. The results showed that the micro flora composition of turbot were different before and after storage. The 16S rDNA analysis,NCBI database and phylogenetic tree showed that the micro flora composition wereAmeromonassp.、Enterobacteriaceaesp.、Rhodobacteraceaesp.、Photobacteriumsp.、Gammaproteobacteriasp.、Shewanellasp.、Bacteroidalessp.andNitriliruptoraceaesp.. The dominant spoilage bacteria of turbot stored in simulated of room temperature logistics wereAeromonassp.、Citrobactersp.andHafniasp..
Turbot;dominant spoilage organism;16S rDNA;selective medium
2016-07-12
唐荣(1992-),女,硕士生,研究方向:水产品高值化利用,E-mail:956336816@qq.com。
*通讯作者:刘尊英(1974-),女,博士,副教授,研究方向:水产品保鲜与加工,E-mail:naturefoods@163.com。
国家科技型中小企业科技技术创新基金(14C26213712172)。
TS254.4
A
1002-0306(2017)05-0334-06
10.13386/j.issn1002-0306.2017.05.055

