脱氧胆酸促进肠道组织产生IL- 1β及诱导肠道炎症作用的研究
赵胜男,龚自珍,周洁菲,吴瑾
(1.上海交通大学医学院附属新华医院,上海 200092; 2.上海市儿科医学研究所,上海 200092)
·论 著·
脱氧胆酸促进肠道组织产生IL- 1β及诱导肠道炎症作用的研究
赵胜男1,2,龚自珍1,2,周洁菲1,2,吴瑾1,2
(1.上海交通大学医学院附属新华医院,上海 200092; 2.上海市儿科医学研究所,上海 200092)
目的:研究高脱氧胆酸(DCA)对肠道促炎因子IL- 1β等的表达及肠道炎症的诱导作用。方法:给予小鼠添加DCA的膳食,建立小鼠肠道高DCA模型,采用HE染色观察小鼠肠道病理损伤情况;以Western Blot检测结肠组织成熟IL- 1β的产生;以实时PCR检测IL- 6、MCP- 1的表达水平;通过髓过氧化物酶(MPO)活力检测肠道炎症情况。结果:给予小鼠添加0.2% DCA的膳食3个月后,其结肠长度明显缩短[对照组(8.1±0.5)cmvsDCA组(7.3±0.3)cm,P<0.01];代表肠道炎症程度的指标MPO活性显著上升[对照组(1.6±0.4)U·g-1vsDCA组(3.0±0.5)U·g-1,P<0.01];HE染色可见结肠黏膜破损,黏膜下水肿及炎症细胞浸润。同时DCA膳食可明显诱导结肠组织成熟IL- 1β的产生,并导致促炎因子IL- 6(对照组1.0±0.1vsDCA组174.6±45.9,P<0.01)及髓系趋化因子MCP- 1(对照组1.0±0.1vsDCA组187.8±26.2,P<0.001)的mRNA水平表达显著升高。结论:高水平DCA可诱导肠道炎症发生,激活炎症小体、促进成熟IL- 1β产生可能是其重要作用机制之一。
炎症性肠病; 脱氧胆酸; 白细胞介素1β; 炎症小体; 小鼠
炎症性肠病(inflammatory bowel disease, IBD)是一种慢性非特异性肠道炎症性疾病,根据其病理特征可分为克罗恩病(Crohn’s disease, CD)和溃疡性结肠炎(ulcerative colitis, UC)[1]。其病情迁延、难以治愈,并且IBD患者发生结直肠癌的风险率明显增高,严重危害人类健康[2]。IBD的确切发病机制未明,除了遗传等因素之外,环境因素被认为发挥重要作用。流行病学研究显示高脂饮食可增加CD和UC的发病率[3],发达国家与城市人口IBD的发病率高于发展中国家和乡镇人口,尤其是西方高脂饮食人群,表明膳食脂肪可能是IBD发病的重要危险因素之一。目前越来越多的证据显示高脂饮食诱导的肠道胆汁酸水平升高,尤其是脱氧胆酸(deoxycholic acid, DCA)水平的增加在诱导IBD发病的过程中发挥重要作用[4- 6],然而高水平DCA诱导肠道炎症的机制尚不明了。
近来研究数据显示,NLRP3炎症小体活化及其相关促炎症细胞因子如白细胞介素(interleukin,IL)- 1β分泌在炎症性肠病发病过程中至关重要[7- 8]。NLRP3炎症小体是由胞浆内模式识别受体(pattern recognition receptors, PRRs)参与组装的多蛋白复合体,能够识别多种病原体相关的分子模式(pathogen- associated molecular patterns, PAMPs)或损伤相关的分子模式(damage- associated molecular patterns, DAMPs),募集和激活促炎蛋白Caspase- 1,活化的Caspase- 1切割IL- 1β前体并促进其成熟释放,参与一系列炎症反应[9]。因此,具有生物活性的IL- 1β产生依赖于炎症小体活化[9]。研究表明IBD患者黏膜固有层巨噬细胞分泌高水平的IL- 1β,炎症肠黏膜组织及血清IL- 1β水平显著升高,并且IL- 1β水平与肠道炎症严重程度正相关,而阻断IL- 1β成熟的治疗手段对于抑制肠炎具有明显效果,支持NLRP3炎症小体活化及IL- 1β分泌在促进肠道炎症中发挥重要作用[10]。肠道高水平DCA导致的肠道炎症是否也通过激活炎症小体来介导引起我们的关注,本研究通过给予小鼠添加DCA的膳食,观察肠道促炎因子IL- 1β等的表达及肠炎发生的情况和特征,为阐明高水平DCA诱导肠道炎症的机制奠定基础。
1 材料与方法
1.1 实验动物
6~8周雌性C57BL/6小鼠,购自上海中国科学院实验动物中心,在无特异病原菌(SPF)、安静、恒温(25 ℃)、昼夜光照节律(明暗周期为12 h:12 h)下饲养。给予足量的饲料以及饮水,保持垫料干燥清洁。
1.2 主要试剂
DCA、组织蛋白裂解液、β- actin抗体(Sigma,美国),总RNA提取试剂盒(Promega,美国),反转录试剂盒(TaKaRa,日本),SYBR Green荧光染料(Life,美国),BCA蛋白定量试剂盒、ECL化学发光液(Thermo,美国),IL- 1β抗体、HRP标记的抗鼠IgG二抗(CST,美国),BSA(生工,中国),髓过氧化物酶(MPO)测定试剂盒(南京建成,中国),4%多聚甲醛(北京鼎国昌盛,中国)。
1.3 方法
1.3.1 动物模型建立 将6~8周雌性C57BL/6小鼠随机分为对照组(常规饲料)与DCA组(常规饲料中按0.2%的比例添加DCA,由上海斯莱克实验动物有限责任公司制作),每组各6只。3个月后颈椎脱臼法处死两组小鼠,取结肠。测量小鼠结肠长度,冰生理盐水洗净结肠中的粪便后分别留取部分结肠组织进行HE染色、MPO活性检测、实时PCR以及Western Blot。
1.3.2 MPO活性检测 切取相同部位肠段,冰生理盐水洗净肠内粪便,去除脂肪系膜组织。称重后按照1∶9(g·ml-1)的比例加冰生理盐水,利用组织匀浆机制备成10%组织匀浆。后续操作步骤按照试剂盒说明书进行。酶标仪读取460nm处的吸光度后,按照试剂盒说明书所给的公式计算MPO活力(U·g组织湿重-1)。
1.3.3 结肠病理损伤 每组小鼠处死后取近肛门处的结肠约1cm,1ml注射器抽取冰生理盐水缓慢冲洗出结肠内粪便,4%多聚甲醛溶液固定。脱水、透明、浸蜡、包埋、切片、HE染色,普通光学显微镜下观察结肠组织学改变并拍照。
1.3.4 实时PCR切取相同部位结肠,冰生理盐水洗净结肠内粪便,去除肠外系膜及脂肪组织。按照试剂盒说明提取组织总RNA,定量后取3μgRNA逆转录制备cDNA。引物由英骏公司(Invitrogen,美国)合成,引物序列:IL- 6上游引物5′-TAGTCCTTCCTACCCCAATTTC- 3′,下游引物5′-TTGGTCCTTAGCCACTCC-TTC- 3′;MCP- 1上游引物5′-TTAAAAACCTGGATCGGAACCAA- 3′,下游引物5′-GCATTAGCTTCAGATTTACGGGT- 3′;β-actin上游引物5′-CCCATCTATGA-GGGTTACGC- 3′,下游引物5′-TTTAATGTCACGCACGATTTC- 3′。反应条件为95 ℃ 3min、95 ℃ 15s、58 ℃ 15s、72 ℃ 1min、60 ℃ 30s,40个循环。
1.3.5WesternBlot切取相同部位结肠,冰生理盐水洗净结肠内粪便,去除肠外脂肪系膜组织,300μl组织蛋白裂解液制备成组织匀浆。1 200r·min-1离心10min后取上清进行BCA蛋白定量。取70μg总蛋白通过12%SDS-PAGE电泳分离。90V恒压转PVDF膜1h,3%BSA室温封闭2~3h,一抗4 ℃摇床过夜。PBST洗膜15min,3次,二抗室温孵育1h,PBST洗膜15min,3次,ECL显色拍照。
1.4 统计学处理
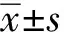
2 结 果
2.1 肠道高DCA使小鼠结肠缩短
对照组和DCA组小鼠3个月后颈椎脱臼法处死,取结肠比较结肠长度改变。结果显示(图1):DCA组小鼠结肠长度[(7.3±0.3)cm]与正常对照组[(8.1±0.5)cm]相比,结肠明显变短(P<0.01)。
2.2 肠道高DCA导致MPO活性升高
造模结束后,颈椎脱臼处死小鼠取结肠制备成10%组织匀浆。按照试剂盒说明测量并计算MPO活力,比较两组小鼠结肠炎症程度。结果发现(图2):与对照组小鼠结肠MPO活力[(1.6±0.4)U·g-1]相比,DCA组[(3.0±0.5)U·g-1]显著增高 (P<0.01)。
a与对照组相比,P<0.01
图1 DCA对小鼠结肠长度的影响
Fig 1 Effects of DCA on the colon length in mice
a与对照组相比,P<0.01
图2 DCA对小鼠结肠MPO活性的影响
Fig 2 Effects of DCA on the colonic MPO activity in mice
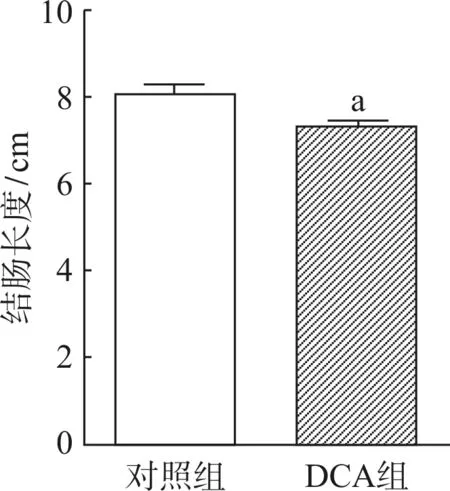
2.3 肠道高DCA损伤小鼠结肠黏膜
分别对两组小鼠结肠进行HE染色,光学显微镜下观察并拍照。对照组结肠黏膜结构清晰,肠腺排列整齐、规则,结肠黏膜上皮完整,无明显的炎症细胞浸润(图3A)。给予小鼠添加0.2% DCA的膳食3个月后可见肠黏膜绒毛损伤,肠上皮完整性破坏,黏膜下水肿以及炎症细胞浸润(图3B)。
2.4 肠道高DCA诱导IL- 1β表达
两组小鼠结肠组织匀浆后,通过Western Blot法检测两组小鼠结肠组织中IL- 1β成熟片段的表达情况。结果显示:与对照组相比,DCA组小鼠结肠成熟的IL- 1β蛋白表达明显增多(图4A)。使用Image Lab软件对Western Blot结果灰度扫描后做统计分析(图4B),两组小鼠结肠IL- 1β表达量的差异有统计学意义(对照组1.1±0.3vsDCA组3.2±0.5,P<0.001)。
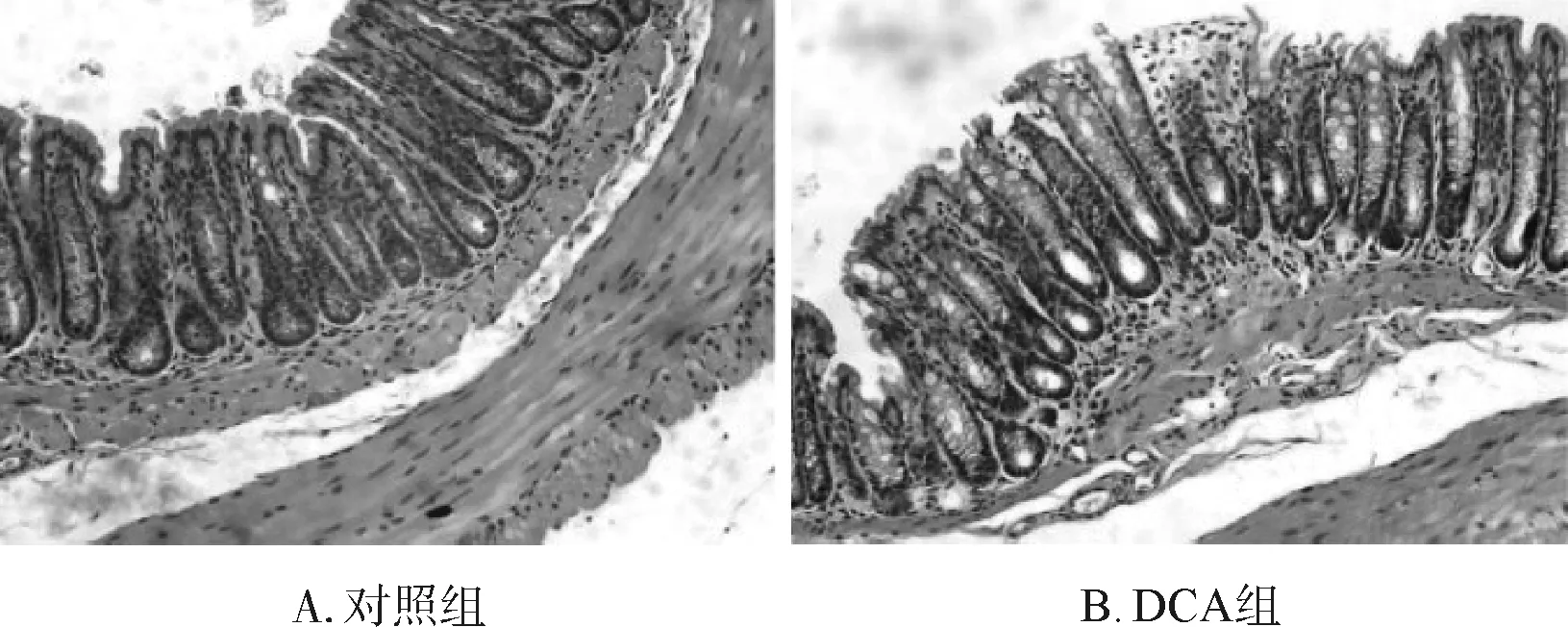
图3 DCA对小鼠结肠组织病理学影响 HE染色×200
Fig 3 Effects of DCA on histopathologic features of the colon in mice HE staining×200
a与对照组相比,P<0.001
图4 DCA对小鼠结肠组织成熟IL- 1β蛋白表达的影响
Fig 4 Effects of DCA on the mature IL- 1β expression of colon tissue in mice
2.5 肠道高DCA诱导IL- 6和单核细胞趋化蛋白- 1(monocyte chemotactic protein 1,MCP- 1)表达
小鼠结肠组织匀浆后提取总RNA,反转录为cDNA后利用实时PCR技术分别测组织IL- 6和MCP- 1的mRNA相对表达量。结果发现与对照组小鼠结肠 IL- 6 mRNA表达量(1.0±0.1)相比,DCA组小鼠IL- 6 mRNA表达量(174.6±45.9)明显升高(图5A,P<0.01)。同时,DCA组小鼠结肠的MCP- 1 mRNA表达量也显著升高(图5B,对照组1.0±0.1vsDCA组187.8±26.2,P<0.001)。
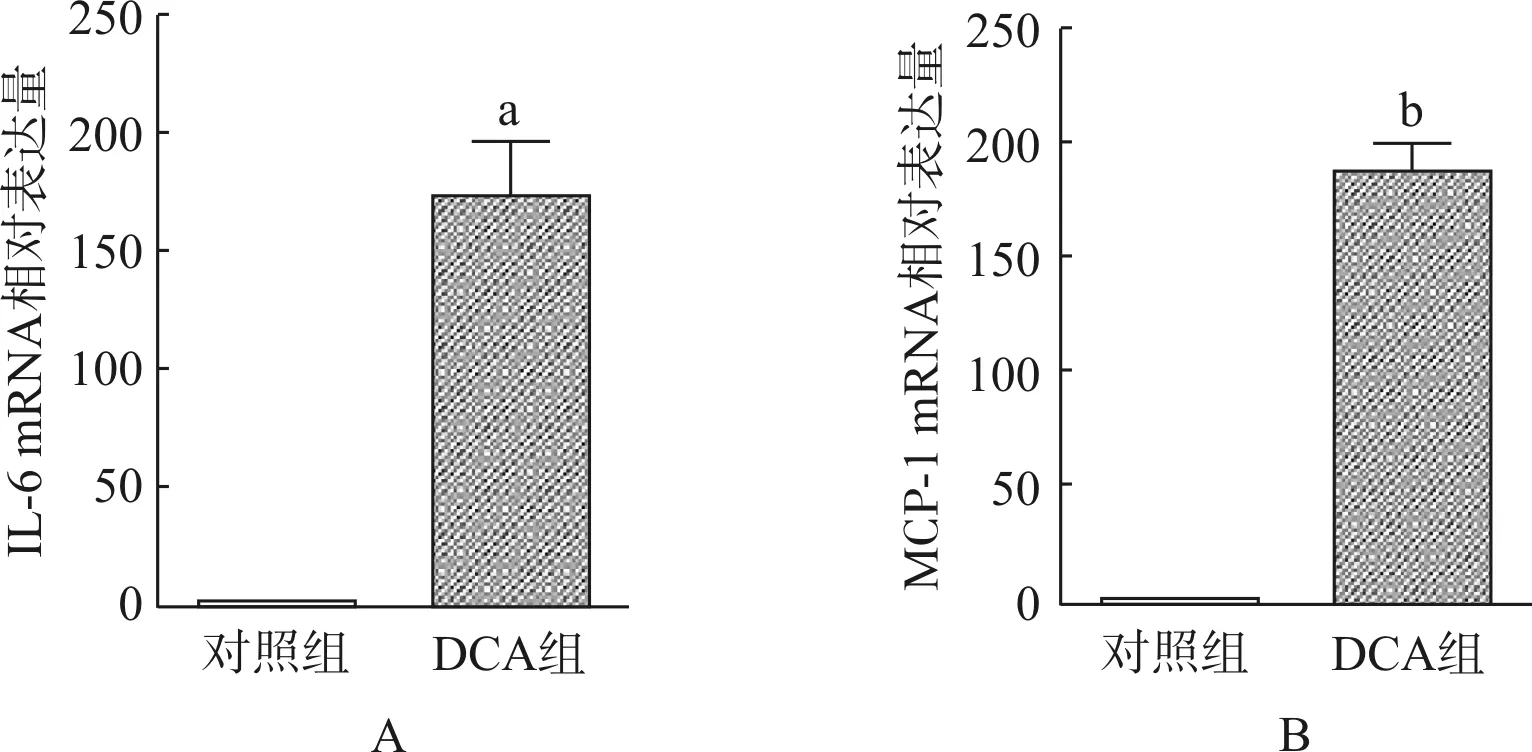
与对照组相比,aP<0.01;bP<0.001
图5 DCA对小鼠结肠IL- 6、MCP- 1 mRNA表达量的影响
Fig 5 Effects of DCA on the mRNA level of IL- 6, MCP- 1 of colon tissue in mice
3 讨 论
胆汁酸是双亲性胆固醇代谢产物,在肝脏合成,储存于胆囊,然后释放入肠道,肝脏合成的初级胆汁酸可在肠道细菌作用下进行7- α脱羟作用生成次级胆汁酸,肠道中的各种胆汁酸经肝肠循环重吸收由门静脉进入肝脏,少部分(约4%)留在肠道,主要为DCA、石胆酸,其中DCA约占人类粪便总胆汁酸的58%[11- 12]。研究发现,高脂饮食能引起胆汁的大量分泌,可导致肠道粪便中次级胆汁酸水平显著增高,尤其是DCA。Stenman等发现高脂饮食的动物粪便DCA的含量较正常饮食升高近10倍,并且肠道防御功能也受到损伤[4]。临床资料发现IBD患者肠道DCA水平升高,并且在炎症病灶结肠组织积聚的DCA水平增高尤为显著[10]。研究显示,对大鼠进行短暂的DCA灌肠可诱导轻度结肠炎和长久性内脏痛觉过敏[13]。我们的研究发现,给予小鼠添加0.2% DCA的膳食3个月后其结肠长度明显缩短,代表肠道炎症程度的指标MPO活性显著上升。HE染色可见结肠黏膜破损,黏膜下水肿及大量炎症细胞浸润,类似于人类的IBD,提示高水平DCA可以诱导肠道炎症;尤为重要的是,DCA膳食可明显诱导结肠组织成熟IL- 1β的产生,提示炎症小体活化的存在。IL- 1β作为参与肠道炎症的重要促炎症因子之一,处于炎症反应的上游,能引起多种炎症细胞因子和效应分子的产生(IL- 6、TNF- α等),被认为在肠道炎症级联反应的早期阶段尤为关键,因此,激活炎症小体、促进IL- 1β产生可能是高水平DCA诱导肠道炎症的重要机制之一。
天然免疫系统在早期宿主防御病原体机制中起着举足轻重的作用,被认为是机体防御的第一道防线,其中单核- 巨噬细胞主要通过PRRs来识别和吞噬病原体。目前已知的PRRs主要包括Toll- like receptor(TLR)、NOD- like receptor(NLR)、RIG- I- like receptor(RLR)等,PRRs感知进化保守的病原体相关分子模式PAMPs,触发胞内信号通路的活化,导致大量细胞因子的产生,进而启动和促进适应性免疫应答。目前研究证明PRRs不仅识别PAMPs,也可识别宿主内源性危险信号- 损伤相关分子模式DAMPs,在多种炎症性疾病中发挥重要作用。NLRP3炎症小体是天然免疫系统的重要组成部分,其异常活化与多种感染性炎症及无菌性炎症密切相关,包括炎症性肠病。NLRP3在CD患者和2,4,6- 三硝基苯磺酸(2,4,6- trinitrobenzenesulfonic acid, TNBS)诱导的小鼠肠炎模型中均高表达[10,14];NLRP3敲基因小鼠对于葡聚糖硫酸钠(dextran sulfate sodium salt, DSS)诱导的肠炎易感性明显降低[7]。以往研究证明NLRP3炎症小体可识别多种内源性成分,如尿酸结晶、ATP等。目前已知激活NLRP3炎症小体的方式主要包括促进钾离子外流、诱导活性氧(reactive oxygen species, ROS)产生以及溶酶体破坏(组织蛋白酶B释放)等3种模式,不同的刺激因素可能通过一种或多种模式激活NLRP3炎症小体[9]。DCA是否可以直接激活NLRP3炎症小体,其激活特点及模式如何仍在探讨之中。
此外,胆汁酸作用的发挥主要是通过其受体实现的,胆汁酸受体分为核受体和膜表面受体,主要包括法尼醇X受体(farnesoid X receptor, FXR)和G蛋白偶联胆汁酸受体(the G- protein- coupled bile acid receptor, Gpbarl)即TGR5等[15]。研究表明,上述受体在巨噬细胞均有不同程度的表达。胆汁酸通过激活相应受体控制脂肪和碳水化合物的平衡,参与能量平衡、血糖控制及免疫调节。对于介导DCA诱导肠道炎症受体的研究将有助于发现IBD治疗的新靶点。
综上所述,我们的研究结果提示胆汁酸DCA可能通过激活炎症小体、促进IL- 1β分泌参与高脂饮食诱导的肠道炎症,在此基础上,对相关机制的进一步深入探讨可能为高脂饮食诱导肠炎的预防及药物治疗提供重要靶点,并为指导建立正确的饮食习惯提供理论依据。
[1] 张丽,陈洪,王玉连.人类炎症性肠病的microRNA表达分析研究的meta分析[J].现代医学,2016,44(3):306- 315.
[2] KAPLAN G G.The global burden of IBD:from 2015 to 2025[J].Nat Rev Gastroenterol Hepatol,2015,12(12):720- 727.
[3] FROLKIS A,DIELEMAN L A,BARKEMA H W,et al.Environment and the inflammatory bowel diseases[J].Can J Gastroenterol,2013,27(3):e18- e24.
[4] STENMAN L K,HOLMA R,KORPELA R.High- fat- induced intestinal permeability dysfunction associated with altered fecal bile acids[J].World J Gastroenterol,2012,18(9):923- 929.
[5] RAIMONDI F,SANTORO P,BARONE M V,et al.Bile acids modulate tight junction structure and barrier function of Caco- 2 monolayers via EGFR activation[J].Am J Physiol Gastrointest Liver Physiol,2008,294(4):G906- G913.
[6] BERNSTEIN H,HOLUBEC H,BERNSTEIN C,et al.Unique dietary- related mouse model of colitis[J].Inflamm Bowel Dis,2006,12(4):278- 293.
[7] BAUER C,DUEWELL P,MAYER C,et al.Colitis induced in mice with dextran sulfate sodium (DSS) is mediated by the NLRP3 inflammasome[J].Gut,2010,59(9):1192- 1199.
[8] SIEGMUND B,LEHR H A,FANTUZZI G,et al.IL- 1 beta - converting enzyme (caspase- 1) in intestinal inflammation[J].Proc Natl Acad Sci U S A,2001,98(23):13249- 13254.
[9] SCHRODER K,TSCHOPP J.The inflammasomes[J].Cell,2010,140(6):821- 832.
[10] COCCIA M,HARRISON O J,SCHIERING C,et al.IL- 1beta mediates chronic intestinal inflammation by promoting the accumulation of IL- 17A secreting innate lymphoid cells and CD4(+) Th17 cells[J].J Exp Med,2012,209(9):1595- 1609.
[11] PAVLIDIS P,POWELL N,VINCENT R P,et al.Systematic review:bile acids and intestinal inflammation- luminal aggressors or regulators of mucosal defence?[J].Aliment Pharmacol Ther,2015,42(7):802- 817.
[12] ALBERTS D S,EINSPAHR J G,EARNEST D L,et al.Fecal bile acid concentrations in a subpopulation of the wheat bran fiber colon polyp trial[J].Cancer Epidemiol Biomarkers Prev,2003,12(3):197- 200.
[13] TRAUB R J,TANG B,JI Y,et al.A rat model of chronic postinflammatory visceral pain induced by deoxycholic acid[J].Gastroenterology,2008,135(6):2075- 2083.
[14] CASTRO J,OCAMPO Y,FRANCO L.Cape gooseberry [Physalis peruviana L.] calyces ameliorate TNBS acid- induced colitis in rats[J].J Crohns Colitis,2015,9(11):1004- 1015.
[15] KEATING N,KEELY S J.Bile acids in regulation of intestinal physiology[J].Curr Gastroenterol Rep,2009,11(5):375- 382.
(本文编辑:周兰波)
Study of deoxycholic acid on the production of IL- 1β and induction of intestinal inflammation
ZHAO Sheng- nan1,2,GONG Zi- zhen1,2, ZHOU Jie- fei1,2,WU Jin1,2
(1.XinhuaHospital,SchoolofMedicine,ShanghaiJiaoTongUniversity,Shanghai200092,China;2.ShanghaiInstituteforPediatricResearch,Shanghai200092,China)
Objective:To investigate the effect of high level deoxycholic acid(DCA)on the IL- 1β production and intestinal inflammation occurrence. Methods: Mice were fed with routine diet supplemented with 0.2% DCA, HE staining was performed to observe intestinal pathological injury; Western Blot and Realtime PCR were adopted to detect mature IL- 1β production and IL- 6, MCP- 1 expression respectively; intestinal inflammation was assessed by the measurement of MPO activity. Results: Mice fed the DCA- supplemented diet developed obvious intestinal inflammation and injury, as evidenced by significant shortening of colon length [control group(8.1±0.5) cmvsDCA group(7.3±0.3)cm,P<0.01] and much higher MPO activity [control group(1.6±0.4)U·g-1vsDCA group(3.0±0.5)U·g-1,P<0.01]; HE staining of colonic tissue in DCA group showed intestinal mucosal impairment, submucosal edema and inflammatory cell infiltration. Of note, the mature IL- 1β level in colon tissue was elevated dramatically in DCA- fed group. Meanwhile, the mRNA levels of IL- 6 (control group 1.0±0.1vsDCA group 174.6±45.9,P<0.01) and MCP- 1 (control group 1.0±0.1vsDCA group 187.8±26.2,P<0.001) in DCA group were significantly increased as well. Conclusion: High level DCA can induce the occurrence of intestinal inflammation, which may at least partially depend on the activation of inflammasome and production of IL- 1β.
inflammatory bowel disease; deoxycholic acid; IL- 1β; inflammasome; mice
2016- 09- 05
2016- 12- 20
上海市自然科学基金资助项目(16ZR1428500)
赵胜男(1991-),女,山东济宁人,在读硕士研究生。E- mail:zhaoshn1991@126.com
吴瑾 E- mail:wujin51@yahoo.com
赵胜男,龚自珍,周洁菲,等.脱氧胆酸促进肠道组织产生IL- 1β及诱导肠道炎症作用的研究[J].东南大学学报:医学版,2017,36(2):171- 176.
R574.62
A
1671- 6264(2017)02- 0171- 06
10.3969/j.issn.1671- 6264.2017.02.008

