用于逆转卵巢癌耐药的HMSN复合载药系统的研究
郭欣,蔡云朗,任慕兰
(1.东南大学 医学院,江苏 南京 210009; 2.东南大学附属中大医院 妇产科,江苏 南京 210009)
·论 著·
用于逆转卵巢癌耐药的HMSN复合载药系统的研究
郭欣1,蔡云朗2,任慕兰2
(1.东南大学 医学院,江苏 南京 210009; 2.东南大学附属中大医院 妇产科,江苏 南京 210009)
目的:构建介孔二氧化硅(HMSN)复合载药系统,探究该系统对卵巢癌耐药细胞株SKOV- 3/ADR耐药的逆转作用。方法:在HMSN表面修饰羧基,通过机械搅拌和静电吸引的作用包载ADR和荧光NVP;采用Zeta电位、透射电镜等方法对此系统进行表征,并测定此系统的包封率和载药量以及在不同pH值环境中的药物释放率;再将实验分为两组,即HMSN- COOH@ADR荧光NVP组和游离ADR荧光NVP组,采用荧光共聚焦观察不同时间点HMSN复合载药系统在胞内的蓄积情况;利用MTT法检测细胞在两组作用24 h后的抑制率,同时通过流式细胞分析仪检测两组的凋亡率。结果:Zeta电位表明HMSN在修饰羧基之前其所带电荷约为-20 mV,在修饰羧基后HMSN所带电荷增加至约-40 mV;通过透射电镜表明此载药系统在包载药物前后的形态和粒径均未发生明显改变;测定HMSN复合载药系统中ADR的包封率为45%,载药量为7.5%,荧光NVP的包封率为30%,载药量为1.4%。HMSN复合载药系统的药物释放率随着环境pH值的降低而逐渐升高,具有显著的pH敏感性,实现了以HMSN所处环境的pH值为“开关”调控药物的释放,有效地减少了复合载药系统在胞外的非特异性释放;通过荧光共聚焦观察发现HMSN复合载药系统作用细胞1 h后,其在胞内的蓄积量即可明显增加,随着作用时间的延长胞内的荧光强度也在逐渐增强;药物作用相同的时间,HMSN- COOH@ADR荧光NVP组较游离ADR荧光NVP组的MTT细胞抑制率和细胞凋亡率均明显提高(P<0.05),对细胞的毒性作用明显增强。结论:构建的HMSN- COOH@ADR荧光NVP的复合载药系统可以有效逆转卵巢癌耐药细胞株SKOV- 3/ADR的耐药性,其逆转耐药的机制是通过非特异性的内吞途径携带复合载药系统进入细胞内,逃避了P- gp等ABC运载蛋白超家族的识别和外排作用。
卵巢癌; 多药耐药; 介孔二氧化硅; NVP- AEW541
近10年来世界各国肿瘤的发病率提高了近1倍,恶性肿瘤的死亡人数增长了约45%,其中卵巢癌作为女性生殖系统常见的恶性肿瘤一直是肿瘤防治的研究热点。现临床应用于卵巢癌的化疗药物较多,最常采用的是紫杉醇配伍铂类药物。随着科研技术的发展,新型的化疗药物也在不断研发,但卵巢癌患者的5年生存率仍然仅有35%左右,预后极差[1]。研究发现,卵巢癌患者化疗失败和死亡的一个重要原因是肿瘤多药耐药[2],多药耐药的发生机制多是因为患者长期接触某一种类的化疗药物,对此种药物产生耐受,并对其他结构和功能不同的化疗药物也产生耐药性。现发现的肿瘤细胞产生多药耐药的原因较多,如激素受体的减少或缺失、DNA损伤修复能力的增强、细胞膜水平上的药物转运和摄取障碍及药物的分布改变等。其中,ABC(ATP- binding cassette)运输蛋白超家族的高表达是产生肿瘤多药耐药的主要原因,作为ATP依赖性的药物泵,可利用ATP水解产生的能量将进入肿瘤细胞内的药物泵出,使蓄积在细胞内的化疗药物减少,从而产生耐药[3]。P- gp是属于ABC运输蛋白超家族的首先在肿瘤细胞中发现的单链跨膜糖蛋白,不同起源的耐药细胞均可表达P- gp,表达量与肿瘤细胞的耐药程度相关[4]。
为逆转肿瘤细胞的多药耐药,现已提出的措施有免疫治疗、基因治疗、细胞因子和多药耐药逆转剂等。但相对于肿瘤多药耐药机制的复杂性与多重性,这些措施的单一性使临床效果一直欠佳,所以目前对逆转肿瘤细胞的多药耐药依然是肿瘤治疗的难点。
随着人们对微观世界研究的深入,纳米医学逐渐走入人们的视野,将纳米技术应用于肿瘤的防治已成为目前肿瘤研究的热点。将化疗药物负载于纳米材料中构建纳米载药系统作用于肿瘤细胞,同时可联合逆转剂或单克隆抗体等不同作用机制的药物,在微观上达到协同增敏、逆转多药耐药的效果[5]。纳米微载体可利用肿瘤组织的增强渗透和保留效应,即EPR效应,发挥被动靶向作用[6],在EPR效应的基础上将叶酸、转铁蛋白或受体的特异性抗体修饰在纳米微载体表面,使微载体可以主动靶向肿瘤组织,更好地实现化疗药物在肿瘤组织的富集[7]。在达到定向富集效果的同时为微载体设计开关,如利用其所处环境的pH值、温度等理化性质的改变调控药物释放、提高药物疗效、降低药物的毒副作用。
本次实验我们欲探究利用介孔二氧化硅(hollow mesoporous silica nanoparticles, HMSN,50 nm)为微载体的负载阿霉素(ADR)和NVP- AEW541的复合载药系统,逆转人卵巢癌细胞株SKOV- 3/ADR的耐药性的可行性及其相关机制。NVP- AEW541是一种吡咯并嘧啶的衍生物,为胰岛素样生长因子1受体(insulin- like growth factor receptor, IGF- 1R)特异性的抑制剂,IGF- 1R是IGF信号轴的重要组成部分。IGF信号轴的激活可活化多条信号通路,主要是高度保守的PI3K/AKT信号通路[8]。PI3K/AKT过度激活时抗凋亡蛋白Bcl- xl表达量增加,Bax促凋亡蛋白表达降低,抑制化疗药物诱导细胞凋亡,使细胞对p- gp相关和不相关的药物敏感性降低,NVP可抑制PI3K/AKT信号通路的激活,阻断胞内信号传导,促进肿瘤细胞凋亡,增强肿瘤细胞对化疗药物的敏感性。同时SKOV- 3/ADR高表达IGF- 1R,负载NVP的HMSN可以主动亲和此细胞株[9],起到主动靶向作用。血液循环系统为中性环境,肿瘤组织局部的pH值为6.5~6,肿瘤细胞内的pH值降至4.5~4,因此HMSN复合载药系统在富集的过程中其所处环境的pH值也在逐渐减低。本次我们设计pH敏感性开关,在HMSN表面修饰羧基使其所带的负电荷升高,但随着pH值的降低,羧基发生电荷反转质子化而带正电,实现MNSN复合载药系统负载药物的定向释放。
1 材料与方法
1.1 主要试剂与材料
HMSN购自安徽鑫磊粉体科技有限公司,ADR、荧光NVP及人卵巢癌细胞SKOV- 3/ADR购自南京凯基生物公司。
1.2 构建HMSN复合载药系统
1.2.1 在HMSN表面修饰羧基 将10 mg HMSN分散在无水乙醇中,超声振荡10 min,加热至80 ℃,加入N- (三甲氧基硅丙基)乙二胺三乙酸钠盐100 μl在充分冷凝回流下磁力搅拌24 h,待体系冷却至室温离心分离,分别用乙醇和去离子水反复离心洗涤3遍即得到表面被- COOH修饰的HMSN。
1.2.2 Zeta电位检测 PBS悬浮混匀获得HMSN- COOH,将混合溶液加入样品池中,操作条件为11.4 V·cm-1、13.0 mA、25 ℃。
1.2.3 HMSN- COOH包载ADR和荧光NVP 称取2 mg的ADR溶解于PBS中,调定PBS的pH值为7.40,将获得的HMSN- COOH均匀分散在此PBS中并定容到10 ml。磁力搅拌过夜后离心,收取上清液并分离HMSN- COOH@ADR,PBS冲洗获得的HMSN- COOH@ADR。精确称取0.5 mg荧光NVP分散于pH值为8的PBS中并以此重悬HMSN- COOH@ADR,同时定容至10 ml,磁力搅拌24 h后离心收取HMSN- COOH@ADR荧光NVP并保留上清液,将HMSN- COOH@ADR荧光NVP分散在PBS中并定容至10 ml,4 ℃冰箱保存备用。
1.2.4 ADR和荧光NVP包封率和载药量的测定 采用pH值为7.40的PBS配置500 μg·ml-1的ADR母液,稀释为400、300、200、100、50 μg·ml-1的工作液,480 nm波长检测上述工作液的吸光度,PBS为空白对照,以吸光度(Y)对盐酸阿霉素浓度(X)进行线性回归并得到回归方程。检测1.2.3包载ADR后上清液的OD值,根据回归方程计算ADR的包封率和载药量。DMSO配置浓度为500 μg·ml-1的荧光NVP母液,稀释的工作液浓度为100、80、60、40、20、10 μg·ml-1。DMSO为空白对照,以吸光度(Y)对荧光NVP(X)进行线性回归并得到回归方程。将1.2.3中包载荧光NVP后上清液真空烘干后溶于DMSO,测其OD值,代入回归方程计算荧光NVP的包封率和载药量。包封率=包入HMSN中的药量/投药总量;载药量=包入HMSN中的药量/总质量(载体+包裹药物)。
1.2.5 不同pH值条件下ADR和荧光NVP的释放率 分别配置pH值为7.4、6.5、5.5、4.5的PBS,并分别将1 mg的 HMSN- COOH@ADR均匀地分散在其中,每间隔10 h检测各组上清液的OD值,检测至120 h。同样,分别将1 mg的HMSN- COOH@荧光NVP分散在上述不同pH值的PBS中,每间隔10 h取各组上清液,真空烘干后溶于DMSO中再检测各组的OD值,检测至50 h。实验重复3次取均值,计算ADR和荧光NVP的释放率。
1.2.6 透射电镜表征 利用透射电镜对HMSN和HMSN- COOH@ADR荧光NVP进行表征,观察HMSN在负载药物后其形态和粒径是否发生变化。
1.3 体外细胞实验
1.3.1 细胞培养 本实验室常规培养人卵巢癌细胞株SKOV- 3/ADR, 4~5 d传代1次。
1.3.2 共聚焦观察在细胞内的聚集 调整细胞浓度为5×105个·ml-1,接种于小皿中培养过夜,加入100 μl的HMSN- COOH@ADR荧光NVP分别在作用1、2 h后弃去培养基,PBS冲洗2遍,上机观察此复合载药系统在胞内的聚集情况。
1.3.3 MTT检测细胞抑制率 消化细胞并调整细胞浓度为5×104个·ml-1,96孔板上接种细胞,每孔100 μl。培养箱中培养过夜,加入100 μl的HMSN- COOH@ADR荧光NVP,即HMSN- COOH@ADR荧光NVP组,对照组加入与HMSN- COOH@ADR荧光NVP组包载相同ADR和荧光NVP的游离ADR和荧光NVP,即游离ADR荧光NVP组,同时设置空白对照组。再置入培养箱中培养24 h后进行MTT染色,λ=490 nm,测定OD值。
1.3.4 检查两组细胞的凋亡率 将细胞接种于6孔板中,待细胞贴壁后按1.3.3中的方法分组,置于培养箱中培养12 h。胰酶消化收集5×105个细胞,Binding Buffer悬浮细胞,加入5 μl Annexin Ⅴ- FITC混匀后加入5 μl Propidium Iodide,混匀。室温、避光反应5~15 min,流式细胞仪检测细胞凋亡情况。
2 结 果
2.1 Zeta电位检测
分别检测HMSN和HMSN- COOH的Zeta电位,在HMSN表面修饰羧基后其所带电荷由原来的-22.3 mV增长至-44.9 mV(图1)。HMSN- COOH所带负电荷的升高增强了其与带正电荷的ADR和荧光NVP间的静电吸引力,有利于药物的包载。

A.HMSN修饰羧基前;B.HMSN修饰羧基后
图1 HMSN修饰羧基前后的Zeta电位
2.2 ADR和荧光NVP的包封率和载药量
根据不同浓度ADR工作液对应的OD值,得到ADR和OD值间的回归方程Y=0.033X(μg·ml-1)+0.015R2=0.997,由此得到ADR的包封率为45%,载药量为7.5%;同理,得到荧光NVP和OD值间的回归方程Y=0.058X(μg·ml-1)+0.012R2=0.995,荧光NVP的包封率约为30%,载药量为1.4%。
2.3 不同pH值环境中HMSN复合载药系统中ADR和荧光NVP的释放率
ADR和NVP两者在酸性环境中比在碱性环境和中性环境有较高的释放率,在碱性和中性环境中ADR和荧光NVP基本无法从HMSN中释放出来,但随着pH值的降低,两者的释放率明显提高(P<0.05),具有显著的pH敏感性(图2)。

A.ADR的释放率;B.荧光NVP的释放率
图2 不同的pH值环境中HMSN复合载药系统中ADR和荧光NVP的释放率
2.4 透射电镜表征
HMSN在负载药物前后透射电镜下显示其形态仍保持为球形,粒径仍约为50 nm(图3)。

A.HMSN负载药物前 ×15万;B.HMSN负载药物后 ×20万
图3 HMSN在包载ADR和荧光NVP前后的粒径和形态均未发生改变
2.5 荧光共聚焦观察HMSN复合载药系统在胞内的聚集情况
通过荧光共聚焦可以看出,随着时间的延长HMSN复合载药系统在胞内的聚集量逐渐增加,并可渗透进入胞核(图4)。
2.6 MTT检测细胞抑制率
在作用相同的时间后,HMSN- COOH@ADR荧光NVP组较游离ADR荧光NVP组表现出较高的抑制率(P<0.05)(表1)。HMSN- COOH@ADR荧光NVP可逆转耐药,提高ADR对SKOV- 3/ADR的杀伤率。
2.7 流式检测两组细胞的凋亡率
药物作用相同的时间,HMSN- COOH@ADR荧光NVP组较游离ADR荧光NVP组表现出更高的凋亡率,P<0.05(图5)。
3 讨 论
本次实验通过构建HMSN复合载药系统作用于SKOV- 3/ADR细胞株,并采用MTT检测细胞抑制率及流式细胞仪检测细胞凋亡率等方法初步证实了构建的HMSN- COOH@ADR荧光NVP较游离的ADR荧光NVP可明显提高对细胞的毒性作用,逆转多药耐药。游离ADR主要通过被动扩散的方式进入细胞,并可较快地进入胞核,但如同SKOV- 3/ADR的耐药细胞的细胞膜上存在的ABC运输蛋白可以将胞内的ADR泵出胞外,明显减弱了化疗效果,易产生细胞的多药耐药性。粒径为50 nm的HMSN复合载药系统,不同于游离ADR可以有效地避免ABC转运蛋白的外排作用,使得药物可以较长时间地蓄积在胞内,逆转肿瘤细胞耐药。
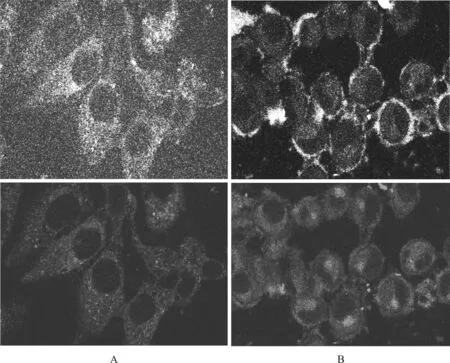
A.1 h ×500;B.2 h ×500
图4 HMSN复合载药系统不同时间点在SKOV- 3/ADR细胞内的聚集情况
表1 两组细胞的MTT抑制率

组 别OD±SD抑制率/%HMSN⁃COOH@ADR荧光NVP组0.203±0.01480.19±1.18a游离ADR荧光NVP组0.392±0.01051.50±2.04
a与游离ADR荧光NVP组相比,P<0.05
粒径小于200 nm的HMSN复合载药系统主要通过网格蛋白调节的非特异性的内吞途径进入细胞,然后依次进入包涵体和溶酶体等[10],在此过程中HMSN复合载药系统所处环境的pH值也在逐渐降低,在HMSN表面修饰的羧基在此过程中会发生电荷反转,质子化而带正电,与ADR和荧光NVP间的静电吸引转为静电排斥,促使HMSN包载的药物可以较为完全且快速地释放在胞内[11]。通过荧光共聚焦观察发现,HMSN复合载药系统在胞内蓄积1 h后其本身及释放的ADR可进入细胞核杀伤肿瘤细胞。本次设计的药物释放开关尽量减少了药物在胞外的释放,这种“特洛伊木马”式的药物释放途径极力避免了纳米粒被摄取前的非特异性药物泄露,在逆转肿瘤细胞耐药的同时还会有效减少化疗药物的毒副作用[12]。
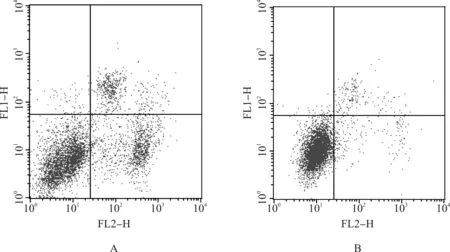
A.HMSN- COOH@ADR荧光NVP组;B.游离ADR荧光NVP组
图5 HMSN复合载药系统组和游离ADR荧光NVP组在作用SKOV- 3/ADR 12 h后流式细胞仪检查两组细胞的凋亡率
本次实验在HMSN中包载的NVP可阻断IGF信号轴,抑制PI3K/AKT通路活化,促进肿瘤细胞凋亡,将肿瘤细胞阻滞在G2/M期并增强阿霉素的化疗效果。NVP的水溶性较差,明显影响其作用的发挥,将NVP负载至HMSN带入细胞,即相当于提高了NVP的溶解性,同时卵巢癌细胞高表达IGF- 1R,使得HMSN复合载药系统可以主动地亲和肿瘤细胞,更为有效地逆转耐药[13],为之后的动物实验在EPR效应的被动靶向的基础上提供主动靶向的方法。
综上所述,本次构建的HMSN- COOH@ADR荧光NVP可有效地避免被耐药细胞膜上的ABC转运蛋白泵出胞外,逆转耐药,同时HMSN复合载药系统的药物释放“开关”可减少化疗药物的副作用。本次实验只是HMSN复合载药系统逆转耐药的体外部分,体内环境复杂,影响因素较多,体外实验不能代替在体实验效果,因此,我们尚需进行HMSN复合载药系统逆转多药耐药的体内实验,以证实此纳米载药系统的作用。
[1] CRAVEIRO V,YANG- HARTWICH Y,HOLMBERG J C,et al.Phenotypic modifications in ovarian cancer stem cells following Paclitaxel treatment[J].Cancer Med,2013,2(6):751- 762.
[2] TOMONO T,KAJITA M,YANO K,et al.,Adenovirus vector infection of non- small- cell lung cancer cells is a trigger for multi- drug resistance mediated by P- glycoprotein[J].Biochem Biophys Res Commun,2016,476(4):183- 187.
[3] WU Q,YANG Z,NIE Y,et al.,Multi- drug resistance in cancer chemotherapeutics:mechanisms and lab approaches[J].
Cancer Lett,2014,347(2):159- 166.
[4] LI W,ZHANG H,ASSARAF Y G,et al.Overcoming ABC transporter- mediated multidrug resistance:molecular mechanisms and novel therapeutic drug strategies[J].Drug Resistance Updates,2016,27:14- 29.
[5] JUN Y W,LEE J HCHEON J,Chemical design of nanoparticle probes for high- performance magnetic resonance imaging[J].Angew Chem Int Ed Engl,2008,47(28):5122- 5135.
[6] TANG C,RUSSELL P J,MARTINIELLO- WILKS R,et al.,Concise review:Nanoparticles and cellular carriers- allies in cancer imaging and cellular gene therapy?[J].Stem Cells,2010,28(9):1686- 1702.
[7] 蔡阳,朱传东,郑勤.金纳米在肿瘤治疗中的应用[J].现代医学,2016,44(6):893- 896.
[8] DOUGLAS J B,SILVERMAN D T,POLLAK M N,et al.Serum IGF- I,IGF- II,IGFBP- 3,and IGF- I/IGFBP- 3 molar ratio and risk of pancreatic cancer in the prostate,lung,colorectal,and ovarian cancer screening trial[J].Cancer Epidemiol Biomarkers Prev,2010,19(9):2298- 2306.
[9] JIN M,BUCK EMULVIHILL M J.Modulation of insulin- like growth factor- 1 receptor and its signaling network for the treatment of cancer:current status and future perspectives[J].Oncol Rev,2013,7(1):e3.
[10] PANYAM J,LABHASETWAR V.Biodegradable nanoparticles for drug and gene delivery to cells and tissue[J].Advanced Drug Delivery Reviews,2012,64:61- 71.
[11] LEE E S,GAO ZBAE Y H.Recent progress in tumor pH targeting nanotechnology[J].J Control Release,2008,132(3):164- 170.
[12] HUANG Y,JIANG Y,WANG H,et al.Curb challenges of the “Trojan Horse” approach:smart strategies in achieving effective yet safe cell- penetrating peptide- based drug delivery[J].Adv Drug Deliv Rev,2013,65(10):1299- 1315.
[13] VANAMALA J,REDDIVARI L,RADHAKRISHNAN S,et al.Resveratrol suppresses IGF- 1 induced human colon cancer cell proliferation and elevates apoptosis via suppression of IGF- 1R/Wnt and activation of p53 signaling pathways[J].BMC Cancer,2010,10:238.
(本文编辑:周兰波)
The study of HMSN compound drug delivery system for reversing ovarian cancer drug resistance
GUO Xin1,CAI Yun- lang2,REN Mu- lan2
(1.TheMedicalSchool,SoutheastUniversity,Nanjing210009,China; 2.DepartmentofGynaecologyandObstetrics,ZhongdaHospital,SoutheastUniversity,Nanjing210009,China)
Objective:To develop a co- delivery system based on hollow mesoporous silica nanoparticles(HMSN), and explore the effect of this system in reversing multiple drug resistance in ovarian cancer cell SKOV- 3/ADR. Methods: HMSN was selected as the nanocarriers, with- COOH modified on the surface and ADR, NVP- AEW541 loaded inside. Then this system was characterized by Zeta potential, TEM and other methods, and the entrapment efficiency, drug loading rate, drug release rate in different pH environment were detected; Experiment was carried out in two groups, HMSN- COOH@ADR fluorescent NVP and free ADR fluorescent NVP group, gathering of the co- delivery system in cells and nucleus was observed by LSCM at different time points; Cells apoptosis and MTT cell inhibition rate were also detected after 24 hours in each group. Results: Zeta potential showed that the charge of HMSN was about -20 mV before modified carboxyl, and rised to -40 mV after modified carboxyl; The size and shape of HMSN were not changed after loading drugs by TEM; The entrapment efficiency was 45% of ADR and 30% of fluorescent NVP, drug loading rate was 7.5% of ADR and 1.4% of fluorescent NVP; The drugs release rate could be significantly improved as the pH value decreased, so the pH value was used as a “switch” which could effectively reduce extracellular nonspecific drug release. The intracellular quantity of HMSN drug delivery system was increased after one hour, and enhanced gradually with time extension. After the same time, the cell apoptosis rate and MTT inhibition rate of HMSN- COOH@ADR fluorescence NVP group were both higher than that of free ADR fluorescent group (P<0.05), indicated the increased cytotoxicity on cells. Conclusion: This HMSN drug delivery system can enter into cells mainly through nonspecific endocytosis, effectively reverse multidrug resistance of ovarian cancer cell SKOV- 3/ADR,thus avoide the identification and efflux effect of P- gp.
ovarian cancer; multidrug resistance; hollow mesoporous silica nanoparticles; NVP- AEW541
2016- 08- 15
2016- 12- 08
郭欣(1991-),女,山东聊城人,在读硕士研究生。E- mail:15905172950@163.com
蔡云朗 E- mail:ylseu63@sohu.com
郭欣,蔡云朗,任慕兰.用于逆转卵巢癌耐药的HMSN复合载药系统的研究[J].东南大学学报:医学版,2017,36(2):148- 154.
R737.31
A
1671- 6264(2017)02- 0148- 07
10.3969/j.issn.1671- 6264.2017.02.004

