酶解法提取紫甘薯多糖及其生物活性研究
吴远耀,汪劲松,张新潮,王卫东,潘继承
(湖北师范大学生命科学学院,湖北 黄石 435002)
酶解法提取紫甘薯多糖及其生物活性研究
吴远耀,汪劲松,张新潮,王卫东,潘继承*
(湖北师范大学生命科学学院,湖北 黄石 435002)
紫甘薯匀浆经过木聚糖酶处理、热水浸提、乙醇沉淀、除蛋白、脱色得到紫甘薯粗多糖,通过DEAE-Cellulose阴离子交换柱层析得到4种多糖组分,并对其抗氧化活性进行了研究。结果表明,采用木聚糖酶提取紫甘薯多糖的最适条件为:酶添加量0.02%、酶解时间60 min、酶解温度55 ℃。紫甘薯多糖具有较好的抑制邻苯三酚自氧化活性和清除·OH能力,是一种效果好、安全性高的新型天然抗氧化物质。
酶解法;紫甘薯多糖;木聚糖酶;抗氧化活性
紫甘薯原产于美洲,生长环境宽泛、容易栽培。引种于日本的紫甘薯,其茎叶和根块中除含有各种营养成分外,还含有丰富的花青素和多糖,紫甘薯水提液具有抗突变和抗氧化能力[1]。研究表明,紫甘薯根块具有抗氧化和降血糖的作用,可用于预防心血管疾病和糖尿病,有治疗肝功能障碍等保健功能[2]。多糖的生物活性是目前研究的热点,如抗氧化、抗肿瘤、抗突变、抑菌等。现今多糖的研究多集中在真菌、海洋植物和药用植物上,对日常生活中的果蔬研究较少。由于紫甘薯为甘薯变种,目前大部分研究都围绕甘薯进行[3],对紫甘薯多糖研究较少。作者以紫甘薯为原料,利用木聚糖酶提取紫甘薯多糖,并研究了其相应的生物活性。
1 实验
1.1 材料、试剂与仪器
新鲜紫甘薯,市售。
木聚糖酶(酶活≥10 000U·g-1,生化级),湖北汇特生物医药技术有限公司。
95%乙醇、氯仿、正丁醇、苯酚、98%浓硫酸,均为分析纯。
ORION型pH计,TGL-16LA型高速冷冻离心机,GL-2M型冷冻离心机,BS-1E型振荡培养箱,KDM型调温电热套,分析天平。
1.2 方法
1.2.1 紫甘薯多糖的提取与分离纯化
(1)将紫甘薯去皮、切片、晾干、粉碎,得到紫甘薯粉。
(2)酶处理紫甘薯粉。称取5 g紫甘薯粉,加入40 mL蒸馏水调成匀浆,按一定比例加入木聚糖酶,于55 ℃、200 r·min-1恒温摇床中培养1 h,于75 ℃恒温水浴5 min让酶失活[4]。
(3)酶解液离心取上清液,向其中加入3 倍体积的无水乙醇[5],4 ℃过夜。
(4)离心,取沉淀,用蒸馏水溶解沉淀。
(5)脱蛋白。配制sevage溶液(氯仿∶正丁醇=4∶1,体积比,下同);按提取液∶sevage溶液=4∶1(体积比)加入sevage溶液脱蛋白,反复脱5次,每次30 min,充分振荡,离心取上清液[6]。
(6)脱色。活性炭使用前烘干数天。将活性炭按3%的比例加入到提取液中,振荡30 min,6 500 r·min-1离心10 min,反复脱2次至溶液透彻,12 000 r·min-1离心10 min,取上清液(即粗多糖),保存至4 ℃冰箱。
(7)采用DEAE-Cellulose阴离子交换柱层析分离纯化粗多糖。将适量处理好的DEAE-Cellulose装柱,用pH值7.4、50 mmol·L-1的PBS缓冲液平衡。将粗多糖上样,分别用0.3 mol·L-1、0.5 mol·L-1、0.8 mol·L-1、2 mol·L-1的NaCl溶液洗脱,流速控制为1.0 mL·min-1,每管收集10 mL。
1.2.2 清除羟基自由基能力的测定[7]
用FeSO4+H2O2产生羟基自由基(·OH),以氧化水杨酸所得产物的吸光值表示·OH的量。反应液中加入多糖200 μL,加入H2O2启动反应,以不加多糖的反应液为对照溶液。测510 nm处的吸光值,多糖对·OH的清除率按式(1)计算:

(1)
式中:A0为对照溶液的吸光值;A1为样品溶液的吸光值。
1.2.3 多糖对邻苯三酚自氧化的抑制作用的测定
取100μL多糖、1.8 mL Tris-HCl缓冲液(0.1 mol·L-1,4 mmol·L-1EDTA,pH值8.2)和1.0 mL双蒸水于反应瓶中,25 ℃水浴保温10 min,加入100μL邻苯三酚(3 mmol·L-1),混合后每隔30 s测325 nm处的吸光值A325,得出A325随时间的变化曲线,以回归方程的斜率作为邻苯三酚的自氧化速率v(△A·min-1)。以不加多糖的反应液为对照溶液。多糖对邻苯三酚自氧化的抑制率按式(2)计算:
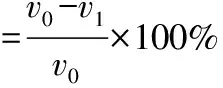
(2)
式中:v0、v1分别为对照溶液和样品溶液的自氧化速率。
1.2.4 多糖含量的测定
采用苯酚-硫酸法测定。标准曲线的绘制:称取恒重的无水葡萄糖0.5 g,溶于500 mL双蒸水中,配制1.0 g·L-1的葡萄糖标准溶液。精密吸取葡萄糖标准溶液0.1 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL,加蒸馏水补足至1 mL,分别加入5%苯酚1 mL混匀,再加入浓硫酸5 mL,振荡混匀放置30 min。以蒸馏水作为空白对照。以波长490 nm处的吸光值为纵坐标、浓度为横坐标绘制标准曲线。
2 结果与讨论
2.1 木聚糖酶添加量对紫甘薯多糖得率和·OH清除率的影响
分别将0.02%、0.06%、0.10%的木聚糖酶添加到紫甘薯匀浆中,固定酶解温度为55 ℃、酶解时间为60 min,考察木聚糖酶添加量对紫甘薯多糖得率(以提取液总糖浓度表示,下同)和·OH清除率的影响,结果如图1所示。

图1 酶添加量对紫甘薯多糖得率和·OH清除率的影响
由图1可以看出,随着酶添加量的增大,多糖得率(总糖浓度)和酶添加量不呈线性关系。酶添加量为0.02%时,多糖得率最高;在0.02%~0.06%酶添加量范围内,随着酶添加量增大,多糖得率反而明显降低;在0.06%~0.10%酶添加量范围内,随着酶添加量增大,多糖得率上升,这可能是由于可溶性多糖含量相应增加。但是随着酶添加量增大,多糖清除·OH能力下降。这可能是由于具有清除·OH能力的多糖被木聚糖酶降解。
2.2 酶解时间对紫甘薯多糖得率和·OH清除率的影响
固定酶解温度为55 ℃、酶添加量为0.02%,考察酶解时间对紫甘薯多糖得率和·OH清除率的影响,结果如图2所示。
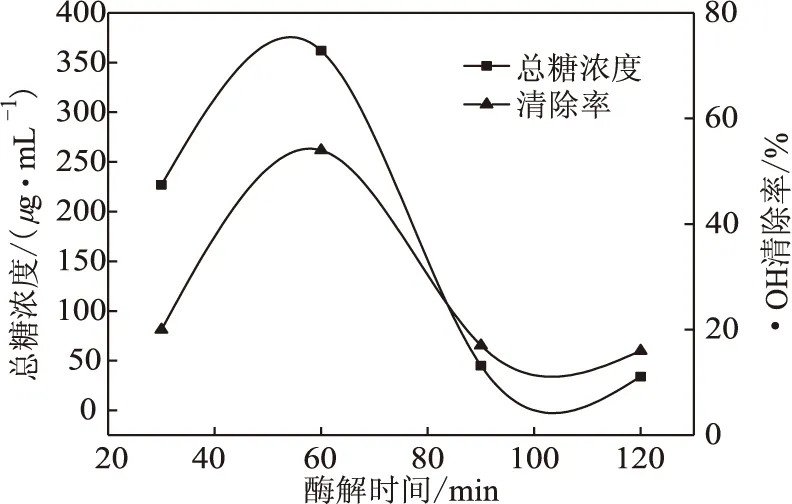
图2 酶解时间对紫甘薯多糖得率和·OH清除率的影响
由图2可以看出,随着酶解时间的延长,多糖得率和·OH清除率逐渐上升;酶解60 min时,多糖得率和·OH清除率均达到最高;酶解时间超过60 min后,多糖得率和·OH清除率均开始下降。原因是,酶解时间太长,超过60 min后,木聚糖酶将粗多糖和木聚糖降解成更小的分子,多糖得率和清除·OH能力受到影响。
2.3 酶解温度对紫甘薯多糖得率和·OH清除率的影响
固定酶添加量为0.02%、酶解时间为60 min,考察酶解温度对紫甘薯多糖得率和·OH清除率的影响,结果见图3。
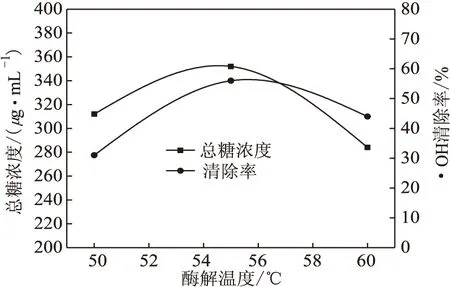
图3 酶解温度对紫甘薯多糖得率和·OH清除率的影响
由图3可以看出,随着酶解温度的升高,多糖得率和·OH清除率均上升;酶解温度为55 ℃时,多糖得率和·OH清除率达到最高;酶解温度超过55 ℃后,多糖得率和·OH清除率下降。
综上,木聚糖酶处理紫甘薯匀浆提取紫甘薯多糖的最适条件为:木聚糖酶添加量0.02%、酶解时间60 min、酶解温度55 ℃。
2.4 多糖的分离纯化
将处理后的紫甘薯多糖粗提液经DEAE-Cellulose阴离子交换柱分离纯化,依次用0.3 mol·L-1、0.5 mol·L-1、0.8 mol·L-1、2 mol·L-1NaCl溶液洗脱收集组分,根据层析图谱的出峰情况判断所得多糖组分。
图4为用苯酚-硫酸法检测,以波长490 nm处吸光值为纵坐标、收集管数为横坐标绘制的洗脱曲线。
由图4可以看出,洗脱曲线有4个峰,收集相应的组分,得到4个多糖组分,分别命名为PPSP Ⅰ、PPSP Ⅱ、PPSP Ⅲ、PPSP Ⅳ。
2.5 多糖抗氧化活性测定结果
2.5.1 对邻苯三酚自氧化的抑制作用
以缓冲溶液为对照,比较紫甘薯多糖4个组分对邻苯三酚自氧化的抑制作用,结果见图5。
由图5可以看出,多糖PPSP Ⅰ、PPSP Ⅱ、PPSP Ⅲ、PPSP Ⅳ4个组分对邻苯三酚自氧化的抑制率均超过40%,其中PPSP Ⅱ对邻苯三酚自氧化的抑制率达到78%。表明紫甘薯多糖具有较好抗氧化的活性。

图5 4种紫甘薯多糖组分和VC对邻苯三酚自氧化的抑制率
2.5.2 清除羟基自由基能力
·OH是对机体危害最大的自由基。以消除Feton反应产生的·OH量为依据,判断紫甘薯多糖的清除·OH活性。以缓冲溶液为空白对照,以维生素C(VC)为阳性对照,比较紫甘薯多糖4个组分和VC对·OH的清除率,结果见图6。

图6 4种紫甘薯多糖组分和VC对·OH的清除率
由图6可以看出,4个多糖组分展现出不同的清除·OH能力,其中多糖PPSP Ⅰ的·OH清除率可达到VC清除率的一半。
2.5.3 多糖抗氧化性活性分析
紫甘薯多糖各组分对邻苯三酚自氧化的抑制作用和清除·OH活性不同,PPSPⅡ对邻苯三酚自氧化的抑制作用最强,PPSPⅠ对·OH的清除活性最强,所有组分都具有一定的抗氧化活性。导致紫甘薯多糖各组分抗氧化性不同的原因可能是多糖结构不同,多糖链越长、空间结构越紧密,多糖空间结构展开需要温度越高,而多糖空间结构展开越多,抗氧化性越强。
3 结论
采用酶解法提取紫甘薯多糖,确定最佳提取工艺条件为:木聚糖酶添加量0.02%(酶活≥10 000 U·g-1)、酶解时间60 min、酶解温度55 ℃。用DEAE-Cellulose阴离子交换柱层析对紫甘薯多糖进行分离,得到了4种多糖组分。结果表明,紫甘薯多糖在体外具有清除·OH能力和抗氧化作用,为紫甘薯多糖保健品开发提供了依据。
[1] TAYLOR S L.Advances in Food and Nutrition Research[M].New York:Academic Press,2007,52(6):1-59.
[2] 明兴加,李坤培,张明,等.紫色甘薯的生理活性及开发应用研究进展[J].食品研究与开发,2007,28(1):144-147.
[3] 林娟,邱宏端,林霄.甘薯多糖的提取纯化及成分分析[J].中国粮油学报,2003,18(2):64-66.
[4] 刘长江,潘松,梁爽.响应曲面法优化软枣猕猴桃多糖超声辅助提取及乙醇沉淀工艺[J].食品科学,2012,33(2):1-6.
[5] 游雪娇,顾振新.百合非淀粉多糖的除蛋白工艺与抗氧化性研究[J].食品工业,2014,35(7):15-20.
[6] 王彦超.木薯淀粉和甘蔗木聚糖生化特性的研究[D].沈阳:东北农业大学,2009.
[7] 李利华.甘薯多糖超声辅助提取及其抗氧化活性的研究[J].食品工业科技,2012,33(18):257-260.
Enzymolysis Extraction of Polysaccharides from Purple Sweet Potato and Its Biological Activity
WU Yuan-yao,WANG Jing-song,ZHANG Xin-chao,WANG Wei-dong,PAN Ji-cheng*
(CollegeofLife,HubeiNormalUniversity,Huangshi435002,China)
Inthispaper,crudepolysaccharidesfrompurplesweetpotatowereobtainedbymeansofxylanasehydrolysis,hotwaterextraction,ethanolprecipitation,deproteinanddecolorization.ThefourpurepolysaccharideswereharvestedwithDEAE-Celluloseanionexchangechromatography.Inaddition,theirantioxidantactivitywasdiscussed.Theoptimalextractionconditionsofpolysaccharideswereasfollows:xylanasedosageof0.02%,enzymolysistimeof60min,enzymolysistemperatureof55 ℃.Polysaccharidesfrompurplesweetpotatoshowedhigherinhibitionactivityforpyrogallolauto-oxidationandscavengingrateon·OH,andtheycanbeusedaseffectiveandsafenaturalantioxidants.
enzymolysis;polysaccharidefrompurplesweetpotato;xylanase;antioxidantactivity
2016-12-17
吴远耀(1988-),男,湖北鄂州人,硕士研究生,研究方向:生物大分子,E-mail:741917544@qq.com;
潘继承,教授,E-mail:992708747@qq.com。
10.3969/j.issn.1672-5425.2017.03.012
O629.12
A
1672-5425(2017)03-0049-04
吴远耀,汪劲松,张新潮,等.酶解法提取紫甘薯多糖及其生物活性研究[J].化学与生物工程,2017,34(3):49-52.

