果糖处理对费菜总黄酮及其相关酶的影响
王春幸,王鸿飞,熊 茜,宋佳敏,胡 月,董栓泉,孙 朦,王凯凯,许 凤
(宁波大学食品科学与工程系,浙江宁波 315211)
果糖处理对费菜总黄酮及其相关酶的影响
王春幸,王鸿飞*,熊 茜,宋佳敏,胡 月,董栓泉,孙 朦,王凯凯,许 凤
(宁波大学食品科学与工程系,浙江宁波 315211)
本文以费菜为研究对象,研究了不同水培温度(20,25,28 ℃)、光周期(8 h/16 h,12 h/12 h,16 h/8 h)和果糖浓度(0、10、20、30、40 mmol/L)对费菜中总黄酮含量及其合成代谢相关酶活性的影响。结果表明:费菜最佳水培温度为25 ℃,光周期为16 h/8 h;30 mmol/L果糖处理可以有效提高费菜中的总黄酮含量,比对照组高1.37 mg/g(鲜重);在培养期间,与对照组相比,果糖处理可以有效减缓苯丙氨酸解氨酶(phenylalnine ammonialyase,PAL),多酚氧化酶(polyphenol oxidase,PPO),查尔酮合酶(chalcone synthase,CHS)和查尔酮异构酶(chalcone isomerase,CHI)活性的下降,同时抑制过氧化物酶(peroxidase,POD)的活性,表明果糖处理通过调控总黄酮合成过程中相关酶的活性从而促进费菜总黄酮的富集。这些结果为提高费菜活性成分和营养品质提供了理论依据。
费菜,水培条件,果糖处理,黄酮合成代谢相关酶
费菜(SedumaizoonL.),属景天科多年生草本植物,学名景天三七,又名养心草,救心草。费菜中主要含有黄酮类、酚酸、萜类、甾醇等活性成分,具有扩张心脑血管、促进血液循环、抗肿瘤等多种功能特性[1-2],从而受到人们的青睐。黄酮是一类低分子量的多酚类次生代谢产物的统称,在自然界中种类繁多,其中相当一部分具有显著的生物活性,例如抗炎、抗氧化、抗病毒、调节血管渗透性、改善记忆和雌激素作用等[3]。外界环境可能作为一种外界信号会引起细胞膜上及细胞膜内的一系列反应,使与植物代谢产物有关的酶合成或活性发生变化,从而影响植物次生代谢产物如黄酮等物质的积累。如碳源可通过调控黄酮合成相关酶的活性而影响黄酮的合成,从而对植物次生代谢产物的种类和含量有重要影响,有研究表明,外源糖处理能显著提高豆芽菜的总酚含量[4]。黄酮类化合物合成途径关键酶有苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)、查尔酮合酶(CHS)和查尔酮异构酶(CHI)。研究证明,外源蔗糖处理可刺激羽扇豆中的苯丙烷类代谢,提高苯丙氨酸解氨酶(PAL)的活性和异黄酮含量[5],从而提高豆芽中总酚含量及其代谢酶活性[6]。
近年来费菜的研究主要集中在活性成分的提取、种类以及其抗氧化能力的评价。如刘飞等人研究了费菜总黄酮的提取工艺和抑菌活性[7];费菜总黄酮经研究表明具有明显的抗氧化[8],降血脂抑制肝癌细胞增殖的功能[2]。但是对于费菜中黄酮的合成机理以及外源糖处理对费菜中总黄酮及其相关酶活性影响的研究较少。因此,本实验采用不同温度和光周期对费菜嫩枝进行水培,研究其总黄酮含量的变化,筛选出最佳温度和光照条件;在此基础之上,使用果糖溶液对费菜嫩枝进行水培,研究果糖对费菜中总黄酮含量和黄酮合成代谢相关酶活性的影响,为改善费菜的营养品质提供理论依据。
1 材料与方法
1.1 材料与仪器
费菜品种为狭叶费菜(Sedumaizoonvar. latifolium),采收其嫩苗于江苏省宿迁,栽种于宁波大学食品科学与工程实验基地;所用试剂:无水乙醇、双氧水、次氯酸钠、硼酸、浓盐酸、氢氧化钠、结晶三氯化铝,磷酸氢二钠、磷酸二氢钠 以上试剂均为国产分析纯;芦丁纯度大于95% 北京索莱宝科技有限公司;外源糖:果糖 北京索莱宝科技有限公司;愈创木酚 上海圻明生物科技有限公司;苯丙氨酸 美国SIGMA公司。
GZP-450N型光照培养箱 上海森信实验仪器有限公司;Cary 50 Scan紫外分光光度计 美国瓦里安技术中国有限公司;BPZ11D分析天平 德国赛多利斯公司;SB3200D型超声波清洗机 宁波新芝生物科技股份有限公司;H2050R湘仪台式高速冷冻离心机 湖南长沙湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 费菜水培工艺条件的确定 采取从母株分蘖出的枝芽,选取长势一致的费菜嫩枝,去掉基部枝叶,剪取12~15 cm,浸入75%乙醇溶液中消毒30 s,再用无菌蒸馏水洗涤5次,每次5 min,待用。
1.2.1.1 费菜水培温度条件的确定 采用浸茎法将处理好的费菜枝条分别放入不同温度(20、25、28 ℃)的培养箱中培养10 d,2000 lx光照12 h,黑暗12 h,每隔48 h换一次培养液。培养液成分:0.02%NaClO溶液,30 mmol/L果糖溶液。
1.2.1.2 费菜水培光照时间条件的确定 将处理好的费菜枝条采用浸茎法放入(25±2) ℃光照培养箱进行培养,以2000 lx光照白/昼(8 h/16 h,12 h/12 h,16 h/8 h)培养10 d,每隔48 h换一次培养液。
1.2.2 费菜水培果糖浓度条件的确定 设置一系列浓度(0、10、20、30、40 mmol,含有0.02% NaClO)的果糖溶液加入培养液中,在(25±2) ℃光照培养箱中培养10 d(0 d为空白),2000 lx光照16 h,黑暗8 h,每隔48 h换一次培养液。
取培养0、2、4、6、8、10 d的处理组和对照组嫩枝,每组随机取样6株,液氮冷冻15 min,于-40 ℃冰箱保存用于总黄酮含量的测定,取其平均值。
1.2.3 费菜总黄酮的提取 采用乙醇超声波辅助提取法提取费菜黄酮,称取1 g费菜样品于研钵中,用50 mL 90%乙醇冰浴研磨提取,匀浆,超声波辅助,超声时间50 min,超声温度为60 ℃,然后浸提2 h,浸提温度60 ℃,进行离心抽滤,制得费菜总黄酮提取液冷藏备用。
1.2.4 费菜总黄酮含量及其相关酶的测定 费菜总黄酮含量的测定:芦丁标准液的配制,精密称取0.0244 g芦丁(120 ℃干燥至恒重),置于100 mL容量瓶中,加入适量的30%乙醇,置水浴上微热使之溶解,冷却后用30%乙醇定容至刻度,摇匀。此时芦丁的浓度为:0.244 mg/mL。
标准曲线的制备,精密量取芦丁标准溶液0、0.2、0.4、0.5、0.6、0.8、1.0 mL于比色皿中,各加入AlCl3溶液,并加乙醇至刻度,在275 nm下测定黄酮的吸光度A,得到的回归方程为:A=34.834x+0.0121,R2=0.9999。样品测定按标准曲线项的方法测定吸光度,代入回归方程计算含量[9]。
苯丙氨酸解氨酶PAL的测定:参照张大勇的方法[10],在290 nm下测定OD值,以每分钟吸光值变化0.01为1个PAL活性单位,用U/g FW表示。
CHS测定:参照NAM的方法[11]进行样品的提取,采用查尔酮合酶试剂盒进行测试,在290 nm下测定OD值,以每分钟吸光值变化0.01为1个CHS活性单位,用U/g FW表示。
CHI测定:CHI的提取在Lister等报道方法的基础上有所改进[4]。精确称取1 g样品,冰浴研磨提取,加入1. 8 mL提取液,离心。取1 mL反应液水浴反应,加200 μL 350 g/L三氯乙酸终止反应,在370 nm测定OD值,以每分钟吸光值变化0.01为1个CHI活性单位,用U/g FW表示。
PPO测定:参照Yang的方法[12],于398 nm处测定OD 值,以每分钟吸光值变化0.01为1个PPO活性单位,用U/g FW表示。
POD测定:按照愈创木酚法[13],略有改动。称取1 g样品,用0.2 mol/L PBS(pH7.8)冰浴研磨提取,离心得上清即粗酶液,5 mL反应液(0.2 mol/L PBS pH7.8,内含0.3%(v/v)愈创木酚,2% H2O2)加入100 μL酶提取液后迅速在470 nm下测定2min,以每分钟吸光值变化0.01为1个POD活性单位,以U/g FW表示。
1.3 数据分析
采用SPSS 17. 0统计软件进行数据统计,用单因素方差分析(one-way ANOVA)中Dunken Text,比较不同处理组数据的差异,采用origin 8.0进行数据处理分析。如果未经说明,实验重复三次,取平均值。
2 结果与分析
2.1 费菜不同部位总黄酮含量的分析
本实验所用费菜不同部位的总黄酮含量如图1所示。

图1 费菜不同部位的总黄酮含量Fig.1 Total flavonoids content in different organs of the Sedum aizoon L.注:不同字母表示差异显著(p<0.05)。
由图1可知,费菜中不同部位的黄酮含量不同,由高到低的顺序为:嫩叶>茎>老叶>花。嫩叶中黄酮含量最高,是花的2.39倍,茎的1.37倍,老叶的1.39倍。且嫩枝代谢较为旺盛,综合含量高,有利于实际生产。因此,本实验采用黄酮含量较高的费菜嫩枝进行水培培养。
2.2 费菜水培条件的确定
费菜的水培条件主要有温度、光照条件等,本实验对温度和光照条件进行单因素实验,其总黄酮含量随培养时间的变化如图2和图3所示。

图2 不同温度下费菜黄酮含量的变化Fig.2 Change of flavonoids under different temperatures in Sedum aizoon L.注:“**”表示黄酮含量与20 ℃比,差异极显著, (p<0.01);“*”表示差异显著(p<0.05)。
由图2可知,温度对费菜富集总黄酮含量的影响非常显著。在光照时间为12 h/12 h培养条件下,不同温度(20、25、28 ℃)费菜嫩枝的黄酮含量总体上随着时间的延长而增加,但25 ℃培养组显著高于其它两组(p<0.05)。三种培养温度下,费菜总黄酮含量在第4、第8 d均达到峰值,25 ℃培养组最高,分别是20、28 ℃培养组的3.54,2.89倍和3.16,1.80倍。综上,可确定费菜最佳水培温度为25 ℃。

图3 不同光周期下费菜黄酮含量的变化趋势Fig.3 Change trend of flavonoids in different photoperiod in the Sedum aizoon L.注:“**”表示黄酮含量与8 h/16 h比,差异极显著 (p<0.05);“*”表示差异显著(p<0.05)。
由如图3可知,在温度为25 ℃培养条件下,不同光周期(8 h/16 h,12 h/12 h,16 h/8 h)费菜嫩枝总黄酮富集量不同,其中长光照周期(16 h/8 h)培养组显著高于短光照周期(8 h/16 h)培养组(p<0.05),高于12 h/12 h培养组(p<0.05);培养期间,长光照周期培养组前期总黄酮含量急速上升,在第4 d到达峰值后下降;12 h/12 h培养组黄酮含量在培养期间呈“M”型;短光照周期培养组总黄酮含量在以上两组之间持续增加;三种光周期条件下,长光照周期培养组总黄酮平均含量在培养期间高于其他两组,即随着光照时间的增加,费菜黄酮含量上升。综上,本实验选择在白/昼为16 h/8 h的条件下培养。
综上,费菜最佳水培条件为温度25 ℃,光周期为16 h/8 h。在该实验条件下,对费菜嫩枝进行外源果糖处理,确定其适宜浓度,并研究其黄酮相关酶活性。
2.3 果糖处理对费菜总黄酮含量的影响
在25 ℃,光照16 h/8 h条件下,使用不同浓度果糖溶液水培对费菜总黄酮含量的影响如图4所示。

图4 不同浓度果糖处理费菜黄酮的含量变化Fig.4 Change of flavonoids content in different concentrations of fructose treatment in Sedum aizoon L.
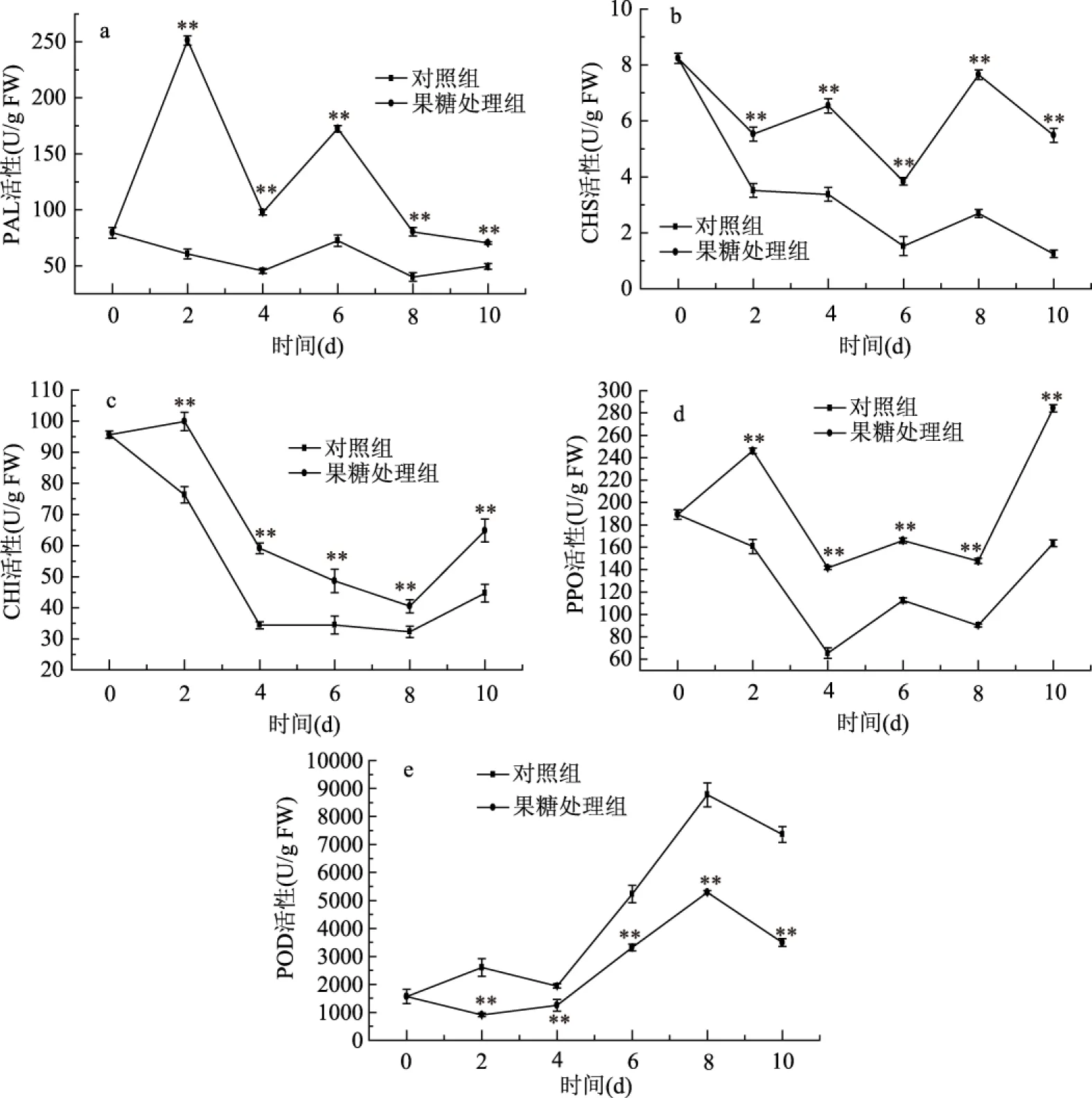
图5 果糖处理对费菜总黄酮相关酶活性的影响Fig.5 The effect of fructose treatment on the activities of flavonoids metabolism related enzymes in Sedum aizoon L.注:“**”表示与对照差异极显著(p<0.01)。
如图4所示,采用不同浓度果糖处理费菜,其黄酮含量随培养天数而变化。不同浓度果糖处理费菜嫩枝黄酮含量积累呈现先上升后下降趋势。不同果糖浓度处理组,黄酮累积程度不同:培养10 d后,30 mmol/L果糖处理组费菜黄酮平均含量最高,比对照组高1.37 mg/g(鲜重)。培养期间,20、30 mmol/L浓度果糖处理组和对照组黄酮含量在第4 d达到高峰,40 mmol/L果糖处理组在第2 d达到高峰,10 mmol/L果糖处理组在第6 d时达到高峰。培养前期40 mmol/L浓度果糖处理组效果比中低浓度处理组好,但后期此处理组末期效果比对照组差。而30 mmol/L果糖处理组黄酮含量普遍优于10、20 mmol/L果糖处理组。所以本实验选择30 mmol/L果糖为最适宜果糖浓度处理组。
2.4 果糖处理对费菜总黄酮相关酶活性的影响
果糖处理对费菜中黄酮合成代谢相关酶随时间变化影响如图5所示。如图5a所示,两组PAL活性随时间变化,呈现W型,在第4 d到达较小值,总体上均呈现下降趋势。与对照组相比,果糖处理组PAL活性显著(p<0.05)高于对照组,表明果糖处理可以有效减缓PAL活性的降低。果糖处理对费菜CHS活性影响如图5b所示,两组CHS活性随培养天数的增加均呈下降趋势,果糖处理可以延缓CHS活性下降,果糖处理组CHS活性显著(p<0.05)高于对照组。如图5c所示,CHI活性在培养过程中呈下降趋势。与对照组相比,果糖处理可以延缓CHI活性下降,在培养期间处理组CHI活性高于对照组(p<0.05),在第2 d CHI活性急剧下降,至第4 d后趋势缓和。
随着培养时间的延长,黄酮类化合物会与PPO、POD等酶发生反应,从而减少费菜组织内黄酮的含量。如图5d所示,果糖处理组和对照组PPO活性均呈现先下降后升高趋势,其中果糖处理组PPO活性显著高于对照组(p<0.05)。由图5e可知,POD活性随培养时间呈先升高后降低的趋势,培养至第4 d时POD活性急剧上升,对照组与处理组均在第8 d达到最大值;果糖处理抑制了POD活性的增加,使得处理组POD活性显著低于对照组(p<0.05)。
3 讨论
3.1 费菜部位与黄酮含量关系
费菜作为一种蔬菜,其主要食用部位是茎和叶。由于地域、品种、水分、温度、光照条件的不同,费菜中不同部位总黄酮的富集情况也有所不同。研究表明费菜中老叶黄酮含量最高[14]。本实验系统研究了费菜中不同部位的总黄酮含量,发现嫩叶中黄酮含量最高,与前人研究结果不符,可能是受产地,季节等因素的影响。在本实验结果中,我们发现随培养时间的延长,费菜黄酮的含量出现波动,培养至第6 d时,黄酮含量出现下降情况(见图2),结合我们在水培过程中发现费菜嫩枝在第6~8 d时出现长根现象,推测黄酮在这一时段参与了费菜组织中的合成代谢,导致了黄酮含量的下降。
3.2 费菜水培条件与黄酮含量关系
改变费菜水培过程中的温度,光周期,以及不同浓度的果糖处理条件,总黄酮富集情况不同。本实验结果表明,适宜的温度有利于黄酮的生成,这与徐友等对银杏的研究结果一致[15]。研究表明,长时间光照条件下费菜黄酮含量较高,可能由于光照条件下叶绿体分化,而叶绿体分化与黄酮积累有关[16];或黄酮合成途径中关键酶PAL受光周期控制[17],在光照时间充足下,增强了PAL活性,从而影响总黄酮合成的效果,而使总黄酮富集量最大。这与孙君明等[18]对大豆幼苗组织和罗美佳等[19]对三七的研究结果一致。各种碳源对植物的次生代谢产物也有重要作用。研究发现,蔗糖有利于人参色素细胞生长及花苷的积累[20];外源糖处理对银杏细胞中黄酮的合成和细胞生长有积极影响[21];蔗糖处理对费菜黄酮具有一定的富集作用[9]。本实验中,在外源果糖处理下,费菜总黄酮含量普遍高于对照组,表明外源果糖有利于费菜组织中黄酮的合成。
3.3 果糖处理与费菜总黄酮相关酶活性关系
PAL、CHI、CHS、PPO及POD可能与黄酮共同形成一个复杂的合成/代谢网络,维持细胞黄酮含量与抗氧化与氧化的平衡,在这个过程中,果糖可能起到了关键的作用。有研究表明,糖代谢通过莽草酸途径连接次生代谢,糖酵解途径和戊糖磷酸途径通过反应最终生成苯丙氨酸[22]。植物通过苯丙烷类合成途径生物合成黄酮类化合物[23],PAL是植物次生代谢特别是苯丙烷途径的关键酶和限速酶,可以为其他物质的代谢反应提供代谢底物[24],所以PAL活性的高低与黄酮类物质合成有密切关系。程水源研究发现生长调节剂能提高黄酮含量,其调控机理与费菜中的PAL活性相关,而PAL对黄酮合成的调控是通过对黄酮合成前提底物的调控来完成的[25]。本研究表明,果糖处理增强了PAL活性,且其变化与其黄酮含量变化同步。可能是由于果糖提高了PAL活性,加速了黄酮合成前提底物的合成,而间接提高了黄酮含量。这与汤月昌研究外源果糖处理青花菜芽的结果一致[26]。
CHS是一种聚酮合成酶,是将苯丙烷类代谢途径引向黄酮类化合物合成的第一个关键酶,CHS催化香豆酰辅酶-A与丙二酰辅酶-A结合生成查尔酮,查尔酮是黄酮合成的前体,因此CHS是催化类黄酮生物合成的第一个限速步骤[27]。查尔酮异构酶(CHI)是黄烷酮代谢过程中的关键酶,而黄烷酮是黄酮类化合物的代谢中间体,即CHS和CHI是将苯丙烷类代谢途径引向黄酮类合成的两个关键酶[28],有研究表明CHS基因在大豆子粒发育过程中的表达趋势与异黄酮积累模式基本一致,表明其可能调控异黄酮的合成[29],且该酶基因的表达效应受糖含量的调控。同时也有研究表明对苦荞麦进行胁迫处理,CHI基因表达量的增加与黄酮含量升高在一定时间段呈正相关[30],因此增加CHI活性能使黄酮类化合物含量增加。这与本实验果糖处理组CHI活性和CHS活性均高于对照组结果相似。
有研究表明黄酮类化合物能与PPO、POD相互作用,总酚与黄酮是PPO和POD的底物,形成黄酮、PPO、POD反应体系,使植物对逆境或成熟衰老做出反应[31]。我们的研究发现,果糖处理和对照组POD酶活性变化与黄酮含量变化趋势相反,而PPO酶活性变化则与黄酮含量变化关系不显著。POD具有催化黄酮聚合形成大分子褐色物质的能力[32]。本实验结果表明,果糖处理可以在贮藏时间内有效的抑制POD活性,从而减少黄酮的代谢。汤月昌等人在研究葡萄糖处理对青花菜抗氧化性的影响中得出葡萄糖处理组的POD活性在贮藏期间一直低于对照组[33],与本结果相似。而POD酶活性的增强可能主要是为了提高费菜植物的抗逆性和衰老所引起的,这与向小林的观点一致[34]。
综上,果糖处理能延缓黄酮合成酶PAL、CHI、CHS活性的下降,抑制POD活性的上升,从而促进黄酮的累积,但培养4 d后,可能由于外界胁迫或衰老等影响,PPO活性与POD活性显著上升,加速黄酮代谢,致使黄酮含量下降。由于果糖处理对PPO活性有显著促进作用,在水培条件下,PPO对费菜嫩枝黄酮合成与代谢中起到了关键性作用。
4 结论
费菜嫩枝的最佳水培条件为温度25 ℃,光周期16 h/8 h。采用浸茎法对费菜进行不同浓度果糖处理,结果表明30 mmol/L处理组效果最好,PAL活性,PPO活性,CHI及CHS活性均比对照组高,POD活性比对照组低。以上结果表明,果糖处理可以对黄酮合成代谢途径中POD、PAL、CHI以及CHS活性产生影响,从而增加费菜中总黄酮含量。
[1]Lin Z,Zhang L,Zhang R,et al. Antiinflammatory effect of ethyl acetate extract of Sedum aizoon L. in LPSstimulated RAW 264.7 macrophages and its HPLC fingerprint[J]. Journal of Chinese Pharmaceutical Sciences,2015,24(10):647-653.
[2]王鸿飞,刘飞,徐超,等. 费菜总黄酮调节血脂及对肝癌细胞增殖的作用[J]. 中国食品学报,2013,13(4):23-27.
[3]曹秦,吴辉,张蓓蓓,等. 黄酮类化合物在防治神经退行性疾病中作用的研究进展[J]. 中国药理学与毒理学杂志,2015,29(3):457-463.
[4]赵晓帼,朱毅,罗云波. 外源蔗糖对萝卜幼苗品质及代谢酶活性的影响[J]. 食品科学,2015,36(9):7-11.
[5]Lister C E,Lancaster J E,Walker J R L. Developmental Changes in Enzymes of Flavonoid Biosynthesis in the Skins of Red and Green Apple Cultivars[J]. Journal of the Science of Food and Agriculture,1996,71(3):313-320.
[6]邱紫云,刘淑敏,倪治明,等. 外源糖处理对绿豆芽VC含量及其抗氧化能力影响的研究[J]. 食品工业科技,2015(19):357-360.
[7]刘飞,王鸿飞,林燕,等. 费菜总黄酮提取工艺的研究[J]. 食品工业科技,2011(4):252-254.
[8]强毅,王政军,陈克克,等. 费菜多酚含量的测定及体外抗菌活性研究[J]. 食品工业科技,2013,34(5):53-56.
[9]胡月,王鸿飞,董栓泉,等. 蔗糖处理对费菜黄酮含量及其抗氧化性的影响[J]. 现代食品科技,2016(1):250-255.
[10]张大勇,李文滨,李冬梅,等. 大豆叶片异黄酮含量与PAL基因相对表达量的关系[J]. 大豆科学,2009,28(4):670-673.
[11]Saleh N A M,Fritsch H,Kreuzaler F,et al. Flavanone synthase from cell suspension cultures of Haplopappus gracilis,and comparison with the synthase from parsley[J]. Phytochemistry,1978,17(2):183-186.
[12]Bi Y,Tian S,Zhao J,et al. Harpin induces local and systemic resistance against Trichothecium roseum,in harvested Hami melons[J]. Postharvest Biology & Technology,2005,38(2):183-187.
[13]Kar M,Mishra D. Catalase,Peroxidase,Polyphenol Oxidase Activities during Rice Leaf Senescence[J]. Plant Physiology,1976,57(2):315-319.
[14]陈华珍,陈建伟. 费菜不同器官中总黄酮的含量比较及其薄层鉴别[J]. 中华中医药学刊,2003,21(11):1867-1867.
[15]徐友,王欢利,汪贵斌,等. 温度和光照强度对银杏叶黄酮合成的影响[J]. 中南林业科技大学学报,2016,36(4):30-34.
[16]王鹏姬,高金锋,苏旺,等. 培养条件对荞麦愈伤组织生长及黄酮合成的影响[J]. 核农学报,2013,27(5):591-597.
[17]焦彩凤,杨润强,顾振新. 植物性食品原料中异黄酮形成机理及富集的影响因素[J]. 食品科学,2015,36(11):256-260.
[18]孙君明,丁安林,沈黎明. 光照对大豆幼苗组织中异黄酮含量和分布的影响[J]. 植物学报,1998,40(11):1015-1021.
[19]罗美佳,夏鹏国,齐志鸿,等. 光质对三七生长、光合特性及有效成分积累的影响[J]. 中国中药杂志,2014,39(4):610-613.
[20]Li S M,Zhu W H. Studies on pigment cell culture of Panax ginseng[J]. Journal of Integrative Plant Biology,1990,32(2):103-111.
[21]李春斌,王关林,岳玉莲,等. 培养条件对银杏悬浮培养细胞黄酮合成影响研究[J]. 大连理工大学学报,2003,43(3):287-291.
[22]李春兰. 葡萄果实中莽草酸途径与多酚积累的关系[J]. 现代农业科技,2010(12):33-36.
[23]刘忠松. 植物雄性不育机理的研究及应用[M]. 中国农业出版社,2001,60.
[24]Besseau S,Hoffmann L,Geoffroy P,et al. Flavonoid accumulation in Arabidopsis repressed in lignin synthesis affects auxin transport and plant growth.[J]. Plant Cell,2007,19(1):148-162.
[25]程水源. 影响银杏叶黄酮形成的主要因子及调控技术的研究[D]. 泰安:山东农业大学,2001.
[26]汤月昌,许凤,董栓泉,等. 果糖对西兰花抗氧化性及其品质的影响[J]. 现代食品科技,2015(4):164-169.
[27]孙利. 不同花生品种类黄酮积累及其合成酶活性对干旱胁迫的响应[D]. 泰安:山东农业大学,2013.
[28]王志彬,申晚霞,朱世平,等. 柑橘CHS基因序列多态性及表达水平对类黄酮生物合成的影响[J]. 园艺学报,2015,34(3):435-444.
[29]田玲,李斌,张晶莹,等. 大豆子粒发育过程中异黄酮合成相关酶基因的表达模式与异黄酮积累的相关分析[J]. 植物遗传资源学报,2014,15(6):1295-1304.
[30]侯伶俐,杨雄榜,董雪妮,等. 逆境胁迫对苦荞花期总黄酮含量及关键酶基因表达的影响[J]. 核农学报,2016,30(1):184-192.
[31]刘伟. 氮钾营养对杭白菊次生代谢产物调控的生理生化基础[D]. 武汉:华中农业大学,2007.
[32]Cheng S Y,Feng X,Li L L,et al. Seasonal Pattern of Flavonoid Content and Related Enzyme Activities in Leaves of Ginkgo biloba L.[J]. Notulae Botanicae Horti Agrobotanici Cluj-Napoca,2012,40(1):98-106.
[33]汤月昌,许凤,王鸿飞,等. 葡萄糖处理对青花菜品质和抗氧化性的影响[J]. 食品科学,2014,35(14):205-209.
[34]向小林. 不同时期山楂叶黄酮含量及抗氧化活性变化[D]. 秦皇岛:河北科技师范学院,2013.
Effect of fructose treatment on flavonoids content and the related enzymes inSedumaizoonL.
WANG Chun-xing,WANG Hong-fei*,XIONG Qian,SONG Jia-min,HU Yue,DONG Shuan-quan,SUN Meng,WANG Kai-kai,XU Feng
(College of Food Science and Engineering,Ningbo University,Ningbo 315211,China)
In this paper,the effects of water culture temperature(20,25,28 ℃),photoperiod(8 h/16 h,12 h/12 h,16 h/8 h)and fructose treatment(0,10,20,30,40 mmol/L)on flavonoid content and anabolism related enzyme activity inSedumAizoonL. were investigated. The results indicated that optimal water culture conditions was 25 ℃,16 h/8 h. 30 mmol/L fructose treatment could effectively improve the content of flavonoids inSedumaizoonL.,which the treatment group was 1.37 mg/g higher than the control group(fresh weight). Compared with control group,fructose treatment could delay the decrease of the activities of phenylalanine ammonia lyase(PAL),polyphenol oxidase(PPO),chalcone synthase(CHS)and chalcone isomerase(CHI),and inhibit the peroxidase(POD)activity. It suggested that fructose treatment regulated the enzymes activities of flavonoids metabolism and promoted the accumulation of flavonoids during culturing. These results laid a theoretical basis for enhancement of the bioactive compounds contents and nutritional values ofSedumaizoonL.
SedumaizoonL.;water culture;fructose treatment;flavonoids metabolism related enzymes
2016-09-13
王春幸(1992-),女,硕士研究生,研究方向:农产品贮藏加工,E-mail:18815283583@163.com。
*通讯作者:王鸿飞(1964-),男,硕士,教授,从事农产品加工,食品科学方面的研究,E-mail:wanghongfei@nbu.edu.cn。
浙江省自然科学基金(LY16C200003);宁波市自然科学基金(2015A610273);浙江省重点研发项目(2016C02G4010891)。
TS255.1
A
1002-0306(2017)05-0124-06
10.13386/j.issn1002-0306.2017.05.015

