花蟹肉酶解多肽美拉德反应产物的抑菌性研究
陈金斌,奚秀秀
(1.温岭市食品药品检验检测中心,浙江温岭 317500;2.宁波大学食品系,浙江宁波 315211;3.上海大学食品系,上海 200444)
花蟹肉酶解多肽美拉德反应产物的抑菌性研究
陈金斌1,奚秀秀2,3
(1.温岭市食品药品检验检测中心,浙江温岭 317500;2.宁波大学食品系,浙江宁波 315211;3.上海大学食品系,上海 200444)
本文基于蟹肉酶解多肽与木糖的美拉德反应产物(PXMRPs)对食品常见污染菌的抑制作用,对PXMRPs生产工艺进行优化。实验结果表明,PXMRPs对金黄色葡萄球菌、蜡状芽孢杆菌、枯草芽孢杆菌和大肠杆菌抑菌4种常见食品污染菌均有不同程度的抑制作用。采用牛津杯法检测PXMRPs的抑菌能力,以木糖与花蟹肉酶解多肽质量比、反应温度和反应时间为自变量进行单因素实验和正交实验。获得最优抑菌效果的PXMRPs生产工艺为:木糖与花蟹肉酶解多肽质量比2∶1,反应温度为120 ℃,反应时间为120 min。PXMRPs对蜡状芽孢杆菌和金黄色葡萄球菌的MIC值均为15 mg/mL,枯草芽孢杆菌和大肠杆菌的MIC值分别为20 mg/mL和30 mg/mL。蟹肉酶解多肽与木糖的美拉德反应产物(PXMRPs)因其良好的抑菌性能,具有开发为天然食品添加剂的可能。
花蟹肉酶解多肽,美拉德反应产物,抑菌性
远海梭子蟹(Portunuspelagicus),俗称远洋梭子蟹、花蟹,隶属于节肢动物门(Arthropoda)、甲壳纲(Crustacea)、软甲亚纲(Malacostraca)、十足(Decapoda)、爬行亚目(Reptantia)、短尾派(Brachyura)、梭子蟹科(Portunidae)、梭子蟹属(Portunus)[1],广泛分布于我国浙江、福建和广东等沿海地区,尤以浙江舟山地区资源丰富。然而,花蟹个体较小、加工困难,长期被加工成蟹糊销售,不仅造成资源浪费,而且降低了花蟹的经济价值。花蟹虽小,但仍具有蟹类的鲜香及诱人的滋味,为了提高花蟹的经济价值,有效利用花蟹制备功能性食品添加剂已成为学者们关注的焦点。前期研究结果表明以花蟹肉为原料具有诸多优点,如花蟹肉经酶解可制备高品质抗氧化肽[2],花蟹肉酶解多肽的美拉德反应产物也具有较好的抗氧化属性[2],这些优点为利用花蟹制备功能性食品添加剂提供了一定的理论基础,相比化学防腐剂抑菌可能会给人体带来副作用,或者物理灭菌可能会破坏食品的营养成分等,花蟹肉自身具备食用的特点,具备成为一种天然的食用型添加剂的可能。
美拉德反应(Maillard reaction,MR)是羰基化合物与氨基化合物经缩合聚合反应生成高分子量聚合物类黑素的反应,属于非酶促褐变反应,该反应会产生大量的美拉德反应产物(Maillard reaction produces,MRPs),其中包括了早期的挥发性化合物,中间产物和大分子量聚合物[3]。MR可以改善食品的色泽和风味,更产生了大量的抗氧化和抗菌性物质[4],能够有效延长食品的货架期。目前,关于氨基酸或多肽与各类还原糖发生美拉德反应增强其抗氧化性和产生特殊香味的研究已有报道[5],然而,对反应赋予多肽强抗菌性原因的研究则较少[6-7],在食品工业生产具抗菌性的天然食品添加剂缺乏具体的理论指导。
本实验通过分析不同反应条件对PXMRPs抑菌性的影响,利用正交实验优化反应条件后测出PXMRPs对常见腐败菌的MIC值,意在充分利用丰富的花蟹资源,减少花蟹资源的浪费,提高花蟹的经济价值,为PXMRPs的实际应用提供理论基础,推动美拉德反应产物制备天然防腐剂在食品工业中的应用。
1 材料与方法
1.1 材料与仪器
新鲜花蟹肉 舟山市世创水产有限公司提供(蟹肉水分79.1%,蛋白质19.5%,脂肪0.3%,灰分1.1%)。
食品级碱性蛋白酶 南宁庞博有限公司。
牛肉膏、蛋白胨、琼脂均为化学级,购自上海生物工程有限公司。
测试菌株:金黄色葡萄球菌(Staphyloccocus)ATCC13565、枯草芽孢杆菌(Bacillussubtilis)ATCC10774、蜡状芽孢杆菌(Cereabacillus)ATCC10635、大肠杆菌(Escherichiacoil)ATCC25922。
木糖 上海捷瑞生物工程有限公司,其余均为食品级。
超纯水 电阻率18.2 MΩ·cm。
电热恒温水浴锅,DK-S22型 上海精宏实验设备有限公司;超净工作台 苏州净化设备有限公司;压力灭菌锅 上海安申医疗器械厂;恒温培养箱 宁波江南仪器厂;电热恒温油槽DKU-2508型 上海森信实验仪器有限公司;电子天平TE212-2型 德国赛多利斯股份有限公司;旋转蒸发器RE52-2 上海沪西分析仪器厂;超纯水仪 Genpure Pro 美国赛默飞世尔科技公司。
1.2 实验方法
1.2.1 花蟹蛋白酶解多肽的制备 花蟹洗净去壳,绞碎,处理后的花蟹肉水分含量为87%~88%,pH6.8~7.0。将处理好的花蟹肉与超纯水1∶2混合,用10 mol/L的NaOH或7 mol/L HCl调节pH至7.5,再用碱性蛋白酶,加酶量3000 U/g,在51 ℃下酶解3.2 h,再经灭酶、过滤、蒸发浓缩和冷冻干燥后,得到花蟹肉酶解多肽干品[6],在-40 ℃下储存,备用。
1.2.2 PXMRPs的制备 依据前期实验结果得出,木糖是最适宜与花蟹肉酶解多肽发生美拉德反应的还原糖之一[2],所以本实验也以木糖作为花蟹肉酶解多肽反应的还原糖。取木糖与花蟹肉酶解多肽共1 g,溶解于100 mL超纯水中,将反应液移至烧瓶后置于油浴中,在冷凝管回流蒸发水蒸气的条件下,反应一段时间后立即将反应液转至冰水浴中冷却终止反应。反应液再经旋转蒸发、冷冻干燥成固体粉末,于-40 ℃下冷冻,备用。
1.2.3 抑菌剂制备 将冷冻的PXMRPs溶解于无菌水中制成浓度为200 mg/mL的抑菌剂溶液备用。
1.2.4 初始菌液的制备 将活化好的大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和蜡状芽孢杆菌的菌液用生理盐水稀释至浓度105~106CFU/mL,作为初始菌液。
1.2.5 PXMRPs抑菌圈测定——牛津杯法 在无菌条件下吸取适量菌悬液,移入灭菌培养皿中,倒入15 mL温度适宜的营养琼脂培养基,混合均匀,待其冷却后,在其表面呈正三角形状放置的3个牛津杯平均分布于整个培养基,在牛津杯中加入100 μL,200 mg/mL的PXMRPs水溶液,每种菌都做两个平行,以超纯水作空白对照[8]。培养基于37 ℃下培养24h。采用十字交叉法测量抑菌圈直径。
1.2.6 PXMRPs抑菌圈大小的正交实验分析 在单因素实验的基础上,以木糖与花蟹肉酶解多肽质量比、反应温度和反应时间为自变量,以抑菌圈直径为因变量,设计三因素三水平的正交分析实验,对PXMRPs抑菌性进行反应条件优化。
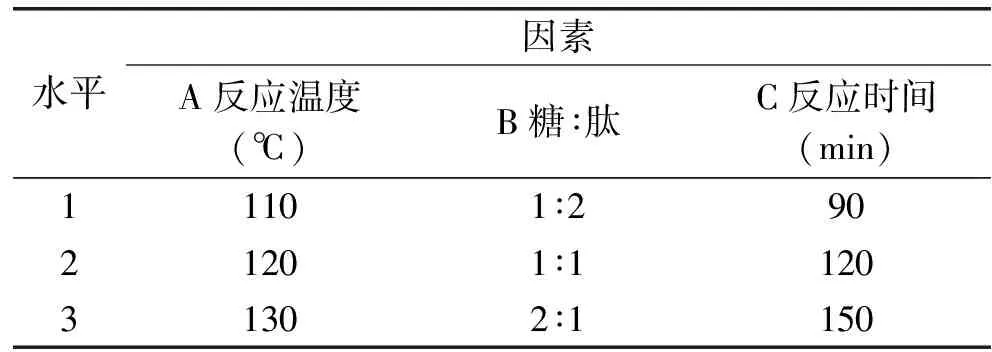
表1 PXMRPs的抑菌性的正交实验因素水平表
1.2.7 PXMRPs最低抑菌浓度(MIC)测定 对优化反应条件后制备的PXMRPs进行MIC测定。将PXMRPs溶解于超纯水中,配置成初始质量浓度分别为100、150、200、250、300、350、400、450、500 mg/mL的水溶液,吸取2 mL加入灭菌的培养皿中,并加入18 mL融化的培养基,充分混匀使反应物最终质量浓度为10、15、20、25、30、35、40、45、50 mg/mL。待培养基冷却后,每个培养基表面移入0.1 mL供试菌液,用涂布棒涂匀,每个样品做3个平行,并做1个未加反应物的空白对照组[9]。观察菌体的生长情况,从无菌生长的培养皿中找到最低反应物浓度的培养皿,此皿的反应物浓度即为其MIC值。
1.2.8 数据处理 本实验设置3组平行,采用Excel 2010和SAS 8.1软件进行方差分析、均值比较、显著性分析和邓肯多重比较。
2 结果与分析
2.1 PXMRPs对四种细菌的抑菌效果
牛津杯法抑菌实验室中,可以通过抑菌圈的大小初步判断抑菌剂抑菌作用的强弱。图1为在反应温度120 ℃,反应时间120 min下花蟹肉酶解多肽与木糖1∶1质量比的PXMRPs分别对蜡状芽孢杆菌、枯草芽孢杆菌、金黄色葡萄球菌以及大肠杆菌的抑菌圈图。由图可知,PXMRPs对4种供试菌都具有抑菌圈,但对金黄色葡萄球菌的抑菌圈最大,蜡状芽孢杆菌和枯草芽孢杆菌的抑菌圈次之,大肠杆菌的抑菌圈最小。4种供试菌中,金黄色葡萄球菌、蜡状芽孢杆菌、枯草芽孢杆菌均为革兰氏阳性菌,大肠杆菌为革兰氏阴性菌,可见PXMRPs有着广谱的抑菌作用,而且对革兰氏阳性菌的抑制作用强于阴性。

图1 PXMRPs对4种菌的抑菌效果Fig.1 Inhibition of bacterial growth by PXMRPs注:1为蜡状芽孢杆菌抑菌图,2为枯草芽孢杆菌抑菌图, 3为金黄色葡萄球菌抑菌图,4为大肠杆菌抑菌图。
2.2 单因素对PXMRPs抑菌效果的影响
2.2.1 木糖与花蟹肉酶解多肽质量比对PXMRPs抑菌圈大小的影响 反应物起始pH为7.0,改变反应物中还原糖和花蟹肉酶解多肽的质量比,反应温度140 ℃,反应时间90 min的条件下制备PXMRPs,其对4种供试菌的抑菌性(用抑菌圈直径的大小来表示抑菌性的强弱)与反应物中还原糖和花蟹肉酶解多肽质量比的关系如图2所示,其中牛津杯直径为7 mm。
由图2可知,随着木糖与花蟹肉酶解多肽质量比从1∶3升高到3∶1,4种供试菌的抑菌圈直径均先上升后下降,由此可见,PXMRPs抑菌性随着木糖与花蟹肉酶解多肽质量比先上升后下降,在比例达到1∶1时,4种供试菌的抑菌圈直径均都达到最大值,即抑菌性达到最大值。反应物中当还原糖的含量高于参与反应的氨基化合物时,可能因为除已参与美拉德反应的还原糖外,反应体系中糖类仍有剩余,在后期作为微生物生存的碳源,促进体系微生物的生长繁殖,故在还原糖含量较高时抑菌圈较小。当反应物中花蟹肉酶解多肽较多时,多余的花蟹肉酶解多肽也能为微生物的生长繁殖提供营养物质。因此只有控制木糖与花蟹肉酶解多肽的比例使其反应完全,且得到的抑菌物质最多时,抑菌效果才最强。

图2 木糖与花蟹肉酶解多肽质量比对 PXMRPs抑菌能力的影响Fig.2 The effects of substrate ratios on the antibacterial ability of PXMRPs
2.2.2 反应温度对PXMRPs抑菌圈大小的影响 反应物起始pH为7.0,反应物中还原糖和花蟹肉酶解多肽的质量比1∶2,反应时间90 min的条件下,改变反应温度,制备PXMRPs,其对4种供试菌的抑菌性(用抑菌圈直径的大小来表示抑菌性的强弱)与反应物中还原糖和花蟹肉酶解多肽质量比的关系如图3所示。
由图3可知,随着反应温度从110 ℃升高到150 ℃,产物对4种菌的抑菌圈直径均先快速上升然后缓慢下降,即反应温度对产物的抑菌性在4种供试菌中的表现趋势基本相同。方差分析显示,反应温度对抑菌圈直径的组间差异显著(p<0.05),4种供试菌的抑菌性均在120 ℃时达到最大值。温度会影响美拉德反应速度,当反应速度较快时,在相同的反应时间内,其产物中的大分子物质(如蛋白黑素)也会较多,虽然高相对分子质量(MI>1000)物质对枯草芽孢杆菌、大肠埃希氏大肠杆菌和金黄色葡萄球菌抑制效果更强[10],但大分子物质从牛津杯中扩散出来的速度较慢,而且也会阻碍其他物质的扩散,抑菌圈也就相对较小。另外当温度升高时,反应物中蛋白质的热降解和糖类的焦糖化反应也会加快,使PXMRPs减少而导致产物抑菌性的降低。

图3 反应温度对PXMRPs的抑菌能力的影响Fig.3 The effects of reaction temperatures on the antibacterial ability of PXMRPs
2.2.3 反应时间对PXMRPs抑菌圈大小的影响 反应物起始pH为7.0,木糖与花蟹肉酶解多肽质量比1∶2,反应温度为140 ℃,改变反应时间的条件下,制备得到的PXMRPs,其对4种供试菌的抑菌性与反应温度的关系如图4所示。
由图4可知,随着反应时间从30 min上升到150 min,产物对4种供试菌的抑菌圈直径均先上升后下降,在120 min时,4种菌的抑菌圈直径均达到最大值,方差分析显示,反应时间120 min时单一菌的抑菌圈直径与该菌的其余各组之间的差异显著(p<0.05)。从图中还可以看出,当反应时间为30、60 min时,其抑菌圈直径均为7 mm左右,而牛津杯的直径也为7 mm,可知,在反应时间为30、60 min时,PXMRPs没有抑菌性,而当反应时间达到90 min时,抑菌性才慢慢开始增强,在反应时间超过120 min后,抑菌性又慢慢开始下降。由此可见,PXMRPs中具有抑菌的物质是在反应的中期开始形成,而且这种物质会在后续的反应中继续参与反应产生其他不具备抑菌性的物质。
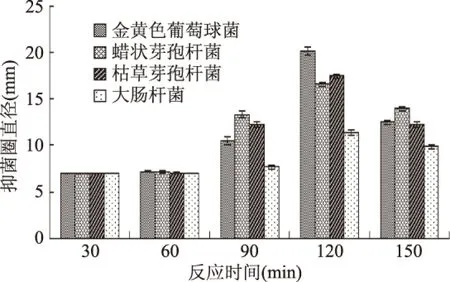
图4 反应时间对PXMRPs的抑菌能力的影响Fig.4 The effects of reaction time on the antibacterial activity of PXMRPs
2.3 正交实验优化PXMRPs抑菌性较强的反应条件
在单因素的基础上,影响PXMRPs抑菌性的因素主要有木糖与花蟹肉酶解多肽的质量比、反应温度和反应时间。随着反应条件的变化,PXMRPs对4种菌的抑菌性趋势基本相同,故选取产物对其中一种菌的抑菌性作为优化反应条件的依据设计正交实验,选取木糖与花蟹肉酶解多肽的质量比、反应温度和反应时间三个因素为自变量,以PXMRPs对金黄色葡萄球菌的抑菌圈直径为应变量,设计L9(34)正交实验表1,采用正交实验筛选PXMRPs抑菌性最佳的工艺条件组合。实验结果和方差分析分别见表2,表3。
表2为正交实验结果和直观分析,由表中的极差分析的R值可以看出,在影响PXMRPs抑菌性的三个因素中,影响主次关系是反应时间(C)>反应温度(A)>木糖与花蟹肉酶解多肽质量比(B),正交优化条件最佳组合为C2A2B3,即反应时间为120 min,反应温度为120 ℃,木糖与花蟹肉酶解多肽质量比为2∶1。另外,由方差分析(表3)可知,3个因素对实验结果都具有显著影响。由验证实验可知,当反应时间为120 min,反应温度为120 ℃,木糖与花蟹肉酶解多肽质量比为2∶1时得到的PXMRPs的抑菌圈大小为(26.4±0.5) mm,比其他实验组得到的金黄色葡萄球菌的抑菌圈都要大,说明优化的反应条件是可行的。

表2 PXMRPs抑菌性的实验设计与结果

表3 PXMRPs抑菌性的正交实验方差分析
2.4 PXMRPs的MIC测定
由表4可见,在优化的反应条件下制备的PXMRPs对几种供试菌种均具有良好的抑制作用,而且随着质量浓度的增加,产物的抑菌效果增强,产物对蜡状芽孢杆菌和金黄色葡萄球菌的抑制作用较强,MIC值均为15 mg/mL(1.5%),对枯草芽孢杆菌的MIC值为20 mg/mL(2%),而对大肠杆菌的MIC值最高(抑菌效果最弱),其值为30 mg/mL(3%)。董周永等[11]研究发现石榴果皮提取物对金黄色葡萄球菌和李斯特菌的MIC为12.5 mg/mL,对巨大芽孢杆菌、枯草芽孢杆菌和沙门氏菌的MIC均为25 mg/mL,而对大肠杆菌的MIC为50 mg/mL。另外,李春美等[12]研究发现用乙醇提取的柚皮提取物对大肠杆菌和金黄色葡萄球菌的MIC均为2.5%,而对沙门氏菌的MIC大于2.5%。由此可见,这些提取物的抑菌活性与PXMRPs的抑菌活性相差不大,有些提取物活性甚至低于PXMRPs的抑菌性。

表4 PXMRPs的MIC测定结果
注:-.代表无菌生长;+.代表有菌生长;++.代表长菌较多。
美拉德反应产生大量碳基化合物、吡嗪类化合物、呋喃类化合物及少量含硫有机物,是焙烤食品香气的重要组成部分。Rufin-Henares J. A等[13]和Vu Thu Trang等[14]的研究表明,MRPs中类黑精以及呋喃、咧哚以及咪唑等衍生物是具有抑菌活性的物质。水产品花蟹中蛋白质富含精氨酸和赖氨酸等鲜味氨基酸,而精氨酸和木糖美拉德反应的混合物能更好抑制食品中常见的病原体和腐败性微生物如大肠杆菌、金黄色葡萄球菌和蜡状芽孢杆菌等[10]。已有研究得出美拉德反应中蛋白质可以参与反应促使MRPs的产生,MRPs可以螯合金属,形成羟甲基糠醛(HMF)之类的物质,研究者认为此类物质能有效抑制细菌的生长[10]。
3 结论
金黄色葡萄球菌、枯草芽孢杆菌、蜡状芽孢杆菌、大肠杆菌是常见的食品致病菌,本实验通过PXMRPs对以上4中常见食品致病菌的抑菌性的研究,并通过单因素实验和正交实验优化反应条件,比较分析PXMRPs抗菌性最佳的工艺参数为:木糖与花蟹肉酶解多肽质量比2∶1,反应温度为120 ℃,反应时间为120 min。实验结果的方差分析可知,在本实验范围内,各因素对制备高效抗菌剂的影响顺序是:反应时间>反应温度>反应物比例。
通过对PXMRPs的抗菌性分析,表明花蟹除了作为蟹糊销售外也具有开发成新型抗菌性食品添加剂的潜能,但花蟹肉酶解多肽的美拉德反应产物中具体的化合物种类以及如何抑制细菌的机理有待进一步深究,这为开发高品质天然蟹味食品添加剂提供了理论基础。
[1]Sroyraya Morakot,Hanna1 Peter J,Changklungmoa Narin,et al. Expression of the male reproduction-related gene in spermatic ducts of the blue swimming crab,Portunus pelagicus,and transfer of modified protein to the sperm acrosome[J]. Journal of Microscopy Research Technique,2013,76(1):102-112.
[2]倪孔巍,张萌,徐大伦,等.花蟹肉酶解物美拉德反应产物的抗氧化性[J].食品与生物技术学报,2015,34(3):239-245.
[3]Liu Qian,Li Jing,Kong Baohua,et al. Antioxidant capacity of Maillard reaction products formed by a porcine plasma protein hydrolysate-sugar model system as related to chemical characteristics[J]. Food Science Biotechnol,2014,23(1):33-41.
[4]Chevalier Francüois,Chobert Jean-Marc,Genot Claude,et al. Scavenging of free radicals,antimicrobial,and cytotoxic activities of the maillard reaction products ofβ-lactoglobulin glycated with several sugars[J]. Food Chemistry,2001(49):5031-5038.
[5]You Juan,Luo Yongkang,Shen Huixing,et al. Effect of substrate ratios and temperatures on development of Maillard reaction and antioxidant activity of silver carp(Hypophthalmichthys molitrix)protein hydrolysate-glucose system[J]. Journal of Food Science and Technology,2011,46(12):2467-2474.
[6]温建丰,杨文鸽,徐大,等.响应面法优化花蟹肉制备抗氧化肽的酶解工艺[J].核农学报,2013,27(12):1881-1886.
[7]李婷,江晓婉,于妍,等.黄鲫蛋白抗菌肽-葡萄糖美拉德反应物的抑菌性实验研究[J].粮油食品科技,2012,20(3):42-45.
[8]Su Bu-Li,Zeng Rong,Chen Jin-Yin,et al. Antioxidant and antimicrobial properties of various solvent extracts from impatiens balsamina L. Stems[J]. Journal of Food Science,2012,77(6):614-619.
[9]宋玉民,常彩萍,达文燕,等.壳聚糖的改性及抑菌性研究[J]. 西北师范大学学报:自然科学版,2010,46(3):71-74.
[10]Hjorleifur Einarsson,Benkt Goran Snygg,Caj Eriksson. inhibition of bacterial growth by Maillard reaction products[J]. Food Chemistry,1983,(31):1043-1047.
[11]董周永,郭松年,赵国建,等.石榴果皮提取物抑菌活性研究[J].西北植物学报,2008,28(3):582-587.
[12]李春美,杜靖,谢笔钧.柚皮提取物的抑菌作用[J].食品与发酵工业,2004,30(1):38-41.
[13]Henares José ángel Rufián,Cueva Silvia Pastoriza De La. Antimicrobial activity of coffee melanoidins-a study of their metal-chelating properties[J]. Journal of Agricultural and Food Chemistry,2009,57(2):432-438.
[14]Trang Vu Thu,Takeuchi Hiroaki,Kudo Hayato,et al. Antimicrobial activity of aminoreductone against helicobacter pylori[J]. Journal of Agricultural and Food Chemistry,2009,57(23):11343-11348.
Antimicrobial activity of maillard reaction products derived from enzymolysis polypeptide ofPortunuspelagicusmeat
CHEN Jin-bin1,XI Xiu-xiu2,3
(1.Wenling Food and Drug Inspection Center,Wenling 317500,China;2.Department of Food Science and Nutrition,Ningbo University,Ningbo 315211,China;3.Department of Food Engineering,Shanghai University,Shanghai 200444,China)
This study investigated the antimicrobial activity of the maillard reaction products which were obtained from enzymolysis polypeptide of pelagicus meat(PXMRPs)on four selected spoilage bacteria frequently found in food includingStaphylococcusaureus,Waxybacillus,BacillussubtilisandE.coli,and the preparation of PXMRPs process was optimized. The results revealed that the PXMRPs had obvious germ inhibiting effect on the four bacterias. Xylose as the reducing sugar,substrate ratios of xylose and enzymolysis polypeptide of pelagicus meat,temperatures and the reaction time were independent variable in the maillard reaction,the diameter of inhibition zone were measured during single factor test and the orthogonal experiment which was to find the optimal parameter of processing in order to strengthen the antibacterial efficiency of PXMRPs. The optimal processing conditions were that the ratio of enzymolysis polypeptide ofPortunuspelagicusand xylose was 2∶1,the temperature was 120 ℃,the reaction time was 120 min. And the MIC(minimum inhibitory concentration)values ofWaxybacillusandStaphylococcusaureuswere both 15 mg/mL,the MIC values ofBacillussubtilisandE.coliwas 20 mg/mL and 30 mg/mL,respectively. Therefore,enzymolysis polypeptide ofPortunuspelagicusmeat showed strong antimicrobial activity because of the modification of maillard reaction,PXMRPs can be used as an antimicrobial in food industry.
enzymolysis polypeptide ofPortunuspelagicusmeat;maillard reaction products;antibacterial activity
2016-09-13
陈金斌(1984-),男,本科,工程师,研究方向:食品检验,E-mail:13738655550@163.com。
*通讯作者:奚秀秀(1993-),女,本科,研究方向:食品科学与工程,E-mail:yizhiyinxuan@163.com。
国家自然科学基金项目(31201284 )。
TS201.1
A
1002-0306(2017)05-0088-05
10.13386/j.issn1002-0306.2017.05.008

