光动力治疗大鼠大面积创伤感染的实验研究
赵占娟 李世杰 徐泽华 商亚贞 刘天军
1(河北大学基础医学院,河北 保定 071000)2(河北大学公共卫生学院,河北 保定 071000)3(河北大学附属医院,河北 保定 071000) 4(中国医学科学院生物医学工程研究所,天津 300192)
光动力治疗大鼠大面积创伤感染的实验研究
赵占娟1李世杰1徐泽华2商亚贞3刘天军4*
1(河北大学基础医学院,河北 保定 071000)2(河北大学公共卫生学院,河北 保定 071000)3(河北大学附属医院,河北 保定 071000)4(中国医学科学院生物医学工程研究所,天津 300192)
探讨新型卟啉类光敏剂PA1介导的光动力抗菌疗法治疗大鼠大面积创伤感染的效果。体外培养创面易感染的3种菌株,有抗药性金黄色葡萄球菌(MRSA)、大肠杆菌(E.coli)和铜绿假单胞菌(P.aeruginosa),探讨3种细菌对PA1的吸收量、光照PA1的最小抑菌浓度和最低杀菌浓度; 取清洁级雄性Wistar大白鼠40只,建立皮肤大面积创伤感染模型,创面滴加光敏剂PA1,用650 nm激光照射治疗,检测各实验组的创面愈合率、不同时相点创面下的菌落数。结果表明,上述3种细菌对PA1的最大吸收量都发生于前30 min,以后趋于平稳。光照PA1对3种细菌均有灭活作用,对MRSA和E.coli的最低杀菌浓度为31 μM,对P.aeruginosa的最低杀菌浓度为62.5 μM。体内实验结果显示,治疗组的各项指标优于模型对照组(P<0.05或P<0.01),高剂量治疗组的各项指标优于中、低量治疗组(P<0.01),为临床治疗大面积创伤感染积累一定的实验经验。
光动力抗菌疗法;创伤感染;光敏剂;卟啉衍生物
引言
各类皮肤破损性疾病是临床多发病之一。体表皮肤受损为微生物侵入提供了途径,而伤后内环境紊乱、免疫机能下降都增加了机体对感染的易感性。由于环境及治疗因素的影响,使环境中菌群随之而变迁。菌群多以金黄色葡萄球菌及绿脓杆菌和大肠杆菌为代表[1]。由于抗生素的广泛及不合理应用,使得细菌的耐药性日益凸显,而广谱抗生素的滥用更是加快了细菌的耐药性转变,严重威胁到了人类健康。因此,寻求高效、低毒、广谱的抗微生物药物已经迫在眉睫。
光动力抗菌疗法(photodynamic antimicrobial therapy PACT)是基于光、光敏剂和氧3种因素协同作用的氧化损伤机制,单一用药很难使病原菌产生耐药性,从而倍受各国科学家的关注[2]。
PACT在治疗由耐药菌引起的大面积烧伤感染、皮肤病、慢性创面感染以及肺结核的实验研究中表现出毒性小、杀菌范围广等优点[3],与抗生素相比,它还具有极少诱导产生耐药性的优点[4],目前仍处于临床前研究阶段。
本实验室在卟啉周边引入多氨基极性基团,合成了一系列新型水溶性的光敏剂,前期的研究筛选出了一种具有良好理化性质的新型水溶性光敏剂PA1,有着良好的光动力抗菌活性作用。本研究将PA1应用于治疗大鼠大面积创伤感染实验,探讨将其用于临床光动力抗菌治疗的可行性。
1 材料和方法
1.1 材料
1.1.1 化合物PA1
PA1为本实验室自行合成(见图1),紫红色粉末,体外实验用磷酸盐缓冲液(PBS)配制为10-2mol/L,使用时用灭菌的液体LB培养基稀释到10-4mol/L以下使用。动物实验时用灭菌的PBS(pH=7.4)稀释到10-4mol/L以下使用。
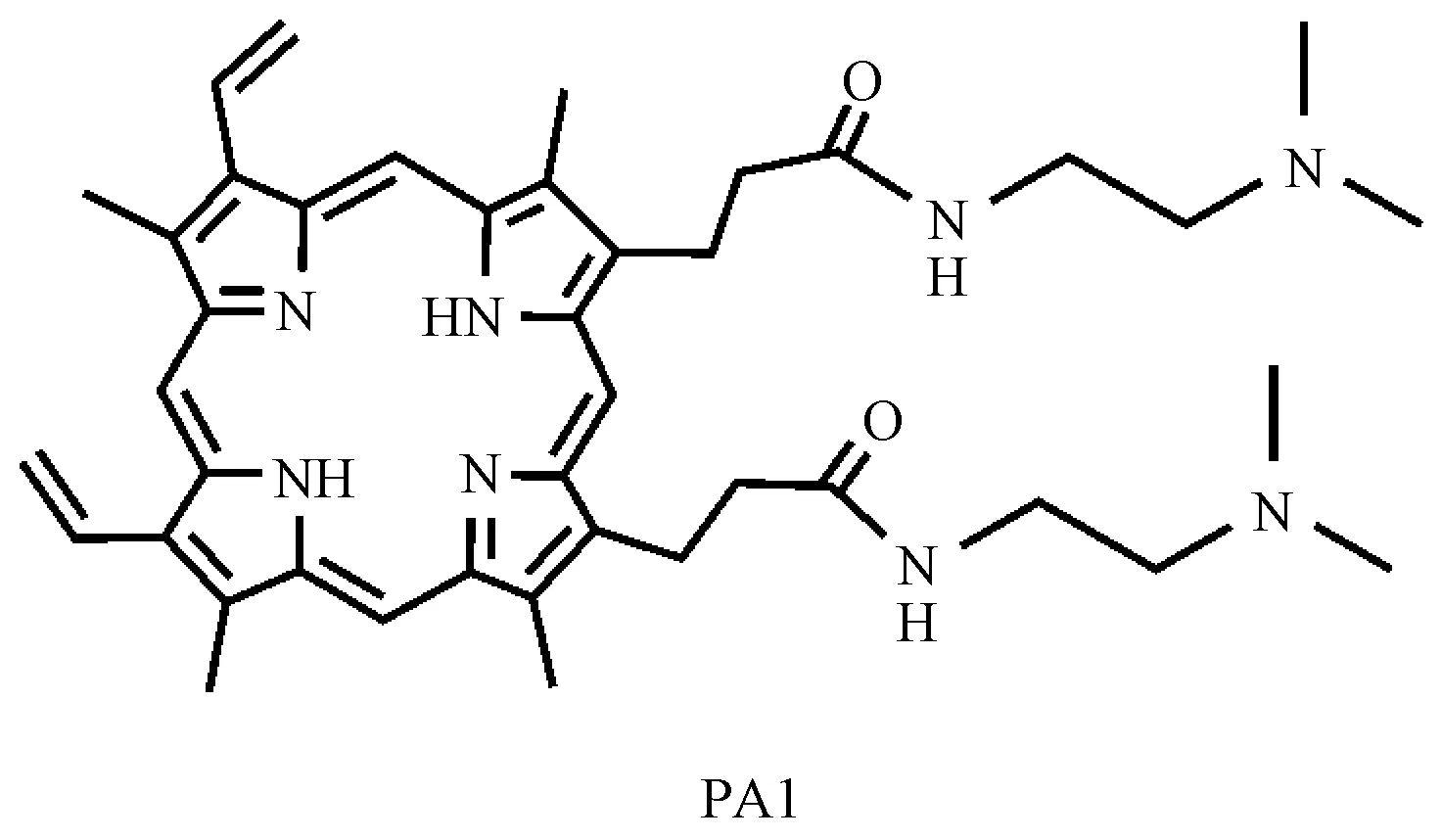
图1 化合物PA1的结构Fig.1 Chemical structural formula of PA1
1.1.2 主要仪器与试剂
半导体激光器(7404,Intense,USA,650 nm光纤输出),多功能酶标仪(Thermo3001,美国),胰蛋白陈 (Oxoid,英国),酵母提取物(Oxoid,英国),氯化钠(天津科威公司),琼脂(Oxoid,英国),PBS缓冲液(Thermo,美国),十二烷基硫酸钠SDS(天津市江天化工技术有限公司)。
1.1.3 实验菌株
标准质控菌株大肠埃希菌(Escherichia,E.coli)(ATCC 25922),抗药性金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA) (临床分离菌株),铜绿假单胞菌(Pseudomonasaeruginosa,P.aeruginosa)(ATCC 27853),由解放军307医院惠赠。
1.2 方法
1.2.1 不同能量密度的激光对MRSA的PACT作用
取处于对数生长期的菌液1 mL,离心,用PBS溶液洗涤,重悬至OD600=0.6;取上述菌液加入96孔培养板内,每孔200 μL;利用650 nm的激光照射,照射强度分别为2、4、6、8、10和12 J/cm2;采用涂布法,对样品进行梯度稀释,分别取10-4、10-5、10-6等4个稀释度迅速涂板,24 h后菌落计数,实验重复3次。
1.2.2 吸收速度的测定[5]
1.2.2.1 标准曲线的配制
1)用0.1M-1%SDS分别配制PA1溶液浓度,分别为0.4、0.8、1.56、3.13、6.25、12.5、25、50 μM。吸取100 μL加入96孔培养板,每个浓度4个复孔。
2)测每孔的荧光吸光度值,绘制标准曲线。
1.2.2.2 革兰氏阴性菌及阳性菌对PA1吸收速度的测定
1)取处于对数生长期的细菌1 mL进行离心(9 000 g,1 min), 用PBS重悬到相应光密度OD600=0.6~0.8。
2)取8个离心管,加入上述菌悬液500 μL,再加入500 μL浓度为25 μM的PA1溶液混匀。
3)将上述离心管分别暗孵育0、10、20、30、40、80、160、320 min,然后离心(9 000 g,1 min),用PBS洗,去上清,留取菌团备用。
4)在上述菌团中加入1 mL 0.1M-1% SDS,溶解细菌24 h。
5)用移液枪吸取100 μL裂解菌液,放入无菌96孔板中,每个浓度4个复孔。
6)上机检测每孔的药物荧光强度值(激发波长418 nm,发射波长658 nm),根据标准曲线将测得的荧光强度值转变为每孔的药物含量,药物含量用吸收量uptake (molecules/cells)表示,实验重复3次。
1.2.3 试验方法
采取光照PA1对革兰氏阴性菌及阳性菌的最小抑菌浓度(minimum inhibitory concentration, MIC)、最小杀菌浓度(minimal bacteriacidal concentration, MBC)的试验方法[6]。
1.2.3.1 MIC的测定
1)称取一定量的药物,用二甲基亚砜DMSO配制溶液,浓度为10-2mol/L。
2)药液的配制:用移液枪吸取原液,用液体培养基稀释到1000 μM, 然后用二倍稀释法将药物依次稀释为500、250、125、63、32、16、8、4、2、10 μM浓度。
3)菌液的制备:取对数生长期的菌液用无菌肉汤,校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/mL。
4)接种物制备:将上述校正好的0.5麦氏比浊标准的菌悬液,经LB肉汤1∶1 000稀释后,每孔中加100 μL至无菌96孔聚苯乙烯板。
5)MIC板制备:无菌操作,将倍比稀释后不同浓度的抗菌药物溶液分别加到上述96孔聚苯乙烯板中,第1~11孔加药液,每孔100 μL,第12孔不加药作为生长对照。此时,第1~11孔药物浓度分别为500、250、125、64、32、16、8、4、2、1、0 μM,每个浓度4个复孔重复实验。
密封后在摇床上暗孵育30 min,取出行激光照射,激光能量密度为6 J/cm2,光照后于暗箱中培养孵育16~20 h判断结果。单纯光敏剂对照组不用激光照射,其他方法同上进行操作。
6)结果判断:小孔内完全抑制细菌生长的最低药物浓度为MIC,阳性对照孔(即不含药物)内细菌明显生长试验才有意义。若结果出现单一的跳孔,记录抑制细菌生长的最高药物浓度;如出现多处跳孔,则不报告结果,重复试验。
1.2.3.2 MBC的测定
在MIC试验基础上,将所有清晰无菌生长的小孔内液体用涂布棒蘸取,分别涂布于相应的琼脂平板培养基,放在36℃ 的恒温培养箱培养过夜(24~48 h),以琼脂平板上菌落数不超过5个的最低药物浓度作为该药物对该菌株的最小杀菌浓度(MBC)。
1.2.4 受试动物
健康雄性(清洁级)Wistar大白鼠40只,体重210~230 g,均由北京华阜康实验动物中心提供,动物合格证为SCXK(京)2009-0004。实验前1周将大鼠置于实验环境中饲养,室温20~25℃。受试动物实验经过中国医学科学院伦理审查。
1.2.5 造模方法[7]
实验当日大鼠禁食,腹腔注射10%水合氯醛(300 mg/kg)麻醉后,将大鼠呈腹卧位固定在固定板上,背部剃毛并消毒;无菌条件下,在制伤部位用直径15 mm的环钻垂直于皮肤各压出1个圆形痕迹(1.77 cm2),沿压痕用无菌弯手术剪剪去全层皮肤(剔除部分深筋膜),制成圆形全层皮肤缺损创面,伤口止血备用。每只大鼠背部两侧各制备2个创面。充分止血后,在伤口表面覆盖与创面大小相仿的圆形纱布,每块纱布表面滴入50 μL新配制的MRSA(10亿/mL)、E.coli(5亿/mL)、P.aeruginosa(5亿/mL)3种菌株混悬液,然后用纱布包扎固定。动物分笼饲养,给予充足的水和食物。创面感染模型成功,进行下一步实验。
1.2.6 动物分组
造模后,将大鼠随机分成模型对照组(生理盐水组)、PACT高剂量治疗组(6 MBC)、PACT中剂量治疗组(3 MBC)、PACT低剂量治疗组(1.5 MBC),共4组,每组10只。
1.2.7 PACT治疗方案
造模感染48 h后,在各组大鼠创面处敷上单层纱布,模型对照组每个创面只滴加50 μL的生理盐水;PACT治疗组的每只大鼠每个创面滴加50 μL(共200 μL)不同浓度的光敏剂,用波长为650 nm的激光(能量密度为60 J/cm2)局部照射每个创面表面10 min,其他部位避光。治疗后移至暗室,避光饲养。由于创面还有残存的光敏剂,第二天PACT治疗组继续照光1次,此为光动力抗菌治疗1次。按照此种方法,进行光动力抗菌治疗2次。
1.2.8 检测指标
1)在体抑菌的影响。用无菌棉签蘸取生理盐水,由创面一侧向另一侧滚动,均匀涂抹全创面一次,并立即置入无菌试管里。检测时,用生理盐水倍比稀释至10-6,然后每个稀释梯度各取100 μL菌液涂布于普通肉汤琼脂平板,每个梯度涂布两个平板。37℃ 过夜培养,观察菌落形态,并计数(colony forming units, CFU)。创面接种细菌24 h后,测定创面3种菌落总数量;其后从第3天起,每隔3 d测一次细菌CFU。
2)创面愈合率。建模后,每天观察伤口愈合情况并拍照,于4、8、12、14 d用游标卡尺测量创面直径,并计算创面面积,采用下列公式计算创面愈合率,有
创面愈合率(%)=
1.2.9 统计学处理
2 结果
2.1 激光能量密度对MRSA的PACT影响[8]
使用不同能量密度的激光(650 nm)照射新型光敏剂PA1(6.25 μM)和MRSA的混悬液。由图2(a)可以看出,随着激光能量密度的增加,对细菌的灭活率也越大,但激光能量密度达到6 J/cm2后,PACT对细菌的灭活率也达到最大,增加能量密度,死亡率未见明显变化,故本次试验选取激光能量密度为6 J/cm2进行以下实验。图2(b)表示在没有光敏剂的情况下单纯激光光照对细菌的灭活率变化,可以看出随着激光能量密度的增加,细菌的灭活率没有明显变化,故认为单纯激光光照对MRSA 的菌株灭活没有作用。
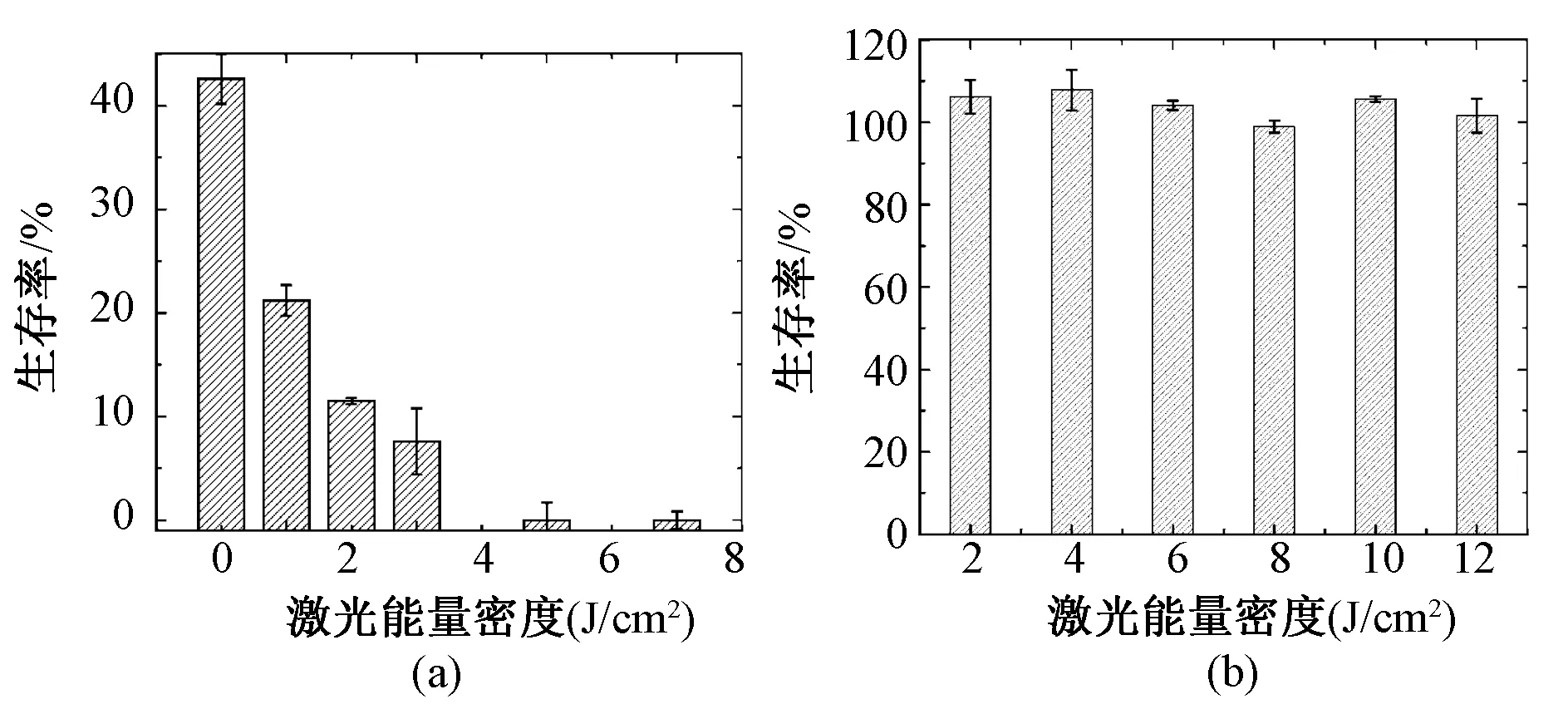
图2 激光能量密度对抗药性金黄色葡萄球菌存活率的影响。(a)不同能量密度的激光光动力抗菌作用; (b)单独激光光照Fig.2 Effects of PA1-PACT. (a) MRSA strains as a factor of laser energy dose illumination at (650 nm); (b) Light alone
2.2 革兰氏阴性菌、革兰氏阳性菌对光敏剂PA1吞噬速度的测定
光敏药物能否进入细菌内部对其PACT疗效是非常重要的,由图3可以看出,3种细菌对PA1的吸收随着时间的延长而发生变化,且最大吸收都发生在前30 min内,以后趋于平稳。鉴于30 min 细菌的吸收能达到最大,故本次体内、体外试验选择暗孵育的时间均为30 min。
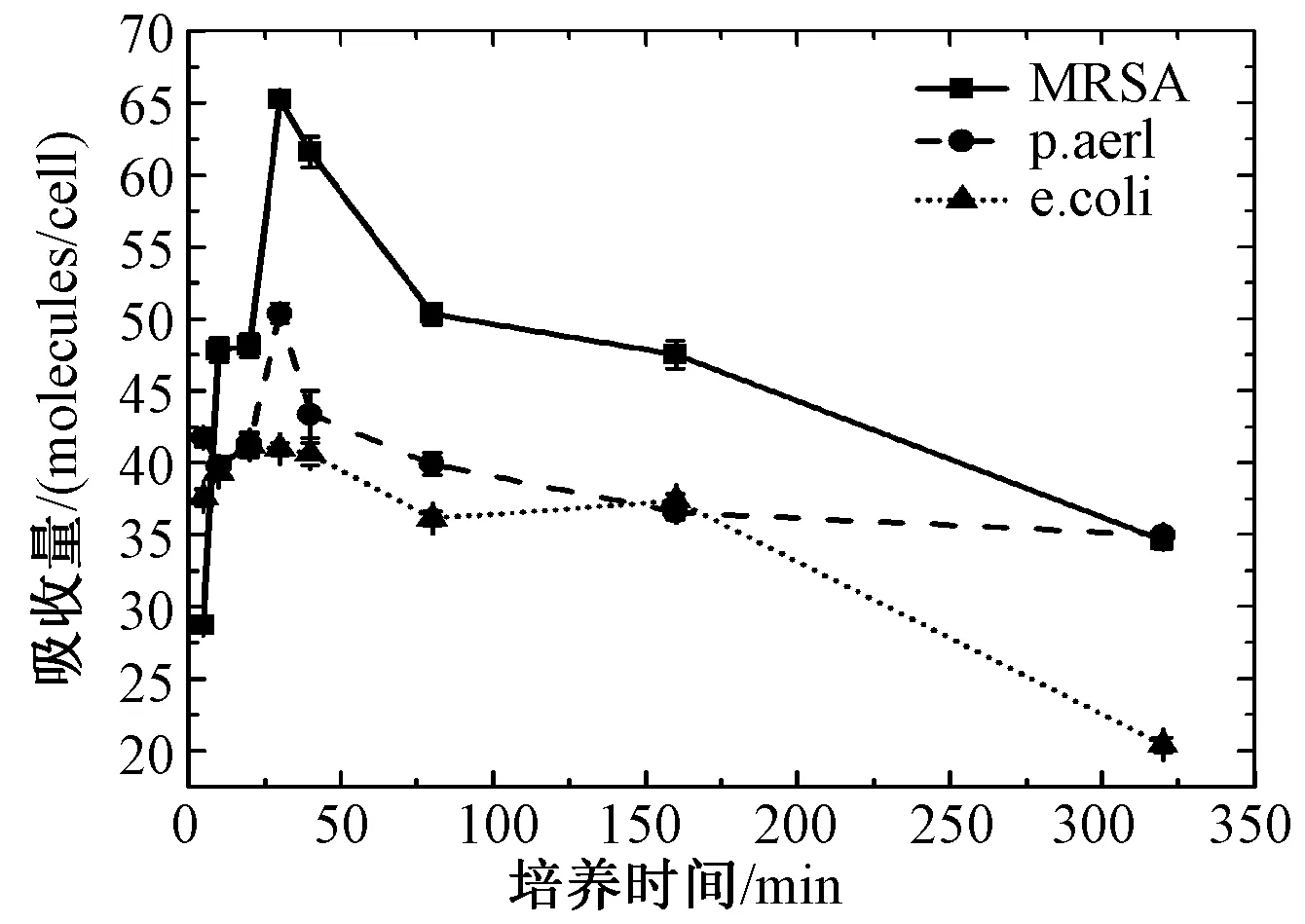
图3 抗药性金黄色葡萄球菌、大肠杆菌和绿脓杆菌对PA1吞噬量的测定Fig.3 Compound PA1 taken up by MRSA, E. coli and P. aeruginosa, as a factor of incubation time
2.3 激光光照光敏剂PA1对革兰氏阴性菌、革兰氏阳性菌的MIC和MBC的比较
表1显示了光敏剂PA1对3种代表菌株光反应、暗反应的MIC和MBC。从实验结果可见,光照PA1对3种细菌均有杀菌作用,对3种菌的MIC都为16 μM。而PA1对3种菌的MBC略有不同,对MRSA、E.coli的MBC(31μM)要低于对P.aeruginosa的MBC(62.5 μM)。
表1 光照光敏剂PA1对3种菌株的MIC和MBC
Tab.1 Minimal inhibitory concentration(MIC, μM) and minimal bactericidal concentration (MBC,μM) of the compound PA1 against MRSA,P.seuginosa,E.coli
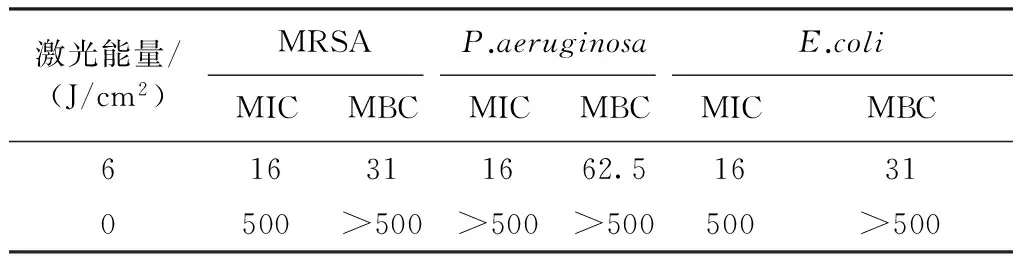
激光能量/(J/cm2)MRSAP.aeruginosaE.coliMICMBCMICMBCMICMBC616311662.516310500>500>500>500500>500
2.4 光动力抗菌疗法治疗大鼠创伤感染试验研究
2.4.1 创面愈合率比较
由表2可见,治疗4d后,PACT高、中、低治疗组愈合率均大于模型对照组(P<0.05),PACT高剂量治疗组的创面愈合率高于中、低剂量组的创面愈合率,差异无显著性(P>0.05)。治疗12d后,PACT治疗组高、中、低剂量组愈合率具有显著性差异(P<0.05)。治疗14d后,PACT高剂量治疗组已经愈合(97.8±1.5),愈合率优于其他各组(P<0.01),模型对照组的创面依然较大,愈合率很低(86.3±7.0),差异具有统计学意义(P<0.05)。
表2 各实验组治疗过程中不同时间点伤口愈合率(%)比较
Tab.2 Percentage of healing area (%) in the wound 4,8,12 and 14 days after treatment with the 4 different groups (n=10, mean±SD)
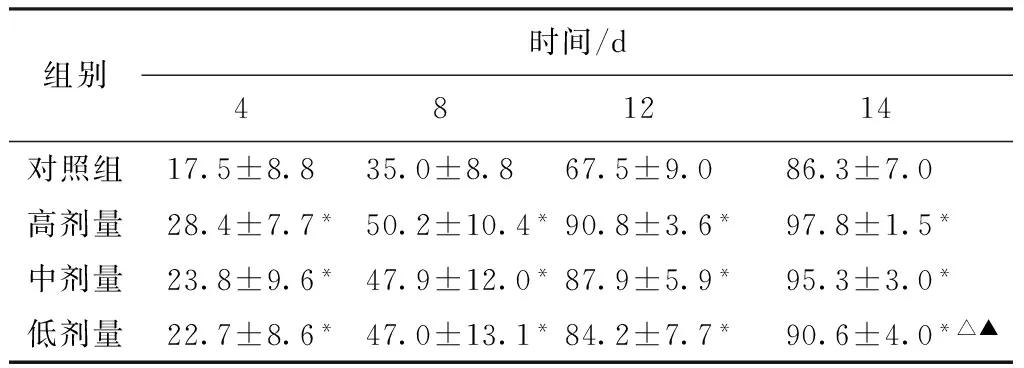
组别时间/d481214对照组17.5±8.835.0±8.867.5±9.086.3±7.0 高剂量28.4±7.7*50.2±10.4*90.8±3.6*97.8±1.5*中剂量23.8±9.6*47.9±12.0*87.9±5.9*95.3±3.0*低剂量22.7±8.6*47.0±13.1*84.2±7.7*90.6±4.0*△▲
注:*表示与对照组比较,P<0.05;△表示与高剂量组比较,P<0.05;▲表示与中剂量组比较,P<0.05。
Note:*Compared with the control group,P<0.05;△Compared with the high-dose group,P<0.05;▲Compared with middle-does group,P<0.05.
2.4.2 不同时间创面下菌落计数的比较
表3的实验结果表明,在各个时间点,PACT治疗组的痂下菌落数与模型对照组相比均降低;高剂量组对3种菌的抑制率高于中、低剂量组的抑制率,在后7~14 d具有显著性差异(P<0.01)。
表3 各实验组治疗过程中不同时间点菌落数的比较
Tab.3 CFU in the wound after treatment 1,4,7,10 and 14 days with the 4 different groups (n=10, mean±SD)

组别时间/d01471014对照组3.2±1.93.2±1.63.2±1.62.9±3.0 2.8±1.52.3±1.1高剂量3.2±1.82.9±1.6*2.8±1.7*2.5±1.4*1.7±0.6*0.0±0.0*中剂量3.2±1.83.0±2.82.9±1.6*2.6±1.5*2.2±0.9*△1.6±0.5*△低剂量3.2±1.83.1±1.8△3.1±1.8△2.8±1.2*△▲2.5±1.41.9±0.6*△▲
注:*表示与对照组比较,P<0.05;△表示与高剂量组比较,P<0.05;▲表示与中剂量组比较,P<0.05。
Note:*Compared with the control group,P<0.05;△Compared with the high-dose group,P<0.05;▲Compared with middle-does group,P<0.05.
3 讨论和结论
光动力抗菌疗法PACT有三要素,即激光、光敏剂和氧,光敏剂的优劣是目前PACT疗效的关键因素。光敏剂是一类具有光活性的化合物,光照光敏剂具有很强的抗菌性能,它可以选择性地富集在特定的组织上,在可见光或紫外光的激发下,在已确定的靶细胞上释放光活化产物来达到杀死靶细胞的目的,从而起到杀菌的功效[9]。第一代光敏剂都是混合物且组成成分不确定,光动力治疗效率差、毒副作用多等,因而开发新型的光敏剂是发展PACT治疗的关键。本研究以四苯基卟啉为母核,引入了多氨基极性基团,获得了一种结构单一、水溶性较好、单线态氧产率较高的化合物PA1。体外实验结果表明,PA1对3种细菌均表现出较好的灭活效果,且无光照时化合物自身的MBC也较低(MBC>500 μM),表明PA1是一种良好的体外抗菌光敏剂。体内实验利用PA1-PACT治疗了由耐药菌引起的大鼠大面积创伤感染,结果显示PACT治疗组的各项指标都优于模型对照组的各项指标(P<0.05或P<0.01),高剂量PACT治疗组的各项指标优于中、低量PACT治疗组的各项指标(P<0.01),提示PACT有杀灭细菌、促进创面愈合的作用。
目前,PACT灭菌的机制尚不完全清楚。有研究认为,光敏剂受到激发会产生多种活性氧簇(reactive oxygen species, ROS),损伤细菌质膜,灭活膜上的转运系统和酶[10],导致细菌DNA损伤[11],达到治疗的目的。今后,应进一步进行相关机制的实验探讨。
综上所述,新型水溶性光敏剂PA1具有良好的光动力抗菌效果,体内(外)实验均取得较好的疗效,表明了PACT治疗大面积创伤感染的可行性,这点与国外的一些PACT体内抗感染的实验研究结果相符[12-13]。相信在将来,随着新型光敏剂的出现及实验条件的改善,PACT将成为临床治疗难治性细菌感染性疾病的一种新疗法。
[1] 葛绳德. 烧伤和创伤后革兰阳性细菌感染[J]. 国外医学: 创伤与外科基本问题分册, 1993, 14(1): 29-33.
[2] Bhatti M, Macrobert A, Meghji S, et al. A study of the uptake of toluidine blue o by porphyromonas gingivalis and the mechanism of lethal photosensitization[J]. Photochemistry and Photobiology, 1998 , 68(3):370-376.
[3] Liyi Huang, Tianhong Dai, Hamblin MR. Antimicrobial photodynamic inactivation and photodynamic therapy for infections[J]. Photodynamic Therapy: Humana Press, 2010; 155-173.
[4] Tavares A, Carvalho CM, Faustino MA, et al. Antimicrobial photodynamic therapy: study of bacterial recovery viability and potential development of resistance after treatment[J]. Marine Drugs, 2009, 8(1):91-105.
[5] Foley JW, Song X, Demidova TN, et al. Synthesis and properties of benzo[a]phenoxazinium chalcogen analogues as novel broad-spectrum antimicrobial photosensitizers[J]. Journal of Medicinal Chemistry, 2006, 49(17):5291-5299.
[6] Rodrigues GB, Dias-Baruffi M, Holman N, et al. In vitro, photodynamic inactivation of Candida, species and mouse fibroblasts with phenothiazinium photosensitisers and red light[J]. Photodiagnosis and Photodynamic Therapy, 2013, 10(2):141-149.
[7] 赵京禹, 付小兵, 雷永红, 等. 大鼠小面积全层皮肤缺损创面模型的制备[J]. 感染、炎症、修复, 2008, 9(1): 64-64.
[8] Zhao Zhanjuan, Li Yanzhou, Meng Shuai, et al. Susceptibility of methicillin-resistant Staphylococcus aureus to photodynamic antimicrobial chemotherapy with α-D-galactopyranosyl zinc phthalocyanines: In vitro study[J]. Lasers in Medical Science, 2013, 29(3):1131-1138.
[9] Zeina B, Greenman J, Purcell W, et al. Killing of cutaneous microbial species by photodynamic therapy[J]. British Journal of Dermatology, 2001; 144(2): 274-278.
[10] Jori G, Brown SB. Photosensitized inactivation of microorganisms[J]. Photochemical and Photobiological Sciences, 2004; 3(5): 403-405.
[11] Salmon-Divon M, Nitzan Y, Malik Z. Mechanistic aspects of Escherichia coli photodynamic inactivation by cationic tetra-meso(N-methylpyridyl)porphine[J]. Photochemical and Photobiological Sciences, 2004, 3(5):423-429.
[12] Yang YT, Chien HF, Chang PH, et al. Photodynamic inactivation of chlorin e6-loaded CTAB-liposomes againstCandida albicans[J]. Lasers in Surgery and Medicine, 2013; 45(3): 175-185.
[13] Hamblin MR, Hasan T. Photodynamic therapy: a new antimicrobial approach to infectious disease? [J]. Photochemical and Photobiological Sciences, 2004; 3(5): 436-450.
Experimental Study on Photodynamic Therapy of Massive Trauma Rats
Zhao Zhanjuan1Li Shijie1Xu Zehua2Shang Yazhen3Liu Tianjun4*
1(BasicMedicalCollege,HebeiUniversity,Hebei,Baoding071000,China)2(SchoolofPublicHealth,HebeiUniversity,Hebei,Baoding071000,China)3(AffiliatedHospitalofHebeiUniversity,Hebei,Baoding071000,China)4(InstituteofBiomedicalEngineering,ChineseAcademyofMedicalSciences,Tianjin300192,China)
photodynamic antimicrobial therapy; wound infection; photosensitizer; porphyrin derivative
10.3969/j.issn.0258-8021. 2017. 02.017
2016-05-13, 录用日期:2016-12-07
天津市重大科技支撑项目(12ZCDZSY11900);河北大学医学学科建设项目(2015A2001);河北大学大学生创新训练计划项目(2015149)
O43;Q631;R641
D
0258-8021(2017) 02-0243-05
*通信作者(Corresponding author),E-mail: TianJunLiu@hotmail.com

