小鼠背部皮肤的在体阻抗谱实验研究
李 颖 宋 冰 刘志朋 殷 涛#*
1(中国医学科学院北京协和医学院生物医学工程研究所,天津 300192)2(英国卡迪夫大学生物医学与生命科学学院口腔医院,卡迪夫 CF144XY)
小鼠背部皮肤的在体阻抗谱实验研究
李 颖1宋 冰2刘志朋1殷 涛1#*
1(中国医学科学院北京协和医学院生物医学工程研究所,天津 300192)2(英国卡迪夫大学生物医学与生命科学学院口腔医院,卡迪夫 CF144XY)
皮肤中角质层与其他层面阻抗的巨大差异,使得将皮肤作为一个整体的阻抗特性研究较难开展。研究在体条件下无创或微创地检测与分析包含角质层的小鼠背部皮肤的阻抗特性。使用Agilent 4294A阻抗分析仪,测量麻醉状态下的15只C57BL/6小鼠背部皮肤的电阻抗频谱,使用表面电极和银针电极,分别对应皮肤和活性皮肤层阻抗数据。在整个实验频率范围(40~107Hz)内,随频率升高,皮肤阻抗幅值呈现-20dB/dec下降;活性皮肤层在40~103Hz之间幅值呈现-10 dB/dec下降,而在103~107Hz之间呈现-3dB/dec下降。皮肤相位随频率上升呈现V型曲线,而活性皮肤层相位呈现Π型曲线。低频时,皮肤阻抗完全由角质层阻抗组成,活性皮肤层的贡献可以忽略不计;当频率为105Hz时,活性皮肤层阻抗占皮肤的10%多,而在107Hz以上时,活性皮肤层阻抗占整个皮肤的80%以上。皮肤阻抗与活性皮肤层阻抗在103Hz以下具有显著性差异(P<0.05),在104Hz以上无显著性差异。结果表明,表面电极与银针电极相结合的对比分析方法能够在微创前提下有效分析角质层在皮肤阻抗中的作用。
小鼠; 皮肤; 角质层; 阻抗; 在体
引言
生物电阻抗是能够反映整个生物组织电学性质的物理量,这些生物组织包括活体或离体生物组织、器官、细胞或细胞器[1]。生物组织的电阻抗可分为阻性和容性成分,随着生物体所加载的激励信号频率发生变化,其阻性与容性成分间比值也随之发生明显变化,这种现象称为“生物组织的阻抗频谱特性”。作为生物体的固有属性,电阻抗反映生物体的生存状态和组织变化,而内生电流和外加电流的通路也会受到组织电阻抗特性的影响。生物电阻抗特性研究在疾病的分子和细胞水平的建模和机制研究[2-4]、肿瘤的早期诊断与筛查[5-6]、心血管系统疾病监测[7-8]、呼吸功能评估[9-10]、体质评测[11-12]等方面具有非常广泛的应用。
由于角质层的存在,皮肤在组织电阻抗研究中一直是较为棘手的问题。Rosell等测量了导电胶处理过的人体皮肤几种不同部位在1~106Hz等不同频率点上的电阻抗[13]。Gabriel等对之前50年中血液、肌肉、皮肤等组织的电阻抗研究数据进行了总结[14]。Martinsen等的仿真研究表明,在低于103Hz频段,皮肤的电阻抗主要体现在角质层;而在高频段,活性皮肤层的阻抗是皮肤阻抗的主要部分[15]。在皮肤阻抗的实验研究中,由于角质层的特殊性,经常被分为干燥和湿润两种情况[14];而对角质层阻抗的研究使用破坏性的方法[16],或在低频条件下完成[15]。笔者通过表面电极和银针电极,测量麻醉状态下所研究小鼠的背部皮肤电阻抗,开展皮肤与活性皮肤层阻抗的幅值、相位以及不同频率电阻抗标准差的对比研究,从而在微创前提下有效分析角质层在皮肤阻抗中的作用,为皮肤的电阻抗研究提供了新的思路。
1 材料和方法
1.1 实验对象与工具
实验小鼠品系为C57BL/6,共15只(7只雄性,8只雌性,SPF级,北京维通利华公司),分别命名为小鼠A、小鼠B等,普通环境饲养(天津实验动物中心),周龄为7~8周,体重为(16.8±1.7)g。麻醉剂为水合氯醛溶液,剂量为每100 g体重注射330 μL的5%水合氯醛溶液。在数据采集前,对麻醉小鼠进行处理,包括固定、背部去毛、清洁皮肤表面、标记测量点。
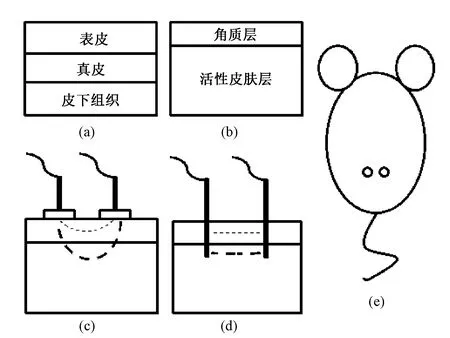
图1 皮肤结构,表面、银针电极与电流分布,以及表面电极和银针电极的放置。(a)皮肤的解剖学分层;(b)皮肤的电学分层;(c)表面电极下的电流分布;(d)银针电极下的电流分布;(e)电极在小鼠背部的放置位置Fig.1 Anatomical and electrical structure of the skin, and placement of the electrodes.(a)The anatomical structure of the skin;(b)The electrical structure of the skin;(c)Demonstration of the currents flowing through stratum corneum and viable skin using surface electrodes;(d)Demonstration of the currents flowing through stratum corneum and viable skin using acupuncture needles;(e)Positions of electrodes placing on mice
皮肤在结构上可以分为3层:表皮(epidermis)、真皮(dermis)和皮下组织(subcutis),如图1(a)所示。其中,表皮是皮肤的最外层,其最外层的致密组织称为角质层(stratumcorneum),角质层与皮肤中其他组织相比,具有较大的电阻抗。因此,从电学特性角度,又可以把皮肤分为两层:第一层是表皮最外层的角质层;第二层是活性皮肤层(viable skin),包括表皮除去角质层的其他部分、真皮层以及皮下组织[15],如图1(b)所示。在本研究中,通过表面电极(圆形直径52 mm,材质为Ag/AgCl,含导电胶)和银针电极(φ0.25×40 mm,材质为0Cr18Ni9不锈钢)分别记录电阻抗。表面电极的电流通过角质层后分为了两部分:一部分流经角质层,一部分流经活性皮肤层,如图1(c)所示。银针电极的电流也可分为流经角质层和流经活性皮肤层的两部分,由于角质层的阻抗非常大,实际流过其间的电流非常小,可认为所有电流都是从活性皮肤层流过,如图1(d)所示。因此,表面电极的测量结果是皮肤阻抗,而银针电极的测量结果是活性皮肤层阻抗。小鼠麻醉后放置在实验台上,测量期间使用医用胶带固定其四肢,如图1(e)所示,圆圈标记为两电极的放置位置,其电极中心间距约为10 mm。使用银针电极记录小鼠皮肤阻抗时,进针长度约为2 mm,并通过铁架台固定,以确保在测量过程中位置不变。用表面电极测量小鼠皮肤阻抗时,使用夹具以最小压力把电极固定在小鼠皮肤上,记录结果。
1.2 数据记录与处理
本研究采用Agilent 4294A阻抗分析仪及42941A测量探头,在40~107Hz范围内,以对数增量方式测量201个频率点的小鼠背部皮肤阻抗。测量方式包括有电压激励和电流激励两种,其中电压激励为5、10、20、50、100、200、500、1 000 mV,电流激励为200、500 μA和1、2、5、10、20 mA。记录数据后,使用Matlab软件进行后续处理:
1)对所有小鼠使用不同电极(表面电极和银针电极)、500 mV激励下背部皮肤阻抗数据进行分析,绘制该条件下的幅值频谱和相位频谱,并计算100~107Hz十倍频程的电阻抗幅值均值和统计分布。
2)对不同电流/电压激励条件下表面/银针电极的小鼠背部皮肤阻抗进行分析,绘制表面/银针电极小鼠背部皮肤阻抗频谱图。
3)对皮肤阻抗和活性皮肤层阻抗在100~107Hz十倍频程的数据进行统计学分析。
2 结果
图2显示500 mV电压激励下的不同小鼠背部皮肤阻抗的幅值、相位频谱和阻抗均值及数据离散度,(a)、(b)分别为皮肤幅值频谱和相位频谱(使用表面电极测得),(c)、(d)分别为活性皮肤层幅值频谱和相位频谱(使用银针电极测得)。其中,米字形点线表示幅值和相位数据的均值。如图 2(a)和(c)以及表1所示,在低频(100 Hz附近)时,皮肤阻抗幅值均值(兆欧级)比活性皮肤层(千欧级)大3个数量级;在高频时,皮肤阻抗幅值虽然大幅下降(千欧级),但仍比活性皮肤层大。总体上,皮肤幅值在100~107Hz的频率区间内以-20 dB/dec的斜率由数十兆欧下降到数百欧,即频率每上升10倍,其幅值下降为原值的1/10,见图2(a)。而活性皮肤层的幅值随着频率增大按两种斜率下降:40~103Hz之间的下降斜率约为-10 dB/dec,而103~107Hz之间的下降斜率约为-3 dB/dec,如图2(c)所示。皮肤和活性皮肤层相位差别很大。皮肤相位随频率增大呈现V型曲线,如图2(b)所示:在100~104Hz的频率间,其数值以-15°/dec的斜率由-45°下降到-80°;随后在104~106Hz间,以10°/dec的斜率由-80°上升到-60°;最终106Hz以后稍有下降。而活性皮肤层相位随频率增大呈现Π型曲线,如图2(d)所示:在104Hz之前,其数值以22.5°/dec的斜率快速上升,随后104~106Hz间,其稳定在-10°~20°之间,最终在106~107Hz间有明显的下降。图2(e)、(f)分别表示不同小鼠间的皮肤和活性皮肤层的幅值在100~107Hz十倍频程间的Box-Whisker图。由该图可知,皮肤和活性皮肤层的幅值标准差都与其均值的量级相当,即幅值越大的数据偏离均值的程度越高;随着频率的升高,无论皮肤还是活性皮肤层,其标准差显著下降。此外,相同频率下皮肤的标准差大于活性皮肤层的标准差。例如,100 Hz时,皮肤和活性皮肤层的标准差分别为1.06×106Ω和2.5×103Ω,两者差与其均值差相当(都是约1000倍以上);但当频率上升到107Hz以上时,皮肤和活性皮肤层的标准差间的差距减小,其标准差分别为159和102 Ω,如表2所示。
表1 皮肤与活性皮肤层幅值在不同频率点的均值对比和活性皮肤层对皮肤的占比比值
Tab.1 Mean impedance of the whole skin and viable skin and their ratio

频率/Hz皮肤阻抗/Ω活性皮肤层阻抗/Ω占比/%1004.93×1069.50×1030.191036.03×1052.58×1030.431047.55×1041.53×1032.031059.49×10396610.181061.67×10356133.5310745439586.84
表2 皮肤与活性皮肤层在500 mV和所有不同激励下阻抗的标准差在不同频率点的对比
Tab.2 Amplitude of the whole skin and viable skin under 500 mV versus under all conditions

频率/Hz皮肤阻抗标准差/Ω活性皮肤层阻抗标准差/Ω500mV全部激励条件下500mV全部激励条件下1001.06×1071.99×1062.50×1032.05×1031031.08×1068.41×1047802641041.14×1053.85×10342472.61051.24×10443422535.81061.69×10366.715014.81071595.371028.16

图3 所有激励下的小鼠背部皮肤阻抗幅值和相位频谱以及测量数据离散程度。(a)皮肤幅值频谱;(b)皮肤相位频谱;(c)活性皮肤层幅值频谱;(d)活性皮肤层相位频谱;(e)皮肤在100~107 Hz十倍频程间的Box-Whisker图;(f)活性皮肤层在100~107 Hz十倍频程间的Box-Whisker图Fig.3 Amplitude and phase spectrums under all stimulations and their discreteness.(a) Amplitude spectrum of the whole skin;(b) Phase spectrum of the whole skin;(c) Amplitude spectrum of the viable skin;(d) Phase spectrum of the viable skin; (e) Box-whisker plot of amplitude of the whole skin on decade frequencies from 100 Hz to 107 Hz;(f) Box-whisker plot of amplitude of the viable skin on decade frequencies from 100 Hz to 107 Hz
图3显示了不同激励下的小鼠背部皮肤阻抗的幅值、相位频谱和阻抗均值及数据离散度,(a)、(b)分别为皮肤的幅值和相位频谱,(c)、(d)分别为活性皮肤层的幅值和相位频谱,其中不同线形分别表示不同刺激条件下的数据,六角形点线表示幅度和相位的均值。如图3(a)、(b)所示,不同激励条件下的皮肤和活性皮肤层的幅值和相位频谱与上述500 mV下的对应频谱形状相似,可以看出电压激励和电流激励的数据之间没有明显差异。低频(100 Hz)时皮肤幅值为活性皮肤层的1 000倍,而在高频(107Hz)时两者的差距几乎为零,如表1所示。频率低于105Hz时,活性皮肤层对皮肤幅值的贡献可以忽略,即皮肤的幅值为活性皮肤层的10倍以上,说明角质层在低频时是皮肤幅值的主要组成部分。在106Hz时,活性皮肤层幅值约为皮肤幅值的1/3。在107Hz时,活性皮肤层的幅值在皮肤中占比达到80%以上。需要注意的是,在活性皮肤层的测量中,当激励到达1 V时,104Hz以下的阻抗幅值明显小于平均值,相位高于平均值。在相位频谱中,如图3(b)、(d)所示,104Hz时,皮肤的相位达到最小,与此同时,活性皮肤层的相位达到最大。皮肤在104Hz之前呈现-20°/dec的下降趋势,相反地,活性皮肤层在相同频段呈现+20°/dec的上升趋势。在104~106Hz的频段,皮肤呈现+10°/dec的上升趋势,而活性皮肤层则基本维持在-15°。在106~107Hz频段,皮肤维持在-60°,而活性皮肤层由-15°下降到-25°。微小信号激励条件下(200、500 μA和10、20 mV),皮肤阻抗相位出现测量误差,因此未绘制;而大信号激励条件下(1 V)与小信号激励下(500 mV或20 mA及以下)活性皮肤层阻抗的幅值和相位差别很大。图3(e)、(f)分别表示不同电刺激参数下皮肤和活性皮肤层的幅值在100~107Hz十倍频程间的Box-Whisker图。对比图2(e)、(f),不同激励条件下,皮肤(见图3(e))和活性皮肤层(见图3(f))幅值间的差异要远远小于不同小鼠间的差异,如表2所示。皮肤和活性皮肤层的幅值离散程度与其幅值数量级相当,且随着频率增加,其离散程度迅速下降。在相同频率下,活性皮肤层与皮肤相比更为收敛。105Hz以上时,不同激励条件下活性皮肤层幅值间的差异可以忽略不计。
通过方差分析,由图4可知,在低频条件下,皮肤层与活性皮肤层的阻抗有显著性差异:在100 Hz时,两者在0.0001水平下有显著性差异;在103Hz时,两者具有显著性差异(P<0.05)。而在高频时(103Hz以上),皮肤阻抗与活性皮肤层阻抗没有显著性差异。
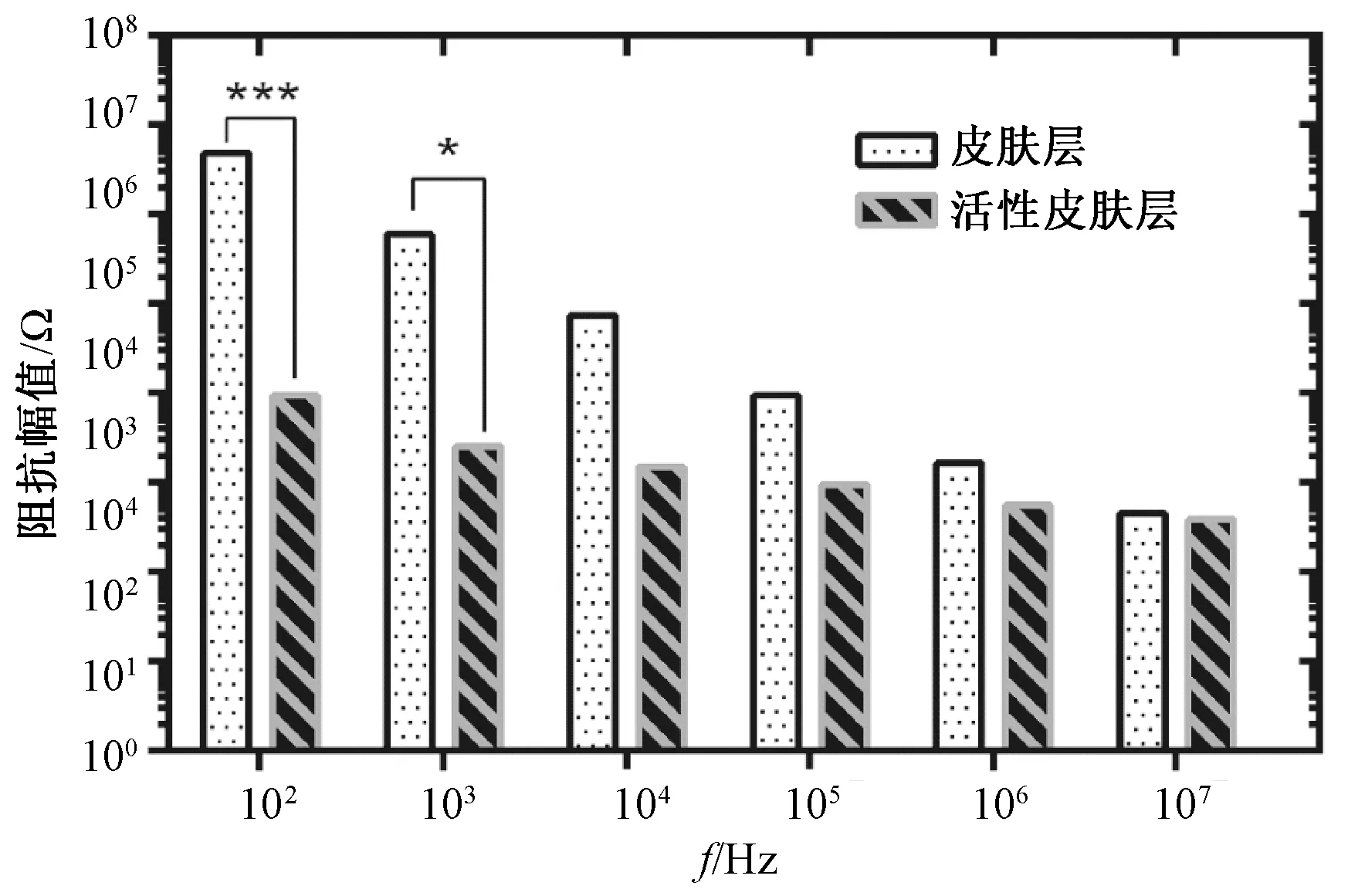
图4 皮肤层与活性皮肤层电阻抗特性在100~107 Hz十倍频程的差异性Fig.4 Data variance of the impedance of skin and viable skin layeron decade frequencies from 100 Hz to 107 Hz.
总体上看:
1)皮肤阻抗幅值在100~107Hz间,呈现-20 dB/dec下降,即频率上升10倍时,其幅值下降为原值的1/10。而活性皮肤层在40~103Hz,幅值呈现-10 dB/dec下降,103Hz之后,幅值呈现-3 dB/dec下降;即在第一频段中,频率每上升10倍,活性皮肤层下降为原值的31.6%,在第二频段中,下降为原值的70.8%。
2)皮肤相位随频率上升呈现V型曲线,先下降再上升,随后略微下降;而活性皮肤层相位呈现Π型曲线,先上升再保持,随后下降。两相位频谱都可以分为3段,两个拐点频率分别为104和106Hz,与α散射和β散射相对应。在104Hz时,皮肤相位达到最小值,而活性皮肤层相位达到最大值。
3)低频时,皮肤阻抗完全由角质层阻抗组成,活性皮肤层的贡献可以忽略不计;当频率为105Hz时,活性皮肤层阻抗占皮肤阻抗的10%多;而在107Hz以上时,活性皮肤层阻抗占皮肤阻抗的80%,如表1所示。
4)在小信号激励条件下(500 mV/cm及以下),皮肤阻抗的测量结果具有较好的一致性,并且与电压或电流的激励模式无关。
5)皮肤阻抗与活性皮肤层阻抗在100 Hz频率下在0.000 1水平下具有显著性差异,在103Hz下具有显著性差异,在103Hz以上没有显著性差异。
3 讨论
皮肤是生物体最大和最特别的器官,其阻抗由电阻和电容组成。由于电容的存在,其阻抗随频率变化较大:低频呈现高阻性,高频呈现较低阻性。在以往的皮肤研究中,由于角质层的存在,常常使用有创的方式。例如,Yamamoto等使用透明胶带不断地去除角质层,在每3次去除后测量一次数据[16]。这种方法创伤非常大,并且很难恢复,不适用于在体测量。本研究首次使用表面电极和银针电极,分别测量皮肤和活性皮肤层频谱,通过对比研究包含角质层的皮肤阻抗频谱,降低了操作难度,提高了可重复性。另外,在本研究的表面电极数据测量中,电极施加了最小压力,待连续3次测量数据不变时记录该数据,从而保证数据的稳定性。Kalia等使用胶带法去除角质层,发现在低频区(103Hz以下)对角质层进行处理将会极大影响皮肤阻抗,并且去除角质层越多,其皮肤电阻抗越低[17]。本研究的着眼点在于对比完整皮肤与活性皮肤层间电阻抗的差别,因此对皮肤处理的方法仅限于去毛,并未对小鼠皮肤采取打磨和浸润等破坏角质层或影响角质层电阻抗特性的方法。采用银针的优势有三方面:首先,可以保证测量结果中不包含角质层电阻抗,更重要的是,与胶带法相比损伤非常小,几乎可以认为是无创。其次,胶带法不能明确界定角质层是否被完全去除,而使用银针则可以认为角质层的阻抗都被旁路了(由于后者具有巨大的阻抗)。再次,在胶带法去除角质层的过程中,由于对皮肤进行了破坏,会引起皮下组织分泌液体,从而影响测量结果;而使用银针不会出现这种情况,银针插入皮肤既不会引起液体分泌,也不会造成出血,从而保证了数据的稳定可靠。Rosell等的工作只给出了几个频率点的数据[13],而本研究得到了整个频率区间的频谱数据,并且计算了阻抗均值和标准差,用以说明其数据规律性和个体差异性。Martinsen等通过有限元仿真研究,认为角质层的阻抗只有在低频条件下才能测量得到[15];而本研究证明,采用表面电极和银针电极相结合的方法,能在高、中、低3个频段分析角质层的特性。Martinsen等还认为,频率为103Hz以下时,角质层的阻抗占皮肤阻抗的主要部分;而本研究表明,频率在105Hz以下,角质层的阻抗占据皮肤阻抗的90%以上,只有频率达到106Hz以上,活性皮肤层阻抗占比才超过30%。本研究发现,随着频率的变化,皮肤和活性皮肤层相位都发生了较大变化,并且两者变化趋势不同。相位的不同,说明其阻抗中电阻和电容分量的比例不同,其生物物理学基础是不同频率下组织的阻抗不同,从而导致电流经过组织层面不同。本研究的观测结果与之前的研究相一致[14,18-19],其中104Hz和106Hz附近的变化称为α散射和β散射,其生物物理学基础分别为细胞膜的平衡离子极化和细胞膜的界面极化。
皮肤幅值和相位频谱在频率较低时,呈现出不连续性误差,特别是在激励较小时,如200、500 μA和10、20 mV时,由于这4种条件下低频相位出现大于零的数据(皮肤阻抗只有电阻和电容分量,因此其相位必须只能小于零),因此在相位频谱的绘制中,把这4组数据去除了,而在符合相位条件的数据中,小信号激励下的皮肤幅值和相位在103Hz以下仍然有不小的误差。Rosell等对人体皮肤表面不同位置在1~106Hz不同频率点的阻抗测量[13]表明,1~105Hz区域其离散性较强,原因是皮肤角质层的电容在10~40 nF间变化,而角质层电容特性的离散性主因是皮肤含水量,外部环境和对皮肤的处理方式会影响皮肤含水量,小鼠身体含水状态和体质特异性也影响皮肤含水量。尽管对小鼠的饲养环境进行了严格控制,但小鼠个体间的差异仍然是不可避免的。此外,在1 000 mV时,活性皮肤层的幅值和相位与其他刺激条件下的数据有巨大的偏离,呈现出较低的幅值和较大的相位。如图3(c)、(d)所示,在1 V的激励下,104Hz以下的活性皮肤层阻抗幅值和相位明显与平均值不同,幅值较小而相位较大。Schwan在研究组织和细胞溶液的文章中指出,生物阻抗在Hz到GHz频段的线性特性只存在于施加电压小于1 V/cm的情况下[19]。在本研究的测量中,最大施加电压为1 V,电极间距为1 cm,因此本研究结果验证了Schwan的观点,施加电压应该小于1 V/cm。本结果提示,500 mV/cm的激励较为理想,如果激励过大,测量结果会较小;激励过小时,测量结果会不稳定,这种情况在皮肤测量时更明显。在激励达到1 V/cm时,测量的电阻抗幅值数据比均值小很多,而相位比均值大很多,此时激励的大小会显著影响测量结果。
4 结论
通过使用表面电极和银针电极,分别测量不同电压和电流激励条件下的小鼠背部皮肤和活性皮肤层阻抗,对两者进行了实验对比研究,确定了其皮肤与活性皮肤层电阻抗幅值和相位的变化范围及变化趋势,为基于小鼠背部皮肤的电学应用打下了良好的基础。实验结果表明,表面电极与银针电极相结合是一种有效分析角质层在皮肤阻抗中作用的方法。由于实验条件所限和实验进展要求,本次实验中仍有许多亟待改进的地方。例如,皮肤表面不同的处理方法下其结果的差异,不同表面电极形状对实验结果的影响,不同表面电极压力对实验结果的影响,这些问题有待进一步改进和完善。
[1] 宋涛, 霍小林, 吴石增. 生物电磁特性及其应用[M]. 北京:北京工业大学出版社, 2008: 91-95.
[2] Cranfield CG, Cornell BA, Grage SL, et al. Transient potential gradients and impedance measures of tethered bilayer lipid membranes: pore-forming peptide insertion and the effect of electroporation[J]. Biophys J, 2014,106(1): 182-189.
[3] Fry CH, Salvage SC, Manazza A, et al. Cytoplasm resistivity of mammalian atrial myocardium determined by dielectrophoresis and impedance methods[J]. Biophys J, 2012,103(11): 2287-2294.
[4] Di Biasio A, Ambrosone L, Cametti C. The dielectric behavior of nonspherical biological cell suspensions: an analytic approach[J]. Biophys J, 2010,99(1): 163-174.
[5] Halter RJ, Hartov A, Poplack SP, et al. Real-time electrical impedance variations in women with and without breast cancer[J]. IEEE Trans Med Imaging, 2015,34(1): 38-48.
[6] Aberg P, Nicander I, Hansson J, et al. Skin cancer identification using multifrequency electrical impedance - A potential screening tool[J]. IEEE Tran Biomed Eng, 2004,51(12): 2097-2102.
[7] Keren H, Burkhoff D, Squara P. Evaluation of a noninvasive continuous cardiac output monitoring system based on thoracic bioreactance[J]. Am J Physiol Heart Circ Physiol, 2007,293(1): H583-H589.
[8] Yu Cheuk-Man, Wang Li, Chau E, et al. Intrathoracic impedance monitoring in patients with heart failure: correlation with fluid status and feasibility of early warning preceding hospitalization[J]. Circulation, 2005,112(6): 841-848.
[9] Corley A, Caruana LR, Barnett AG, et al. Oxygen delivery through high-flow nasal cannulae increase end-expiratory lung volume and reduce respiratory rate in post-cardiac surgical patients[J]. Br J Anaesth, 2011,107(6): 998-1004.
[10] Vardavas CI, Anagnostopoulos N, Kougias M, et al. Short-term pulmonary effects of using an electronic cigarette: impact on respiratory flow resistance, impedance, and exhaled nitric oxide[J]. Chest, 2012,141(6): 1400-1406.
[11] De Miguel-Etayo P, Moreno LA, Santabarbara J, et al. Anthropometric indices to assess body-fat changes during a multidisciplinary obesity treatment in adolescents: EVASYON Study[J]. Clin Nutr, 2015,34(3): 523-528.
[12] Gatterer H, Schenk K, Laninschegg L, et al. Bioimpedance identifies body fluid loss after exercise in the heat: a pilot study with body cooling[J]. PLoS ONE, 2014,9(10): e109729.
[13] Rosell J, Colominas J, Riu P, et al. Skin impedance from 1 Hz to 1 MHz[J]. IEEE Trans Biomed Eng, 1988,35(8): 649-651.
[14] Gabriel C, Gabriel S, Corthout E. The dielectric properties of biological tissues: I. Literature survey[J]. Phys Med Biol, 1996,41(11): 2231-2249.
[15] Martinsen ØG, Grimnes S, Haug E. Measuring depth depends on frequency in electrical skin impedance measurements[J]. Skin Research and Technology, 1999,5(3): 179-181.
[16] Yamamoto T, Yamamoto Y. Electrical properties of the epidermalstratumcorneum[J]. Med Biol Eng, 1976,14(2): 151-158.
[17] Kalia YN, Pirot F, Guy RH. Homogeneous transport in a heterogeneous membrane: water diffusion across humanstratumcorneumin vivo[J]. Biophysical Journal, 1996, 71(5): 2692-2700.
[18] Pethig R, Kell DB. The passive electrical-properties of biological-systems - their significance in physiology, biophysics and biotechnology[J]. Phys Med Biol, 1987,32(8): 933-970.
[19] Schwan HP. Electrical properties of tissues and cell suspensions: mechanisms and models[C]// Proceedings of the 16th Annual International Conference of the IEEE EMBS. Baltimore: IEEE, 1994: A70-A71.
Experimental Study oninvivoImpedance Spectrums of Mice′s Back Skin
Li Ying1Song Bing2Liu Zhipeng1Yin Tao1#*
1(InstituteofBiomedicalEngineering,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Tianjin300192,China)2(SchoolofDentistry,CollegeofBiomedicalandLifeSciences,CardiffUniversity,CardiffCF144XY,UK)
Different from other tissues, it is difficult to study the impedance ofstratumcorneumregarding skin as a whole subject, due to its huge impedance. The aim of this work is to non-invasively examine the characteristics of the impedance of mice’s back skin includingstratumcorneuminvivo. Using Agilent 4294A impedance analyzer, impedance spectrums of the back skin of 15 C57BL/6 mice under anesthesia were measured, and surface electrodes and acupuncture needles were used to record data as the whole skin and viable skin respectively. Along with the increase of frequency, the amplitude of impedance of the whole skin declined at the rate of -20 dB/dec within all the frequency span from 40 Hz to 107Hz; whereas that of the viable skin decreased at -10 dB/dec in the range of 40 Hz to 103Hz, and at -3 dB/dec in the range of 103Hz to 107Hz. The phase of the whole skin decreased and then increased in a V-shape curve, and that of viable skin varied as a Π-shape curve. At low frequencies, such as 100 Hz, the whole skin impedance can be regarded as only consisting of the impedance ofstratumcorneum, and the viable skin part can be omitted. At medium frequencies, such as 105Hz, the viable skin contributes over 10% to the whole skin impedance. However, at high frequencies, such as 107Hz, the viable skin contributed over 80% to the whole skin impedance. The impedance of the whole skin and viable skin showed significant difference below 103Hz (P<0.05) and no significant difference over 104Hz. The results showed that this novel method that comparing the impedance recorded by surface electrodes and acupuncture needles was effective in the analysis of the impedance ofstratumcorneumwithin the whole skin impedance.
mice; skin;stratumcorneum; impedance;invivo
10.3969/j.issn.0258-8021. 2017. 02.007
2016-07-19, 录用日期:2016-10-15
国家自然科学基金仪器专项(81127003);国家自然科学基金(81171424)
R318
A
0258-8021(2017) 02-0172-08
# 中国生物医学工程学会高级会员(Senior member, Chinese Society of Biomedical Engineering)
*通信作者(Corresponding author),E-mail: bme500@163.com

