基于全局排序模式同步的多通道脑电同步特性分析
崔 冬 蒲伟婷 李小俚 王 磊 尹世敏 边志杰
1(燕山大学信息科学与工程学院,河北 秦皇岛 066004)2(北京师范大学认知神经科学和学习国家重点实验室,北京 100875)3(中国人民解放军火箭军总医院神经内科,北京 100088)
基于全局排序模式同步的多通道脑电同步特性分析
崔 冬1*蒲伟婷1李小俚2王 磊3尹世敏3边志杰3
1(燕山大学信息科学与工程学院,河北 秦皇岛 066004)2(北京师范大学认知神经科学和学习国家重点实验室,北京 100875)3(中国人民解放军火箭军总医院神经内科,北京 100088)
脑电同步是脑功能区域整合的重要表现。基于时间序列的排序模式,提出一种简单易行的多通道脑电信号同步分析方法——全局排序模式同步(GMS)。仿真分析显示,该算比基于加权排序互信息的全局同步因子对弱耦合的检测更为灵敏。对26例遗忘型轻度认知障碍和20例认知功能正常的2型糖尿病患者闭眼静息态的脑电信号,采用基于小波增强的独立分量分析算法进行预处理,将32路脑电信号分为前额、中央区、顶区、枕区、左颞和右颞6个区域进行全局同步分析,并利用独立样本t检验对两组被试之间的人口学特征、神经心理学检查和同步值进行统计分析,利用皮尔森线性相关分析研究各区域同步值和认知功能之间的关系。结果显示,糖尿病轻度认知障碍患者与正常对照组相比,各脑区的全局排序模式同步值均减小,尤其是中央区(P<0.01)、顶区(P<0.05)和枕区(P<0.05)有显著性的降低,且前额(r=0.298,P=0.045)、中央区(r=0.327,P=0.026)、顶区(r=0.32,P=0.03)的全局排序模式同步值均与MOCA得分有显著的正相关性,表明GMS是与认知功能下降相关的脑电特征。
2型糖尿病;轻度认知障碍;全局排序模式同步
引言
老年人认知功能障碍(mild cognitive impairment, MCI)是介于正常老年和轻度痴呆之间的一种认知损伤状态,严重影响老年人的正常生活。糖尿病的发病率逐年增加,尤其是2型糖尿病;研究显示,糖尿病是老年认知功能障碍的独立危险因素[1-2]。Cukierman等指出,糖尿病患者发生MCI的概率是非糖尿病患者的1.2~1.5倍,前者发生痴呆的风险是后者的1.6倍[3]。与同年龄和性别相匹配的老年人群相比, MCI 人群发展成老年痴呆症(Alzheimer′s disease, AD)的转换率要高几十倍[4-5]。研究与糖尿病MCI相关的脑电特征,有利于早期诊断,针对 MCI 具有危险因素的高发人群早期进行预防,减缓或逆转痴呆的脑功能损害,对于改善老年人生活质量、减轻家庭和社会的负担具有重要意义。
近年来,EEG信号同步特性的研究表明,MCI和AD患者脑电信号同步强度出现异常。MCI患者较正常人在额顶的一致性降低,额区的delta频段和颞区的delta到alpha3 频段一致性提高[6]。遗忘型轻度认知障碍(amnesic mild cognitive impairment, aMCI)患者,额区、额-颞区、额-顶区在delta和theta频段的相位滞后指数明显下降[7]。AD患者的全局区域同步(global field synchronization, GFS)值在beta1、beta2、beta3和全频段(1~70 Hz)都要低于正常人群,且与MOCA和CDR成正相关[8]。
2002年,学者Bandt和Pompe提出了一种新的时间序列分析方法[9],该方法基于比较序列相邻值,根据特定的事件顺序,把序列描述为一系列排序模式(Motif, M),进而度量序列的复杂性。该方法简单易行,计算速度快,极具鲁棒性,且对非线性单调转换具有不变性。序列的排序模式已被作为一种复杂度测量方法,用于分析脑电信号同步。基于排序模式的同步方法得到广泛的应用,如排序互信息(permutation mutual information, PMI)、排序条件互信息(permutation conditional mutual information,
PCMI)和排序同步算法(motif-synchronization, MS)等[10]。PMI 算法用于分析癫痫发作脑电信号[11],以及分析麻醉大脑活动的动力学特征[12-13]。PCMI算法已经成功用于分析患有破伤风毒素灶癫痫的大鼠海马区CA1和CA3的耦合方向[14]、癫痫患者脑电信号之间的耦合方向性[15],以及糖尿病认知障碍患者EEG的耦合方向性指数[16]。MS算法成功用于分析慢性疼痛病患者的脑电信号[17]。
然而,上述3种算法只能用于双通道脑电信号的同步分析,且PMI算法和PCMI算法计算量大、效率低。基于加权排序互信息的全局同步因子(S-estimator based normalized weighted permutation mutual information, SNWPMI)是一种基于排序模式的多通道脑电同步强度分析算法,它保留信号的幅度信息,对排序模式概率的计算方法进行了改进,但其运算量较大[18]。本研究提出了一种基于排序模式的多通道脑电信号同步分析方法——全局排序模式同步算法 (global motif-synchronization, GMS),比较简单易行,应用GMS算法对糖尿病认知功能障碍的脑电同步特征进行了分析。
1 方法与实验
1.1 全局排序模式同步算法
对于多通道时间序列Zi(k),i=1,…,M,k=1,…,N,其中M为通道数,N为数据长度。首先,将时间序列Zi(k)的任意两通道Zi(i=1,…,M)和Zj(j=1,…,M)嵌入到m维相空间中,得到向量VZi(v)=(Zi(v),Zi(v+τ),…,Zi(v+(m-1)τ))和VZj(v)=(Zj(v),Zj(v+τ),…,Zj(v+(m-1)τ)),其中,v=1,2,…,L,向量个数L=N-(m-1)τ,m和τ分别为嵌入维数和延迟时间。
然后,通过比较向量VZi(v)和VZj(v)的相邻值,将其映射为排序模式,进而将时间序列Zi和Zj转换成排序模式序列MZi和MZj。
图1为排序模式示意,其中(a)为m=3时的所有排序模式,(b)为信号中排序模式的举例,(c)为转换过程,转换公式如下:
MZi(v)=
(1)

图1 排序模式示意。(a)所有排序模式(m=3);(b)信号中的排序模式举例(m=3)(τ=1或=2);(c)时间序列转换成排序模式过程Fig.1 The schematic diagram of ordinal patterns.(a)All of the ordinal patterns(m=3);(b) Example of ordinal patterns(m=3)(τ=1 or=2);(c) The schematic diagram of time series into ordinal patterns
定义c(MZi,MZj)为MZi序列和MZj的不同t延迟序列对应位置出现相同模式的频数的最大值,有
(2)
(3)
式中,延迟时间t∈(0,1,…,tn),tn为考虑的最大延迟,窗长度Lm=L-tn。
类似地,可得cji。进而定义Qij为通道Zi和Zj间的同步强度,表示为
(4)
通过求得多通道时间序列Zi(k)两两通道间的同步强度,获得同步矩阵Q,对Q进行特征值分解Qvi=λivi,得到特征值λ1≤λ2≤…≤λM,对特征值进行归一化,有
(5)
最后,全局排序模式同步算法(globalmotif-synchronization,GMS) 定义为
(6)
1.2 仿真实验
为了验证GMS算法的性能,首先将该方法在洛伦兹混沌模型产生的仿真数据上进行测试。洛伦兹模型如下:
(7)
式中:σ、γ、β为模型参数,(σ,γ,β)=(175,10,8/3);i为通道数目(i=1,…,7);cij为通道j和i之间的耦合强度,cij=1时序列完全相关,cij=0时序列不相关。
为了研究多通道同步算法估计的同步值与模型中cij的关系,令每两个通道之间的耦合系数相同,表示为c,利用模型生成耦合系数c从0到1、步长为0.2的6组多通道耦合时间序列,长度为5 000点。
嵌入维数m和延迟时间τ是两个重要的参数。为了获得神经信号的时间特性,选取过大的m将会使时间信息丢失,且为了保证每种可能的联合模式出现,m的选取需要满足L>m!×m!×m!,Bandt等人建议嵌入维数m=3,…,7[9],对于严重非平稳的EEG序列,本研究取m=3。若延迟时间τ过小,所得的空间向量将会包含过多的冗余信息,但若τ过大,空间向量则不具有相关性,最终致使信息丢失,因此本研究取常用值τ=1。

图2 GMS和SNWPMI值随耦合系数的变化Fig.2 The values of GMS and SNWPMI change with the coupling coefficient
图2为GMS算法和SNWPMI算法估计的同步强度值随c变化的关系曲线,其中SNWPMI算法参数选取与GMS算法相同。可以看出,GMS值与SNWPMI值均随c的增大而增大,较能反映多通道信号间的同步强度,且GMS值在耦合系数c较小时即能检测到同步,对弱耦合的检测更为灵敏。
1.3 糖尿病aMCI多通道脑电同步分析
1.3.1 资料
选取在二炮总医院神经内科就诊的2型糖尿病患者46例,符合aMCI纳入标准和排除标准[19],记录患者的基本人口特征和神经心理学得分情况。依据MOCA得分对患者进行分组,MOCA分数<26为糖尿病轻度认知障碍组(aMCI组,26例),MOCA分数≥26为对照组(对照组,20例)。使用SPSS 20.0软件中独立样本t检验分析,对两组患者的基本人口特征和神经心理学进行统计分析,计量资料以均值±标准差的形式表示,结果如表1所示。可以看出,两组患者在人口统计中没有存在显著差异,即年龄、性别、受教育程度等方面是匹配的。两组患者在神经心理学检查统计的MMSE得分、MOCA得分、AVLT-即刻回忆、AVLT-30min延迟回忆、AVLT-长延迟再认、语言流畅性测试和日常生活能力FAQ等方面存在显著差异(即P<0.05),而在Boston命名测试、轨迹测试A与B、WAIS数字广度测试方面均无显著差异。在记忆、语言和日常生活等方面,对照组的能力比aMCI组强。
表1 人口学特征和神经心理学检查统计结果
Tab.1 The results of demographic characteristics and neuropsychological examination

因素aMCI组对照组P值年龄69.30±8.64368.55±9.7520.782受教育程度13.19±3.44112.95±2.7040.797MMSE27.53±2.46928.70±1.0800.039*MOCA21.50±2.94226.75±1.0190.000***AVLT-即刻回忆5.43±2.1366.95±1.6480.012*AVLT-30分钟延迟回忆4.48±4.3318.25±2.7310.001**AVLT-长延迟再认10.80±3.73013.25±1.5170.005**Boston命名测试18.25±4.05619.70±0.4700.120语言流畅性测试14.87±4.59917.55±3.0510.032*轨迹测试A61.40±24.67958.36±20.4100.666轨迹测试B110.28±55.228105.78±42.0210.769WAIS数字广度测试11.76±2.65013.25±2.6720.069日常生活能力(FAQ)2.32±4.2490.30±1.1280.030*
注:与对照组相比,*表示P<0.05,**表示P<0.01,***表示P<0.001。
Note: Compared with the control,*indicatesP<0.05,**indicatesP<0.01,***indicatesP<0.001.
1.3.2 EEG数据采集与预处理
脑电信号采用EGI的GES300型128通道脑电记录仪来记录,试者处于闭眼静息状态进行静息EEG数据采集,以双侧乳突为参考电极,采样频率500 Hz,时长5 min,通过0~200 Hz带通滤波,阻抗小于50 kΩ。本研究采用基于小波增强的独立分量分析算法[20-21]对EEG信号进行预处理,去除眼电以及一些其他的外界干扰。
1.3.3 数据分析
从采集到的脑电信号中选择出32道电极信号,分成6个大脑区域,分别为前额(frontal, F)、中央区(central, C)、顶区(parietal, P)、枕区(occipital, O)、左颞(left temporal, LT)、右颞(right temporal, RT),如图3所示。嵌入维数为3,延迟时间为1,数据长度为5 s。首先计算各脑区所有的GMS/SNWPMI值同步强度值,剔除超出均值±3倍标准方差的异常值,最后求得均值即为各脑区信号的同步强度。利用SPSS 20.0统计软件对数据进行统计分析处理,两组间的比较采用独立样本t检验,P<0.05认为差异有统计学意义。为了进一步分析同步特性与认知功能障碍之间的关系,采用皮尔森线性相关,分析了所有患者GMS/SNWPMI值与神经心理学测试得分的相关性。

图3 大脑分区Fig.3 The brain regions of interest
2 结果
aMCI组与对照组各脑区的全局同步强度GMS和SNWPMI值的统计结果如图4所示,*表示P<0.05,**表示P<0.01。可以看出,两种算法aMCI组的同步强度值普遍低于对照组。GMS值在中央区、顶区和枕区显著低于对照组,SNWPMI值在中央区和枕区显著低于对照组。二者结果较为一致,GMS的值更为显著。
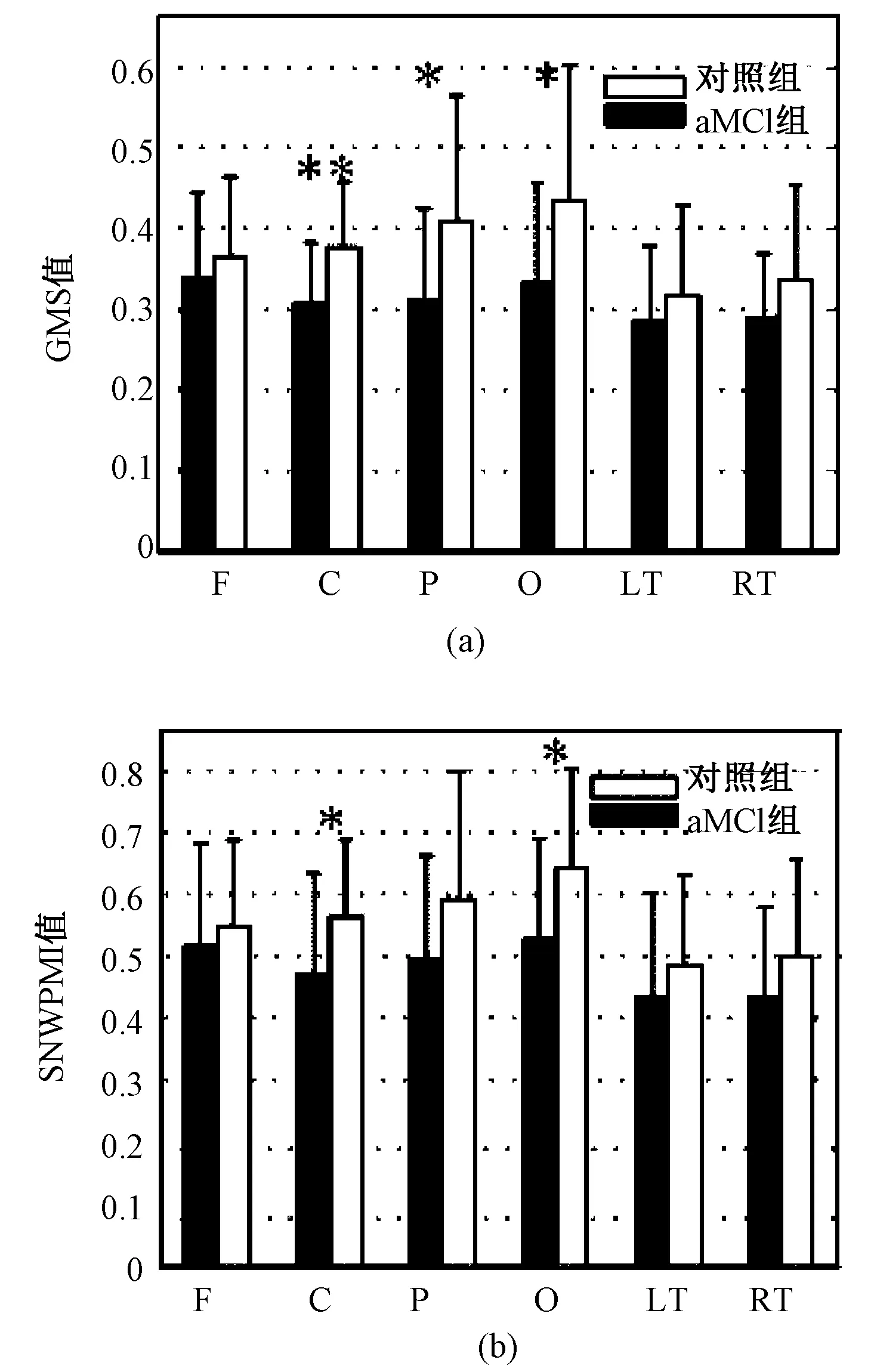
图4 aMCI组与对照组各脑区同步值。(a)GMS值;(b)SNWPMI值Fig.4 The synchronization value of aMCI group and control group in brain regions. (a)GMS values; (b)SNWPMI values
同步特性与认知功能障碍间的关系如图5所示,GMS同步强度值在前额、中央区、顶区均与MOCA得分存在显著的正相关性。SNWPMI同步强度值在前额正比于MMSE值,且前额、中央区和左颞的SNWPMI同步强度值也均与语言流畅性测试得分存在显著的正相关性,二算法相关性分析结果的差异较大。

图5 神经心理学量表与同步值线性分析结果。(a)前额GMS值与MOCA;(b)中央区GMS值与MOCA;(c)顶区GMS值与MOCA;(d)前额SNWPMI值与MMSE;(e) 前额SNWPMI值与语言流畅性;(f) 中央区SNWPMI值与语言流畅性;(g) 左额SNWPMI值与语言流畅性Fig.5 The results of linear analysis of neuropsychological scale and synchronization value.(a)Frontal GMS values and MOCA;(b)Central GMS values and MOCA;(c) Parietal GMS values and MOCA;(d) Frontal SNWPMI values and MMSE;(e) Frontal SNWPMI values and semantic fluency; (f) Central SNWPMI values and semantic fluency; (g) Left temporal SNWPMI values and semantic fluency
3 讨论
本研究基于时间序列的排序模式,提出了全局排序模式同步算法GMS。该算法通过度量各时间序列排序模式的相关性,构造同步矩阵,进一步量化全局同步强度,算法比排序互信息等简单易行,鲁棒性强。仿真实验显示,该算法可以跟踪洛伦兹混沌模型产生的多通道序列耦合强度的变化,反映多通道信号间的同步强度, 较基于加权排序互信息的全局同步因子对弱耦合的检测更具灵敏性。
应用GMS算法对2型糖尿病轻度认知障碍患者的脑电同步特征进行研究,发现aMCI组各脑区的全局排序模式同步值普遍低于对照组,在前额、中央区、顶区尤其显著;在对所有患者的神经性心理学测试得分和GMS值进行相关性分析中,检测出前额、中央区、顶区的GMS同步强度值均与MOCA得分存在显著的正相关性。GMS同步强度值的结果与SNWPMI一致,但相关性分析方面二者结果差异较大,SNWPMI同步强度值主要与患者的语言流畅性有关,与SNWPMI算法考虑了信号幅度的影响有关[18]。Lee等利用全局同步索引算法,分析了AD患者(25名)和年龄匹配的对照组(22名)18通道的脑电信号,发现AD患者在beta1(13~18 Hz)、beta2(19~21 Hz)、beta3(22~30 Hz)和gamma(31~50 Hz)频段同步强度值要显著低于对照组,所有患者的同步值与MMSE评分在beta和gamma频段正相关[22]。Park等应用全局区域同步算法,发现AD患者的同步值在beta1(13~18 Hz)、beta2(19~21 Hz)、beta3(22~30 Hz)和全频段(1~70 Hz)低于对照组,在beta1、beta3和全频段上与MMSE正相关[23]。全局耦合索引算法被用于分析12名MCI和12名对照组的EEG信号,发现MCI患者的脑电同步强度普遍低于对照组的脑电同步强度,尤其在alpha(8~12 Hz)、beta1(13~18 Hz)和beta2(19~21 Hz)频段上,MCI患者的同步值在alpha频段上与MMSE和MOCA得分正相关[24]。Jeong等利用互信息方法,研究发现AD患者大脑中相隔较远的脑区之间互信息比健康人群存在一定程度的降低[25]。2型糖尿病aMCI患者在枕区alpha频段的一致性与对照组相比显著下降,且与MOCA得分呈显著的正相关性[26]。以上结果与本结果具有一致性。
EEG信号同步已经成为评估和诊断MCI和AD的一种重要手段,本研究提出新的全局排序模式同步算法,简单有效,分析了具有糖尿病的aMCI与认知功能正常的控制组的全局排序同步特征,发现全局同步值降低,且与MOCA得分正相关,指出GMS是与糖尿病患者认知能力下降相关的EEG特征。
4 结论
本研究基于时间序列的排序模式,提出了一种多通道脑电信号同步分析方法——全局排序模式同步。仿真结果显示,该算法能够准确地反映多通道信号间的同步强度。进而将其用于分析全局糖尿病aMCI脑电信号,发现两组人群脑电信号同步值存在显著差异,aMCI组的GMS值普遍低于对照组,特别是在中央区、顶区和枕区。对同步与认知功能的皮尔森线性相关分析发现,前额、中央区、顶区的GMS同步强度值均与MOCA得分存在显著的正相关性,表明GMS是与认知功能下降相关的脑电特征。
[1] Chen Ruihua, Jiang Xiaozhen, Zhao Xiaohui, et al. Risk factors of mild cognitive impairment in patients with type 2 diabetes[J]. Chinese General Practice, 2012, 15(24): 2758-2761.
[2] 李敏, 张丽, 王敏哲. 老年2型糖尿病与轻度认知功能障碍的关系研究[J]. 中国全科医学, 2011, 14(5):1537-1539.
[3] Cukierman T, Gerstein HC, Williamson JD. Cognitive decline and dementia in diabetes-systematic overview of prospective observational studies[J]. Diabetologia, 2006, 48(12): 2460-2469.
[4] D’Amelio M, Rossini PM. Brain excitability and connectivity of neuronal assemblies in Alzheimer’s disease: From animal models to human findings[J]. Progress in Neurobiology, 2012, 99(1): 42-60.
[5] Davatzikos C, Bhatt P, Shaw LM, et al. Prediction of MCI to AD conversion, via MRI, CSF biomarkers, and pattern classification[J]. Neurobiology of Aging, 2011, 32(12): 2322.e19-e27.
[6] Moretti D, Frisoni GM, Rosini S, et al. Cerebrovascular disease and hippocampal atrophy are differently linked to functional coupling of brain areas: an EEG coherence study in MCI subjects[J]. Journal of Alzheimers Disease Jad, 2008, 14(3):285-299.
[7] Tóth B, File B, Boha R. EEG network connectivity changes in mild cognitive impairment-preliminary results[J]. International Journal of Psychophysiology, 2014, 92(1): 1-7.
[8] Ma CC, Liu AJ, Liu AH, et al. Electroencephalogram global field synchronization analysis: a new method for assessing the progress of cognitive decline in Alzheimer’s disease[J]. Clinical Eeg & Neuroscience, 2014, 45(2):98-103.
[9] Bandt C, Pompe B. Permutation entropy: A natural complexity measure for time series[J]. Physical Review Letters, 2002, 88(17): 174102.
[10] Li Xiaoli, Ouyang Gaoxiang. Estimating coupling direction between neuronal populations with permutation conditional mutual information[J]. Neuroimage, 2010, 52: 497-507.
[11] Li Hongli, Wang Jiang, Deng Bin, et al. Analysis of mutual information and synchronism for epileptic EEG signals[J]. Computer Engineering and Applications, 2013, 49(6): 19-22.
[12] Liang Zhenhu, Liang Shujuan, Wang Yinghua, et al. Tracking the coupling of two electroencephalogram series in the isoflurane and remifentanil anesthesia[J]. Clinical Neurophysiology Official Journal of the International Federation of Clinical Neurophysiology, 2014, 126(2): 412-422.
[13] Liang Zhenhu, Wang Yinghua, Ouyang Gaoxiang, et al. Permutation auto-mutual information of electroencephalogram in anesthesia[J]. Journal of Neural Engineering, 2013, 10(2): 516-522.
[14] Li Xiaoli, Ouyang Gaoxiang. Estimating coupling direction between neuronal populations with permutation conditional mutual information[J]. Neuro Image, 2010, 52: 497-507.
[15] Li Jing, Liu Xianzhen, Ouyang Gaoxiang. Permutation conditional mutual information and its application to epileptic EEG[C]// Proceedings of the 2013 International Conference on Computer Sciences and Applications. 2013:733-736.
[16] Wen Dong, Bian Zhijie, Li Qiuli, et al. Resting-state EEG coupling analysis of amnestic mild cognitive impairment with type 2 diabetes mellitus by using permutation conditional mutual information[J]. Clinical Neurophysiology, 2015, 127(1):335-348.
[17] Rosário RS, Cardoso PT, Muoz MA. Motif-synchronization: a new method for analysis of dynamic brain networks with EEG[J]. Physica A Statistical Mechanics & Its Applications, 2015, 439: 7-19.
[18] Cui Dong, Pu Weiting, Liu Jing, et al. A new EEG synchronization strength analysis method: S-estimator based normalized weighted-permutation mutual information[J]. Neural Networks, 2016,82, 30-38.
[19] 崔冬, 刘静, 边志杰, 等. 2型糖尿病患者轻度认知障碍多通道同步性分析[J]. 生物医学工程学杂志, 2015, 32(2): 279-283.
[20] Castellanos NP, Makarov VA. Recovering EEG brain signals: artifact suppression with wavelet enhanced independent component analysis[J]. Journal of Neuroscience Methods, 2006, 158(2): 300-312.
[21] Akhtar MT, Mitsuhashi W, James CJ. Employing spatially constrained ICA and wavelet denoising, for automatic removal of artifacts from multichannel EEG data[J]. Signal Processing, 2012, 92(2): 401-416.
[22] Lee SH, Park YM, Kim DW. Global synchronization index as a biological correlate of cognitive decline in Alzheimer's disease[J]. Neuroscience Research, 2010, 66(Suppl 1): 333-339.
[23] Park YM, Che HJ, Im CH, et al. Decreased EEG synchronization and its correlation with symptom severity in Alzheimer's disease[J]. Neuroscience Research, 2008, 62(2): 112-117.
[24] Wen Dong, Xue Qing, Lu Chengbiao, et al. A global coupling index of multivariate neural series with application to the evaluation of mild cognitive impairment[J]. Neural Networks, 2014(56): 1-9.
[25] Jeong J, Gore JC, Peterson BS. Mutual information analysis of the EEG in patients with Alzheimer's disease[J]. Clinical Neurophysiology Official Journal of the International Federation of Clinical Neurophysiology, 2001, 112(5):827-835.
[26] Bian Zhijie, Li Qiuli, Wang Lei, et al. Relative power and coherence of EEG series are related to amnestic mild cognitive impairment in diabetes[J]. Frontiers in Aging Neuroscience, 2014, 6:1-9.
Global Motif-Synchronization Based Multivariate EEG Synchronization Analysis
Cui Dong1*Pu Weiting1Li Xiaoli2Wang Lei3Yin Shimin3Bian Zhijie3
1(SchoolofInformationScienceandEngineering,YanshanUniversity,Qinhuangdao066004,Hebei,China)2(StateKeyLaboratoryofCognitiveNeuroscienceandLearning&IDG/McGovernInstituteforBrainResearch,BeijingNormalUniversity,Beijing100875,China)3(DepartmentofNeurology,TheRocketForceGeneralHospitalofPLA,Beijing100088,China)
EEG synchronization is considered to be the performance of brain functional area integration. A time series motif based multi-channel synchronization method——global motif-synchronization (GMS) was proposed in this study. The simulation analysis indicated that the new algorithm was more sensitive than S-estimator based normalized weighted permutation mutual information in detection weak coupling. The algorithm was used to analyze the EEG synchronization of 26 amnesic MCI and 20 normal controls of patients with diabetes in eye-closed resting state. The wavelet enhanced independent component analysis was used to eliminate artifacts. The 32-channels EEG was divided to frontal, central, parietal, occipital, left temporal and right temporal region respectively. The independent samplest-testwas performed to test differences in demographic characteristics, neuropsychology and regional synchronization values between two groups. The Pearson’s linear correlation was used to study the associations between regional synchronization values and cognitive functions. The results showed that GMS values in each brain region of diabetes patients with MCI were lower than that of control group. Especially, the GMS values decreased significantly in central (P<0.01), parietal (P<0.05) and occipital (P<0.05) regions. The MOCA scores and GMS value had a significant positive correlation in frontal (r=0.298,P=0.045), central (r=0.327,P=0.026) and parietal (r=0.32,P=0.03) regions. The GMS is an important EEG characteristic that is correlated with cognitive function impairment.
type 2 diabetes; mild cognitive impairment; global motif-synchronization
10.3969/j.issn.0258-8021. 2017. 02.002
2016-05-30, 录用日期:2016-11-10
国家自然科学基金(61102005,61271142);河北省自然科学基金(F2014203132);河北省高等学校科学技术研究重点项目(ZD2015095)
R318
A
0258-8021(2017) 02-0136-07
*通信作者(Corresponding author),E-mail: cuidong@ysu.edu.cn

