次声对大鼠海马区钙调依赖性蛋白激酶Ⅱ及Tau蛋白表达的影响
蔡丽,王晋,崔尧,张鸽,武松艳,张文东,刘朝晖
次声对大鼠海马区钙调依赖性蛋白激酶Ⅱ及Tau蛋白表达的影响
蔡丽1,王晋2,崔尧3,4,张鸽2,武松艳1,张文东1,刘朝晖1
目的探讨8 Hz、130 dB次声对大鼠海马区钙调依赖性蛋白激酶Ⅱ(CaMKⅡ)及tau蛋白表达的影响。方法56只雄性Sprague-Dawley大鼠随机分为对照组(n=8)、1 d组(n=8)、7 d组(n=8)、14 d组(n=32)。14 d组再分为照射后1 h、6 h、24 h、48 h亚组,每亚组8只。对照组每天次声仓内无次声作用放置2 h,其余各组8 Hz、130 dB次声照射2 h。免疫组织化学、Western blotting和ELISA方法检测各组大鼠海马区磷酸化CaMKⅡ(pT286-CaMKⅡ)及tau蛋白表达。结果14 d组pT286-CaMKⅡ水平最高(F> 14.912,P<0.001),tau蛋白表达最多(F>36.229,P<0.001),7 d组次之(P<0.05)。14 d组中,次声后1 h、6 h,tau蛋白表达最高,24 h有所恢复,但仍较对照组高(P<0.05)。结论8 Hz、130 dB次声作用后,大鼠海马区CaMKⅡ磷酸化水平和tau蛋白表达及磷酸化水平增高,可能参与次声致大鼠学习记忆功能受损。
次声;钙调依赖性蛋白激酶Ⅱ;tau蛋白;学习记忆;海马;大鼠
[本文著录格式]蔡丽,王晋,崔尧,等.次声对大鼠海马区钙调依赖性蛋白激酶Ⅱ及Tau蛋白表达的影响[J].中国康复理论与实践,2017,23(3):298-303.
CITED AS:Cai L,Wang J,Cui Y,et al.Effects of infrasound on expression of calmodulin-dependent protein kinase II and tau protein in hippocampus of rats[J].Zhongguo Kangfu Lilun Yu Shijian,2017,23(3):298-303.
次声波是一种频率<20 Hz,处在人耳可听范围之外的声波,自然界运动(地震、海啸、火山爆发等)和人类生产生活活动(船舶发动、火箭发射、载人航天飞船等)都可产生次声波[1],严重威胁宇航员及相关职业人员的身心健康。
次声波主要通过生物共振的方式对生物体各个器官和组织产生影响。已知人脑的固有频率为8 Hz左右,当次声频率接近8 Hz时,会对人的中枢神经系统(central nervous system,CNS)产生影响。关于次声对CNS的作用机制研究已涉及不同层面,包括神经元凋亡、氧化应激损伤、轴突变性、谷氨酸代谢、海马超微结构、血脑屏障和脑血管、齿状回神经前体细胞增殖、学习记忆、胶质细胞活化和神经系统炎症反应、TRPV4在次声损伤中的作用等[2-14]。
tau蛋白是一种微管相关蛋白(microtubule-associated proteins,MAPs),属于含磷蛋白质,主要分布于大脑的额叶、海马及内嗅区,外周神经系统的含量也较丰富,而小脑中一般分布较少[15]。其正常生理功能是诱导与促进微管蛋白合成微管,并与之结合以维持微管结构和功能的稳定及微管解离,诱导微管成束并促进囊泡运输等物质转运。tau蛋白的过度磷酸化会影响微管稳定性,改变其正常结构,造成神经元间信息传递受阻,进而发展成神经元退行性变和认知障碍[16]。
我们在前期研究中发现,8 Hz、130 dB次声作用一定时间可以导致大鼠海马区Ca2+浓度改变[17]。本研究中观察8 Hz、130 dB次声作用下,大鼠海马细胞内钙调蛋白依赖性蛋白激酶Ⅱ(calmodulin-dependent protein kinaseⅡ,CaMKⅡ)和tau蛋白的表达及其变化规律,并探讨其相关机制。
1 材料与方法
1.1主要仪器与材料
次声压力舱及次声信号检测系统:第四军医大学研制。全自动组织脱水机、组织包埋机、低温恒冷切片机和LEICA LA型全自动光学显微镜:LEICA公司。鼠抗免疫组化试剂盒、鼠抗tau多克隆抗体、辣根过氧化标记的鼠二抗:武汉博士德公司。鼠抗tau单克隆抗体:ABCAM公司。CaMKⅡ苏氨酸-286位点磷酸化(pT286-CaMKⅡ)多克隆鼠抗体:PROMEGA公司)。tau蛋白磷酸化(pSer262-tau)蛋白ELISA试剂盒:ELABSCIENCE公司。
1.2模型制备
健康雄性成年Sprague-Dawley大鼠56只(第四军医大学实验动物中心提供),体质量180~220 g,饲养于安静环境下(基础噪音≤40 dB),自由饮水,标准饲料喂养。将大鼠编号,随机数字表法将大鼠随机分组。暴露于8 Hz、130 dB次声中,每天2 h,按暴露时间分为对照组、1 d组、7 d组、14 d组共4组(对照组在次声仓内无次声放置2 h)。对照组、1 d组、7 d组每组8只;14 d组32只,再分为照射后1 h、6 h、24 h、48 h共4个亚组(n=8)。
1.3检测方法
1.3.1免疫组织化学染色
按预定时间取各时点大鼠,1 d组、7 d组、14 d组照射后1 h内完成灌注取材,14 d组剩下动物按预定作用后不同时间取材。各组随机取4只大鼠,1%戊巴比妥钠20 mg/kg腹腔注射麻醉,生理盐水心内灌注至肝发白(约30 min),换用4℃4%多聚甲醛心内灌注30~40 min(即刻出现肢体与尾部的抖动),触摸肝组织较硬时,停止灌注。剥离脑组织,置4%多聚甲醛固定24 h;冠状切片,厚30 μm左右,放入组织包埋盒中,流动水冲洗2 h;全自动组织脱水机中脱水,石蜡包埋。切片机切成组织薄片(厚3 μm)。加pT286-CaMKⅡ多克隆鼠抗(1∶100)和tau单克隆抗体(1∶100),SAB三步法行免疫组化染色。
LEICA LA型全自动光学显微镜放大400倍观察,1392×1040像素扫描(图像分析软件Simple PCI 5.2)并存档。每个标本随机取4张切片,每张切片在海马细胞层随机取3处面积相同的pT286-CaMKⅡ及tau蛋白阳性表达区域测灰度值,取平均值;再以分子层做被底,随机取3处相同面积区域测灰度值,取平均值;用被底灰度值减去pT286-CaMKⅡ及tau蛋白阳性表达区域的灰度值,得到阳性表达细胞的相对灰度值。每个标本4张切片测得的相对灰度值再取平均值。
1.3.2Western blotting
各组另4只大鼠断头活杀,碘酒、乙醇及生理盐水清洗后,无菌条件下5 min内剥出双侧海马区组织,迅速放入液氮罐内冻存。
BCA法测定蛋白浓度。取预染蛋白Marker 3 μl和蛋白30 μg相对应的体积上样,进行0.1 SDS-聚丙烯酰胺凝胶80 V电泳30 min左右,待出现明显条带时,转换为140 V电压电泳约1 h。将目的蛋白转移到PVDF膜上(300 mA,2 h);室温下用含0.05 BSA的TBST封闭1.5 h;TBST反复冲洗5次,每次5 min;加入鼠抗tau(1∶1000)、鼠抗β-actin(1∶1000)一抗,4℃冰箱过夜。TBST反复冲洗5次,每次5 min,加入相应的辣根过氧化物酶标记的羊抗兔或羊抗鼠二抗(1∶2000),室温下孵育2 h。ECL显色,电泳凝胶成像分析仪采集结果。取目的蛋白灰度值与内参β-actin灰度值之比。
1.3.3ELISA
取冻存的海马组织,预冷PBS冲洗组织上血液,按1∶9提取组织上清液行pSer262-tau ELISA检测。每孔加入标准品和待测样品100 μl,酶标板覆膜,37℃孵育90 min;弃去液体,甩干,每孔加入生物素化抗体工作夜100 μl(使用前15 min内配置),酶标板覆膜,37℃温育1 h;弃去液体,甩干,洗板3次;每孔加入酶结合工作液100 μl(使用前15 min内配置),覆膜,37℃温育30 min;弃去液体,甩干,洗板5次;每孔加入底物溶液(TMB)90 μl,酶标板覆膜,37℃避光孵育15 min左右(根据实际显色情况酌情缩短或延长,当标准孔出现明显梯度时即终止);每孔加入终止液50 μl,终止液加入顺序应与底物溶液加入顺序一致;立即用酶标仪在450 nm波长测量各孔光密度(optical density,OD)。依据标准蛋白浓度梯度得到相应公式,将各组待测蛋白的OD代入公式,得到pS-er262-tau蛋白浓度。
1.4统计学分析
2 结果
2.1免疫组织化学染色
8 Hz、130 dB次声照射后,大鼠海马各亚区(CA1、CA3、DG)均以14 d组pT286-CaMKI及tau蛋白表达最多(P<0.01)。7 d组pT286-CaMKⅡ在CA3区与1 d组和对照组有非常显著性差异(P<0.01),其他区域无显著性差异(P>0.05)。7 d组tau蛋白在各区均与1 d组和对照组有显著性差异(P<0.05)。
14 d组内,各区pT286-CaMKⅡ和tau蛋白表达均在照射后1 h和6 h最高,24 h后有所恢复,但仍较对照组、1 d组、7 d组高(P<0.05)。
见表1~表4,图1~图2。

表1 各组海马pT286-CaMKⅡ水平(相对灰度)
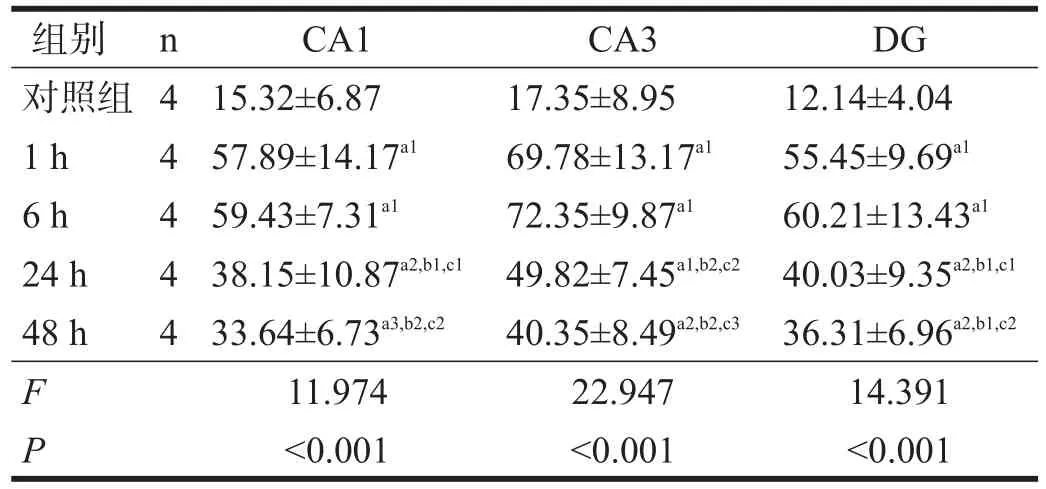
表2 14 d组各亚组海马pT286-CaMKⅡ水平(相对灰度)
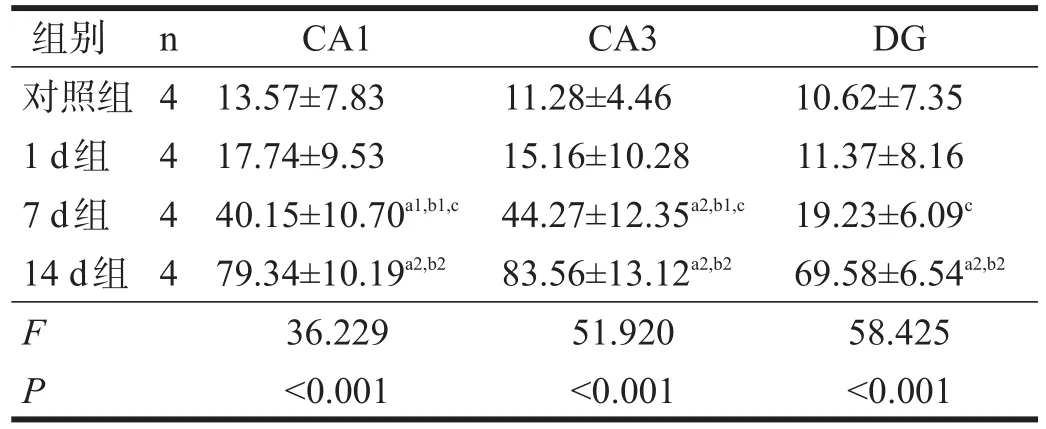
表3 各组海马tau蛋白水平(相对灰度)
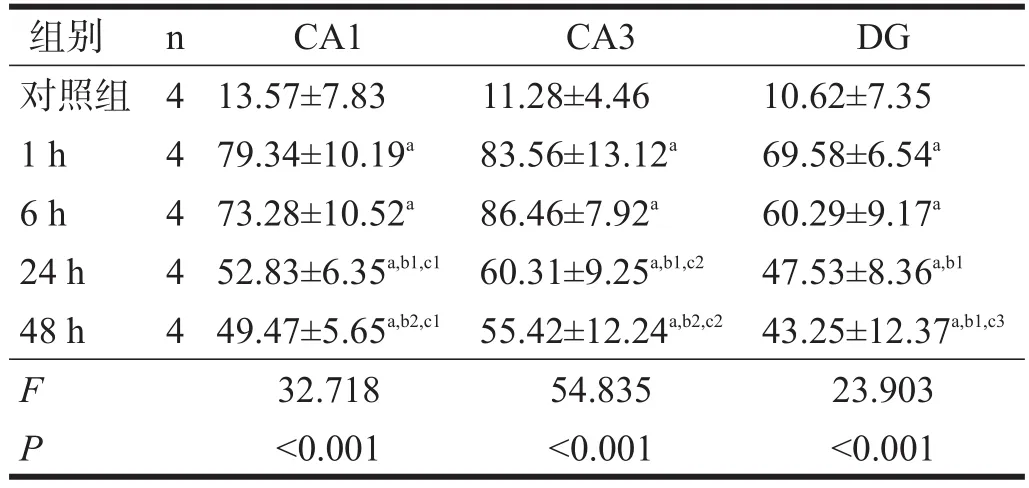
表4 14 d组各亚组海马tau蛋白水平(相对灰度)
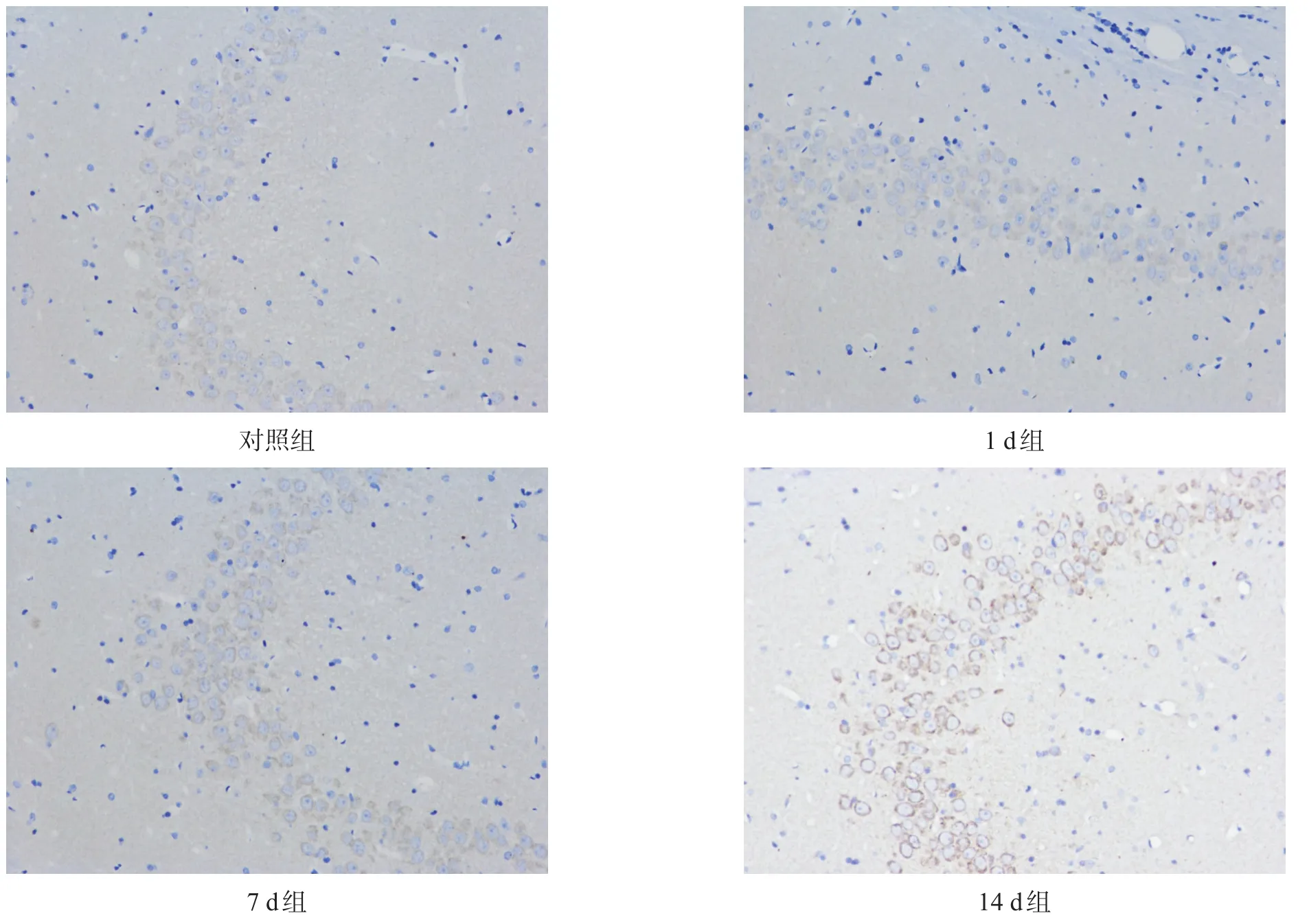
图1 次声照射不同时间大鼠海马区tau蛋白表达(免疫组化染色,200×)
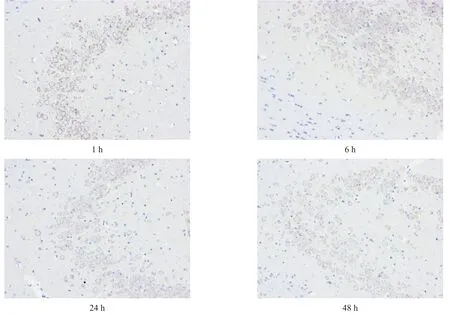
图2 次声照射14 d后不同时间大鼠海马区tau蛋白表达(免疫组化染色,200×)
2.2Western blotting
随次声照射时间延长,大鼠海马区tau蛋白表达增加,各组间均有显著性差异(P<0.05)。见表5。
14 d组内,tau蛋白表达以照射后1 h和6 h最高,24 h有所恢复,但仍高于对照组(P<0.05)。见表6。
2.3ELISA
大鼠海马区pSer262-tau蛋白表达14 d组最高(P< 0.01),其次为7 d组(P<0.05),1 d组与对照组间无显著性差异(P>0.05)。见表5。
14 d组内,pSer262-tau蛋白表达在照射后1 h和6 h最高,24 h有所恢复,但仍高于对照组(P<0.05)。见表6。
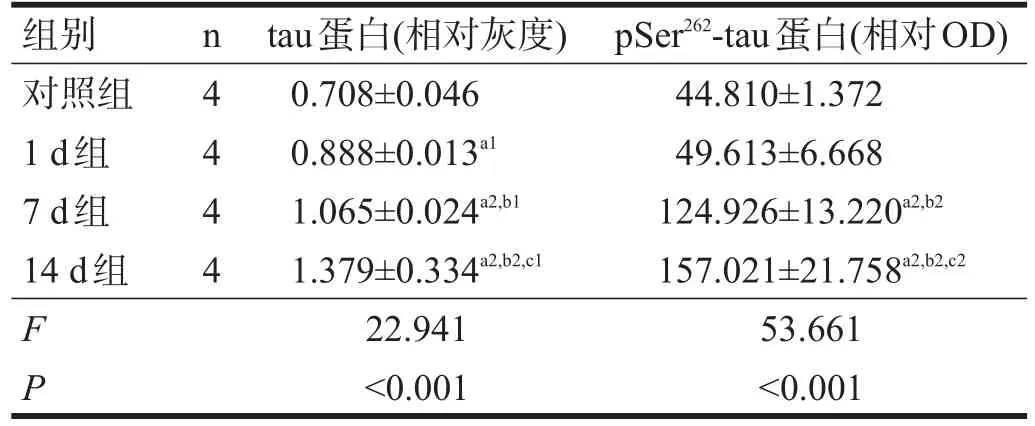
表5 各组海马区tau蛋白及pSer262-tau蛋白表达
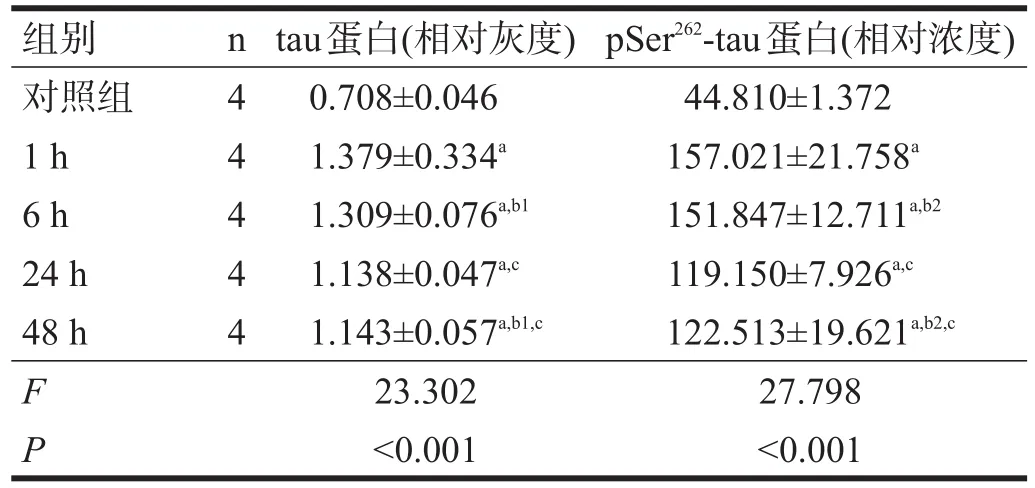
表6 14 d组各亚组海马区tau蛋白及pSer262-tau蛋白表达
3 讨论
tau蛋白作为神经元骨架蛋白之一,广泛存在于神经元胞体及其轴突中,在维持微管结构和功能的稳定性中起重要作用。1975年,Cleveland等首次发现tau蛋白在与微管绑定时会发生磷酸化。tau蛋白的过度磷酸化可以通过降低tau对微管的亲和力、消耗正常tau蛋白和微管相关蛋白,影响微管稳定性,改变微管的正常结构,使之转变为成对螺旋丝(paired helical filaments,PHFs),并以纤维丝团形式堆积在神经元内,形成神经纤维缠结(neurofibrillary tangle,NFT),从而使轴浆运输紊乱,神经递质的运输、释放和重摄取异常,造成神经元间信息传递受阻,最终发展成神经元退行性变和认知障碍[18]。
一定频率和声压级的次声暴露,可以损伤动物的学习记忆功能,减少海马的神经发生,引起神经元轴突变形,并随声压级增高而加重。有研究表明,8 Hz、130 dB次声波作用后,大鼠海马DG区具有增殖能力的前体细胞数目明显下降,水迷宫检测的空间认知能力明显受损[19]。
本研究显示,8 Hz、130 dB次声作用下,大鼠海马tau蛋白水平及其磷酸化水平均随照射时间延长而增加,这与前期实验发现次声作用后大鼠海马区Ca2+浓度升高的时间一致。
CNS中的Ca2+主要作用于轴突的生长,影响正在发育中的神经元的神经分泌活动,神经介质受体蛋白植入细胞膜,以及突触传递;还可以调节神经元的存活、神经元树突和轴突结构发育及突触可塑性,影响神经元回路的形成及学习、记忆等过程。利用钙成像技术观察发现,随着次声波的声压级和刺激时间增长,海马区细胞内Ca2+浓度明显升高,海马区神经元凋亡增多;神经元的凋亡增加时间与海马细胞内Ca2+升高的时间一致[20-21]。这提示海马细胞内Ca2+浓度异常增高或超载在次声所致神经细胞结构和/或功能损伤中可能是一个关键因素。
已知CaMKⅡ是一种较大型具有10个亚单位的酶,是脑内含量最丰富的蛋白激酶,在海马和新皮层的突触后神经元致密层密度最高。该酶的特点是Ca2+依赖的自动磷酸化:当它被Ca2+激活后即进入一种活动状态,此时即使去除Ca2+仍能保持其活性,包括自动磷酸化[22]。本研究显示,8 Hz、130 dB次声作用后,大鼠海马区CaMKⅡ磷酸化水平普遍增高,tau蛋白磷酸化过程也明显增强。
在CNS中,tau蛋白含有多个磷酸化位点,可被多种脯氨酸蛋白激酶和非脯氨酸蛋白激酶催化磷酸化反应。其中CaMKⅡ、糖原合成酶激酶3等被认为是脑内调节tau蛋白磷酸化最重要的蛋白激酶,也是近年来的研究热点[23]。我们推测,次声波可能通过调节CaMKⅡ磷酸化,干扰tau蛋白的正常功能。
体外实验也证实,CaMKⅡ可以使tau蛋白Ser262~Ser356等多个位点磷酸化,这些位点的磷酸化会促进与阿尔茨海默病(Alzheimer's disease,AD)发生密切相关的NFTs形成[24]。AD患者多表现为学习记忆等认知障碍。免疫组织化学染色法检测AD动物海马CA1区CaMKⅡα与过度磷酸化的tau蛋白共存,且CaMKⅡα的免疫阳性反应多集中于海马区老年斑,提示CaMKⅡα可能参与tau蛋白的过度磷酸化和老年斑的形成[25]。
综上所述,我们推测8 Hz、130 dB次声可能通过Ca2+-CaMKⅡ-tau蛋白途径介导神经退行性变及认知障碍。应用Ca2+拮抗剂是否有助于对次声引起的脑功能损害进行防护,仍需要进一步研究。
[1]章菲,杨庆生,夏雅琴,等.次声:监测地震的新领域[J].地学前缘,2013,20(6):94-101.
[2]Pei ZH,Chen BY,Tie R,et al.Infrasound exposure induces apoptosis of rat cardiac myocytes by regulating the expression of apoptosis-related proteins[J].Cardiovasc Toxicol,2011,11 (4):341-346.
[3]张歆薇,刘海强,徐胜龙,等.次声作用对大鼠血浆SOD、MDA、NO水平的影响[J].现代生物医学进展,2012,12(18): 3416-3418.
[4]Lin T,Liu Y,Shi M,et al.Promotive effect of ginsenoside Rd on proliferation of neural stem cells in vivo and in vitro[J].J Ethnopharmacol,2012,142(3):754-761.
[5]Cheng H,Wang B,Tang C,et al.Infrasonic noise induces axonal degeneration of cultured neurons via a Ca2+influx pathway[J].Toxicol Lett,2012,212(2):190-197.
[6]Cai J,Jing D,Shi M,et al.Epigallocatechin gallate(EGCG)attenuates infrasound-induced neuronal impairment by inhibiting microglia-mediated inflammation[J].J Nutr Biochem,2014,25 (7):716-725.
[7]谭永霞,李玲,陈景藻,等.次声对大鼠海马超微结构的影响[J].中国康复理论与实践,2003,9(11):645-647.
[8]费舟,章翔,王晓峰,等.次声作用后大鼠血脑屏障的改变及意义[J].医学争鸣,1999,20(8):678-680.
[9]Liu J,Lin T,Yan X,et al.Effects of infrasound on cell proliferation in the dentate gyrus of adult rats[J].Neuroreport,2010, 21(8):585-589.
[10]袁华,龙华,牟翔,等.8 Hz次声对大鼠学习记忆能力和神经元再生的影响[J].中国康复医学杂志,2008,23(5):385-387.
[11]魏智钧,李玲,胨莆藻,等.次声作用对大鼠记忆功能及隔内侧核和斜角带核胆碱能神经元表达的影响[J].中华物理医学与康复杂志,2001,23(2):79-82.
[12]江山,徐成峰,李亚娜,等.次声诱导原代培养大鼠星形胶质细胞释放谷氨酸的研究[J].中国康复医学杂志,2014,29(6): 499-503.
[13]Du F,Yin L,Shi M,et al.Involvement of microglial cells in infrasonic noise-induced stress via upregulated expression of corticotrophin releasing hormone type 1 receptor[J].J Neurosci Res,2010,167(3):909-919.
[14]Shi M,Du F,Liu Y,et al.Glial cell-expressed mechanosensitive channel TRPV4 mediates infrasound-induced neuronal impairment[J].Acta Neuropathol,2013,126(5):725-739.
[15]胡江平,耿瑞,李凯军.tau蛋白与阿尔茨海默病的研究进展[J].中国康复理论与实践,2014,20(11):1031-1034.
[16]O'Day DH,Myre MA.Calmodulin-binding domains in Alzheimer's disease proteins:extending the calcium hypothesis[J].Biochem Bioph Res Co,2004,320(4):1051-1054.
[17]Liu Z,Gong L,Li X,et al.Infrasound increases intracellular calcium concentration and induces,apoptosis in hippocampi of adult rats[J].Mol Med Rep,2011,5(1):73-77.
[18]Martin L,Latypova X,Terro F.Post-translational modifications of tau protein:implications for Alzheimer's disease[J]. Neurochem Int,2011,58(4):458-471.
[19]Yuan H,Long H,Liu J,et al.Effects of infrasound on hippocampus-dependent learning and memory in rats and some underlying mechanisms[J].Environ Toxicol Phar,2009,28(2): 243-247.
[20]Liu ZH,Chen JZ,Ye L,et al.Effects of infrasound at 8 Hz 90 dB/130 dB on NMDAR1 expression and changes in intracellular calcium ion concentration in the hippocampus of rats[J]. Mol Med Rep,2010,3(6):917-921.
[21]刘朝晖,陈景藻,李康樗,等.不同声压级次声对大鼠海马细胞凋亡的影响[J].中华物理医学与康复杂志,2004,26(3): 148-151.
[22]吕国蔚.医学神经生物学[M].北京:高等教育出版社,2000: 87-88,184-202.
[23]Liang Z,Liu F,Iqbal K,et al.Decrease of protein phosphatase 2A and its association with accumulation and hyperphosphorylation of tau in Down syndrome[J].J Alzheimers Dis,2008,13 (3):295-302.
[24]Avila J.Tau kinases and phosphatases:Commentary[J].J Cell Mol Med,2008,12(1):258-259.
[25]Wang YJ,Chen GH,Hu XY,et al.The expression of calcium/ calmodulin-dependent protein kinase II-α in the hippocampus of patients with Alzheimer's disease and its links with AD-related pathology[J].Brain Res,2005,1031(1):101-108.
Effects of Infrasound on Expression of Calmodulin-dependent Protein Kinase II and Tau Protein in Hippocampus of Rats
CAI Li1,WANG Jin2,CUI Yao3,4,ZHANG Ge2,WU Song-yan1,ZHANG Wen-dong1,LIU Zhao-hui1
1.Department of Rehabilitation Medicine,Tangdu Hospital,the Fourth Military Medicine University,Xi'an, Shaanxi 710038,China;2.Section of Radiation Medicine Teaching&Research,the Fourth Military Medicine University,Xi'an,Shaanxi 710032,China;3.Beijing Bo'ai Hospital,China Rehabilitation Research Center,Beijing 100068,China;4.Capital Medical University School of Rehabilitation Medicine,Beijing 100068,China
LIU Zhao-hui.E-mail:15829845741@163.com
ObjectiveTo study the effect of infrasound on expression of calmodulin-dependent protein kinase II(CaMKII)and tau protein in hippocampus of rats.MethodsFifty-six male Sprague-Dawley rats were randomized into control group(n=8),1-day group(n=8), 7-day group(n=8)and 14-day group(n=32),and the 14-day group was subgrouped as 1-hour,6-hour,24-hour,48-hour subgroups,naming after the time after infrasound exposure,8 in each subgroup.All the test groups were put in an infrasound field with 8 Hz,130 dB for 2 hours daily,while the control group was put in the infrasound instrument without infrasound exposure for 2 hours daily.The expression of pT286-CaMKII and tau protein in hippocampus was detected with immunohistochemisty,Western blotting and enzyme-linked immunoabsorbent assay.ResultsThe expression of pT286-CaMKII was the most in 14-day group(F>14.912,P<0.001),as well as the expression of tau protein(F>36.229,P<0.001),and secondary in 7-day group(P<0.05).For 14-day group,the expression of tau protein was the most in 1-hour and 6-hour subgroups,and dropped down in 24-hour subgroup,although more than that in the control group(P<0.05).ConclusionExposure of 8 Hz,130 dB infrasound may induce phosphorylation of CaMKII and tau protein,and the expression of tau protein in hippocampal cells in rat,which may disturb their learning and memory function.
infrasound;calmodulin-dependent protein kinase II;tau protein;learning and memory;hippocampus;rats
R594.9
A
1006-9771(2017)03-0298-06
2016-10-26
2017-01-04)
国家自然科学基金项目(No.31470825)。
1.第四军医大学唐都医院康复医学科,陕西西安市710038;2.第四军医大学放射医学教研室,陕西西安市710032;3.中国康复研究中心北京博爱医院,北京市100068;4.首都医科大学康复医学院,北京市100068。作者简介:蔡丽(1987-),女,汉族,陕西商南县人,硕士研究生,治疗师,主要研究方向:言语认知功能障碍的治疗及其机制。通讯作者:刘朝晖(1962-),女,汉族,山西运城市人,博士,副主任医师,硕士研究生导师,主要研究方向:物理治疗的临床应用与机制研究。E-mail:15829845741@163.com。
10.3969/j.issn.1006-9771.2017.03.010
——水芹主要害虫识别与为害症状

