气相色谱法测定蜂蜜和蜂王浆中氟胺氰菊酯的残留
王祥云金银银汪志威张 倩王新全闵顺根
(1中国农业大学理学院,北京100093;2省部共建国家重点实验室培育基地“浙江省植物有害生物防控重点实验室”,农业部农药残留检测重点实验室,浙江省农业科学院农产品质量标准研究所,杭州310021)
气相色谱法测定蜂蜜和蜂王浆中氟胺氰菊酯的残留
王祥云1,2金银银2汪志威2张 倩2王新全2闵顺根1
(1中国农业大学理学院,北京100093;2省部共建国家重点实验室培育基地“浙江省植物有害生物防控重点实验室”,农业部农药残留检测重点实验室,浙江省农业科学院农产品质量标准研究所,杭州310021)
氟胺氰菊酯属于合成除虫菊酯,是国内蜂业生产中使用最广泛的杀螨剂,在蜂蜜和蜂王浆等蜂产品中潜在残留风险。本文建立了蜂蜜和蜂王浆中氟胺氰菊酯残留测定方法。方法以正己烷+丙酮混合溶液提取蜂蜜和蜂王浆样品中的氟胺氰菊酯残留,经弗罗里硅土固相萃取柱净化,以气相色谱—电子捕获检测器检测,外标法定量。试验结果显示,在5~100 μg/kg添加水平下,方法回收率在90.6~110%,相对标准偏差低于10%,满足残留分析方法的要求;蜂蜜和蜂王浆中的方法定量限分别为5 μg/kg和10 μg/kg,满足国内外残留限量的要求。
蜂蜜;蜂王浆;氟胺氰菊酯;气相色谱带电子捕获检测器
1 前言
蜂螨是蜂业生产中的头号病虫害,蜂农每年需进行1~3次药物防治以确保蜂群的正常发展[1]。对于蜂螨的防治,世界各国科学家和从业者尝试了各种措施,但效果最显著、起效最快的仍为化学合成杀螨剂。目前蜂农使用化学杀螨剂主要为氟胺氰菊酯,氟胺氰菊酯对蜜蜂大蜂螨等寄生螨具有极好的防效,且对蜜蜂的毒性最低,因而在世界范围内成为了应用最广泛的蜂业杀螨剂[2]。
我国自20世纪90年代推广使用新型氟胺氰菊酯杀螨制剂——“螨扑”[3]以来,蜂螨至今已对其产生了较大的抗药性,迫使蜂农在使用时增加剂量和频率,导致蜂蜜和蜂王浆产品中的氟胺氰菊酯残留风险越来越高[2]。此外,近年来氟胺氰菊酯被发现具有一定的发育和生殖毒性,对消费者潜在一定的健康风险,欧盟更是将其列为内分泌干扰物[4]。为此,国内外各主管部门为确保消费者的蜂产品食用安全,纷纷建立了蜂蜜和蜂王浆中的最大残留限量标准。其中,日本[5]、欧盟[6]分别规定了蜂蜜和蜂王浆中氟胺氰菊酯残留限量为0.05 mg/ kg;我国规定了蜂蜜中的最大残留限量为0.05 mg/kg[7],蜂王浆中尚无明确规定;美国仅规定了蜂蜜中的氟胺氰菊酯残留限量为0.02 mg/kg[8]。
目前,蜂蜜和蜂王浆中氟胺氰菊酯残留量的仪器检测方法较多[9],包括气相色谱法[10-15]、气相色谱质谱法[16]、液相色谱法[17-19]和液相色谱串联质谱法[20-21]等。然而,针对灵敏度最高、仪器保有量最大的气相色谱电子捕获检测器的相关文献和标准方法已稍显陈旧,个别方法表现出溶剂用量大、使用含氯试剂等不足,本文拟建立基于气相色谱电子捕获检测器,能同时满足蜂蜜、蜂王浆乃至两者混合物中的氟胺氰菊酯残留量检测的分析方法。
2 材料与方法
2.1 仪器与试剂
GC 2010 Plus气相色谱仪,配备电子捕获检测器和自动进样器;涡旋仪;离心机;氮吹仪;旋转蒸发仪;固相萃取装置。弗罗里硅土柱(1 g,6 ml,天津博纳艾杰尔科技有限公司)。氟胺氰菊酯标准溶液(1000 mg/L,中国农业科学院环境保护科研监测所),正己烷、丙酮均为分析纯,购自华东医药有限公司。
2.2 试验方法
2.2.1 试样提取
准确称取2 g蜂王浆或5 g蜂蜜(精确至0.01 g)至50 ml离心管中,加入10 ml水并涡旋10 s以溶解样品,静置1 min,加入20 ml正己烷-丙酮(1+1,V/V),涡旋震荡提取1 min,7000 r/min离心3 min,取上清液于100 ml鸡心瓶中,残渣再加入20 ml正己烷-丙酮(1+1,V/V)涡旋提取一次,合并上清液,在旋转蒸发仪上于300 Mpa、37℃浓缩至近干,氮气吹干,待净化。
2.2.2 试样净化
以5 ml正己烷进行淋洗活化弗罗里硅土柱,以9 ml正己烷分3次超声鸡心瓶,并依次转移至萃取小柱上,弃去上述流出液,最后以10 ml正己烷+丙酮(95+ 5,V/V)洗脱目标化合物,收集于10 ml刻度管中,37℃水浴下氮吹干,以1 ml正己烷涡旋超声定容后转移至进样小瓶,以气相色谱质谱电子捕获检测器检测,外标法定量。
2.2.3 仪器条件
色谱柱:VF-1MS(30 m×0.25 mm×0.25μm)石英毛细管柱;载气:氮气,纯度≥99.999%;流速为1.0 ml/ min;进样口温度:280℃;检测温度:300℃;柱温:温度80℃,保持1min,30℃/min升至200℃,保持1min,随后以10℃/min升至280℃保持6 min;进样量:1μl;进样方式:不分流进样,1 min后打开分流阀。
3 结果与分析
3.1 检测仪器的确定
关于氟胺氰菊酯的检测,现有文献及标准中所使用检测仪器主要包括气相色谱带电子捕获检测器(GCECD)、气相色谱质谱(GC-MS)、液相色谱带紫外检测器(LC-UVD)以及液相色谱串联质谱(LC-MS/MS)等。
为评价各仪器对氟胺氰菊酯的检测效果,试验中分别配置了氟胺氰菊酯的系列标准溶液,其中GCECD和GC-MS采用正己烷稀释,LC-UVD和LC-MS/ MS采用甲醇水溶液稀释。试验结果见表1。

表1 氟胺氰菊酯标准溶液在各仪器上的响应情况
表1中的结果表明,对于氟胺氰菊酯的测定,GCECD和LC-MS/MS具有更佳的灵敏度,线性范围也足以满足检测工作的需求。但考虑到GC-ECD在各类实验室配置比例更高,选其作为氟胺氰菊酯的检测仪器,有助于提高方法的适用性。因此,最终本方法采用GCECD作为检测仪器。
3.2 提取溶剂的选择与优化
综合《SN/T 2575-2010进出口蜂王浆中多种菊酯类农药残留量检测方法》[14]、《农业部781号公告-9-2006蜂蜜中氟胺氰菊酯残留量的测定气相色谱法》[10]和《SN/T 0213.5-2002出口蜂蜜中氟胺氰菊酯残留量检验方法液相色谱法》[17]等标准方法及《气相色谱法测定蜂王浆中氟胺氰菊酯残留量》[11]、《蜂王浆中氟胺氰菊酯与氟氯苯氰菊酯残留的提取净化及超高效液相色谱测定方法研究》[19]、《气相色谱法同时检测蜂蜜中溴螨酯、蝇毒磷、氟胺氰菊酯和氟氯苯氰菊酯残留》[13]等相关文献方法的结果表明,正己烷+丙酮(1+1,V/V)、正己烷+二氯甲烷(1+1,V/V)和乙腈是蜂蜜或蜂王浆中氟胺氰菊酯提取的常用溶剂。
试验中,首先进行了提取液溶剂用量试验。在蜂蜜和蜂王浆试样中添加适量的氟胺氰菊酯标准溶液,获得添加水平为50 μg/kg的待测样品。随后以3×20 ml提取液进行三阶段提取,并各自进行后续的分析过程。试验结果表明:三种提取液的结果基本一致。大部分氟胺氰菊酯被第一阶段20 ml提取液有效提取,第二阶段20 ml可将剩余氟胺氰菊酯完全提取,第三阶段20 ml提取液中无氟胺氰菊酯残留检出。即2×20 ml提取液可将试样中的可提取氟胺氰菊酯残留完全提取。试验随即开展了上述溶剂对蜂蜜和蜂王浆中氟胺氰菊酯提取效率的研究,试验结果详见表2。
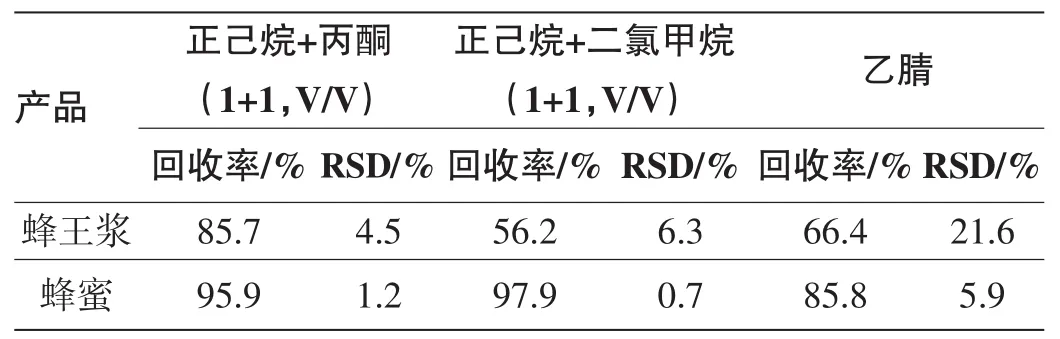
表2 蜂蜜、蜂王浆中氟胺氰菊酯以不同提取液提取的回收率和变异系数(n=6)
结果显示:对于蜂蜜而言,三种提取液均可得到良好的提取效果;对于蜂王浆而言,仅有正己烷+丙酮(1+ 1,V/V)能高效、稳定的提取蜂王浆中的氟胺氰菊酯,正己烷+二氯甲烷(1+1,V/V)和乙腈的提取效率均偏低,且乙腈作为提取液时发现提取效率以及稳定性都较差。其中蜂王浆试验中正己烷+二氯甲烷(1+1,V/V)与乙腈的提取回收率偏低,可能源于提取过程中形成的胶状体,剩余的氟胺氰菊酯残留被胶状体所包覆而无法完全提取。
3.3 净化方式的选择和优化
根据现有的文献及标准方法,选用HLB(500 mg,6 ml,Waters)和弗罗里硅土(1 g,6 ml,Agela)固相萃取柱作为净化萃取柱,并重点考察淋洗液种类及体积对样品回收率及净化效果的影响。
3.3.1 淋洗曲线
在经预淋洗的小柱上加入1 ml正己烷稀释的氟胺氰菊酯标准溶液,分别以下列净化方式开展淋洗曲线试验。
净化方式1:HLB柱,以正己烷+二氯甲烷(1+1,V/ V)洗脱;净化方式2:弗罗里硅土柱,以正己烷+乙醚(9+1,V/V)洗脱;净化方式3:弗罗里硅土柱,以正己烷+丙酮(9+1,V/V)洗脱;净化方式4:弗罗里硅土柱,以正己烷+丙酮(95+5,V/V)洗脱;净化方式5:弗罗里硅土柱,以正己烷+丙酮(98+2,V/V)洗脱。
结果显示:净化方式1~5分别需要2 ml、24 ml、10 ml、10 ml和20 ml洗脱液,考虑节约溶剂及实验室时间的考虑,排除了净化方式2和5,后续在净化方式1、3和4的基础上进行方法优化。
3.3.2 最佳比例洗脱液的确定
分别以净化方式1、3和4做回收实验,添加浓度为50 μg/kg,以考察其回收率,确定最佳比例洗脱液(结果见表3)。

表3 不同净化方式的回收情况(n=3)

表4 方法回收率和精密度
根据表3的结果显示,三种净化方式的回收率和变异系数均在《GBT 27404-2008实验室质量控制规范食品理化检测》[22]附录F要求范围内,即均可满足本法的的需求。考虑到净化方式4的变异系数以及谱图相对更为干净,最终选择正己烷-丙酮(95+5,V/V)作为洗脱液,洗脱体积为10 ml。
3.4 方法的线性范围和灵敏度
以正己烷分别配置1.00 μg/L、2.00 μg/L、5.00 μg/ L、10.0 μg/L、20.0 μg/L、50.0 μg/L、100 μg/L、200 μg/L和500 μg/L的系列标准工作液溶液,经气相色谱电子捕获检测器检测,结果表明,氟胺氰菊酯的仪器响应在10.0~500 μg/L范围内呈线性,回归方程为y=3291x-10612,相关系数(R2)为0.999。
实验通过在样品中添加系列浓度并进行回收测定的方式确定方法的检出限(S/N=3)和定量限(S/N=10)。结果表明,在实验条件下,本方法检出限分别为蜂蜜中2 μg/kg、蜂王浆中4 μg/kg,方法定量限分别为蜂蜜中5 μg/kg、蜂王浆中10 μg/kg,结果见表4。
考虑到国内外蜂蜜和蜂王浆中氟胺氰菊酯的最大残留限量分别为20~50 μg/kg和50 μg/kg,因此本方法的定量限足以满足蜂蜜和蜂王浆在我国日常监管和国内外贸易中的需求。
3.5 方法的准确度和精密度
本方法以添加回收的方式考察了方法的准确度和精密度。在空白样品称取后,加入0.1 ml相应浓度的氟胺氰菊酯标准溶液,涡旋1min混匀,静置半小时,使标准溶液被样品充分吸收,然后按本方法进行检测,试验结果表明,蜂蜜的方法回收率90.6~95.7%,蜂王浆的方法回收率在95.9~110%,相对标准偏差均小于10%,准确度和精密度均达到残留分析方法的要求,代表性图谱见图1。

图1 蜂蜜和蜂王浆的空白和添加图谱
[1]陈芳,李熠,王勇,等.QuEchERs-GC法测定蜜蜂生物体的氟胺氰菊酯残留[J].中国蜂业.2014,65:44-46.
[2]周婷,王强,姚军.钠离子通道与蜜蜂狄斯瓦螨对氟胺氰菊酯的抗性机理[J].昆虫知识.2003,40:491-495.
[3]农业科技通讯编辑部.新型高效杀蜂螨制剂-螨扑的试制与推广[R].农业科技通讯.1997:33.
[4]欧盟委员会官网.内分泌干扰物研究优先列表.[查询时间2016-09-17].
[5]日本肯定列表.农产品中氟胺氰菊酯限量 [OL].[查询时间2016-09-17].
[6]欧盟食品安全委员会农药残留数据库 [OL].[查询时间2016-09-17].
[7]农业部235号公告.动物性食品中兽药最高残留限量[S].
[8]美国政府出版办公室.蜂蜜中氟胺氰菊酯限量 [OL].[查询时间2016-09-17].
[9]贾琪,邱静,李熠,等.氟胺氰菊酯在蜂产品中的残留检测研究进展[J].农产品质量与安全.2014:47-51.
[10]赵静,薛晓锋,赵孟彬,等..农业部公告781-9-2006蜂蜜中氟胺氰菊酯残留量的测定气相色谱法 [S].北京:中国标准出版社,2006.
[11]谭韩英,仇厚援,张志恒,等.气相色谱法测定蜂王浆中氟胺氰菊酯残留量[J].农药.2012,51:815-821.
[12]王吉祥,王亚琴,赵昱,等.气相色谱法检测蜂蜜中蝇毒磷及氟胺氰菊酯残留[J].食品研究与开发.2013,34.
[13]薛晓锋,赵静,邱静,等.气相色谱法同时检测蜂蜜中溴螨酯、蝇毒磷、氟胺氰菊酯和氟氯苯氰菊酯残留 [J].中国养蜂. 2005,56:10-12.
[14]丁慧瑛,谢文,蒋晓英,等.SN/T 2575-2010进出口蜂王浆中多种菊酯类农药残留量检测方法[S].浙江:中华人民共和国浙江出入境检验检疫局,2010.
[15]倪澜荪,曾静,邵俊杰.蜂蜜中氟胺氰菊酯测定方法的研究[J].现代商检科技.1998,8:18-23.
[16]庞国芳,范春林,刘永明,等.GB/T 19426-2006蜂蜜、果汁和果酒中497种农药及相关化学品残留量的测定气相色谱-质谱法[S].北京:中国标准出版社,2006.
[17]曾静,戴华,林雁飞,等.SN/T 0213.5-2002出口蜂蜜中氟胺氰菊酯残留量检验方法液相色谱法[S].中华人民共和国国家质量监督检验检疫总局,2002.
[18]戴华,黄志强,陈新焕.蜂蜜中氟胺氰菊酯残留量的HPLC测定方法[J].农药.2000,39:21-22.
[19]董盛月.蜂王浆中氟胺氰菊酯与氟氯苯氰菊酯残留的提取净化及超高效液相色谱测定方法研究 [J].食品科学.2009,30: 272-274.
[20]庞国芳,李岩,范春林,等.GB/T 20771-2008蜂蜜中486种农药及相关化学品残留量的测定液相色谱-串联质谱法 [S].北京:中国标准出版社,2008.
[21]周萍,李英华,胡福良,等.高效液相色谱串联质谱法同时测定蜂王浆中氟胺氰菊酯、三唑醇和蝇毒磷残留 [J].食品科学. 2013,34:180-184.
[22]鲍晓霞,乔东,章晓氡,等.GB/T 27404-2008实验室质量控制规范食品理化检测[S].北京:中国标准出版社,2008.
The determination of Tau-fluvalinate residue in Honey and Royal jelly by Gas Chromatography
Wang Xiangyun1,2,Jin Yinyin2,Wang Zhiwei2,Zhang Qian2,Wang Xinquan2,Min Shungen1
(1 College of Science,China Agricultural University,Beijing 100094;2 State Key Lab Breeding Base for Zhejiang Sustainable Plant Pest Control;MOA Key Lab for Pesticide Residue Detection;Institute of Quality and Standard for A-gro-products,Zhejiang Academy of Agricultural Sciences;Hangzhou 310021)
Tau-fluvalinate,an synthesized pyrethrin,was the most popular miticide in bee industry and then caused the residue risk in the honey and royal jelly.A method was developed to determine the residue of Tau╞fluvalinate in honey and royal jelly.The residue was extracted by n-hexane and acetone mixture,cleaned by a florisil column, detected by a gas chromatography with electron capture detector and calculated with external standards.At fortification levels 5~100 μg/kg,the recoveries ranged from 90.6~110%and the relative standard deviation was less than 10%.The quantitation limits of method were 5 μg/kg for honey and 10 μg/kg for royal jelly,which were sensitive enough compared to the MRLs set by governments around the world.
honey;royal jelly;tau-fluvalinate;gas chromatography with electron capture detector
浙江省自然科学基金(LQ14B070004)
王祥云(1983-),副研究员,博士研究生,从事农产品中农药等污染物研究。
闵顺耕(1963-),教授,博导,从事农产品营养品质与农药残留快速分析技术,minsg@263.net。

