干旱胁迫下香蕉miRNAs的表达分析
张恒 冯仁军 王静毅 云天艳 李成梁 张银东 张锡炎

摘 要 以干旱驯化和未驯化的香蕉幼苗为研究材料,采用实时荧光定量PCR方法检测干旱胁迫过程中6个miRNAs的表达变化。结果表明:6个miRNAs在所有香蕉幼苗的干旱胁迫响应过程中均有表达,但其表达模式存在差异,在直接干旱处理下,miR156k、miR160a、miR162a、miR164a、miR166d的表达均呈现升高-降低的趋势,miR397b的表达则呈现升高-降低-升高-降低的趋势;在驯化后干旱处理下,miR156k、miR162a、miR166d、miR397b的表达均呈现升高-降低的趋势,miR160a、miR164a的表达则呈现升高-降低-升高-降低的趋势。干旱胁迫响应过程中(除处理后第10天外),驯化后的香蕉幼苗中miRNAs的表达量基本上高于未驯化香蕉幼苗中miRNAs的表达量,同时还发现miR160a和miR164a的表达量都非常高。上述研究结果将为香蕉干旱胁迫应答研究奠定基础。
关键词 香蕉;干旱胁迫;miRNAs;表达分析
中图分类号 S668.1 文献标识码 A
The Expression Analysis of Banana miRNAs
Under Drought Stress
ZHANG Heng1, FENG Renjun2 *, WANG Jingyi2 , YUN Tianyan1,
LI Chengliang1, ZHANG Yindong1 **, ZHANG Xiyan2 **
1 College of Agronomy, Hainan University, Haikou, Hainan 570228, China
2 Institute of Tropical Bioscience and Biotechnology, CATAS / Key Laboratory of Biology and Genetic Resources
of Tropical Crops, Ministry of Agriculture, Haikou, Hainan 571101, China
Abstract The miRNAs expression of drought-acclimated and non-acclimated banana plantlets were researched under the drought stress by Real-time PCR. The experimental results showed that the expression of six miRNAs were detected in all plantlets under the drought stress, but the expression patterns of these miRNAs were differential. The expression profiles of miR156k, miR160a, miR162a, miR164a and miR166d were increased first and decreased later, and the expression pattern of miR397b showed a tendency of increase first then decrease, again rise again fall in the non-acclimated banana plantlets. On the other hand, in the drought-acclimated banana plantlets, the expression profiles of miR156k, miR162a, miR166d and miR397b were increased first and decreased then, and the expression patterns of miR160a and miR164a showed a tendency of increase first then decrease,again rise again fall. At all time points except for the 10th day after drought treatment, the expressional levels of most miRNAs in the acclimated banana plantlets were higher than those in the non-acclimated plantlets, and the expressional levels of miR160a and miR164a were higher than those of the other four miRNAs in any plantlets at any time points. These research findings should lay a better foundation for the further research of drought-stress response mechanism in banana.
Key words bananas; drought stress; miRNAs; expression analysis
doi 10.3969/j.issn.1000-2561.2017.01.015
香蕉(Musa spp.)是一種多年生大型常绿单子叶草本植物,产于热带和亚热带地区,是世界上主要水果之一,也是重要的粮食和经济作物[1]。干旱是一个始终存在的世界性难题,严重影响了香蕉的产量与品质,是香蕉生产的主要非生物胁迫因素之一。microRNA(miRNA)是一类不编码蛋白质、不具有开放阅读框的内源性的具有茎环结构的单链RNA,广泛存在于真核生物中,与生物体的生长发育关系密切[2]。目前,与非生物胁迫相关的miRNAs已在多种植物中有研究报道。众多国内外研究发现,miRNAs具有高度的保守性与表达时序性。拟南芥的miR393、miR319、miR397、miR167、miR168、miR171和miR408在干旱条件下的表达量均提高;苜蓿在缺水条件下,其miR393、miR398a和miR408的表达量均上调,而miR169在根中的表达量则下调;在豌豆、玉米、大麦和小麦中均发现与干旱相关的miRNAs的表达能受干旱和ABA诱导[3-12]。但是,目前有关香蕉干旱胁迫miRNAs的研究却未见报道。
成熟的miRNA序列通常只有20~24 bp,由于长度太短,给cDNA第一链的合成以及后续的PCR扩增带来了一定的难度。随着人们对miRNA研究的不断深入,越来越多的手段可以用来解决这一问题。目前,miRNA相关的研究方法主要有以下几种:Northern blotting法、茎环RT-PCR法、miRNA芯片技术、polyA聚合酶加尾法[13-17]。本实验室通过高通量测序的方法在前期研究中发现了6个与干旱胁迫相关的miRNAs(miR156k、miR160a、miR162a、miR164a、miR166d和miR397b)。本研究采用茎环RT-PCR法对前期研究获得的6个miRNAs的表达情况进行研究,分析这些miRNAs在干旱胁迫下香蕉幼苗中的表达差异性和时序性,从而为与香蕉干旱胁迫相关的miRNAs研究奠定基础。
1 材料与方法
1.1 材料
巴西香蕉幼苗购自中国热带农业科学院组培中心。将香蕉幼苗置于光照、温度和湿度相对稳定的条件下进行培养,培养15 d后,待其长至约30 cm高时,开始对幼苗进行干旱处理。
1.2 方法
1.2.1 试验设计 本研究共设2个处理和1个对照:未经干旱驯化的香蕉幼苗干旱处理(DNH)、经干旱驯化的香蕉幼苗干旱处理(DH)和对照(DC)。香蕉幼苗的干旱驯化:对正常生长的香蕉幼苗停止浇水,对其实施自然干旱,干旱20 d后对其进行浇水,直到这些受到严重旱害的香蕉幼苗表型恢复正常,这些能恢复正常生长的香蕉幼苗即为干旱驯化香蕉幼苗。然后对驯化和未驯化香蕉幼苗进行干旱处理,从第0天开始,每间隔1 d对处理和对照进行取样。在10个时间点(0、2、4、6、8、10、12、14、16、18 d)分别采集处理和对照的顶部功能叶,清洁后将其置于液氮中速冻,于-80 ℃保存备用。
1.2.2 茎环RT-PCR法引物设计 茎环引物一般由2部分的序列构成,它们分别为5′端的由38个固定碱基构成的序列和3′端的8个与成熟miRNA 3′端反向互补的序列。通过茎环引物引导,miRNA被特异地反转录为一段约70 bp的cDNA序列[18-19]。本研究分别设计了6个miRNAs的茎环引物、PCR正向引物和PCR通用引物(表1)。
1.2.3 香蕉叶片总RNA的提取 采用改良的CTAB法[20]对香蕉叶片的RNA进行提取,提取完后取3 μL总RNA进行1%琼脂糖凝胶电泳,并在紫外分光光度计下检测所提取的RNA纯度。
1.2.4 cDNA第一链的合成 以提取到的香蕉叶片总RNA为模板,利用表1所设计的特异性茎环引物,根据美国Invitrogen公司的M-MLV Reverse Transcriptase(C28025-021)说明书进行cDNA第一链的合成。
1.2.5 实时荧光定量PCR(qRT-PCR)检测miRNAs的表达量 以香蕉5s rRNA作为内参基因、去离子水作为模板的阴性对照、反转录得到的cDNA第一链为模板,按表2的体系进行qRT-PCR扩增,检测干旱胁迫下驯化和未驯化香蕉幼苗miRNAs的表达量。所使用的仪器为美国安捷伦公司的Mx3005P荧光定量PCR仪。miRNAs的相对表达量采用2-△△Ct法计算获得,计算公式为:△△Ct=(Ct miRNAs-Ct 5s rRNA)处理-(Ct miRNAs-Ct 5s rRNA)对照。
2 结果与分析
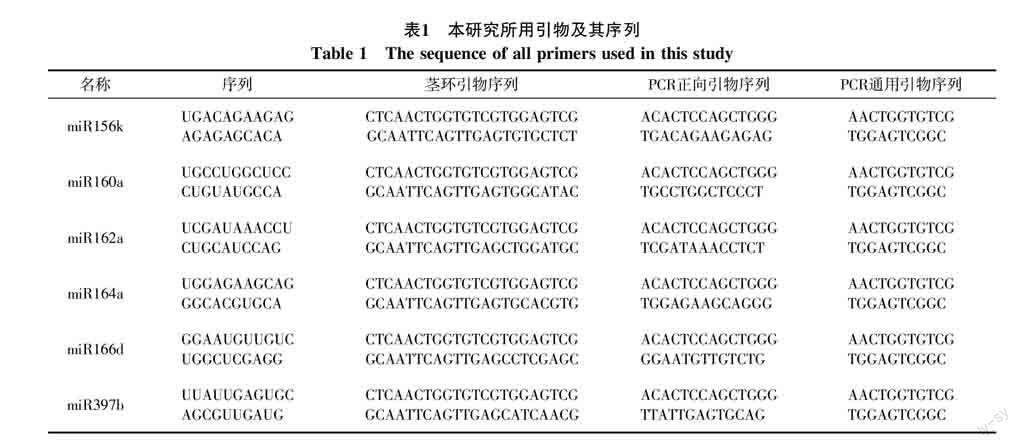
2.1 干旱胁迫对香蕉幼苗表型的影响
香蕉幼苗在干旱胁迫下的表型变化如图1所示。随着时间的推移和干旱程度的加深,香蕉幼苗出现明显变化,如生长停止,叶片萎蔫并下垂。从第4天起,香蕉幼苗底部的功能叶片开始出现轻度的萎蔫;到第10天时,香蕉幼苗最顶端的功能叶开始萎蔫,此时底部功能叶已严重脱水;到第14天时,香蕉幼苗顶部功能叶严重萎蔫,底部功能叶卷曲、枯黄,最终坏死。
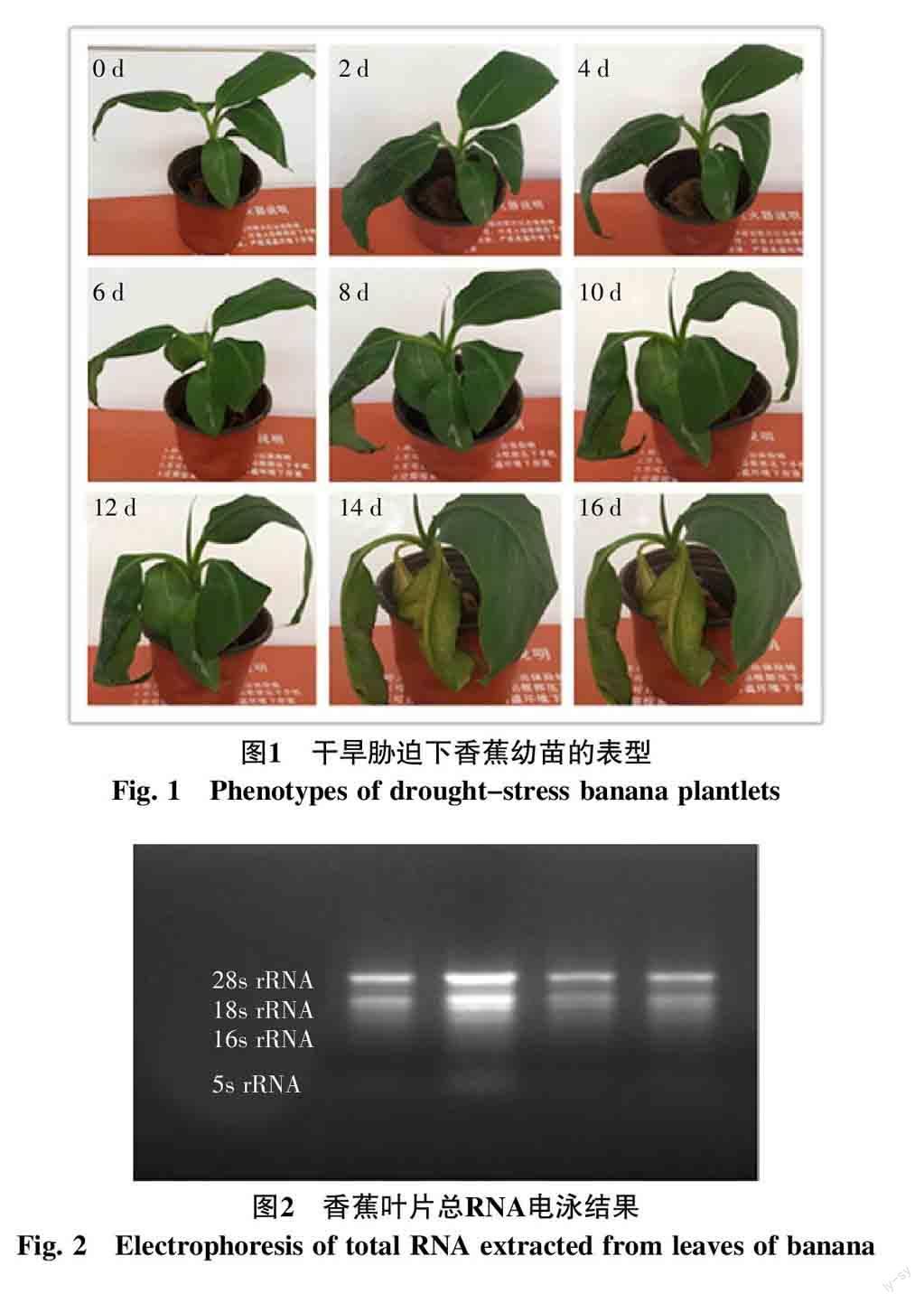
2.2 香蕉总RNA提取质量分析
采用改进的CTAB法从香蕉叶片中提取总RNA。每孔上样量为3 μL,进行1%的琼脂糖凝胶电泳,验证所提取RNA的完整性(图2)。结果显示,所提取的香蕉叶片总RNA中28s rRNA与18s rRNA条带清晰,28s rRNA的亮度约是18s rRNA的2倍,且无降解及拖尾现象,同时还富集到了16s rRNA与5.8s rRNA,其中16s rRNA可能是叶绿体RNA。取2 μL样液稀释至200 μL,进行分光光度计检测,结果显示,A260/A280比值为1.962~2.085,符合A260/A280为1.9~2.1的范围,能够满足后续试验的要求。
2.3 干旱胁迫对驯化和未驯化香蕉幼苗miRNAs表达的影响
本研究检测了驯化和未驯化香蕉幼苗叶片中6个miRNAs(miR156k、miR160a、miR162a、miR164a、miR166d、miR397b)在干旱胁迫下10个时间点(0 d、2 d、4 d……18 d)的表达量。结果如图3所示,驯化和未驯化香蕉叶片中6个miRNAs在干旱下的10个时间点均有表达,随着干旱程度的加深,miRNAs的表达处于动态变化中。在干旱胁迫下,未驯化香蕉叶片中miR156k、miR160a、miR162a、miR164a、miR166d的表达量在时间上均呈现升高-降低的变化趋势(单峰),且均在干旱处理第10天时表达量达到峰值;但miR397b的表达量在时间上则呈现升高-降低-升高-降低的变化趋势(双峰),且在干旱处理第2天和第8天时表达量达到峰值。驯化香蕉叶片中miR156k、miR162a、miR166d、miR397b的表达量在时间上均呈现升高-降低的趋势(单峰),且均在干旱处理第8天时表达量达到峰值;而miR160a、miR164a的表達量呈现升高-降低-升高-降低趋势(双峰),且均在干旱处理第4天和第10天时表达量达到峰值。
從表达量上看,所检测的驯化和未驯化香蕉叶片中6个miRNAs在干旱胁迫下10个时间点的表达量均具有明显差异。总体来说除了干旱处理第10天外,驯化后香蕉叶片miRNAs表达量基本上高于未驯化香蕉叶片中的表达量。另外,无论是驯化还是未驯化香蕉叶片中,miR160a和miR164a的表达量都非常高。
3 讨论
香蕉是芭蕉科芭蕉属多年生大型常绿单子叶草本植物,其生长发育对水分需求量大,对干旱十分敏感。干旱是重要的非生物胁迫之一,严重影响植物的生长发育。本研究在干旱胁迫下检测了干旱驯化和未驯化香蕉幼苗中6个miRNAs的表达变化。结果表明,干旱驯化和未驯化香蕉幼苗中miRNAs在干旱胁迫下的表达变化趋势不同,概括起来可大致将其分为2种:一种是呈上升-下降的“单峰型”趋势,如未驯化香蕉幼苗的miR156k、miR160a、miR162a、miR164a、miR166d,以及驯化幼苗的miR156k、miR162a、miR166d、miR397b;另一种是呈升高-降低-升高-降低的“双峰型”趋势,如未驯化香蕉幼苗的miR397b,以及驯化幼苗的miR160a、miR164a。
干旱胁迫下驯化和未驯化香蕉幼苗的miRNAs在个别时间点的表达量非常高,如未驯化幼苗的miR156k、miR160a、miR162a、miR164a、miR166d在处理的第10天,驯化幼苗的miR156k、miR162a、miR166d、miR397b在处理的第8天。未驯化香蕉幼苗的miRNAs在第10天时对干旱胁迫的响应最为剧烈,说明干旱10 d是未驯化香蕉幼苗的一个非常关键的时间点,即未驯化香蕉幼苗响应干旱胁迫的一个临界点;而驯化香蕉幼苗的miRNAs却在第8天对干旱胁迫的响应最为剧烈,但此时其miRNAs表达量远低于未驯化香蕉幼苗的miRNAs在第10天时的表达量。因此,从干旱响应时间上看,驯化香蕉幼苗的miRNAs对干旱胁迫的应答要早于未驯化香蕉幼苗的miRNAs。此外,除干旱处理第10天外,驯化香蕉幼苗中miRNAs表达量基本上都高于未驯化香蕉幼苗中miRNAs的表达量。推测其机理:当未驯化香蕉植株首次面对干旱胁迫时,由于其不能识别干旱胁迫,于是其可能会调动体内所有与胁迫相关的代谢途径去响应干旱胁迫,最后通过调整相关代谢途径的动态平衡去适应干旱胁迫,同时建立起对干旱胁迫的识别和防御系统,形成“干旱记忆”;而当驯化香蕉植株面对干旱胁迫时,其体内早已建立的干旱识别和防御系统能很快识别干旱胁迫,并仅调用干旱胁迫防御系统进行胁迫响应,所以能较快较易地适应干旱胁迫。另外,无论是驯化还是未驯化香蕉幼苗中,miR160a和miR164a的表达量都非常高,推测其可能在香蕉植株抗旱过程中扮演着重要的角色,但这还需要进一步实验证明。
前人的研究结果表明,本研究所选取的6个miRNAs在不同物种的多种胁迫下均有表达,但在香蕉中尚未发现有关此类miRNAs的报道(表3)。孙现军[21]和孔德艳[22]通过构建基因定点突变体系,分别在大豆和水稻中证明了miR160a与miR397b响应于干旱胁迫,但没有从定量的角度对其进行表达分析。本研究在干旱驯化和未驯化香蕉幼苗中定量分析了这6个miRNAs在响应干旱胁迫过程中的表达变化特征,这将为与香蕉干旱胁迫相关的miRNAs研究奠定基础。
参考文献
[1] 刘以道, 张慧坚. 世界香蕉产业发展概况及发展趋势[J]. 世界农业, 2013(10): 76-79.
[2] 卢加举, 廖文彬, 朱白婢, 等. MicroRNA的研究进展[J]. 分子植物育种, 2006, 4(S2): 73-77.
[3] 黄鹤丽, 林 电, 章金强, 等. 水分胁迫对巴西香蕉幼苗叶片生理特性的影响[J]. 热带作物学报, 2009, 30(4): 485-488.
[4] Zhao B, Liang R, Ge L, et al. Identification of drought-induced microRNAs in rice[J]. Biochemical & Biophysical Research Communications, 2007, 354(2): 585-590.
[5] 许振华, 谢传晓. 植物microRNA与逆境响应研究进展[J]. 遗传, 2010, 32(10): 1 018-1 030.
[6] 马风勇, 朱永兴, 石晓霞, 等. 植物miRNA抗逆性研究进展[J]. 西北农林科技大学学报: 自然科学版, 2012(5): 217-223.
[7] Liu H H, Tian X, Li Y J, et al. Microarray-based analysis of stress-regulated microRNAs in Arabidopsis thaliana[J]. Rna-a Publication of the Rna Society, 2008, 14(5): 836-843.
[8] Inês T, Cláudio C, Tamas D, et al. miR398 and miR408 are up-regulated in response to water deficit in Medicago truncatula[J]. Planta, 2010, 231(3): 705-716.
[9] Ramanjulu S, Avnish K, Jian-Kang Z. Posttranscriptional induction of two Cu/Zn superoxide dismutase genes in Arabidopsis is mediated by downregulation of miR398 and important for oxidative stress tolerance[J]. Plant Cell, 2006, 18(8): 2 051-2 065.
[10] Liu D, Yu S, Chen Z, et al. Ectopic expression of miR396 suppresses GRF target gene expression and alters leaf growth in Arabidopsis[J]. Physiologia Plantarum, 2009, 136(2): 223-236.
[11] Po-Pu L, Montgomery T A, Noah F, et al. Repression of AUXIN RESPONSE FACTOR10 by microRNA160 is critical for seed germination and post-germination stages[J]. Plant Journal for Cell & Molecular Biology, 2007, 52(1): 133-146.
[12] 王佳偉. 受microRNA160调控的生长素响应分子ARF10和16控制植物根冠发育[D]. 上海: 中国科学院研究生院(上海生命科学研究院), 2005.
[13] 韦荣昌, 赵 欢, 马小军, 等. microRNA检测方法的研究进展[J]. 江苏农业科学, 2013, 41(9): 17-19.
[14] 王 芳, 余 佳, 张俊武. 小RNA(MicroRNA)研究方法[J]. 中国生物化学与分子生物学报, 2006, 22(10): 772-779.
[15] 李 贺, 张志宏, 高秀岩, 等. 草莓microRNA的RT-PCR鉴定[J]. 中国农业科学, 2009, 42(4): 1 465-1 472.
[16] 景 花, 宋沁馨, 周国华. MicroRNA定量检测方法的研究进展[J]. 遗传, 2010, 32(1): 31-40.
[17] 薛慧慧, 马骁骁, 朱长保, 等. 改进茎环引物RT-PCR法实时定量检测microRNA[J]. 现代生物医学进展, 2014, 14(28): 5431-.
[18] Wu R M, Wood M, Thrush A, et al. Real-Time PCR quantification of plant miRSSSAs using universal probeLibrary technology[J]. AstronomischeNachrichten, 2007(2): 12-15..
[19] 赵 丽, 杨 洋, 温传俊. 茎一环RT-PCR法定量miRNA-421的引物设计[J]. 南京师大学报: 自然科学版, 2012, 35(2): 83-88.
[20] 史后蕊, 冯仁军, 王静毅, 等. 香蕉GAPDH基因家族的生物信息学及转录表达分析[J], 热带作物学报, 2014, 35(6): 1 117-1 123.
[21] 孙现军. CRISPR/Cas9基因定点突变体系构建与大豆抗旱相关gma-miR160功能研究[D]. 杨凌: 西北农林科技大学, 2015.
[22] 孔德艳. 水稻抗旱相关miRNAs的克隆及其功能的初步研究[D]. 武汉: 华中农业大学, 2010.
[23] Cui N, Sun X, Sun M, et al. Overexpression of OsmiR156k, leads to reduced tolerance to cold stress in rice (Oryza sativa) [J]. Molecular Breeding, 2015, 35(11): 1-11.
[24] 李春贺. 盐胁迫条件下不同耐盐棉花miRNA差异表达研究[J]. 山东农业科学, 2009(7): 12-17.
[25] Chuck G, O'Connor D. Small RNAs going the distance during plant development[J]. Current Opinion in Plant Biology, 2010, 13(1): 40-45.
[26] Li X P, Zeng Q F, Zhang G S, et al. GmMIR160A, a class of soybean microRNA gene, negatively regulates progress of leaf senescence[J]. Guihaia, 2015.
[27] 李利红. 二氧化硫胁迫下拟南芥防御基因的差异表达及表观遗传调控机制研究[D]. 太原: 山西大学, 2012.
[28] 周 韬. 盐胁迫下胡杨的生理响应及miRNA表达动态变化[D]. 北京: 北京林业大学, 2014.
[29] 牟桂萍, 纪春艳, 许东林, 等. 植物miR164家族研究进展[J]. 生命科学, 2013(5): 532-538.
[30] 刘 萱. 玉米根系铅胁迫响应microRNA及其靶基因的表达分析[D]. 成都: 四川农业大学, 2012.
[31] Zhou X, Wang G, Sutoh K, et al. Identification of cold-inducible microRNAs in plants by transcriptome analysis[J]. Biochimica Et Biophysica Acta, 2008, 1 779(11): 780-788.
[32] Gavnholt B, Larsen K. Molecular biology of plant laccases in relation to lignin formation[J]. Physiologia Plantarum, 2002, 116(3): 273-280.

