牛病毒性腹泻黏膜病毒獷2基因的原核表达与免疫原性分析
王宇婷 马莉莉 李晓月 王士霞 毕莹 倪宏波
摘要[目的]原核表达牛病毒性腹泻黏膜病毒(BVDV)E2基因编码蛋白。[方法]采用PCR方法从BVDV中扩增E2基因片段,与原核表达载体pET-32a连接,构建重组表达质粒pET-32a-E2,轉化E.coli(Rosetta)感受态细胞,重组菌用1 mmol/L IPTG诱导表达E2蛋白,进行SDS-PAGE电泳,并用Ni-NTA亲和层析柱纯化目的蛋白,经Western blot分析鉴定免疫原性。[结果]重组质粒pET-32a-E2经PCR及酶切鉴定证明构建正确,重组质粒能够在大肠杆菌中大量表达,表达产物的分子质量大小约为58 kDa,纯化后E2重组蛋白浓度0.521 mg/mL,Western blot分析表明,其能被BVDV阳性血清识别,具有很好的免疫原性。[结论]E2蛋白成功表达,为后续建立BVDV检测方法奠定了基础。
关键词牛病毒性腹泻黏膜病毒;E2基因;原核表达
中图分类号S852.4文献标识码
A文章编号0517-6611(2017)12-0122-02
Abstract[Objective]To prokaryotic express the bovine viral diarrheamuscosal disease viruses E2 gene encoding protein.[Method]Bovine viral diarrheamuscosal disease viruses E2 gene were amplified by PCR and linked into the pET32a prokaryotic expression vector,prokaryotic expression recombinant plasmid pET32aE2 was constructed,which was then trandformed into E.coli(Rosetta)cells for protein expression.E2 protein of recombinant strains was induced to express by 1 mmol/L IPTG and SDSPAGE electrophoresis,target protein was purified by NiNTA affinity chromatography column and the immunogenicity was identified by Western blot analysis.[Result]The recombinant plasmid pET32aE2 was confirmed by PCR,restriction enzyme.It had highlevel expression in E.coli.SDSPAGE showed that recombinant protein with molecular weight of 58 kDa,with concerntration of 0.521 mg/mL.Western blot showed that recombinant protien can reacts with positive serum,indicating good immunogenicity.[Conclusion]E2 protein is expressed in successfully,which lays foundation for establishing BVDV detection method in future.
Key wordsBovine viral diarrheamucosal disease viruses;E2 gene;Prokaryotic expression
牛病毒性腹泻/黏膜病(Bovine viral diarrhea/mucosal disease,BVD/MD)是由牛病毒性腹泻黏膜病毒(Bovine viral diarrheamucosal disease viruses,BVDV)引起的急性、接触性传染病。BVDV除感染牛外,还可感染猪[1],也会感染鹿、羊、骆驼、兔及其他动物,其宿主相当广泛。近年来也有人感染BVDV[2]以及从生物制品中分离出BVDV的报道[3]。
BVDV依据5′端非编码序列,可分成BVDV基因1型和BVDV基因2型;依据BVDV在细胞培养物中能否产生细胞病变,可分为致细胞病变型(Cytopathogenic,CP)和非细胞病变型(Noncytopathogenic,NCP),CP型是1.25 kDa,NCP型是1.23 kDa,包括一个开放阅读框、5′非翻译区和3′非编码区。其中C、Erns、E1和E2为结构蛋白,p7、NS2/3、NS4A、NS4B、NS5A和NS5B等为非结构蛋白[4]。E2蛋白是BVDV的主要保护性抗原蛋白。该试验对BVDV E2基因进行了克隆,并用大肠杆菌表达系统表达,通过SDS-PAGE和Western blot分析重组E2蛋白的反应原性,为BVDV检测方法的建立提供基础资料。
1材料与方法
1.1材料和试剂
BVDV-1 NADL株,pET-32a质粒、大肠杆菌Rosetta、DH5α感受态细胞、BVDV阳性血清由黑龙江八一农垦大学预防兽医实验室保存。RNA提取试剂盒购自北京博凌科为生物有限公司。蛋白纯化用的Ni螯合柱购自美国英杰生物技术有限公司。HRP标记的山羊抗小鼠二抗和PVDF膜购于北京中杉金桥公司。
1.2方法
1.2.1引物设计及合成。
参照GenBank上BVDV E2基因设计引物,引物序列为上游F1:5′—ACT GGATCC CACTTGGATTGCAAACCTGAATTCTCG—3′;下游F2: 5′—ATCG AAGCTT CCCTAAGGCCTTCTGTTCTGATAGAC—3′。
上游引物含有BamH Ⅰ位点,下游引物含有HindⅢ位点。引物及测序服务由北京华大基因公司完成。
1.2.2BVDV E2的原核表达载体构建。
以BVDV-1 NADL株的基因组为模板进行E2基因的扩增和测序分析,并将其连接到pET-32a表达载体上,转化E.coli(Rosetta)中并涂布在氯霉素和氨苄青霉素抗性的LB平板上,过夜培养,取单克隆扩大培养后提取质粒和酶切鉴定,得到pET-32a-E2阳性重组菌。
1.2.3BVDV E2基因在E.coli(Rosetta)中表达、纯化和检测。将重组质粒转入到E.coli(Rosetta)中,挑取单克隆扩大培养,37 ℃,180 r/min振荡培养过夜,1 mmol/L IPTG诱导6 h,收集菌液沉淀,用PBS反复悬浮2次,超声破碎,收集上清液和沉淀。分别对上清液和沉淀进行12% SDS-PAGE检测,确定蛋白是在包涵体中表达。离心后用Ni-NTA亲和层析柱按说明书来纯化蛋白。
1.2.4Western blot检测重组菌表达。
将纯化前的蛋白定量,12%SDS-PAGE电泳后转PVDF膜,5%的脱脂乳4 ℃过夜封闭,1∶100倍稀释一抗37 ℃孵育2 h,1∶5 000倍稀释二抗37 ℃孵育1 h,用DAB显色。
2结果与分析
2.1目的基因的PCR扩增
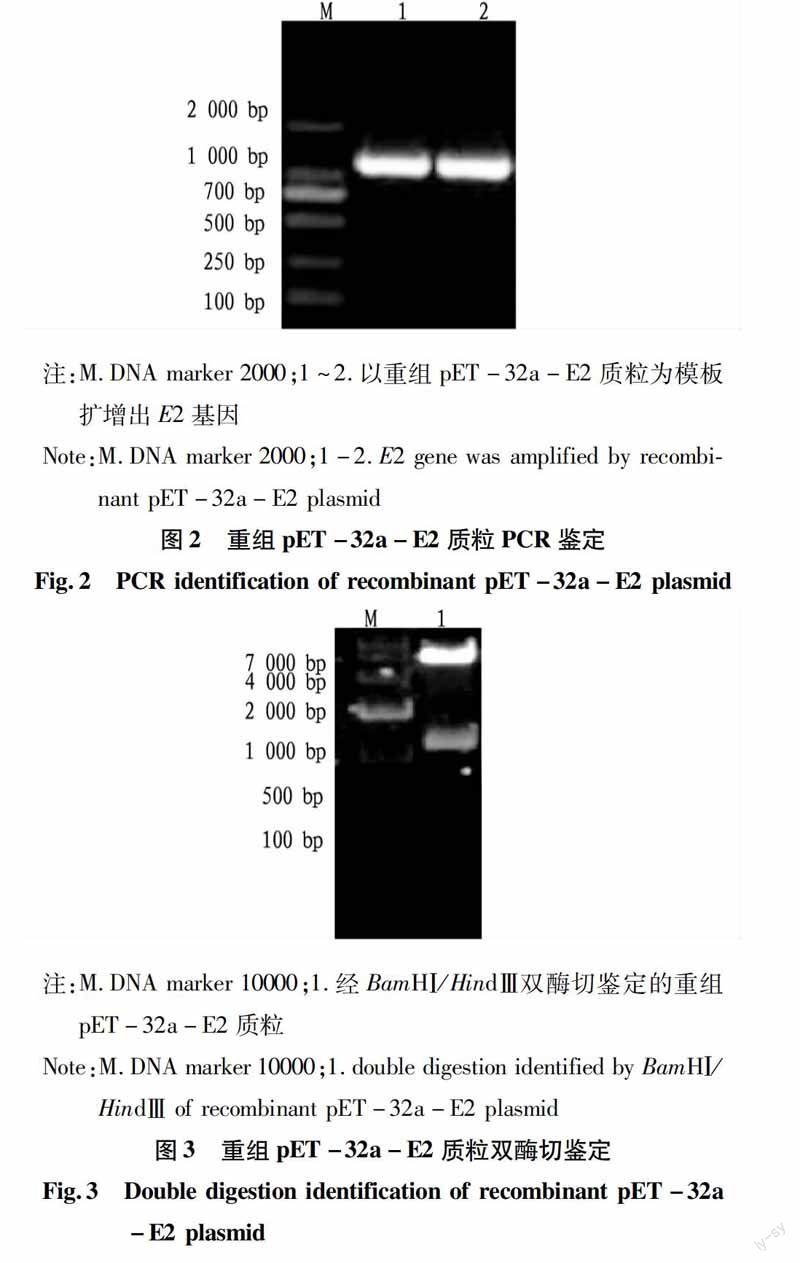
用F1/F2 引物扩增E2基因,PCR扩增产物经琼脂糖凝胶电泳检测得到约1 122 bp条带,与预期结果相符(图1)。
2.2重组质粒的PCR及酶切鉴定
将重组质粒pET-32a-E2用F1/F2引物扩增到1 122 bp条带(图2),用双酶切法鉴定重组质粒pET-32a-E2,用BamHⅠ/HindⅢ双酶切片段,同样经1%琼脂糖凝胶电泳检测得到5 900 bp和1 122 bp质粒片段,与预期结果相符(图3)。
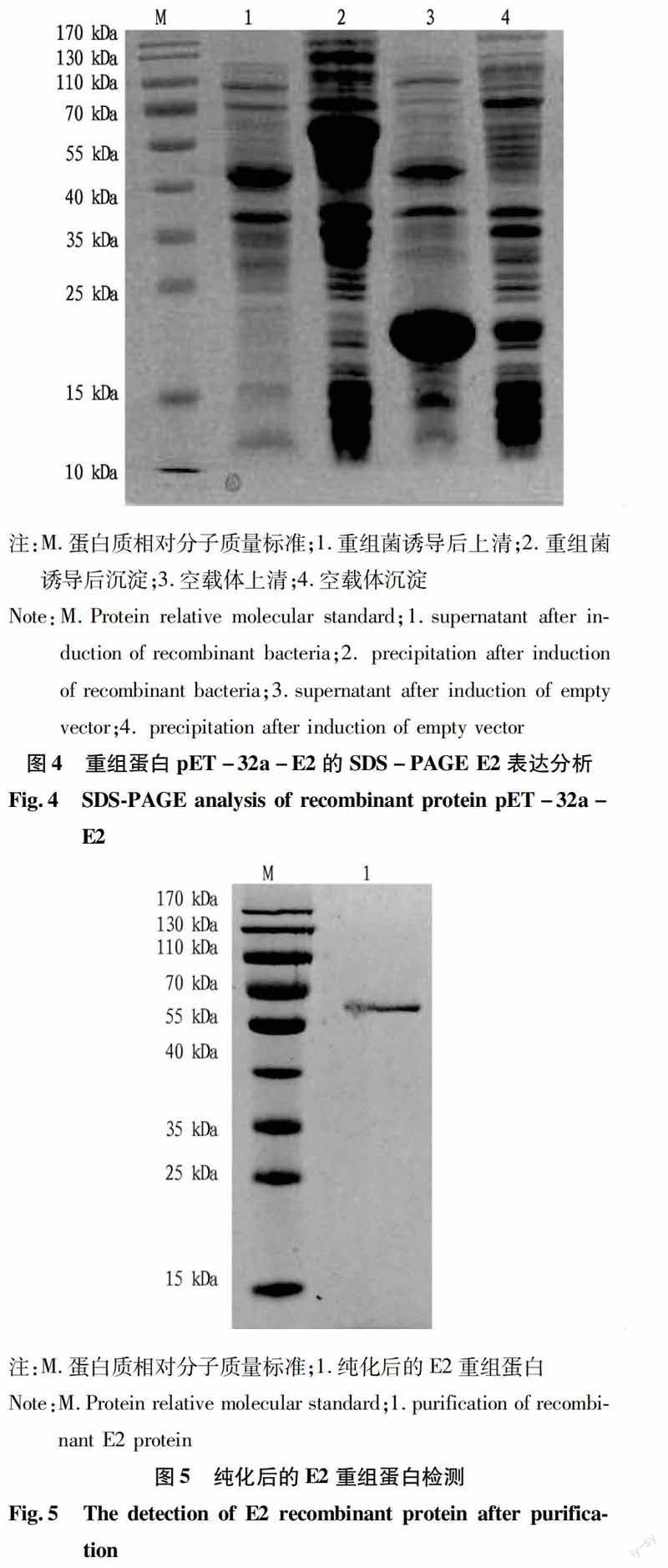
2.3重组蛋白的诱导表达
重组菌经IPTG诱导,12%SDS-PAGE分析表明,目的蛋白成功表达并经纯化后的重组蛋白与目的蛋白条带一致。重组蛋白pET-32a-E2相对分子质量约为58 kDa,与理论分析值相符合(图4~5)。
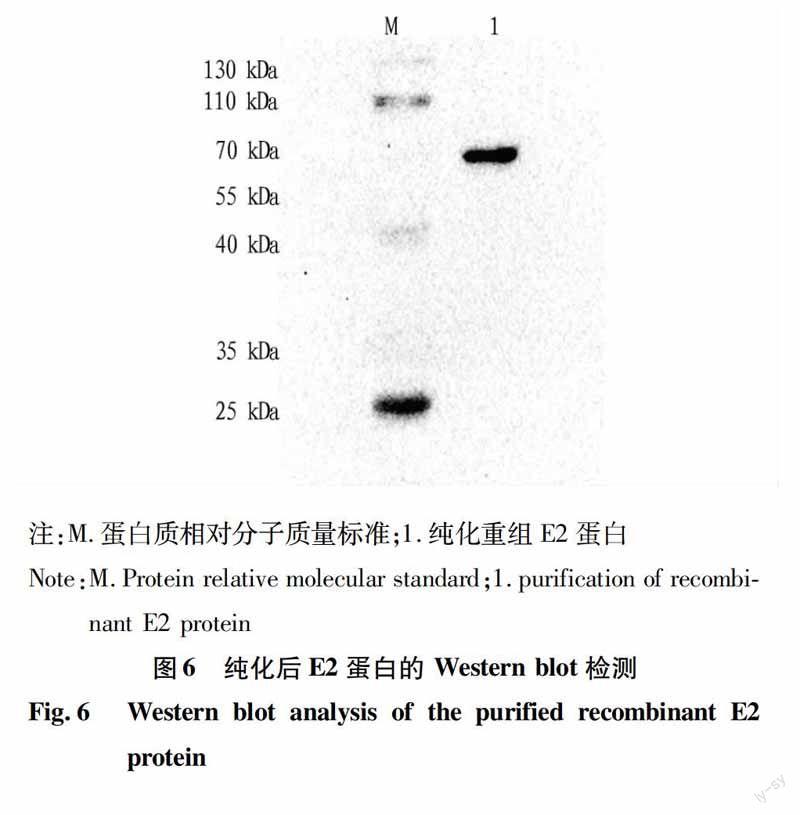
2.4Western blot鉴定
重组菌表达产物通过Western blot进行分析,结果显示,在58 kDa处有明显的条带,与理论分析值相符(图6)。
3讨论与结论
试验选择BVDV E2基因为研究对象,是由于在BVDV的结构基因中E2位于BVDV病毒粒子囊膜表面,能诱导感染动物产生病毒中和抗体并刺激机体发生免疫应答[5],因此E2作为诊断抗原很有意义。刘昱成等[6]对BVDV-2 E2基因进行原核表达,利用原核表达的E2蛋白建立的间接ELISA方法。鉴于国内BVDV-1型流行较为广泛,该试验根据BVDV-1型的E2基因原核表达并建立检测方法。同样,BVDV会引发持续感染。持续性感染的动物就会充当携带BVDV的宿主和感染源。持续性感染BVDV的母畜会抑制胎儿的先天免疫系统,使胎儿在早期妊娠期间产生免疫耐受,给养牛业的发展带来很大危害。Saliki等[7]建立的夹心ELISA来检测持续感染的牛;邓宇等[8]用纯化的BVDV免疫蛋鸡制备出的卵黄抗体作为包被抗体,建立牛病毒性腹泻病毒抗原捕获ELISA方法,都在BVD的流行病学调查中发挥了重要的作用。该试验根据GenBank的BVDV E2基因序列,设计特异性引物,扩增出BVDV E2基因,将其克隆到原核表达载体上,并成功表达,经Ni-NTA柱纯化后得纯度较高的E2蛋白(纯化后E2蛋白浓度0.521 mg/mL),Western blot分析表明,重组E2蛋白能与BVDV阳性血清发生特异性反应,说明纯化的重组E2蛋白有很好的免疫原性。以纯化的E2蛋白为抗原为建立BVDV检测方法奠定了基础。
参考文献
[1] 邓宇.猪源牛病毒性腹泻病毒研究进展[J].畜牧与兽医,2012,44(9):97-99.
[2] JONES L R,WEBER E L.Application of singlestranded conformation polymorphism to the study of bovine viral diarrhea virus isolates[J].Vet Diagn Invest,2001,13(1):50-56.
[3] PETERHANS E,BACHOFEN C,STALDER H,et al.Cytopathic bovine viral diarrhea viruses(BVDV):Emerging pestiviruses doomed to extinction[J].Vet Res,2010,41(6):44.
[4] 范進江,薄新文,钟发刚.牛病毒性腹泻病毒基因组结构与蛋白功能研究进展[J].动物医学进展, 2008,29(5):68-72.
[5] XUE W,MINOCHA H C.Identification of the cell surface receptor for bovine viral diarrhoea by using antiidotypic antibodies[J].J Gen Virol,1993,74(1):73-79.
[6] 刘昱成,孟庆玲,乔军,等.BVDV2 E2基因的原核表达及重组蛋白反应源性的研究[J].石河子大学学报(自然科学版),2013,31(6):680-683.
[7] SALIKI J T,HUCHZERMEIER R,DUBOVI E J.Evaluation of a new sandwich ELISA kit thatuses serum for detection of cattle persistently infected with BVD virus[J].Ann N Y Acad Sci,2000,916(1):358-363.
[8] 邓宇,王新华,郭燕,等.牛病毒性腹泻病毒抗原捕获ELISA检测方法的标准化研[J].中国预防兽医学报,2007,29(7):541-544.

