保护酶CAT在木薯种质抗螨中的功能初步研究
梁晓 卢芙萍 卢辉 伍春玲 何宏力 陈青 朱俊洪

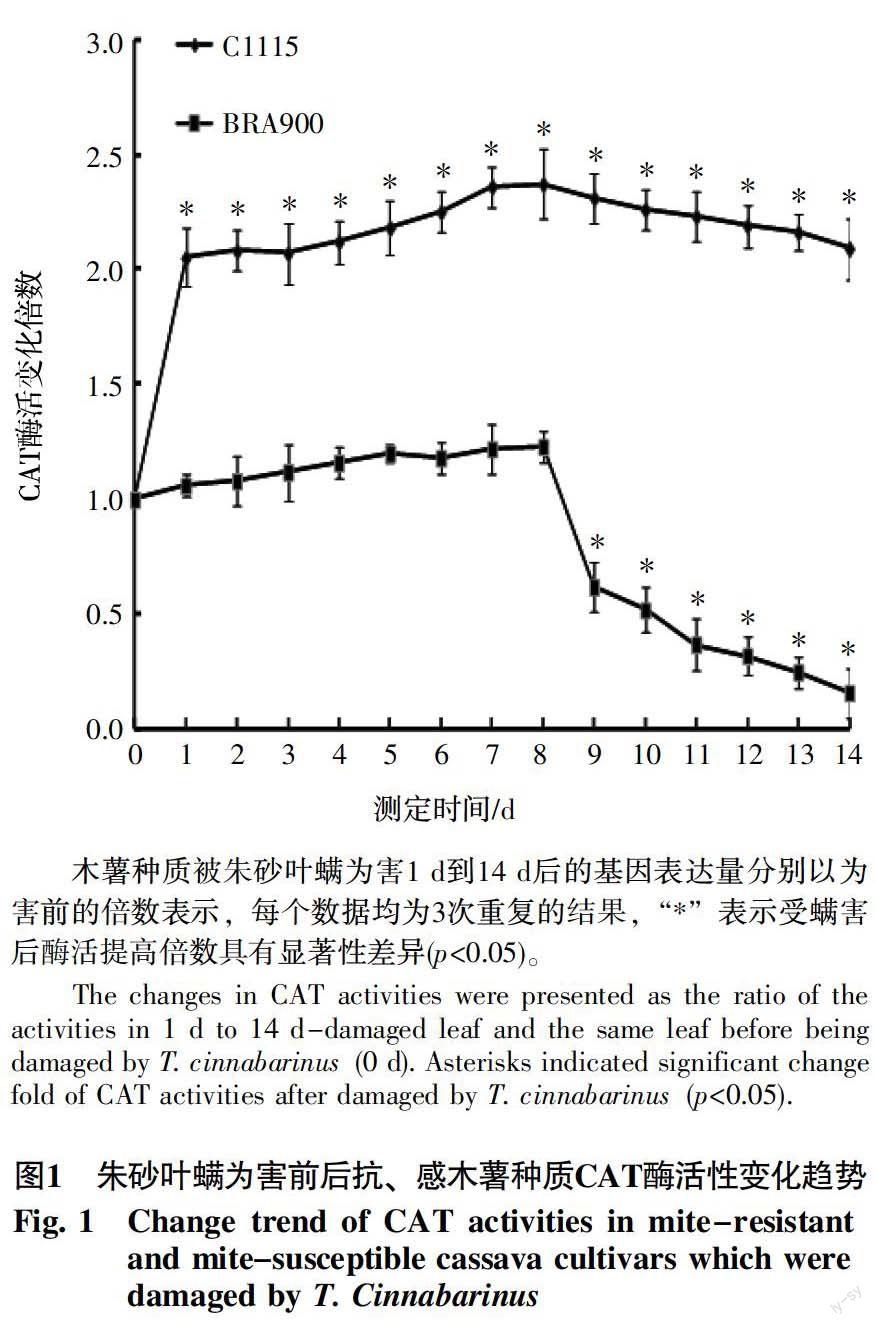

摘 要 为验证保护酶CAT在木薯抗螨中的功能,测定分析了朱砂叶螨取食抗、感螨木薯种质后,CAT的表达量和酶活分别在木薯和朱砂叶螨中的变化情况。结果表明,一方面,朱砂叶螨取食1 d和8 d后,感螨木薯种质BRA900体内MeCAT1的表达量和CAT总酶活仅分别较为害前提高1.11倍、1.24倍和1.06倍、1.15倍,而在抗螨木薯种质C1115体内则分别较为害前提高2.75倍、2.62倍和2.36倍、2.38倍,均显著高于感螨木薯水平。另一方面,朱砂叶螨取食感螨种质BRA900 1 d和8 d后,保护酶TcCAT的基因表达量和CAT酶活分别是为害前的1.13倍、0.98倍和1.02倍、0.99倍,而取食抗螨木薯种质C1115 1 d和8 d后分别降低至为害前的0.57倍、0.61倍和0.52倍、0.61倍,均显著低于取食感螨木薯水平。以上结果初步证实了保护酶CAT在木薯中被诱导能够缓解朱砂叶螨造成的氧化损伤,在朱砂叶螨中被抑制不利于取食为害,从而形成木薯抗螨性的功能。本研究为将CAT作为基因资源应用于抗螨木薯种质创制提供了理论基础。
关键词 CAT;朱砂叶螨;木薯种质;抗螨功能
中图分类号 S433.1;S433.7 文献标识码 A
Abstract In order to validate the function of catalase(CAT)in cassava resistance to mite, we determined the changes of transcriptions and activities of CAT in either cassava or Tetranychus cinnabarinus after the mite-resistant and mite-susceptible cassava cultivars were damaged by T. cinnabarinus. The results showed that, in one hand, compared to the same leaves before damaged by T. cinnabarinus, the transcriptions of MeCAT1 and total activities of CAT in leaves of 1 d and 8 d-damaged mite-susceptible cassava cultivar BRA900 was 1.11- and 1.24-fold, 1.06- and 1.15-fold, respectively, while the corresponding multiples of transcriptions in 1 d and 8 d-damaged leaves of mite-resistant cassava cultivar C1115 was 2.75- and 2.62-fold, and was 2.36- and 2.38-fold of total activities, respectively, which were both significantly higher than the levels of BRA900. In the other hand, when T. cinnabarinus feeding on BRA900 for 1 d and 8 d, the transcriptions of TcCAT and activities of CAT in T. cinnabarinus was 1.13 and 0.98-fold, 1.02- and 0.99-fold compared to those before feeding, respectively, while the corresponding multiples of transcriptions in T. cinnabarinus feeding on C1115 was 0.57- and 0.61-fold, and were 0.52- and 0.61-fold of total activities, respectively, which were both significantly lower than the levels of BRA900. These results preliminarily demonstrated that the induction of CAT could release oxidative damage caused by T. cinnabarinus, and the suppression of CAT could inhibit the feeding adaption of T. cinnabarinus, which both contribute to cassava resistance to mite. This study provides a theoretical basis for molecular breeding of mite-resistance cassava.
Key words Catalase; Tetranychus cinnabarinus; cassava; resistance to mite
doi 10.3969/j.issn.1000-2561.2017.02.024
木薯(Manihot esculenta Crantz)亦稱树薯,属大戟科木薯属,具有粗生粗长,耐贫瘠、干旱、高产、淀粉含量高等特点[1],是世界8亿人口的主粮和中国热带地区重要的工业原料、饲料、生物质能源和救荒作物,是仅次于水稻、玉米、甘蔗、甘薯的第五大作物,因其可在山地、坡地等随处种植,“不与人争粮,不与粮争地”,在热带地区农民增收方面发挥着极其重要的作用。近年来木薯在热区的种植面积不断增加,并逐渐成为中国热区农业的支柱产业之一[2]。
朱砂叶螨(Tetranychus cinnabarinus Boisduval)是危害木薯最严重的世界危险性害螨,自2005年以来,该螨在广西、广东、海南、云南、江西等地严重发生与成灾,导致当地木薯减产20%~30%,严重危害时可造成减产50%~70%[3],已成为严重制约木薯产业可持续发展的主要因子之一。目前,各木薯产区对于朱砂叶螨的防治仍依赖于化学药剂防治,但朱砂叶螨一般于木薯种植后6~8个月暴发成灾,此时的木薯地已封行,给喷施药剂造成很大困难,同时由于朱砂叶螨个体小、繁殖能力强、世代短、发育快等特点,比其他害虫容易产生抗药性,在化学防治过程中,因施药技术落后、农药的有效利用率不足、使用频率与剂量不断加大导致“3R”等问题日趋严重[3-4]。因此,寻求新的有效地控制朱砂叶螨的策略和方法成为当前木薯产业发展中亟待解决的重要问题。
当前,培育抗螨木薯是防治朱砂叶螨最经济、有效、简便的方法,而抗螨基因的挖掘及其功能研究是采用分子育种手段获得抗螨木薯的关键。害虫为害寄主植物时,其造成的组织创伤会在寄主植物体内产生过量的活性氧,影响植株正常生长。同时,害虫摄入的植物次生代谢物质也会造成害虫的氧化损伤,不利于取食为害。过氧化氢(hydrogen peroxide,H2O2)是导致氧化损伤的主要活性氧之一,过氧化氢酶(Catalase,CAT)能够将H2O2分解为水和氧气,是将H2O2含量维持在相对稳定水平的最重要的抗氧化酶[5-6]。因此,测定分析寄主植物和害虫互作时CAT基因表达和酶活力的变化情况将有助于研究CAT在作物抗虫中的功能。研究表明,CAT活性的增加与寄主植物的抗虫性关系密切[7-8]。然而迄今为止,尚缺乏保护酶CAT在木薯抗螨中的功能报道。因此,本研究通过测定朱砂叶螨取食抗螨木薯种质C1115和感螨木薯种质BRA900后,CAT基因表达量和酶活力分别在木薯和朱砂叶螨体内的变化情况,初步验证其在木薯种质抗螨中的功能,为采用分子育种手段进行抗螨木薯种质创制提供理论基础和材料支撑。
1 材料与方法
1.1 材料
1.1.1 供试木薯种质 抗螨木薯种质C1115,感螨木薯种质BRA900[9]由中国热农业科学院热带作物品种资源研究所国家木薯种质资源圃提供。
1.1.2 供试朱砂叶螨饲养 参考李迁的方法进行朱砂叶螨的室内饲养[9]。
1.1.3 试验器材 Ultraspec 3000紫外可见光分光光度计(Pharmacia Biotech, Ltd., Cambridge, UK)、MJ Research PTC-100 PCR仪(MJ Research Inc.)组织匀浆机、高速冷冻离心机、Bio-Rad iCycler & iQ Real-Time PCR系统(Bio-Rad,USA)等。
1.1.4 试验药品 配制缓冲液的相关试剂均为国产分析纯试剂,缓冲液按照分子克隆实验指南(第三版)配制。RNA提取及酶活测定相关试剂均购自Sigma公司(Sigma-Aldrich Company,USA)。Trizol试剂盒Invitrogen(Invitrogen Inc. USA),DNaseⅠ试剂盒,cDNA合成试剂盒,Master mix,MaximaTM SYBR Green qPCR Master Mix试剂盒均为Fermentas公司产品(Fermentas, Glen Burnie, MD)。
1.2 方法
1.2.1 酶液提取及活性测定 测定木薯叶片的CAT酶活时,将50头朱砂叶螨雌成螨接种于室内种植3个月的木薯顶芽下方叶片上。为测定CAT酶活性在抗螨木薯C1115和感螨木薯BRA900中的变化趋势,取100 mg受螨害的叶片用于酶液提取,同时以为害前的100 mg叶片组织CAT酶活作为对照。采样从接种害螨1 d一直进行到14 d,采样间隔期也为1 d,以确定CAT酶活变化最显著的取样时间。测定朱砂叶螨CAT酶活时,将大约200头朱砂叶螨雌成螨接种于采自田间生长6个月的健康木薯叶片上,并按照1.1.2的方法室内饲养,分别取200头取食前,取食抗、感木薯葉片的成螨用于酶活分析。上述各个木薯或朱砂叶螨处理均设置3个重复。CAT酶活测定参照Lu[10]的方法以H2O2的消耗量来计算。测定时反应混合液(1.5 mL)包含50 mmol/L磷酸盐缓冲液(pH7.0),15 mmol/L H2O2,以及100 μL酶提取液。H2O2的消耗量通过测定240 nm波长下的吸光值,并由摩尔消光系数(36 mol/L cm)定量。CAT的酶活表示为CAT单位/每分钟/每克蛋白。
1.2.2 保护酶基因CAT表达量的荧光定量PCR测定
木薯叶片和朱砂叶螨的RNA样品采集方法与酶活分析相同,两者总RNA的提取参照Trizol RNA提取试剂盒进行。经gDNA Eraser(TaKaRa Biochemicals, Dalian, China)处理去除基因组DNA后,取1.0 μg RNA用于cDNA的合成。cDNA样品经nuclear-free水10倍稀释后作为荧光定量PCR的模板,分别以木薯Meactin和朱砂叶螨Tcactin为管家基因,相关基因的引物信息[11]如表1所示。PCR反应条件为:95 ℃预温育1 min后,以40个循环完成如下程序:95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸20 s。分别以来源于未经朱砂叶螨为害的木薯叶片和未取食木薯叶片的朱砂叶螨的cDNA为对照,被为害或取食的木薯MeCAT1和朱砂叶螨TcCAT基因表达量以为害前的相对倍数表示,根据Pfaffl的2-ΔΔCt方法计算而得[12],每个处理均设置3个重复。
1.3 数据分析
采用SPSS软件进行数据分析,显著性差异分析采用Student's t-test方法,所有数据均为3个生物学重复的平均值±标准(Means±SE),显著性检测水平为p<0.05。
2 结果与分析
2.1 抗、感木薯种质受朱砂叶螨为害后CAT酶活变化趋势分析
从图1可以看出,抗螨木薯种质C1115受朱砂叶螨为害1 d后,叶片中CAT的活性与为害前相比显著升高,随后酶活变化倍数缓慢增加至8 d达到最大值,而为害9~14 d时,又呈现缓慢下降趋势,1~14 d内抗螨木薯CAT的活性分别达到为害前的2.05~2.37倍,并始终维持在显著升高的水平(Student's t-test, p<0.05)。感螨木薯种质受螨害1~8 d过程中,CAT活性变化不大,分别达到为害前的1.06~1.23倍,而受螨害9~14 d过程中,随着木薯叶片受害逐渐严重,CAT活性分别显著降低至受害前的0.62~0.16倍。基于以上结果,我们最终选择1 d和8 d作为CAT酶活和基因表达量测定的最佳时间点。
2.2 朱砂叶螨为害前后抗、感木薯叶组织中MeCAT1基因表达量差异分析
从图2可以看出,朱砂叶螨为害前后抗、感木薯种质叶组织中MeCAT1基因表达量变化倍数存在显著差异。朱砂叶螨为害1 d和8 d后,感螨木薯种质BRA900叶组织中MeCAT1的基因表达量仅分别较为害前提高1.11倍和1.24倍,而抗螨木薯种质C1115叶组织中MeCAT1的基因表达量较为害前分别提高2.75倍和2.62倍,以上结果表明抗螨木薯种质C1115能够通过显著提高保护酶MeCAT1的转录水平,有效清除朱砂叶螨为害累积的活性氧,从而较感螨种质BRA900具有更强的抗螨害能力。
2.3 朱砂叶螨为害前后抗、感木薯种质叶组织中CAT总活力差异分析
从图3可以看出,朱砂叶螨为害前后抗、感木薯种质叶组织中CAT总活力存在显著差异。朱砂叶螨取食1 d和8 d后,感螨木薯种质BRA900叶组织中CAT总活力较为害前提高1.06倍和1.15倍,而抗螨木薯种质C1115叶组织中CAT总活力較为害前分别提高2.36倍和2.38倍,以上结果表明木薯叶片中CAT总活力的变化趋势与基因水平相一致,抗螨木薯种质C1115通过显著提高保护酶CAT的活力,有效清除朱砂叶螨为害累积的活性氧,从而较感螨种质BRA900具有更强的抗螨害能力。
2.4 取食抗、感木薯种质前后朱砂叶螨体内TcCAT基因表达差异分析
从图4可以看出,取食抗、感木薯种质前后朱砂叶螨体内TcCAT基因表达量变化存在显著差异。朱砂叶螨取食感螨木薯种质BRA900 1 d、8 d后体内保护酶TcCAT的表达量分别是为害前的1.13倍和0.98倍,而取食抗螨木薯种质C1115 1 d、8 d后TcCAT的表达量降低至为害前的0.57倍和0.61倍。上述结果表明与取食感螨种质BRA900相比,取食抗螨种质C1115后,朱砂叶螨体内TcCAT表达受到了显著抑制削弱了朱砂叶螨修复自身氧化损伤的能力,不利于其为害抗螨种质C1115。
2.5 取食抗、感木薯种质前后朱砂叶螨体内CAT酶活力差异分析
从图5可以看出,取食抗、感木薯种质前后朱砂叶螨体内CAT酶活力变化存在显著差异。朱砂叶螨取食感螨木薯种质BRA900 1 d、8 d后体内CAT酶活力分别是为害前的1.02倍和0.99倍,而取食抗螨木薯种质C1115 1 d、8 d后CAT酶活力降低至为害前的0.52倍和0.61倍。上述结果表明朱砂叶螨取食抗、感螨木薯种质后酶活的变化趋势与基因水平一致,取食抗螨种质C1115后CAT酶活力被显著抑制削弱了朱砂叶螨修复自身氧化损伤能力,不利于其为害抗螨种质C1115。
3 讨论
寄主植物受害虫为害后保护酶被诱导与其植物抗虫性显著相关[8,10,14]。Bendnarski等[6]测定了豌豆幼苗叶子受长管蚜为害后的氧化应激反应,发现CAT活性的提高可以显著增强豌豆苗的抗蚜力。王梅玉等[13]研究发现,不同品种番茄受刺皮瘿螨为害后体内CAT等保护酶活性有所提高,且以抗螨品系YZ618提高幅度最大。Lu等[14]研究发现抗螨橡胶树种质被6点始叶螨取食后,CAT的活性也呈现显著提高的趋势。此外,研究还发现CAT等保护酶活性被诱导可能与黄瓜幼苗应对烟粉虱为害的自我保护机制相关[15]。本研究发现,抗螨木薯种质C1115被朱砂叶螨为害后,MeCAT1基因表达量和CAT总酶活均较为害前有显著提高,并且表达量提高倍数显著高于感螨种质BRA900。保护酶CAT能够有效缓解朱砂叶螨取食后造成的氧化损伤,是形成C1115的抗螨能力的重要因素。
害虫取食寄主植物时,害虫体内保护酶基因表达量和酶活性显著被抑制也与寄主植物抗虫性关系密切[16-17]。Krishnan等[16]发现棉贪夜蛾取食西红柿后体内CAT的活性显著高于取食半人工饲料,并推断CAT活性增强是形成其对西红柿寄主取食适应性的主要因素。对森林天幕毒蛾和白斑毒蛾的研究表明[17],两种毒蛾取食寄主植物时摄入的单宁酸均能够显著抑制中肠CAT的活性而不利于其为害。本研究中朱砂叶螨取食抗螨木薯种质C1115后,体内TcCAT的表达量和活性与取食前相比显著下降,表明抗螨木薯C1115抑制了朱砂叶螨CAT修复自身氧化损伤的功能,不利于被朱砂叶螨为害;而朱砂叶螨取食感螨木薯种质BRA900后,体内CAT的表达量和活性与取食前相比变化不大,说明朱砂叶螨能够正常启动活性氧清除机制以应对摄入的次生代谢物质造成的氧化损伤,从而易于在感螨木薯BRA900上为害。
本研究表明抗螨木薯能够通过提高CAT基因表达量和酶活增强自身修复氧化损伤能力,同时通过抑制朱砂叶螨CAT酶活不利于螨害发生。以上两个方面是木薯形成抗螨能力的重要因素,并初步证实保护酶CAT在木薯种质抗螨中的功能,具有作为有效基因资源应用于抗螨木薯分子育种的应用潜力,但其功能有待进一步研究与验证。
参考文献
[1] Cock J H. Cassava: a basic energy source in the tropics[J]. Science, 1982, 218(4574): 755-762.
[2] 伍 薇, 柯佑鹏. 中国木薯产业发展现状及前景展望[J]. 中国热带农业, 2011, 12(3): 6-9.
[3] 陈 青, 卢芙萍, 黄贵修, 等. 木薯害虫普查及其安全性评估[J]. 热带作物学报, 2010, 31(5): 819-827.
[4] Smith C M. Plant resistance to insects. A fundamental approach[M]. New York: John Wiley and Sons Ltd., 1989.
[5] Andre C, Kim S W, Yu X H, et al. Fusing catalase to an alkane-producing enzyme maintains enzymatic activity by converting the inhibitory byproduct H2O2 to the cosubstrate O2[J]. Proc Natl Acad Sci USA, 2013, 110(8): 3 191-3 196.
[6] 胡甘雨, 司风玲, 车燕飞, 等, 葱蝇过氧化氢酶基因的克隆及生物信息学分析[J]. 西南大学学报(自然科学版), 2014, 34(1): 32-40.
[7] 李毅平, 龚 和. 昆虫体内抗氧化系统研究进展[J]. 生命科学, 1998, 10 (5): 240-243.
[8] Bednarski, W Borowiak-Sobkowiak, B Wilkaniec, et al. Oxidative stress in pea seedling leaves in response to Acyrthosiphon pisum infestation[J]. Phytochemistry, 2013, 93: 49-62.
[9] 李 遷, 卢芙萍, 陈 青, 等. 木薯种质对朱砂叶螨的抗性评价[J]. 热带作物学报, 2015, 36(1): 143-151.
[10] Lu F, Chen Q, Chen Z, et al. Effects of heat stress on development, reproduction and activities of protective enzymes in Mononychellus mcgregori[J]. Exp Appl Acarol, 2014, 63(2): 267-284.
[11] Xu J, Duan X, Yang J, et al. Enhanced reactive oxygen species scavenging by overproduction of superoxide dismutase and catalase delays postharvest physiological deterioration of cassava storage roots[J]. Plant Physiol, 2013, 161(3): 1 517-1 528.
[12] Pfaffl, M W. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Res, 2001, 29(9): e45-e45.
[13] 王梅玉, 王冬生, 洪晓月, 等. 番茄叶片理化性质差异与抗番茄刺皮瘿螨性[J]. 昆虫知识, 2008, 45(6): 904-908.
[14] Lu F, Chen Z, Lu H, et al. Effects of resistant and susceptible rubber germplasms on development, reproduction and protective enzyme activities of Eotetranychus sexmaculatus (Acari: Tetranychidae)[J]. Exp Appl Acarol, 2016: 1-17.
[15] Zhang S Z, Hua, B Z, Zhang F. Induction of the activities of antioxidative enzymes and the levels of malondialdehyde in cucumber seedlings as a consequence of Bemisia tabaci (Hemiptera: Aleyrodidae) infestation[J]. Arthropod-Plant Inte, 2008, 2(4): 209-213.
[16] Krishnan N, Kodrík, D. Antioxidant enzymes in Spodoptera littoralis (Boisduval): are they enhanced to protect gut tissues during oxidative stress?[J]. J Insect Physiol, 2006, 52(1): 11-20.
[17] Barbehenn R V. Gut-based antioxidant enzymes in a polyphagous and a graminivorous grasshopper[J]. J Chem Ecol, 2002, 28(7): 1 329-1 347.

