香蕉枯萎病菌4号生理小种cat1基因敲除与表型分析
王小琳 李春强 杨景豪 李文彬 孙建波 彭明


摘 要 前期蛋白质组学研究发现尖孢镰刀菌古巴专化型4号生理小种(Foc4)中的过氧化氢酶1(cat1)基因受到巴西蕉诱导上调表达,为研究cat1基因在Foc4侵染香蕉过程中的作用,利用同源重组方法敲除Foc4的cat1基因,并对获得的敲除突变体开展表型分析和致病性测定。结果表明:cat1基因缺失对Foc4的菌丝、孢子形态、菌落生长、抗渗透压胁迫和细胞壁选择性压力等没有影响;但引起菌株抵抗外源氧胁迫、细胞壁穿透能力、纖维素利用能力减弱和对巴西蕉的致病性减弱。显示cat1基因的产物通过清除香蕉分泌的活性氧在Foc4对香蕉的致病过程中起作用,并参与病原菌对寄主纤维素成分的代谢。此结果为进一步深入研究香蕉枯萎病菌的致病机理奠定基础。
关键词 巴西蕉;尖孢镰刀菌古巴专化型;cat1基因;基因敲除;致病性
中图分类号 S436.681 文献标识码 A
Abstract It was found that the cat1 gene in Fusarium oxysporum f. sp. cubense race 4(Foc4)was up-regulated induced by Musa sp. AAA. cv. Baxi in our previous proteomics analysis. In order to investigate the function of cat1 during the host infection process of Foc4, the cat1 gene in Foc4 was deleted by the homologous recombination method. The phenotype and pathogenicity of the cat1 knockout mutants were then analyzed. The results indicated that there were no apparent difference between the mutants and the wild type strain on mycelium and spores morphology, colonial growth, osmotic stress resistance and cell wall selective pressure. However, the mutants showed significant decrease in the abilities of exogenous oxygen stress resistance, penetrability of cell wall, cellulose utilization, and the pathogenicity to Musa spp. AAA. cv. Baxi. These results suggested that the cat1 gene in Foc4 should be involved in pathogenesis by scavenging host-derived ROS, and participated in the process of host cellulose degradation.
Key words Musa spp. AAA. cv. Baxi; Fusarium oxysporum f. sp. cubense; cat1 gene; knockout; pathogenicity
doi 10.3969/j.issn.1000-2561.2017.02.023
香蕉属于芭蕉科(Musaceae)芭蕉属(Musa),是全球最大的草本开花植物。香蕉作为著名的热带和亚热带水果,其进出口贸易量和年交易量占各类水果之首,交易金额也达到了世界第二[1]。由尖孢镰刀菌古巴专化型(Fusarium oxysporum f. sp. cubense, Foc)引起的香蕉枯萎病是制约香蕉生产的重要原因之一。尖孢镰刀菌属半知菌类(Fungiimperfecti)梗孢目(Moniliales)痤孢科(Tubercular)镰刀菌属(Fusarium)。尖孢镰刀菌通过侵染寄主植物维管束系统,破坏植物的输导组织,并能够在生长发育代谢过程中产生毒素危害作物,造成植物枯萎继而死亡,影响产量。香蕉枯萎病是一种土传病害,目前还没有一种防治效果理想的化学药剂,且化学防治存在田间药剂流失严重、危害环境和人类的健康等问题,因此,培育抗病品种成为十分迫切的替代策略[2]。探讨尖孢镰刀菌的致病相关基因的功能,可深入了解尖孢镰刀菌的致病机理,有利于抗病育种研究。
近年来,虽然关于香蕉枯萎病菌致病相关基因的研究已经取得了一定的进展[3-5],但离详细阐明枯萎病菌的致病机理还有一定的距离。本研究室通过蛋白组学的研究发现Foc4中过氧化物酶系统中的过氧化氢酶1(catalase1,cat1)受到巴西蕉诱导后蛋白表达量上调了2.4倍,而Foc1中却无明显变化(未发表),提示cat1可能在Foc4的致病过程中起作用。众所周知,病原真菌中存在的抗氧化系统对其成功感染宿主起重要作用。人体病原真菌能够成功侵染寄主的前提是它们能够抵抗在侵染过程中寄主效应细胞产生的活性氧,而过氧化氢酶在植物和某些人类病原菌的致病机理中起着重要作用,包括空肠弯曲菌[6]、结核杆菌[7]、根癌土壤杆菌[8]等。但cat1基因在尖孢镰刀菌古巴专化型中的功能尚未见报道。为了阐明Foc4中的cat1基因是否在病原菌的致病过程中发挥作用,笔者利用DNA同源重组的方法对Foc4的cat1基因进行敲除,并对敲除突变体的致病性和表型进行分析。
1 材料与方法
1.1 材料
尖孢镰刀菌古巴专化型(Fusarium oxysporum f.sp. cubense)4号生理小种B2菌株,由黄俊生研究员惠赠,分离自海南岛并进行了基因组测序。pCT74质粒由本研究室保存(福建省农科院惠赠)。巴西蕉(Musa spp. AAA. cv. Baxi)由中国热带农业科学院组织培养中心提供。试验用到的培养基或试剂有:PDA、PDB培养基和纤维素刚果红培养基(购自海博生物);再生培养基、STC溶液和PTC溶液按黄东杰等[9]的方法进行配制;Driselase崩溃酶(20 mg/mL,Sigma),Lysing Enzyme溶壁酶(20 mg/mL,购自广东省微生物研究所);V8培养基(V8果汁200 g/L,CaCO3 3.0 g/L,琼脂20 g/L,pH值5.8)。
1.2 方法
1.2.1 真菌基因组DNA的提取 将野生型B2菌株接种于PDB培养基中,200 r/min、28 ℃摇床振荡培养5 d,过滤收集菌丝体,之后用CTAB法[10]提取基因组DNA。
1.2.2 cat1基因敲除载体的构建 根据野生型基因组DNA测序序列,分别在cat1基因的上下游截取800~1 500 bp左右的DNA序列,记为同源臂A和同源臂B,并设计引物,记为cat1-AF和cat1-AR、cat1-BF和cat1-BR(表1)。用这2对特异引物以野生型基因组DNA为模版进行PCR扩增,获得cat1基因開放阅读框上游5′端的同源臂A和下游3′端的同源臂B的DNA。PCR扩增采用2×Taq PCR master Mix试剂(TIANGEN),PCR反应条件为:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min,31个循环;最后72 ℃延伸补齐7 min。经1.0%琼脂糖凝胶电泳后回收PCR产物。
将回收DNA用pLB零背景快速克隆试剂盒连接至pLB载体,构建pLB-A和pLB-B克隆载体;用限制性内切酶KpnⅠ和ApaⅠ将pLB-A克隆载体进行酶切,之后连接于经相同限制性内切酶线性化的pCT74载体(包含潮霉素抗性基因hph和GFP基因表达盒)中,构建pCT74-A克隆载体;用限制性内切酶EcoRⅠ和SpeⅠ将pLB-B克隆载体进行酶切,之后连接于经相同限制性内切酶线性化的pCT74-A克隆载体中,构建cat1基因敲除载体,即A-pCT74-B敲除载体;以A-pCT74-B敲除载体为模版,用同源臂A的前引物cat1-AF和同源臂B的后引物cat1-BR进行PCR扩增,获得用于转化的线性DNA片段,即A+hph+gfp+B。PCR扩增采用PrimeSTAR Max Premix(2×)试剂(TaKaRa),PCR反应条件为:98 ℃变性10 s;55 ℃退火5 s;72 ℃延伸30 s,35个循环。最后回收纯化备用。
1.2.3 尖孢镰刀菌原生质体制备和DNA转化 参照黄东杰等[9]和李春强等[11]的方法进行,连续培养4代获得稳定转化子。
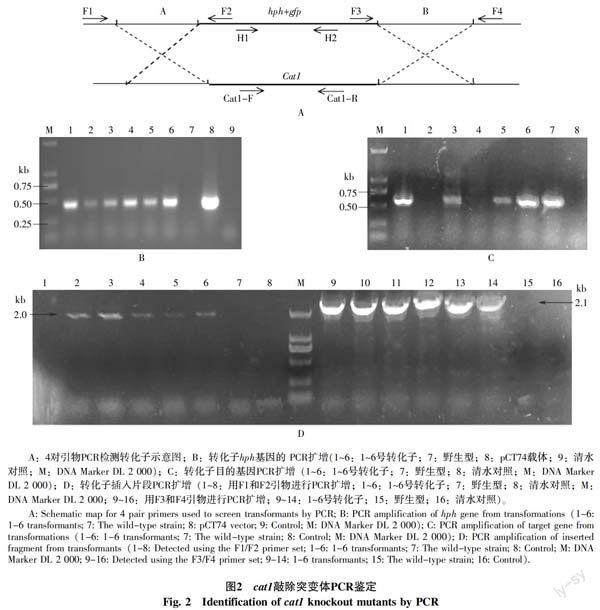
1.2.4 cat1基因敲除突变体的鉴定 用CTAB[10]法提取转化子基因组DNA,以转化子和野生型菌株的基因组DNA为模板,根据基因组序列设计特异引物,对转化子进行PCR扩增检测。引物H1和H2检测hph+GFP片段是否整合到基因组中;引物F1和F2检测转化子是否在目的基因上游5′端发生同源重组;引物F3和F4检测转化子是否在目的基因下游3′端发生同源重组;引物cat1-F和cat1-R检测转化子是否敲除掉目的基因。预计的扩增片段分别约490、2 000、2 100、600 bp。如果引物H1和H2、F1和F2、F3和F4的PCR扩增结果均为阳性,且引物cat1-F和cat1-R的PCR扩增结果为阴性,就可确定该转化子为cat1基因敲除突变体。PCR扩增采用2×Taq PCR master Mix试剂(TIANGEN),PCR反应条件为:94 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸3 min,31个循环;最后72 ℃延伸补齐7 min。
1.2.5 突变体表型观察
(1)菌落形态观察:在敲除突变体和野生菌的培养皿上打取Φ=5 mm的菌饼,分别接种于PDA和V8培养基上,每个菌株接种3个重复,28 ℃培养6 d后拍照记录。
(2)玻璃纸穿透实验:分别从敲除突变体和野生型的菌落上打取菌饼倒贴至PDA平板中央,将半径为4 cm的半圆形玻璃纸灭菌后贴在培养基上,并使其覆盖住3/4的菌块,3个重复,28 ℃倒置培养5 d后拍照记录。
(3)纤维素利用实验:打取Φ=5 mm的敲除突变体和野生菌的菌饼分别接种于纤维素刚果红培养基中,3个重复,28 ℃培养7 d后观察菌落形态,并拍照记录。
(4)过氧化氢耐受性实验:打取Φ=5 mm的敲除突变体和野生菌的菌饼,分别接种于含有不用浓度H2O2的PDA(0.1%、0.25%、0.5%)平板上,每个梯度做3个重复,28 ℃培养5 d后观察菌圈大小,并拍照记录。
(5)渗透压胁迫实验:打取Φ=5 mm的敲除突变体和野生菌的菌饼分别接种于不同浓度NaCl(1、2 mol/L)的PDA平板上,每个梯度做3个重复,28 ℃培养5 d后观察菌落形态,并拍照记录。
(6)细胞壁选择性压力实验:打取Φ=5 mm的敲除突变体和野生菌的菌饼分别接种于不同浓度山梨醇(1、2 mol/L)的PDA平板上,每个梯度做3个重复,28 ℃培养5 d后观察菌落形态,并拍照记录。
1.2.6 致病性测定
(1)离体叶片实验:将巴西蕉叶片用75%酒精消毒,并用无菌水冲洗晾干后,再用灭菌针在叶片正面叶脉上刺出伤口,分别打取Φ=5 mm的敲除突变体和野生菌的菌饼,接种在伤口处,使用蘸有无菌水的灭菌棉片覆盖在接种的伤口上保湿,3个重复,确保每个重复使用同一片叶片。28 ℃培养5 d后观察菌落形态,并拍照记录。
(2)香蕉苗致病性实验:选取长势良好苗期相同的巴西蕉(株高约10 cm,有5~6片叶子),用灭菌针头对香蕉苗的健康白色的根进行刮伤处理,分别打取Φ=5 mm的敲除突变体和野生菌的菌饼,接种在伤口处,同时接种PDA作为对照,并用保鲜膜固定。每株苗刮伤2~4个伤口,每个菌种接种10株巴西蕉。实验重复3次。根据天气和土壤条件适当浇水。45 d后将球茎切开观察拍照,并记录每株幼苗发病级数[12]。
1.3 数据处理
香蕉幼苗发病情况用病情指数表示:病情指数=[∑(发病级数×该级株树)]/(最高级数×总株树)×100。同时计算香蕉苗的发病率,公式如下:发病率=(发病株树/实验测试总株数)×100%[12]。所得数据采用GraphPad Prism 6.02进行统计分析。
2 结果与分析
2.1 cat1基因敲除载体的构建
从图1-A可看出,用限制性内切酶KpnⅠ和ApaⅠ对pCT74-A克隆载体进行酶切,可切下约900 bp的DNA条带,即同源臂A;用EcoRⅠ和SpeⅠ对A-pCT74-B敲除载体进行酶切,可切下1 500 bp的DNA条带,即同源臂B。以A-pCT74-B敲除载体为模版,用引物cat1-AF和cat1-BR进行PCR扩增,扩增出一条5 000 bp左右的DNA条带(图1-B),与预计的条带大小相符,且测序结果表明克隆的DNA序列正确。上述结果表明cat1基因敲除載体构建成功。
2.2 cat1敲除突变体的PCR鉴定
转化共获得10个转化子,并在含有潮霉素抗性的PDA平板上再生培养后,随机选取其中6个转化子进行PCR扩增鉴定。以其基因组DNA为模板,分别用4对引物(H1和H2、F1和F2、F3和F4、cat1-F和cat1-R)进行PCR扩增鉴定(图2-A)。用H1和H2引物对进行PCR扩增,结果显示6个转化子和pCT74对照均能扩增出一条约490 bp的目的条带,野生型基因组DNA和清水对照均无条带(图2-B)。用cat1-F和cat1-R引物对进行PCR扩增,2号和4号转化子及清水对照均未扩增出条带,其他的转化子和野生型基因组DNA均能扩出一条600 bp左右的DNA条带(图2-C)。用F1和F2引物对进行PCR扩增,2~6号转化子均能扩增出一条2 000 bp左右的DNA条带,1号转化子、野生型基因组DNA和清水对照均无条带;用F3和F4引物对进行PCR扩增,1~6号转化子均能扩增出一条2 100 bp左右的DNA条带,野生型和清水对照均无条带(图2-D)。综上所述,可确定2号和4号转化子均为cat1基因敲除突变体。
2.3 cat1敲除突变体的表型观察
选取2号转化子作为cat1基因敲除突变体(即敲除子Δcat1)进行表型观察。
2.3.1 菌落形态观察 在激光共聚焦显微镜480 nm激发光下,Δcat1的孢子和菌丝均能够发出强而稳定的绿色荧光(图3-A),说明GFP蛋白在细胞中呈现组成型表达。对Δcat1在PDA平板上的生长观察发现,与野生型相比,Δcat1的长势稍慢一些,但并无明显差异;在V8培养基上,Δcat1和野生型长势相同;两者在PDA培养基上的菌落均以平铺为主,而在V8培养基上菌丝则呈现簇立状(图3-B)。
2.3.2 玻璃纸穿透实验 用玻璃纸可替代植物细胞壁来评测病原菌的穿透能力。野生型菌株可透过玻璃纸正常生长,而Δcat1则几乎不能透过玻璃纸生长(图3-C)。说明cat1基因的敲除能够大大减弱野生型菌株的穿透能力。
2.3.3 纤维素利用实验 在纤维素刚果红培养基上,Δcat1的菌丝相对于野生型明显薄很多(图3-D)。Δcat1利用纤维素的能力明显降低,显示cat1基因可能在Foc4纤维素利用的相关途径中起作用。
2.3.4 过氧化氢耐受性实验 在0.1% H2O2的PDA平板上,Δcat1和野生型菌株的形态和大小均无明显差异;在0.25% H2O2的浓度下,Δcat1开始表现出与野生型菌株的差异,菌落大小明显小于野生型菌株;而在0.5% H2O2浓度下,Δcat1几乎不能生长,而野生型菌株却还能生长(图3-E)。Δcat1对H2O2敏感性的增加,说明cat1基因对Foc4野生型菌株对抗外源氧化胁迫非常重要。
2.3.5 渗透压胁迫实验 在1 mol/L和2 mol/L NaCl的PDA平板上,Δcat1和野生型均表现出一致的长势。两者均在2 mol/L NaCl的浓度下生长受到明显的抑制(图3-F)。
2.3.6 细胞壁选择性压力实验 在含有不同浓度山梨醇的PDA平板上生长5 d后,Δcat1和野生型的菌落均没有明显的差别(图3-G)。
2.4 cat1敲除突变体的致病性测定
2.4.1 离体叶片实验 在香蕉的离体叶片正面叶脉接种5 d后,野生型在离体叶片上能形成较大面积的褐色病斑,且叶片背面有较多菌丝定殖;而Δcat1形成的病斑明显小许多,且背面只有少数菌丝定殖(图4-A)。这说明Δcat1的定殖能力大大减弱。
2.4.2 香蕉苗致病性实验 利用巴西蕉盆栽苗对Δcat1进行致病性测定。接种培养45 d后观察,结果发现接种野生型菌株的巴西蕉苗叶片表现出严重黄化枯萎现象,植株的叶片大面积黄化,且切开球茎观察到球茎部位褐化程度严重,发病症状达到了4~5级;而接种Δcat1菌株的巴西蕉苗叶片则表现出轻微的黄化现象,叶片顶部及边缘出现黄化现象,切开球茎观察,发现球茎有黄线,发病症状约在2~3级;接种PDA的对照巴西蕉苗均没有出现叶片黄化现象,且球茎发病症状为0级,无症状(图4-B、图4-C)。根据病情指数和发病率数据统计,接种Δcat1菌株的巴西蕉植株平均病情指数(37.4)和发病率(53.3%)低于野生型菌株的平均病情指数(62.9)和发病率(80%)(图5)。这表明cat1缺失突变体对巴西蕉的致病性减弱。
3 讨论
活性氧迸发是植物对病原菌的入侵产生的最明显的早期防御反应之一[13]。 当病原真菌入侵植物寄主时,植物会通过有氧呼吸和代谢等产生大量的活性氧,对病原真菌造成氧化胁迫。而病原真菌存在一至几种抗氧化系统,可逃避来自寄主细胞的活性氧簇的杀害。在真菌中,过氧化氢酶被认为是植物和病原菌互作过程中帮助病原菌消除寄主分泌的活性氧物质的重要成分[14]。
多数植物病原真菌含有一至数个过氧化氢酶[15]。新生隐球菌(Cryptococcus neoformans)的4个过氧化氢酶(Cat1、Cat2、Cat3、Cat4)在对抗内外源性的氧化胁迫时,能有相互功能性地重叠和互补[16]。烟曲霉中cat1基因编码的Cat1P过氧化氢酶参与体外过氧化氢的消除,且能与其他的cat基因一起作用,短暂地保护真菌免受寄主的防御反应活性氧迸发的伤害[17]。粗糙脉孢菌(Neurospora crassa)中的cat1主要存在孢子中,相比其他的过氧化氢酶更耐高温,且具有良好的盐碱稳定性,还可通过调节细胞内的氧浓度而使细胞抗氧化[18]。有报道稻瘟病菌catB突变株对大麦的致病力严重减弱,且对H2O2非常敏感,结果还发现catB在增强真菌细胞壁方面扮演着重要的角色,对真菌能够强有力地入侵寄主起到很大的作用[19]。
在Foc4中,齐兴柱等[20]研究发现catA和catC在H2O2诱导下上调表达。但catP2基因缺失突变体对外源氧化胁迫不敏感[21]。本研究结果发现,Foc4中的cat1基因敲除突变体玻璃纸穿透能力下降,对H2O2的敏感性增加,且在香蕉叶片的定殖能力大大减弱,对巴西蕉的致病性明显减弱,推测cat1能够透过消除寄主分泌的活性氧物质来参与病原菌对外源氧胁迫的反应,从而参与Foc4的致病过程。这与Foatf1基因的功能相似[3],他们之间可能存在某些联系。但cat1与其他几个cat之间的关系及其调控机制及其在病原菌致病性中的具体机理还有待进一步研究。
同时,本研究结果还发现Δcat1对纤维素的利用能力明显降低。过氧化氢酶能够通过共价修饰绑定到纤维素[22],但具体如何影响菌株对纤维素的利用,或者是cat1在Foc4的纤维素利用调控途径中起着某种作用,还需进一步研究。
参考文献
[1] 黄秉智, 周灿芳, 吴雪珍, 等. 2011年广东香蕉产业发展现状分析[J]. 广东农业科学, 2012, 39(5): 12-26.
[2] Kavino M, Kumar N, Damodaran T, et al. Biochemical markers as a useful tool for the early identification of Fusarium oxysporum f.sp cubense, race 1 resistance banana clones[J]. Archives of Phytopathology and Plant Protection, 2009, 42(11): 1 069-1 078.
[3] Qi X Z, Guo L J, Yang L Y, et al. Foatf1, a bZIP transcription factor of Fusarium oxysporum f.sp. Cubense, is involved in pathogenesis by regulating the oxidative stress responses of Cavendish banana(Musa spp.)[J]. Physiological and Molecular Plant Pathology, 2013, 84(1): 76-85.
[4] 王飞燕, 郭立佳, 杨腊英, 等. 尖孢镰刀菌古巴专化型4号生理小种fpd1基因敲除与表型分析[J]. 热带作物学报, 2015, 36(8): 1 462-1 468.
[5] 蒋艳琴, 曾 涛, 陈汉清, 等. 尖镰孢古巴专化型Focr4-1701突变体的生物学表型研究[J]. 基因组学与应用生物学, 2013, 32(3): 339-346.
[6] Day W J, Sajecki J L, Pitts T M, et al. Role of catalase in Campylobacter jejuni intracellular survival[J]. Infect Immun, 2000, 68(11): 6 337-6 345.
[7] Manca C, Paul S, Barry C E, et al. Mycobacterium tuberculosis catalase and peroxidase activities and resistance to oxidative killing in human monocytes in vitro[J]. Infect Immun, 1999, 67(1): 74-79.
[8] Xu X Q, Pan S Q. An Agrobacterium catalase is a virulence factor involved in tumorigenesis[J]. Molecular Microbiology, 2000, 35(2): 407-414.
[9] 黄东杰, 彭 明, 李春强. 几株尖孢镰刀菌的绿色荧光蛋白基因轉化[J]. 热带农业科学, 2014, 34(1): 59-62.
[10] Li C Q, Shao J F, Wang Y J, et al. Analysis of banana transcriptome and global gene expression profiles in banana roots in response to infection by Race 1 and Tropical Race 4 of Fusarium oxysporum f.sp. cubense[J]. BMC Genomics, 2013, 14(4): 851.
[11] 李春强, 梁慧施, 彭 明, 等. GFP标记的尖孢镰刀菌西瓜专化型侵染西瓜过程观察[J]. 热带作物学报, 2011, 32(10): 1 935-1 939.
[12] 齐兴柱, 杨腊英, 郭立佳, 等. FoAP1基因在香蕉枯萎病菌致病过程中的功能分析[J]. 植物病理学报, 2013, 43(6): 596-605.
[13] Wojtaszek P. Oxidative burst: An early plant response to pathogen infection[J]. Biochemical Journal, 1997, 322(3): 681-692.
[14] Guo M, Chen Y, Du Y, et al. The bZIP transcription factor MoAP1 mediates the oxidative stress response and is critical for pathogenicity of the rice blast fungus Magnaporthe oryzae[J]. PLoS Pathogens, 2011, 7(2): 1-21.
[15] Hansberg W, Salas-Lizana R, Domínguez L. Fungal catalases: Function, phylogenetic origin and structure[J]. Archives of Biochemistry and Biophysics, 2012, 525(1): 170-180.
[16] Giles S S, Stajich J E, Nichols C, et al. The Cryptococcus neoformans catalase gene family and its role in antioxidant defense[J]. Eukaryotic Cell, 2006, 5(9): 1 447-1 459.
[17] Shibuya K, Paris S, Ando T, et al. Catalases of Aspergillus fumigatus and inflammation in aspergillosis[J]. Nippon Ishinkin Gakkai Zasshi, 2006, 47(4): 249-255.
[18] Díaz A, Rangel P, Montes de Oca Y, et al. Molecular and kinetic study of catalase-1, a durable large catalase of Neurospora crassa[J]. Free Radical Biology & Medicine, 2001, 31(11): 1 323-1 333.
[19] Skamnioti P, Henderson C, Zhang Z, et al. A novel role for catalase B in the maintenance of fungal cell-wall integrity during host invasion in the rice blast fungus Magnaporthe grisea[J]. Molecular Plant-Microbe Interactions, 2007, 20(5): 568-580.
[20] 齊兴柱, 杨腊英, 黄俊生. FOC4的2个过氧化氢酶基因的克隆与表达分析及其引起的香蕉苗活性氧迸发研究[J]. 中国农学通报, 2012, 28(15): 163-169.
[21] 齐兴柱. 几个抗氧化胁迫相关基因在香蕉枯萎病菌致病中的作用研究[D]. 海口: 海南大学, 2013: 65-71.
[22] Metelitsa D I, Pliugacheva E I, Ermolenko I N, et al. Covalent immobilization of catalase on molded cellulose carriers[J]. Prikl Biokhim Mikrobiol, 1992, 28(4): 531-538.

