橡胶树胶孢炭疽菌T—DNA标记基因Lv1初步分析
郑肖兰 李秋洁 许沛冬 吴伟怀 郑金龙 习金根 梁艳琼 李锐 张驰成 郑行恺 贺春萍 易克贤


摘 要 通过对实验室已构建的胶孢炭疽菌T-DNA突变体库中各突变体致病力的测定,获得致病力丧失突变菌株T-900,利用TAIL-PCR克隆标记基因侧翼序列,进行比对和序列分析,获取假设基因Lv1的全序列,采用生物信息学方法进行Lv1基因预测及功能分析,最后通过敲除野生型菌株RC178中的基因Lv1进行功能分析。结果表明,获取的假定基因Lv1全序列共4 450 bp,基因预测显示T-DNA侧翼序列位于预测基因的1 727 bp处,正好处于预测基因的第1个外显子内;并且推测该基因为组蛋白H3基因,含有2个内含子,3个外显子;功能验证结果发现敲除突变体△T-900-16与T-900致病力表现一致,推测Lv1基因与RC178的致病力相关。
关键词 胶孢炭疽菌;T-DNA;Lv1;功能分析
中图分类号 Q78;S432.4 文献标识码 A
Abstract Anthracnose leafspot, caused by the fungal pathogen Colletotrichum gloeosporioides, is a devastating disease that affects rubber trees. A mutant strain T-900 was obtained from T-DNA insertion mutation library, with weakened virulence to rubber trees. The flanking sequence was cloned by Tail-PCR and compared with the whole genome sequence of C. gloeosporioides. A 4 450 bp length DNA sequence was obtained and named as Lv1, which was submitted to NCBI for gene prediction and functional analysis. The results showed that the T-DNA insertion site was located at 1 727 bp of Lv1, in the first exon of the gene. Gene structural analysis indicated that Lv1 was speculated as a histone H3 gene with 3 exons and 2 introns. By knocking out Lv1 from a wild strain RC178, the virulence of △T-900-16 was as the same as T-900, which proved that Lv1 was related to the virulence of RC178.
Key words Colletotrichum gloeosporioides; T-DNA; Lv1; functional analysis
doi 10.3969/j.issn.1000-2561.2017.02.022
橡胶是重要的工业原料,天然橡胶具有合成橡胶不可代替的特性。商品天然橡胶约99%产自橡胶树,全世界橡胶树栽培总面积1 000万hm2,其中中国有92万hm2,橡胶树炭疽病是限制我国橡胶增产的主要因子之一,其病原菌致病性遗传方面的资料是橡胶树抗病品种的选育和持久利用的理论基础[1]。而克隆致病相关基因则是橡胶树炭疽病菌致病性的分子遗传学基础工作。
随着DNA测序技术的发展,大量的生物基因组序列在GenBank中快速积累,功能基因组学成为当前生命科学研究的热点,目前,基于遗传学的基因突变技术是基因功能研究的重要方法之一[2]。土壤杆菌介导的遗传转化技术(ATMT)已经成为研究病原真菌功能基因的重要技术[3-4]。通过ATMT突变体寻找致病性相关基因已成为目前研究橡胶树炭疽病菌的分子致病机理最有效的研究方法。本试验从构建的橡胶树炭疽病菌T-DNA插入突变体库中,筛选获得一株致病性明显减弱的突变菌株T-900。通过对T-900的表型分析和插入位点侧翼序列的克隆,结合生物信息学分析插入突变基因(拟命名为less virulence 1, 缩写Lv1),并对其功能进行分析,推测Lv1是橡胶树胶孢炭疽菌致病性相关的基因,本研究为阐明橡胶树炭疽病菌致病的分子机理奠定了一定的基础。
1 材料与方法
1.1 材料
供试菌株:橡胶树胶孢炭疽菌野生型RC178,由中国热带农业科学院环境与植物保护研究所保存,突变菌株T-900从本实验室构建的橡胶树胶孢炭疽菌T-DNA突变体库中筛选获得。
1.2 方法
1.2.1 胶孢炭疽菌突变菌株T-900致病力测定
参照刘艳等[5]的方法,采用健康的幼嫩叶片进行离体接种。
1.2.2 T-DNA插入位點基因Lv1获得及生物信息学分析 为鉴定转化子T-DNA插入拷贝数的情况,大量提取已被PCR证实且致病力丧失的4个转化子DNA,经EcoRⅠ充分酶切后,进行Southern杂交分析。所用的探针为启动子捕获载体质粒 pCAHPH 中的潮霉素片段,经过电泳分离,胶回收后经标记获得。Southern杂交采用地高辛标记试剂盒,改良的实验方法包括Southern杂交、洗膜及显色反应等参照翟李刚[6]的硕士论文。T-900 T-DNA侧翼序列的克隆则采用TAIL-PCR方法扩增T-900的侧翼序列,所采用的特异引物和简并引物参考刘艳[7]的硕士论文,并将获得的侧翼序列在NCBI及橡胶树胶孢炭疽菌全基因组序列上进行比对分析,分析其同源序列,并获取插入位点预测基因Lv1的全序列。进而分析其外显子、内含子。利用Expasy提供的ProtParam、ProtScale、COIL等在线工具分别预测该基因编码蛋白质的基本理化性质、亲疏水性、卷曲螺旋区域等;用SignaP4.1 server工具预测蛋白质的信号肽;用PredictProtein工具预测二级结构;用SMART工具预测蛋白质的结构域;用Psort工具对该蛋白质序列进行亚细胞定位预测;用Protfun2.2工具进行功能预测。
1.2.3 T-DNA插入位点基因Lv1功能分析
(1)Lv1基因敲除突变体的获得。以pCT74质粒为模板,以HYG/F(5′GGCTTGGCTGGAGCTAGTGGAGGTCAA3′)和HY/R(5′GTATTGACCGATTCCTTGCGGTCCGAA3′)为引物扩增潮霉素抗性基因hph左侧片段,以YG/F(5′GATGTAGGAGGGCGTGGATATGTCCT3′)和HYG/R(5′AACCCGCGGTCGGCATCTACTCTATTC3′)为引物扩增hph右侧片段。然后以RC178的基因组DNA为模板,在Lv1基因上游片段设计引物:a-F(5′TCCTGTGTCTTTGCGTTTGG3′)和a-R(5′TTGACCTCCACTAGCTCCAGCCAAGCCGGAGTGATTGTGTGCCAGAC3′);在Lv1基因下游片段设计引物:b-F(5′GAATAGAGTAGATGCCGACCGCGGGTTAAACAGCAGCAAAGGATGGC3′)和b-R(5′GGGGAGCATAGTATCGGAAAGTACA3′);通过这两对引物扩增Lv1基因的上下游片段。引物a-R和b-F 5′端的27 bp分别与HYG/F和HYG/R的序列反向互补。PCR反应体系:PCRmix 25 μL、引物2 μL、模板1 μL、H2O 22 μL;PCR反应程序为:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。反应完成后,将PCR产物在1%的琼脂糖进行电泳,并在凝胶成像系统中观察结果。将预期片段的PCR产物胶回收,连接,转化后送测序。分析获得的PCR片段序列与橡胶树胶孢炭疽菌序列的差异。
以基因上游片段a和hph左侧片段HH的回收产物为模板,以a-F、HY/R为引物;以基因下游片段b和hph右侧片段HY的回收产物为模板,以YG/F、b-R为引物,分别进行融合PCR,获得基因上游片段与hph左侧片段的融合产物a+HH,和基因下游片段与hph右侧片段的融合产物b+HY。将预期目的条带大小的片段回收,连接,转化后送上海立菲生物技术有限公司测序,并将获得的正确融合PCR产物保存于 -20 ℃,用于原生质体转化。
利用同源重组原理对橡胶树炭疽菌RC178的Lv1进行全基因敲除,具体方法参照李秋洁[8]的硕士论文。
(2)基因敲除突变体的分子验证。设计5组引物对获得的Lv1基因敲除突变菌株进行验证:①在 hph基因内部设计引物HYG/F与HYG/R,以RC178及突变体基因组为模板,用潮霉素hph基因内部引物HYG/F和HYG/R组合,PCR扩增获得的潮霉素抗性基因片段。原則上疑似突变体中的靶标基因被hph基因替代,或者是hph基因随机插入突变体基因组中时,均能扩增出目标片段,而野生型菌株和阴性基因敲除突变体则不能扩增目标条带。②在Lv1基因内部设计引物H3-F(5′CAGCCCAGTT
TCCTACCTA3′)和H3-R(5′ACGCATTCGTAACGCCAGA3′),以野生型和基因敲除突变体基因组进行PCR扩增,如果目的基因Lv1为单拷贝的话,该引物对不能从基因敲除阳性突变体基因组中扩出条带,但能从野生型和阴性基因敲除突变体基因组中扩增出目的条带;如果目的基因在菌株总基因组中属于多拷贝基因,突变体只是敲除了其中一个拷贝,仍然存在着其他与目的基因相同的基因片断时PCR也能扩增到相应条带。③为了证明获得的转化子是否为Lv1基因敲除突变体,以该基因两侧远端设计H3-F1(5′TGACAGTGGGCAGCAGGTAT3′)和H3-R1(5′ACGGAAGAGGGGCATTAGGT3′)引物对,以野生型和基因敲除突变体基因组进行PCR扩增,该引物对可进一步验证获得的敲除突变体中Lv1基因片段敲除与否。④为了确定是否存在已敲除Lv1基因突变体,在该基因上游设计引物H3-F2(5′AAAAAAGGGCCATGGTACGTACTCC3′)与潮霉素抗性基因内部引物HY/R配对;同时在该基因下游设计引物H3-R2(5′CCCTACGGCGGTTGAGAATC3′)和潮霉素抗性基因右臂内部引物YG/F配对,以野生型和敲除突变体基因组为模板进行PCR扩增,此两组引物对均可从基因敲除阳性突变体中扩出目的条带,但不能从野生型与阴性突变体扩出条带。
(3)Lv1基因敲除突变体的致病力测定。方法参见1.2.1。
2 结果与分析
2.1 T-900与RC178的致病力测试
通过离体叶片菌饼刺伤接种测试,接种4 d后观察,结果如图1,发现空白对照无发病;T-900虽有发病,但病斑极小;RC178发病,病斑大而且变黑褐色,可见T-900的致病力明显比野生型菌株RC178的致病力弱。
2.2 T-900的T-DNA插入位点基因Lv1分析
杂交分析结果如图2-A,用于杂交的4个转化子插入拷贝数如下:T-990为3拷贝、T-900为2拷贝、T-1103为单拷贝、T-1580为3拷贝。
图2-B为T-900经过TAIL-PCR扩增的第2轮和第3轮产物的电泳图,通过对第3轮产物回收、连接、转化、克隆和测序,获得1条1 275 bp特异片段。
将PCR产物序列在NCBI上进行比对,结果与粗糙脉孢菌(Neurospora crassa)的H3组蛋白相似性为100%,和蛇苔属植物的H3组蛋白相似性为99%,据此初步推测该T-DNA插入位点相关基因为H3组蛋白相关基因。
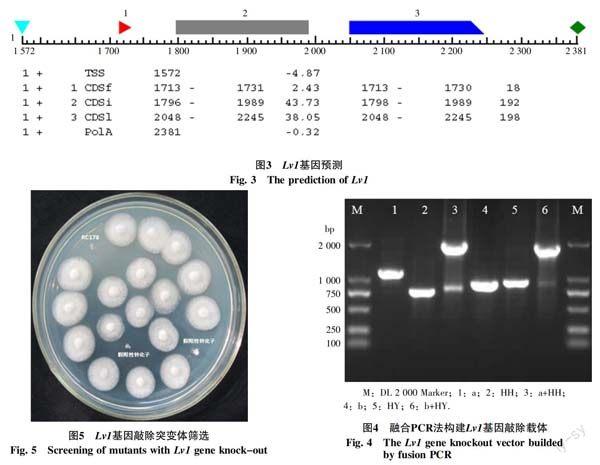
与橡胶树炭疽病菌全基因组序列进行比对,获取包括侧翼序列在内的4 450 bp核苷酸序列作为预测基因Lv1,将该序列提交到softberry网站,以 Magnaporthe grisea、Fusarium graminearum和Aspergillus等模式菌进行基因预测结果显示:T-DNA侧翼序列位于预测基因的1 727 bp处,正好处于预测基因的第1个外显子内;并且推测该基因为组蛋白H3基因,与前面推测结果一致;此外,该预测基因编码蛋白,含有2个内含子和3个外显子(图3)。
依据Lv1核苷酸序列预测的氨基酸序列为:MARTKQTARKSTGGKAPRKQLASKAARKSAPSTGGVKKPHRYKPGTVALREIRRYQKSTELLIRKLPFQRLVREIAQDFKSDLRFQSSAIGALQESVESYLVSLFEDTNLCAIHAKRVTIQSKDIQLARRLRGERN。对预测到完整的氨基酸序列,进一步进行生物信息学分析,发现该蛋白质含有136个氨基酸残基数,分子质量为15 391.8 u,理论等电点为11.15,分子式为:C672H1 134N216O193S2。不稳定系数为49.3,属于不稳定蛋白。脂肪系数为80.44,总平均疏水性为-0.717。亲疏水性分析表明:该氨基酸序列的亲水性氨基酸多于疏水性氨基酸,在第99~109个氨基酸之间出现疏水性最大值1.378,此区间疏水性较高;在第37~47氨基酸之间出现亲水性最大值-2.70,此区间亲水性较高。综合总平均疏水性和亲疏水性图的结果,推测该氨基酸序列所编码的蛋白质具有较强的亲水性。预测蛋白无信号肽,说明该蛋白为非分泌蛋白。该蛋白质序列含有51.5%的α螺旋,含有2.2% β折叠,46.3%的无规卷曲(环状结构)。且该蛋白在34~136氨基酸区域存在H3组蛋白结构域,结构域与Chaetomium globosum(球毛壳菌)组蛋白H3同源性最高。其亚细胞定位于细胞核,这与H3组蛋白是核小体的组成部分是一致的。同时预测结果显示该蛋白属结构性蛋白。
2.3 T-DNA插入位点基因Lv1功能分析
2.3.1 Lv1基因敲除突变体的获得 采用融合PCR法构建Lv1基因敲除突变体,结果如图4:泳道1和4是以RC178为模板,分别以a-F和a-R,b-F和b-R为引物扩增Lv1基因的上下游片段,获得的上游片段a,大小为1 096 bp;下游片段b,大小为854 bp。泳道 2和5是以pCT74质粒为模板,以HYG/F和HY/R配对,YG/F与HYG/R配对为引物分别扩增hph左右侧片段,获得的左侧片段HH,大小为798 bp;获得的右侧片段HY,大小为918 bp。泳道3是a-F与HYG/R为引物,以上游片段a与潮霉素抗性基因左臂HH为模板,进行融合PCR获得a+HH产物;泳道6是以b-R与YG-F为引物,下游片段b与潮霉素抗性基因右臂HY为模板进行融合PCR获得b+HY产物。融合片段a+HH和b+HY回收纯化、连接、转化、测序,结果表明融合片段a+HH(1 879 bp)和b+HY(1 753 bp)为预期片段,证明融合成功(图4)。
回收纯化片段a+HH和b+HY等量混合转化到RC178原生质体中,获得基因敲除突变体,用含250 μg/mL潮霉素培養基进行筛选(图5),未转化成功的转化子和RC178在含潮霉素(250 μg/mL)的培养基上培养3 d未长出菌落,正常生长的为基因敲除突变体,结果一共获得23个基因敲除突变体,分别命名为△T-900-1、△T-900-2、△T-900-3……△T-900-22、△T-900-23。
2.3.2 Lv1基因敲除突变体的分子验证 图6是以RC178及基因敲除疑似突变体基因组为模板,用潮霉素hph基因内部引物HYG/F和HYG/R组合,PCR扩增获得的潮霉素抗性基因片段。从图6可知,随机挑取的菌株除RC178外,其他参试基因敲除突变体均扩增出目标条带,说明参试的突变体均检测到潮霉素抗性标记基因,推测疑似突变体中的靶标基因已经被潮霉素hph基因替代,或者是hph基因随机插入突变体基因组中。
为了剔除hph基因随机插入突变体,本试验以Lv1基因内部引物H3-F和H3-R扩增RC178及基因敲除疑似突变体基因组,验证是否被潮霉素抗性基因置换Lv1。由电泳结果图7得知:随机挑取的每株参试菌包括RC178均能扩增出Lv1基因片断,推测其原因一个是真正的Lv1基因没有被敲除,另一个原因是Lv1基因在菌株总基因组中属于多拷贝基因,突变体只是敲除了其中一个拷贝,仍然存在着其他与目的基因相同的基因片断。所以PCR能扩增到条带。
图8是以H3-F1和H3-R1为引物,PCR扩增RC178和基因敲除突变体基因组的结果,从图8可知:泳道1、3、7、8、14、16、19对应的突变体为△T-900-1、△T-900-3、△T-900-7、△T-900-8、△T-900-14、△T-900-16、△T-900-19,这些突变体均能扩增出2条条带:一条1 800 bp左右,另一条2 300 bp左右,此结果与预期结果完全符合。
图9是引物H3-F2与HY/R配对,H3-R2与YG/F配对,以野生型和敲除突变体基因组为模板进行PCR扩增的结果。上下游扩增结果均显示:泳道1、2、4、6对应的突变体△T-900-1、△T-900-3、△T-900-8、△T-900-16对应的泳道显示扩增出目标条带,证明这4个基因敲除突变体中的Lv1已经被敲除。
2.3.3 基因敲除突变体的表型分析 Lv1基因敲除突变体的菌落形态如图10,从图10得知其菌丝颜色及菌落形态变化不大,但生长速率突变体均比野生型菌株RC178 明显减弱。
对Lv1基因敲除突变体的致病力测试结果(图11)表明,突变体△T-900-1、△T-900-3、△T-900-8的致病力变化并不十分明显,△T-900-1和△T-900-8甚至有致病力增强的趋势,仅有△T-900-16致病力明显减弱。
3 讨论
差异表达基因的检测与分析已成为研究具有差异生物学表型的常规策略,对通过实验所获得的差异基因片段进行生物信息学分析,主要包括基于国际互联网的序列相似性分析、片段重叠群分析和全长cDNA序列分析,以此对获得的插入位点基因片段进行功能预测。
此外,基因敲除是应用DNA同源重组原理发展起来的一门新技术,是研究基因功能的重要手段。为了深入研究Lv1在野生型菌株RC178致病过程中的作用,本课题构建了Lv1基因靶向敲除载体,进一步用于转染RC178原生质体,建立Lv1基因敲除突变体,并观察Lv1在致病过程中的作用。
在Lv1基因敲除突变体的PCR验证过程中,每个参试菌株均能扩增出目的基因片断,推测其原因一个是真正的Lv1没有被敲除,另一个原因是该基因在菌株总基因组中属于多拷贝基因,突变体只是敲除了其中一个拷贝,仍然存在着其他与该基因相同的基因片断,所以PCR能扩增到条带;这与相关文献报道H3组蛋白基因是已知的重復基因中唯一的一种具有蛋白质编码机能的基因,它们在DNA合成开始前短暂地表达,因而它的活动与细胞周期密切相关[9]相符合。推测上述原因也造成Lv1基因敲除突变体的致病力测试结果中△T-900-3与RC178比较差异并不明显,△T-900-1、△T-900-8甚至有致病力增强的趋势。造成此结果另外原因推测:由于插入突变体T-900的拷贝数为2,在目的基因敲除过程中有可能敲除另外一个插入侧翼序列,或者由于组蛋白能被组蛋白甲基转移酶和去甲基化酶进行可逆的甲基化修饰,从而影响染色质的结构。这与黄鹏云[9]研究发现稻瘟病菌中由组蛋白甲基转移酶和去甲基化酶所修饰的H3组蛋白甲基化模式,影响染色质的状态,进而宏观上影响基因表达,并最终影响稻瘟病菌的发育和致病过程一致;此外,李毛毛[10]研究发现组蛋白乙酰基转移酶HATs在生物体中具有重要的作用,通过与组蛋白去乙酰基酶HDAC的相互作用实现了生物体内基因组整体水平的调控。HATs和HDAC主要通过对组蛋白中H3、H4核心组蛋白中Lys残基的乙酰化和去乙酰化,实现调控不同功能基因的表达;致病力测试结果中唯有△T-900-16致病力减弱,与原来T-900致病力相似,推测为Lv1已经被敲除,下一步工作将设计引物,将敲除的基因Lv1重新导入△T-900-16作为互补的恢复菌株,进一步将Lv1基因进行深入研究。
参考文献
[1] 郑肖兰, 傅 帅, 郑服丛, 等. 植物病原菌抗药性研究进展[J]. 热带农业科学, 2011, 31(1): 86-90.
[2] Zheng Xiaolan, Liu Yan, Wei Xiaohui, et al. Generation and analysis of pathogenicity-related gene mutants of Colletotrichum gloeosporioides using a novel promoter trapping system[J]. Plant Diseases and Pests, 2013(3): 12-15, 19.
[3] 冯 娟, 朱廷恒, 崔志峰, 等. 农杆菌介导的灰葡萄孢T-DNA插入突变菌株库构建及插入位点[J]. 微生物学报, 2009 50(2): 169-173.
[4] Liu Liping, Zhao Dian, Zheng Lu, et al. Identification of virulence genes in the crucifer anthracnose fungus Colletotrichum higginsianum by insertional mutagenesis[J]. Molecular Pathogenesis, 2013, 64: 6-17.
[5] 刘 艳, 贺春萍, 易克贤, 等. 橡胶炭疽病菌致病相关突变体的筛选及表型分析[J]. 热带作物学报, 2014, 35(11): 2 278-2 283.
[6] 翟李刚. 橡胶树胶孢炭疽菌CgATG4和CgATG8基因的克隆与功能初步分析[D]. 武汉: 华中农业大学, 2013.
[7] 刘 艳. 橡胶炭疽病菌(Colletotrichum gloeosporioides)致病相关突变体表型分析及插入位点定位[D]. 海口: 海南大学, 2010.
[8] 李秋洁. 柱花草炭疽病菌致病缺陷转化子的筛选及其致病相关基因StCg-ALS和StCg-800的功能分析[D]. 海口:海南大学, 2015.
[9] 黄鹏云. 组蛋白H3甲基化模式在稻瘟病菌发育和致病过程中的功能分析[D]. 杭州: 浙江大学, 2015.
[10] 李毛毛. 大豆疫霉组蛋白乙酰转移酶相关基因PsGCN5的克隆与功能分析[D]. 合肥: 安徽农业大学, 2013.

