石英砂—腐殖酸—Cupriavidus gilardii CR3复合体对铜离子的吸附特性及机理研究
杨玉双 王小雨

摘要[目的] 研究pH、初始铜离子浓度和吸附时间对石英砂-腐殖酸-Cupriavidus gilardii CR3复合体吸附铜离子的影响。[方法]利用等温吸附模型和动力学模型拟合试验数据,通过测定复合体吸附铜离子前后的Zeta电位、扫描电子显微镜-能谱(SEM-EDS)和傅里叶红外光谱(FTIR),研究吸附剂对铜离子的吸附特性及机理。[结果] pH是影响吸附能力的主要因素,静电作用可使复合体表面负电荷增多,提高吸附量。在最适pH(5.0)下,复合体对铜离子的最大吸附量为13.08 mg/g。复合体对铜离子的吸附过程符合化学单分子吸附的Langmuir 模型和二级动力学模型。[结论]该研究认为静电作用和单分子化学吸附是石英砂-腐殖酸-Cupriavidus gilardii CR3复合体吸附铜离子的主要机制。
关键词吸附剂;吸附;动力学模型;等温吸附模型;铜离子
中图分类号X53文献标识码A文章编号0517-6611(2017)09-0062-05
Study on Characteristics and Mechanism of Copper Ions by Quartz Sandhumic AcidCupriavidus gilardii CR3
YANG Yushuang, WANG Xiaoyu*
(School of Environment, Northeast Normal University, Changchun, Jilin 130117)
Abstract[Objective]To study the effect of pH, initial copper ions concentration and contact time on composites of sandhumic acidCupriavidus gilardii CR3. [Methods]Experimental data were simulated by adsorption isotherms and kinetics. Adsorption characteristics and mechanism of copper ions by adsorbents was studied by determining the Zeta potential before and after adsorption of copper ions, and scanning SEMEDS and FTIR. [Results]The results showed that pH was important parameters for the adsorption capacity of composites for copper ions. Electrostatic effect increased the negative charge on the surface of composite, and increased adsorption capacity. At the optimum pH (5.0), the maximum adsorption capacity of the complex was 13.08 mg/g. The adsorption process of copper ions by composites of sandhumic acidCupriavidus gilardii CR3 was in according with Langmuir model and two order kinetic model.[Conclusion]The study considered that electrostatic interaction and single molecule chemical adsorption were the main mechanisms of adsorption of copper ions by composites of sandhumic acidbcateria.
Key wordsAdsorbent;Adsorption;Kinetic modeling;Adsorption isotherms;Copper ion
銅虽然是生物体必需的微量元素,但是大量铜离子会对环境和人体健康构成威胁。铜离子进入地下水环境,先通过包气带的土壤水带层,再进入地下水[1]。土壤水带层不仅存在大量的矿物和有机质,是微生物生存的区域,也是污染物包括重金属离子进入地下水的第一道天然屏障[2-3],因此,掌握土壤矿物质、有机质和微生物对重金属的作用机制至关重要。
目前有关重金属在土壤水带层的研究多集中于土壤矿物、有机质和微生物的单一体系和彼此作用的二元体系对重金属的吸附,而对三者复合的三元吸附体系的研究却鲜见报道。研究表明,矿物质、有机质和细菌的一元体系对重金属都具有一定的吸附作用[4-8]。针对二元吸附体系,Zhu等[9]对比分析了针铁矿和针铁矿-细菌复合体吸附铜和铬,发现复合体的吸附能力大于单一体系;Arias等[10]研究发现,腐殖酸可促进高岭石对铜的吸附;Fang等[11]研究发现,蒙脱石-细菌复合体可以比蒙脱石提供更多的吸附位点,对铜的吸附效率达42.5%。相对于三元复杂体系,Du等[12]通过静态吸附试验和仪器表征,证明蒙脱石-腐殖酸-细菌复合体对镉的吸附行为是细菌表面的吸附位點起主要作用;Du等[13]还确定了不同类型有机和无机配体对矿物-细菌复合体吸附镉的影响不同。
在众多用来研究吸附的抗性细菌中,贪铜菌属细菌是比较特殊的一类,其最显著的特征是对铜离子具有较高抗性和吸附能力[14-15]。已报道的贪铜菌属细菌重金属抗性基因都是由质粒控制,如Cupriavidus taiwanensis的抗性基因位于质粒pRALTA上,Cupriavidus metallidurans CH34抗性基因位于PMO128和PMO130质粒上。有学者从沥青土壤中筛选到了1株新颖的重金属抗性细菌Cupriavidus gilardii CR3,该菌对包括铜在内的9种重金属具有抗性。该菌株的特殊之处在于不具备质粒,其功能基因均定位于2个环状染色体上[16]。然而,这种特殊的细菌与矿物质、腐殖酸复合体对铜离子的吸附特性和机理还鲜见报道。
笔者为模拟真实的土壤-地下环境,选取石英砂、腐殖酸和特殊的抗性细菌Cupriavidus gilardii CR3制备三元复合吸附剂,采用静态吸附试验,研究三元复合体吸附铜离子的特性,运用等温吸附模型和动力学模型拟合试验结果,探讨该复合体对铜离子的吸附机理,旨在为今后研究重金属对自然环境的影响奠定理论基础。
1材料与方法
1.1石英砂-腐殖酸-Cupriavidus gilardii CR3复合体和铜离子母液的制备
石英砂-腐殖酸-Cupriavidus gilardii CR3复合体:称取0.01 g石英砂(1 g/L)、5 mg/L腐殖酸和1 mL Cupriavidus gilardii CR3 1 g/L于50 mL离心管中,用0.01 mol/L KNO3定容至10 mL,于28 ℃ 180 r/min振荡48 h达吸附平衡。10 000 r/min离心10 min,收集沉淀物得石英砂-腐殖酸-Cupriavidus gilardii CR3復合体悬液[12]。
铜离子母液:精确称取17.048 g CuCl2·2H2O粉末,用去离子水溶解并定容至100 mL容量瓶,得到1 mol/L铜离子贮备液;用无菌水稀释铜离子贮备液,得到5 mmol/L铜离子母液,避光保存,备用。
1.2石英砂-腐殖酸-Cupriavidus gilardii CR3复合体对铜离子的吸附特性试验
1.2.1pH对复合体吸附铜离子的影响。在50 mL离心管中加入1 mL复合体悬液和2 mL铜离子母液,pH分别为20、3.0、4.0、5.0、6.0和7.0的0.01 mol/L KNO3作为电解液,铜离子的最终浓度为64 mg/L,反应体系为10 mL,振荡反应24 h达吸附平衡。采用原子吸收法测定溶液中铜离子浓度。根据式(1)、(2)计算吸附量和吸附效率:
qe=v(C0-Ce)m(1)
Ad(%)=C0-CeC0×100(2)
式中,qe为平衡吸附量(mg/g);v为反应液体积(L);C0为铜离子起始浓度;Ce为铜离子平衡浓度;m为吸附剂质量(g);Ad为吸附效率(%)。
1.2.2初始铜离子浓度对复合体吸附铜离子的影响。加不同体积铜离子母液于50 mL离心管中,使初始铜离子浓度为6.4、19.2、32.0、44.8、64.0、83.2、96.0、108.8和128.0 mg/L;加1 mL复合体菌悬液和pH 5.0的0.01 mol/L KNO3作为电解液定容至10 mL。吸附平衡后离心测定溶液中铜离子浓度。
用2种等温吸附模型模拟初始铜离子浓度对吸附的影响,分别是假定化学单分子吸附的Langmuir 模型和基于异构面的经验公式Freundlich 模型,直线方程如下式:
Ceqe=1qmb+Ceqm(3)
lnqe=lnKF+1nlnCe(4)
式中,qm为最大吸附量(mg/g);n和KF为Freundlich模型吸附常数;b为Langmuir模型吸附常数。
1.2.3
吸附时间对复合体吸附铜离子的影响。在50 mL离心管中加入1 mL复合体悬液和2 mL铜离子母液,再用pH为50的0.01 mol/L KNO3定容至10 mL(体系中的铜离子浓度为64 mg/L),于28 ℃ 180 r /min振荡培养,分别在吸附前60 min 每5 min测1次样,前60~200 min每10 min测1次样,之后每60 min测1次,直到吸附平衡。
运用二级动力学方程和颗粒内扩散方程,对复合体吸附铜离子的动力学数据进行拟合:
tqt=1kq2e+1qet(5)
qt=kdt12+d(6)
式中,t为反应液体积(L);qt为t时刻铜离子吸附量(mg/g);k为反应速率常数(min-1);kd为扩散速率常数;d为颗粒内扩散方程常数。
1.3石英砂-腐殖酸-Cupriavidus gilardii CR3復合体吸附铜离子的机理试验
1.3.1Zeta电位。分别在pH为2.0、3.0、4.0、5.0、6.0、70的条件下测定复合体吸附64 mg/L 铜离子24 h后的Zeta电位。
1.3.2
扫描电子显微镜-能谱(SEM-EDS)。pH为5.0时复合体吸附64 mg/L铜离子24 h前后样品经一系列处理并喷金镀膜,进行SEM-EDS分析。
1.3.3
傅里叶红外光谱(FTIR)。复合体吸附64 mg/L铜离子(pH = 5.0,吸附24 h)前后的样品离心冷冻干燥,按3∶100制样,与KBr混合研磨,进行FTIR分析。
2结果与分析
2.1石英砂-腐殖酸-Cupriavidus gilardii CR3复合体对铜离子的吸附特性
2.1.1
pH对复合体吸附铜离子的影响。pH是影响吸附重金属离子的重要参数,它不仅影响吸附剂表面的性质,而且影响溶液中重金属离子的存在形态。溶液中铜离子通常以Cu2+、CuOH+ 和Cu(OH)2 3种类型存在[17]。从图1可见,铜在复合体表面的吸附量和吸附效率随pH的升高而增大。当溶液pH在2.0~4.0时,铜离子的吸附量由6.50 mg/g增加到13.08 mg/g,吸附效率从9.68%上升到19.48%;当pH为6.0时,吸附量降低,pH为7.0时,吸附量增大。
吸附量随pH变化关系是溶液中的质子与铜离子竞争吸附复合体表面结合位点的结果。该试验中,强酸性溶液中(pH为2.0),H3O+ 占据复合体表面的吸附位点,减少了金属离子与复合体结合的机会,降低了吸附量;随着pH的升高(pH 2.0~5.0),由于复合体表面发生去质子化,吸附剂受负电荷控制,吸引带正电荷的金属离子,使吸附量增加,这是Cu2+和CuOH+共同作用的结果;pH ≥ 5.3时,发现Chen等[18]和Xie等[19]的研究也有类似现象,铜离子发生沉淀,产生Cu(OH)2,这种现象使吸附量偏大,但不是复合体吸附铜离子的结果,因此后续试验选择pH 5.0。
2.1.2
吸附等温模型。由图2可知,Langmuir模型描述复合體对铜离子吸附等温线具有更好的相关性,其相关系数R2=0950 8,尽管Freundlich方程也可以用来描述吸附剂的吸附行为,但相关性没有Langmuir模型拟合的效果好(R2=0290 3)。研究者发现很多吸附剂吸附重金属的过程符合Langmuir 模型,Du等[12]研究发现,蒙脱石-腐殖酸-细菌多组分三元复合体吸附镉的过程符合Langmuir 模型;吴平霄等[20]研究高岭土-胡敏酸二元复合体对铜、镉和铬离子吸附解吸试验,发现复合体对3种金属离子的吸附都符合以化学吸附为主的Langmuir 模型;Zhu等[9]对比研究针铁矿和针铁矿-细菌复合体吸附铜和铬的效果,结果显示,单一体系和二元体系吸附过程都符合Langmuir 模型。Bayramogˇlu等[21]和Veit 等[22]假设Langmuir 模型的吸附过程是单分子化学吸附,复合体对铜的吸附过程符合Langmuir 模型,说明该吸附是化学单分子吸附。
2.1.3动力学模型。为了研究吸附过程中的具体步骤,将试验数据用二级动力学和颗粒内扩散模型拟合,拟合结果见图3。由图3可知,二级动力学方程可以较好地拟合吸附的试验结果,相关系数R2为0.938 0,进一步证明该吸附是化学吸附,涉及金属离子与表面质子的交换吸附,吸附速率与其表面未结合的位点数目成正比,这与Zhu等[9]和Du等[12]的研究结论一致。
2.2石英砂-腐殖酸-Cupriavidus gilardii CR3复合体吸附铜离子的机理
2.2.1
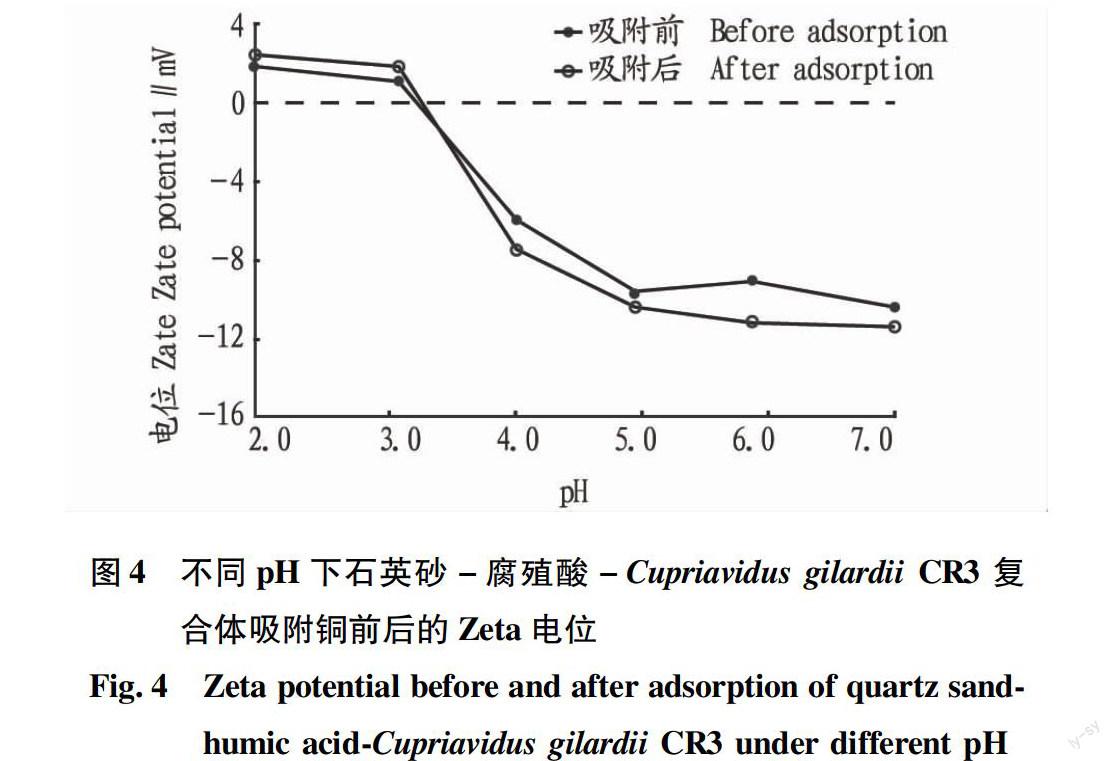
Zeta电位。Zeta 电位是通过测定吸附剂的电渗流速,反映吸附剂表面电化性质。为研究复合体的表面电荷对吸附的影响,笔者对复合体及复合体吸附铜离子后的Zeta 电位进行测定,结果见图4。由图4可知,溶液的pH对复合体电位的影响较大,在等电点3.2左右(即在 Zeta 电位等于0时的 pH),
图4不同pH下石英砂-腐殖酸-Cupriavidus gilardii CR3复合体吸附铜前后的Zeta电位
Fig.4Zeta potential before and after adsorption of quartz sandhumic acidCupriavidus gilardii CR3 under different pH
复合体表面质子达到平衡。在pH≤3.2时,复合体表面带正电荷,pH > 3.2时,复合体表面带负电荷。复合体吸附铜离子后,随着pH的升高,电位从+3 mV降低到-11 mV,复合体表面的负电荷增多,吸引带正电荷的铜离子,使吸附量增大,说明静电作用参与吸附过程。Wang等[23]运用Zeta 电位测定了不同pH下蒙脱石、枯草芽孢杆菌及其复合体的电位变化,发现在较低pH下,3种吸附剂都受正电荷控制,吸附量较少,且随着pH的升高,吸附剂表面的负电荷增多,吸附量随之增大;Walker等[24]研究了Escherichia coli 和Bacillus subtilis 分别与黏土矿物复合对重金属的吸附作用,结果表明,静电作用改变复合体表面的吸附位点,使负电荷增大,这与该研究的结论一致。
2.2.2
SEM-EDS。对比观察图5,可以看出Cupriavidus gilardii CR3的变化导致复合体的变化。吸附铜离子前复合体中的细胞完整,且被腐殖酸包裹,带有黏稠性;吸附铜离子后,复合体相对于未负载铜的细菌表面变得不再粘稠,出现
坑洞和凹陷变形。Huang等[25]和Lu 等[26]也证明了重金属
使细菌表面破损,改变其表面形貌。从图6可以发现,吸附后出现2个铜离子吸收峰位,是铜离子覆盖在复合体表面,证明复合体确实对铜离子发生吸附作用。
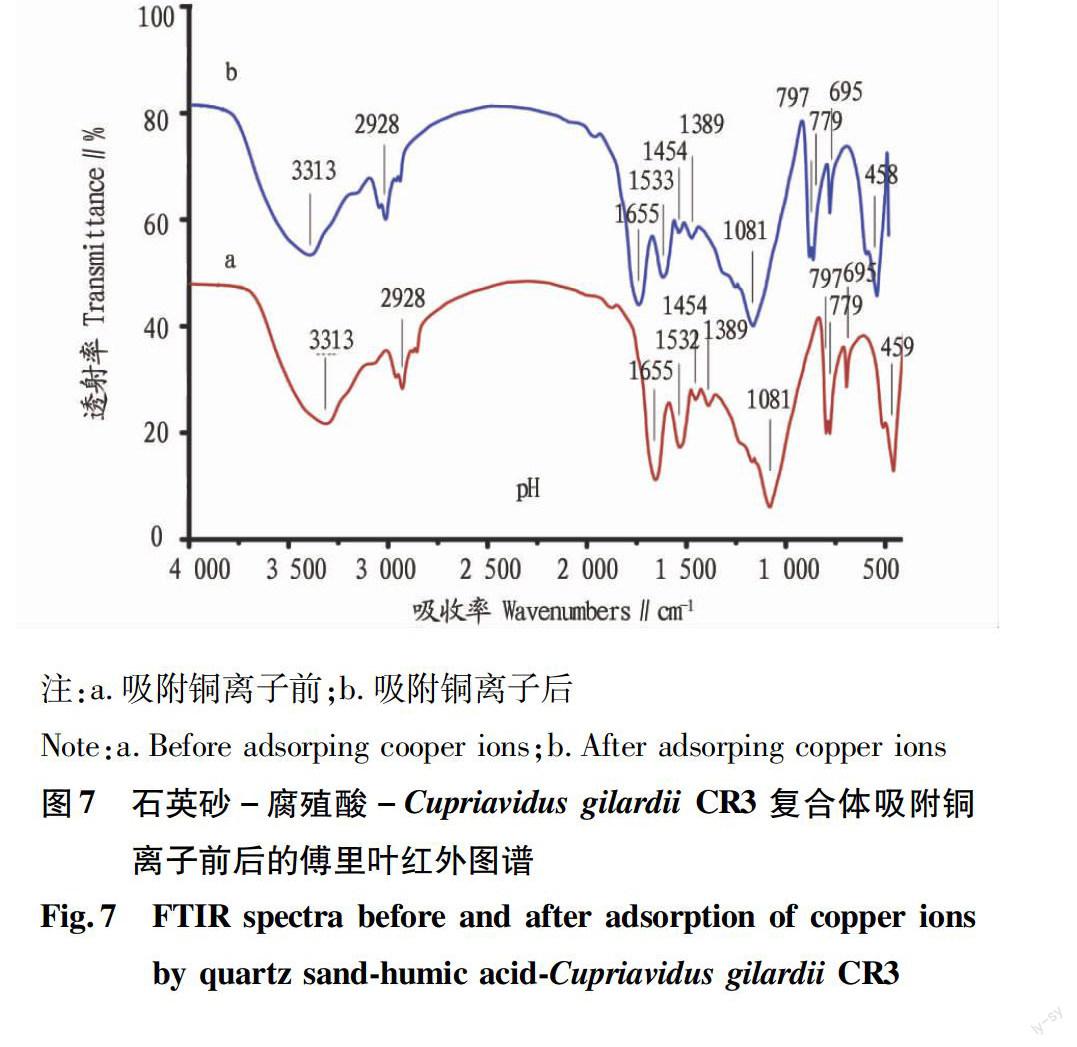
2.2.3FTIR。FTIR是研究吸附剂表面官能团的有效手段。复合体吸附铜离子前后官能团的特征峰变化情况见图7。在3 313 cm-1对应蛋白的-OH 和-NH;
2 928 cm-1对应CH2对称或不对称拉伸;1 655、1 532和1 454 cm-1分别对应C=O酰基I拉伸、C-N/N-H酰基II拉伸和-CH3/CH2蛋白吸收峰;1 389 cm-1对应C=O拉伸;1 081 cm-1对应C-OH/C-O-C/C-C/P=O;余下的吸收峰对应石英砂中的二氧化硅峰位[27-30](图7a)。这其中主要含有的官能团是羟基、羧基、氨基和磷酸基等。复合体吸附铜离子后,上述吸收峰的位置几乎没有发生偏移(< 15 cm-1)。
3结论
(1)pH是影响吸附铜离子的主要因素,最适的pH为50,静电作用改变石英砂-腐殖酸-Cupriavidus gilardii CR3复合体的吸附位点,使吸附量随着pH的升高而增大。
(2)复合体吸附铜离子的过程符合Langmuir模型和二级动力学模型,为单分子化学吸附。
(3)通過SEM-EDS发现,复合体吸附铜离子的过程与细菌变化有关,为进一步确定细菌在复合体吸附中的作用,后续试验将进行石英砂、腐殖酸和Cupriavidus gilardii CR3单一体系和它们彼此二元体系吸附铜离子的研究。
参考文献
[1] LI Z Y,FAN X Y,QI X B,et al.The impact of renewable wastewater on the distribution of heavy metals in plants,soil and underground water[J].China rural Water and hydropower,2012,7:5-8.
[2] ANAND R R,ASPANDIAR M F,NOBLE R R P.A review of metal transfer mechanisms through transported cover with emphasis on the vadose zone within the Australian regolith[J].Ore geology reviews,2015,73:394-416.
[3] WEAVER L,WEBBER J B,HICKSON A C,et al.Biofilm resilience to desiccation in groundwater aquifers:A laboratory and field study[J].Science of the total environment,2015,514:281-289.
[4] CELIS R,HERMOSIN M C,CORNEJO J.Heavy metal adsorption by functionalized clays[J].Environ Sci Technol,2000,34(34):4593-4599.
[5] PEACOCK C L,SHERMAN D M.Surface complexation model for multisite adsorption of copper(II)onto kaolinite[J].Geochim Cosmochim Acta,2005,69(15):3733-3745.
[6] HUANG Q Y,CHEN W L,XU L H.Adsorption of copper and cadmium by Cuand Cdresistant bacteria and their composites with soil colloids and kaolinite[J].Geomicrobiol J,2005,22(5):227-236.
[7] ELESWED B,KHALILI F.Adsorption of Cu(II)and Ni(II)on solid humic acid from the Azraq area,Jordan[J].Journal of colloid and interface science,2006,299(2):497-503.
[8] PADMAPRIYA G,MURUGESAN A G.Biosorption of copper ions using rhizoplane bacterial isolates isolated from Eicchornia crassipes ((Mart.)solms)with kinetic studies[J].Desalination and water treatment,2015,53(13):3513-3520.
[9] ZHU J,HUANG Q Y,PIGNA M,et al.Competitive sorption of Cu and Cr on goethite and goethitebacteria complex[J].Chemical engineering journal,2012,179(1):26-32.
[10] ARIAS M,BARRAL M T,MEJUTO J C.Enhancement of copper and cadmium adsorption on kaolin by the presence of humic acids[J].Chemosphere,2002,48(10):1081-1088.
[11] FANG L C,CAI P,LI P X,et al.Microcalorimetric and potentiometric titration studies on the adsorption of copper by P.putida and B.thuringiensis and their composites with minerals[J].Journal of hazardous materials,2010,181(1/2/3):1031-1038.
[12] DU H H,CHEN W L,CAI P,et al.Cd(II)sorption on montmorillonitehumic acidbacteria composites[J].Scientific reports,2016,6:19499.
[13] DU H H,CHEN W L,CAI P,et al.Cadmium adsorption on bacteria–mineral mixtures:Effect of naturally occurring ligands[J].European journal of soil science,2016,67(5):641-649.
[14] CHEN W M,WU C H,JAMES E K,et al.Metal biosorption capability of Cupriavidus taiwanensis and its effects on heavy metal removal by nodulated Mimosa pudica[J].Journal of hazardous materials,2008,151(2/3):364-371.
[15] MONSIEURS P,MOORS H,VAN H R,et al.Heavy metal resistance in Cupriavidus metallicdurans CH34 is governed by an intricate transcriptional network[J].Biometals,2011,24(6):1133-1151.
[16] WANG X Y,CHEN M L,XIAO J F,et al.Genome sequence analysis of the naphthenic acid degarding and metal resistant bacterium Cupriavidus gilardii CR3[J].Plos one,2015,10(8):132881.
[17] LI X N,LI A R,LONG M Z,et al.Equilibrium and kinetic studies of copper biosorption by dead Ceriporia lacerata biomass isolated from the litter of an invasive plant in China[J].Journal of environmental health science and engineering,2015,13(1):1-8.
[18] CHEN X C,WAMG Y P,LIN Q,et al.Biosorption of copper(II)and zinc(II)from aqueous solution by Pseudomonas putida CZ1[J].Colloids Surf B:Biointerfaces,2005,46(2):101-107.
[19] XIE H,ZHAO Q Q,ZHOU Z R,et al.Correction:Efficient removal of Cd(II)and Cu(II)from aqueous solution by magnesium chloridemodified Lentinula edodes[J].Rsc Adv,2015,5(42):33478-33488.
[20] 吳平霄,徐玉芬,朱能武,等.高嶺土/胡敏酸复合体对重金属离子吸附解吸实验研究[J].矿物岩石地球化学通报,2008,27(4):356-362.
[21] BAYRAMOGˇLU G,BEKTAS
瘙 塁 ,ARICA M Y.Biosorption of heavy metal ions on immobilized whiterot fungus Trametes versicolor[J].Journal of hazardous materials,2003,101(3):285-300.
[22] VEIT M T,TAVARES C R G,GOMESDACOSTA S M,et al.Adsorption isotherms of copper(II)for two species of dead fungi biomasses[J].Process Biochem,2005,40(10):3303-3308.
[23] WANG N,DU H H,HUANG Q Y,et al.Surface complexation modeling of Cd(II)sorption to montmorillonite,bacteria,and their composite[J].Biogeosciences discussions,2016,13(19):5557-5566.
[24] WALKER S G,FLEMMING C A,FERRIS F G,et al.Physicochemical interaction of Escherichia coli cell envelopes and Bacillus subtilis cell walls with two clays and ability of the composite to immobilize heavy metals from solution[J].Applied and environmental microbiology,1989,55(11):2976-2984.
[25] HUANG F,DANG Z,GUO C L,et al.Biosorption of Cd(II)by live and dead cells of Bacillus cereus RC1 isolated from cadmiumcontaminated soil[J].Colloids Surf B:Biointerfaces,2013,107(4):11-18.
[26] LU W B,SHI J J,WANG C H,et al.Biosorption of lead,copper and cadmium by an indigenous isolate Enterobacter sp.J1 possessing high heavymetal resistance[J].Journal of hazardous materials,2006,134(1/2/3):80-86.
[27] GAO X D,CHOROVER J.Insitu monitoring of Cryptosporidium parvum oocyst surface adhesion using ATRFTIR spectroscopy[J].Colloids Surf B:Biointerfaces,2009,71(2):169-176.
[28] OMOIKE A,CHOROVER J.Adsorption to goethite of extracellular polymeric substances from Bacillus subtilis[J].Geochim Cosmochim Acta,2006,70(4):827-838.
[29] UESHIMA M,GINN B R,HAACK E A,et al.Cd adsorption onto Pseudomonas putida in the presence and absence of extracellular polymeric substances[J].Geochim Cosmochim Acta,2008,72(24):5885-5895.
[30] XIA L,XU X J,ZHU W, et al.A comparative study on the biosorption of Cd2+ onto Paecilomyces lilacinus XLA and Mucoromycote sp.XLC[J].Int J Mol Sci,2015,16(7):15670-15687.

