孕鼠铁缺乏对子代G H-I G F-1轴的影响
桑璐,马雅静,周祖钊,王维,林霖,邱智枫
(1.石河子大学医学院,新疆石河子832002;2.江苏省涟水县人民医院,江苏淮安223400)
孕鼠铁缺乏对子代G H-I G F-1轴的影响
桑璐1,马雅静1,周祖钊1,王维2,林霖1,邱智枫1
(1.石河子大学医学院,新疆石河子832002;2.江苏省涟水县人民医院,江苏淮安223400)
目的探讨大鼠妊娠期铁缺乏对新生仔鼠生长激素-胰岛素样生长因子-1(GH-IGF-1)轴的影响及机制。方法4周龄雌性Wistar大鼠36只,随机分为实验组和对照组,分别饲低铁饲料和含铁饲料喂养4周,检测雌鼠血红蛋白(Hb)浓度,血细胞比容(HCT)、红细胞平均容积(MCV)、红细胞平均血红蛋白量(MCH)、红细胞平均血红蛋白浓度(MCHC)及红细胞分布宽度(RDW)等血液学相关参数。将雌鼠与正常雄鼠合笼,孕末期检测血液学相关参数并行骨髓铁染色。观察仔鼠存活率及体重。实时荧光定量聚合酶链式反应(qRTPCR)方法检测新生仔鼠垂体生长激素(GH)及肝脏胰岛素样生长因子-1(IGF-1)表达量。结果相比对照组,实验组低铁干预4周后孕鼠孕末期Hb、HCT、MCV、MCH及MCHC等水平降低(P<0.05),RDW水平升高(P<0.05);实验组大鼠骨髓细胞内铁及外铁减少;实验组新生仔鼠体重及仔鼠存活率低于对照组(P<0.05);实验组垂体GH信使核糖核酸(mRNA)及肝脏IGF-1 mRNA的表达低于对照组(P<0.05)。结论妊娠期铁缺乏下调子代GH和IGF-1 mRNA表达造成子代低出生体重。
铁缺乏;生长激素;胰岛素样生长因子-1
铁是人体必需的微量元素之一,妊娠期铁缺乏及缺铁性贫血(iron deficiency anemia,IDA)是妊娠期最常见的营养缺乏性疾病。据统计,全球有38%的孕妇贫血,而其中大多数为IDA[1]。孕期铁缺乏,不仅可导致早产,增加产妇病死率,同时也增加子代低出生体重和小于胎龄儿的发生率[2]。生长激素(growth hormone,GH)是由腺垂体分泌的,受下丘脑分泌的生长激素释放激素(growth hormone releasing hormone,GHRH)和生长抑素(somatostatin,SS)的双重调节,对生长和发育的调控发挥重要作用。GH的促生长作用主要通过胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)的介导[3]。而孕妇铁缺乏致低出生体重的机制是否与生长激素-胰岛素样生长因子-1(growth hormone-insulin-like growth factor-1,GH-IGF-1)轴有关,本实验通过建立孕鼠铁缺乏模型及实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,PCR),探讨孕鼠围产期铁缺乏对新生仔鼠GH-IGF-1轴的影响及机制。
1 材料与方法
1.1 实验对象
无特定病原体级Wistar雌鼠36只,体重70~85 g;雄鼠18只,体重75~90 g。均由新疆医科大学实验动物中心提供[生产许可证号:SCXK(新)2013-0001]。
1.2 饲料配方
缺铁性贫血模型复制参考呼延武等[4]低铁干预造模方法。低铁饲料:全脂奶粉68.0%,葡萄糖22.0%,酪蛋白6.0%,混合盐4.0%,混合维生素0.3 g/kg。普通饲料:七水合硫酸亚铁(FeSO47H2O)1.5 g/kg,其余成分不变。用原子吸收光谱法测定配制好的饲料中铁元素含量。低铁饲料含铁10.0 mg/kg;正常对照饲料含铁216.0 mg/kg。
1.3 主要试剂和仪器
铁染色液(上海太阳公司),总核糖核酸(ribonucleic acid,RNA)提取试剂盒(北京天根公司),反转录试剂盒(日本TaKaRa公司),荧光染料Quanti Nova SYBR Green PCR试剂盒(德国QIAGEN公司),全自动血细胞分析仪BC6800(广东省深圳迈瑞公司),显微镜(日本Olympus公司),qRTPCR仪TIB-8000(福建省厦门泰普公司)。
1.4 目的及内参引物设计
按照美国国家生物技术信息中心(national center for biotechnology information,GenBank)中大鼠GH及IGF-1基因序列设计相应引物,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参基因,引物均由上海生物工程股份有限公司合成,序列及参数(见表1)。
1.5 方法
1.5.1 复制缺铁性贫血孕鼠模型将36只Wistar雌性大鼠随机分为实验组和对照组,每组各18只,每笼3~4只饲养于不锈钢鼠笼中。动物在室温为(24±3)℃,相对湿度(50±10)%,人工模拟自然昼夜环境条件下饲养,饮用去离子水,动物自由摄食饮水。适应性饲喂1周后,实验组饲低铁饲料,对照组饲含铁饲料。4周后与健康成年Wistar雄性大鼠以2∶1比例合笼,确认受精后(孕0 d)分笼饲养,孕期继续饲喂低铁饲料和含铁饲料直至分娩。雌鼠孕末期(孕18 d)行眼内眦静脉采血,检测血红蛋白(hemoglobin,Hb)浓度、血细胞比容(haematocrit,HCT)、红细胞平均容积(mean corpuscular volume,MCV)、红细胞平均血红蛋白量(mean corpuscular hemoglobin,MCH)、红细胞平均血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)及红细胞分布宽度(red blood cell distribution width,RDW)等血液学相关参数。

表1 GH、IGF-1及G APD H基因引物序列及参数
1.5.2 孕鼠骨髓铁染色随机抽取实验组和对照组孕鼠各3只进行骨髓铁染色,取大腿股骨骨髓制成涂片,24 h内用铁染色液进行染色,显微镜下观察铁染色颗粒。
1.5.3 新生仔鼠一般资料观察观测仔鼠体重、活胎数及死胎数。
1.5.4 qRT-PCR检测提取新生仔鼠(<24 h)垂体和肝组织RNA时,按RNA提取试剂盒说明书提取。确定总RNA样本质量和浓度,以500 ng总RNA为模板,按逆转录试剂盒说明书合成互补脱氧核糖核酸(complementary de oxyribonucleic acid,cDNA)。qRT-PCR的反应体系为20μl:SYBR GreenⅠ(× 2)10μl,正反向引物各1.4μl,cDNA模板2μl,无酶水6.6μl。每个样本均做3个复孔。反应条件:95℃预变性2 min,95℃变性5 s,60℃退火延伸10 s,共40个循环。根据2-△△Ct对基因表达进行相对定量分析。
1.6 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,数据用两独立样本t检验进行分析,若不服从正态分布则用非参数检验,存活率用χ2检验比较,P<0.05为差异有统计学意义。
2 结果
2.1 两组雌鼠孕末期血液学参数
在低铁干预前,两组血液学参数指标差异无统计学意义(P>0.05),低铁干预4周后,实验组Hb、HCT、MCV、MCH及MCHC低于对照组(P<0.05),而实验组RDW高于对照组(P<0.05),表明低铁干预成功。孕末期实验组Hb、HCT、MCV、MCH及MCHC低于对照组(P<0.05),实验组RDW高于对照组(P<0.05),实验组表现为小细胞低色素性贫血,实验组大鼠在整个妊娠期都呈贫血状态(见表2~4)。
2.2 孕末期骨髓铁染色
骨髓小粒铁染色是临床诊断铁缺乏的金标准[5],对照组大鼠细胞外铁可达(++~+++),细胞内铁可见,巨噬细胞是细胞外铁储存的主要细胞,酸性亚铁氰化钾染色后,可见巨噬细胞胞质中含有大量蓝色沉淀铁颗粒。相比于对照组,实验组大鼠骨髓细胞内铁及外铁减少,表明缺铁性贫血孕鼠模型复制成功(见图1)。
表2 低铁干预前两组血液学参数比较(n=18±s)
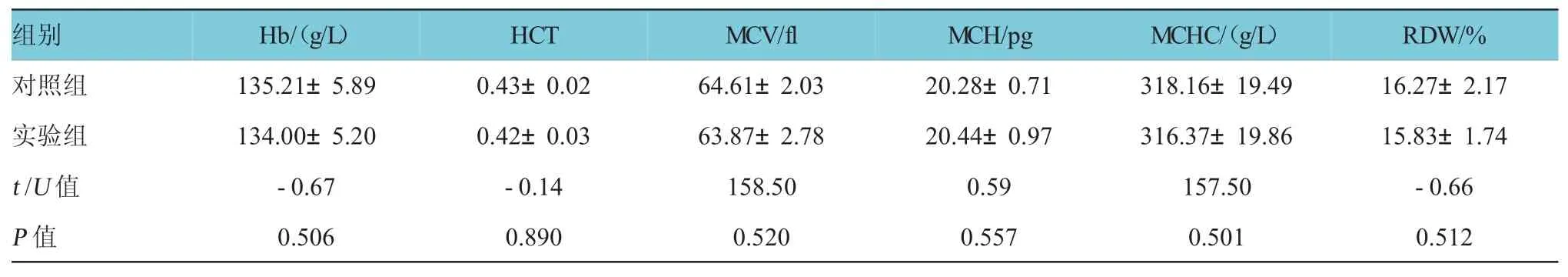
表2 低铁干预前两组血液学参数比较(n=18±s)
R D W / %对照组1 3 5 . 2 1 ± 5 . 8 9 0 . 4 3 ± 0 . 0 2 6 4 . 6 1 ± 2 . 0 3 2 0 . 2 8 ± 0 . 7 1 3 1 8 . 1 6 ± 1 9 . 4 9 1 6 . 2 7 ± 2 . 1 7实验组1 3 4 . 0 0 ± 5 . 2 0 0 . 4 2 ± 0 . 0 3 6 3 . 8 7 ± 2 . 7 8 2 0 . 4 4 ± 0 . 9 7 3 1 6 . 3 7 ± 1 9 . 8 6 1 5 . 8 3 ± 1 . 7 4t/U值-0 . 6 7 -0 . 1 4 1 5 8 . 5 0 0 . 5 9 1 5 7 . 5 0 -0 . 6 6P值0 . 5 0 6 0 . 8 9 0 0 . 5 2 0 0 . 5 5 7 0 . 5 0 1 0 . 5 1 2组别H b /(g / L)H C T M C V / f l M C H / p g M C H C /(g / L)
表3 低铁干预4周后两组血液学参数比较(n=18±s)
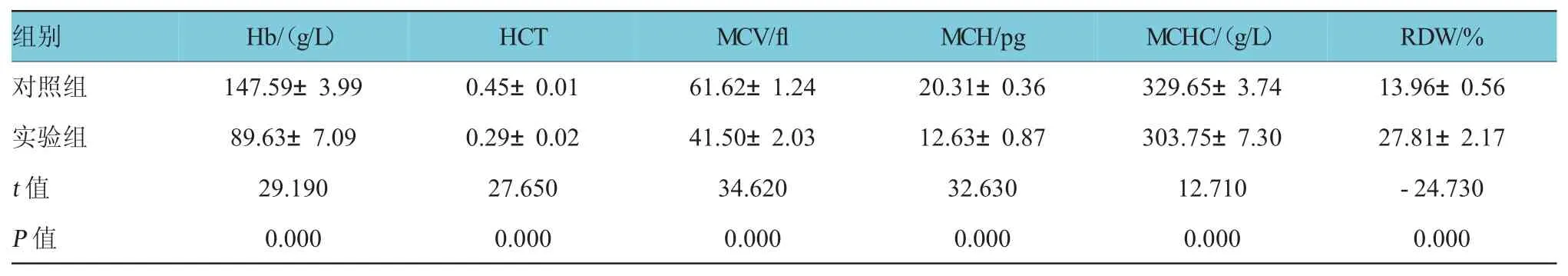
表3 低铁干预4周后两组血液学参数比较(n=18±s)
R D W / %对照组1 4 7 . 5 9 ± 3 . 9 9 0 . 4 5 ± 0 . 0 1 6 1 . 6 2 ± 1 . 2 4 2 0 . 3 1 ± 0 . 3 6 3 2 9 . 6 5 ± 3 . 7 4 1 3 . 9 6 ± 0 . 5 6实验组8 9 . 6 3 ± 7 . 0 9 0 . 2 9 ± 0 . 0 2 4 1 . 5 0 ± 2 . 0 3 1 2 . 6 3 ± 0 . 8 7 3 0 3 . 7 5 ± 7 . 3 0 2 7 . 8 1 ± 2 . 1 7t值2 9 . 1 9 0 2 7 . 6 5 0 3 4 . 6 2 0 3 2 . 6 3 0 1 2 . 7 1 0 -2 4 . 7 3 0P值0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0组别H b /(g / L)H C T M C V / f l M C H / p g M C H C /(g / L)
表4 孕末期两组血液学参数比较(n=18±s)

表4 孕末期两组血液学参数比较(n=18±s)
R D W / %对照组1 4 5 . 8 2 ± 8 . 2 2 0 . 4 4 ± 0 . 0 3 6 1 . 7 0 ± 1 . 0 9 2 0 . 6 3 ± 1 . 0 0 3 3 4 . 3 5 ± 1 6 . 0 9 1 3 . 6 8 ± 1 . 0 3实验组9 8 . 9 3 ± 6 . 7 7 0 . 3 2 ± 0 . 0 3 3 5 . 4 6 ± 0 . 7 7 1 1 . 0 0 ± 0 . 4 4 3 1 0 . 0 0 ± 1 3 . 1 9 2 6 . 4 0 ± 1 . 3 5t/U值1 7 . 4 6 0 1 0 . 8 5 0 7 7 . 7 1 0 0 . 0 0 0 2 8 . 0 0 0 -3 0 . 2 0 0P值0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0组别H b /(g / L)H C T M C V / f l M C H / p g M C H C /(g / L)

图1 孕末期大鼠骨髓铁染色
2.3 新生仔鼠一般资料情况
与对照组比较,实验组新生仔鼠体型偏小,皮肤颜色偏粉白。实验组新生仔鼠体重低于对照组(P<0.05),每窝产仔率及仔鼠存活率也低于对照组(P<0.05)(见表5)。
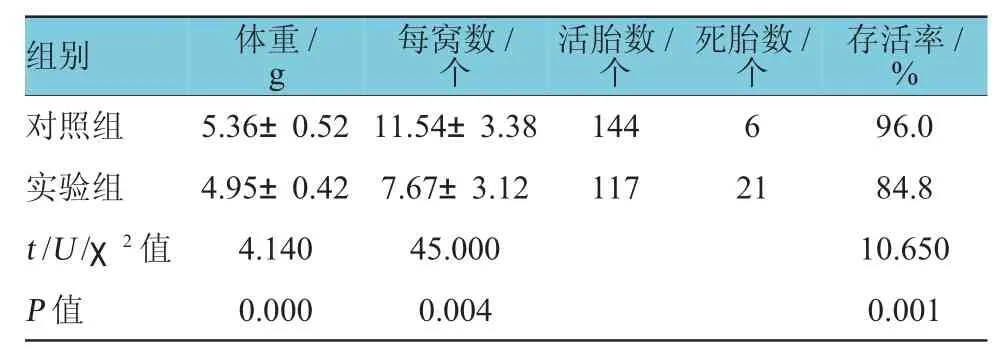
表5 实验组与对照组新生仔鼠一般资料比较
2.4 qR T-PC R结果
与对照组比较,实验组垂体GH信使核糖核酸(messenger ribonucleic acid,mRNA)的表达低于对照组(P<0.05),实验组肝脏IGF-1 mRNA表达低于对照组(P<0.05)(见表6和图2)。
表6 qR T-PC R结果(n=12±s)

表6 qR T-PC R结果(n=12±s)
肝脏I G F -1对照组1 . 0 0 ± 0 . 3 9 1 . 0 0 ± 0 . 1 8实验组0 . 6 6 ± 0 . 3 2 0 . 6 2 ± 0 . 2 0t值-2 . 5 0 0 -3 . 4 2 0P值0 . 0 2 0 0 . 0 0 7组别垂体G H
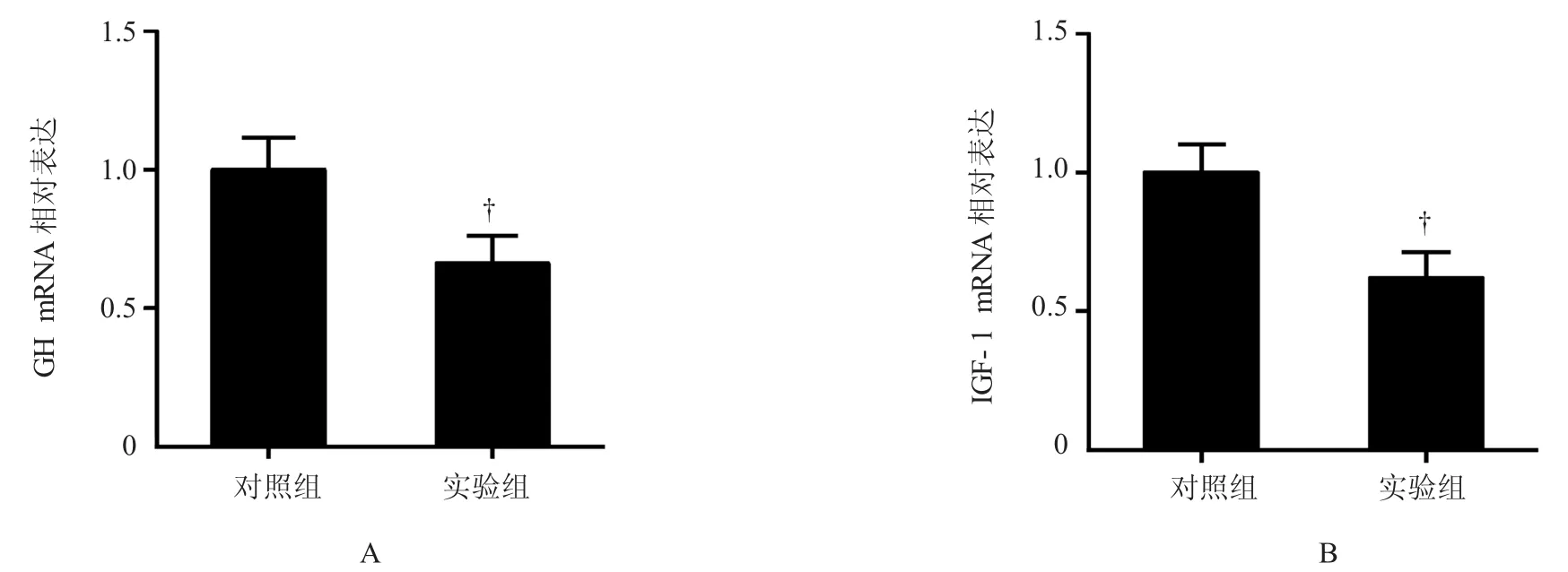
图2 实时定量PC R结果
3 讨论
妊娠合并贫血是临床中常见的高危妊娠类型,在妊娠期贫血中95%为IDA,IDA对母婴的健康有很大影响。重度贫血是孕产妇死亡的高危因素,占孕产妇死亡原因的20%[6]。贫血时由于胎盘氧气供应不足,可导致胎儿生长受限、流产、早产、死胎、新生儿窒息及缺血缺氧性脑病[7]。孕妇妊娠期的营养状况对新生儿具有较大影响,铁对神经系统的发育有促进作用[8],铁是一种合成多巴胺的辅酶,铁缺乏会改变多巴胺受体密度及其活性,孕期铁缺乏会增加子代患精神分裂的风险[9]。在本实验中,有1只实验组孕鼠在妊娠末期死亡,铁缺乏组每窝产仔率和存活率均低于正常对照组(P<0.05)。
国内外对于妊娠期贫血与低出生体重相关的报导已有不少,低出生体重的发生率为10.6%,贫血是造成低出生体重的危险因素之一[10]。王晓燕等[11]研究发现,妊娠期妇女随着贫血程度的加重,新生儿极低体重以及早产的发生率也有明显上升的趋势。B RIBOT等[12]报导,与体内铁正常的孕妇比较,孕早期铁缺乏的孕妇分娩的新生儿体重平均低192 g。郭志荣等[13]通过统计学分析发现,妊娠早期贫血可轻微增加早产及低出生体重的危险,而妊娠晚期贫血则与早产及低出生体重无关。丽丽[14]研究发现,孕末期或整个孕期贫血可导致低出生体重儿的发生率增高。在本研究中,实验组孕鼠在整个妊娠期都处于贫血状态,实验组仔鼠与对照组相比体型偏小,且新生仔鼠体重低于对照组(P<0.05),与上述研究相符,其原因可能包括贫血孕妇血液中的含氧量和养分均减少,导致胎盘供应的氧和营养物质均不能满足胎儿生长发育的需要。
胎儿在宫内生长发育受多种因素调节。GH的促进生长作用主要通过肝、软骨等组织产生的IGF-1介导,形成GH-IGF-1轴。长骨的生长需要GH和IGF-1的协同作用。IGF-1主要由肝脏分泌,是胎儿生长发育的主要调节因子,有促细胞分化和增殖活性,可促进蛋白质和脂肪的合成,是具有胰岛素样作用的一种多肽。AKCAKUS等[15]检测100例新生儿脐血中的IGF-1含量,发现孕周越小,体重越低,IGF-1水平也越低,早产儿和小于胎龄儿出生时IGF-1均低于适于胎龄儿。秦楠等[16]研究发现,成年大鼠铁缺乏后血清中IGF-1降低,且大鼠生长发育缓慢。蒋斓等[17]研究孕鼠围产期铁缺乏,发现子代肝脏中IGF-1蛋白水平降低。本研究中,铁缺乏组新生仔鼠垂体中GH mRNA水平明显低于对照组(P<0.05),且肝脏中IGF-1 mRNA的表达低于对照组(P<0.05)。提示实验组新生仔鼠体重偏低,体格偏小与孕母缺铁性贫血使子代GH-IGF-1轴下调有关。
综上所述,围产期铁缺乏不但影响子代存活率,还通过下调GH-IGF-1 mRNA的表达,使子代出现低出生体重。生长轴是由“下丘脑-GH-IGF-1”组成的神经内分泌轴。下丘脑分泌的GHRH和SS以突发式间歇性地分泌到垂体门静脉,协调控制垂体GH的分泌[3]。GH与生长激素结合蛋白结合,通过血液循环,与肝细胞膜表面的生长激素受体结合,启动肝细胞内的信号转导机制,促进IGF-1的表达[18]。SS可抑制GH释放及GH基因的转录,从而降低GH的合成。许宁一等[3]研究发现,低氧会促进下丘脑SS的释放,从而抑制GH-IGF-1轴,进而抑制大鼠体重增重。而缺铁性贫血引起的子代低出生体重,是否是通过低氧上调SS的表达,而造成GH和IGF-1低表达,铁缺乏在其中发挥的具体作用仍有待进一步验证。
[1]STEVENS GA,FINUCANE MM,DE-REGIL LM,et al.Global, regional,and national trends in haemoglobin concentration and prevalence of total and severe anaemia in children and pregnant and non-pregnant women for 1995-2011:a systematic analysis of population-representative data[J].Lancet Global Health,2013,1(1): e16-e25.
[2]范晓东,王如,常闻艳.妊娠晚期缺铁性贫血对妊娠结局的影响[J].国际妇产科学杂志,2014(3):274-276.
[3]许宁一.低氧等应激对大鼠GH-IGF-1轴的作用及其调控机制[D].浙江:浙江大学,2004.
[4]呼延武,马雅静,周祖钊,等.雌性大鼠缺铁性贫血模型的建立及相关指标观察研究[J].中国妇幼保健,2015,30(1):128-130.
[5]李浩,付美兰.缺铁性贫血诊断的研究进展[J].医学综述,2015, 21(3):462-464.
[6]SANGHVI T G,HARVEY P W,WAINWRIGHT E.Maternal iron-folic acid supplementation programs:evidence of impact and implementation[J].Food&Nutrition Bulletin,2010,31(2):100-107.
[7]BÁNHIDY F,ACS N,PUHÓ E H,et al.Iron deficiency anemia:pregnancy outcomes with or without iron supplementation[J].Nutrition,2011,27(1):65-72.
[8]PEIRANO P D,ALGARÍN C R,CHAMORRO R,et al.Sleep and neurofunctions throughout child development:lasting effects of early iron deficiency[J].Journal of Pediatric Gastroenterology& Nutrition,2009,48(3):S8-S15.
[9]SORENSEN H J,NIELSEN P R,PEDERSEN CB,et al.Association between prepartum maternal iron deficiency and offspring risk of schizophrenia:population-based cohort study with linkage of danish national registers[J].Schizophrenia Bulletin,2011,37(5):982-987.
[10]MITAO M,PHILEMON R,OBURE J,et al.Risk factors and adverse perinatal outcome associated with low birth weight in northern tanzania:a registry-based retrospective cohort study[J]. Asian Pacific Journal of Reproduction,2016,5(1):75-79.
[11]王晓燕,买里古尼·米来,张小荣,等.哈萨克族妇女妊娠期缺铁性贫血对新生儿结局的影响以及干预措施研究[J].中国卫生产业,2016,4(17):17-19.
[12]RIBOT B,ARANDA N,VITERI F,et al.Depleted iron stores without anaemia early in pregn ancy carries increased risk of lower birthweight even when supplemented daily with moderate iron[J].Human Reproduction,2012,27(5):1260-1266.
[13]郭志荣,蒋国雄,周永兰.妊娠期贫血与早产、低出生体重关系的meta分析[J].苏州大学学报,2003,23(3):373-377.
[14]丽丽.妊娠期缺铁性贫血与新生儿体重、早产的关系[D].广西:广西医科大学,2015.
[15]AKCAKUS M,KOKLU E,KURTOGLU S,et al.The relationshipamongintrauterinegrowth,insulinlikegrowthfactorI (IGF-I),IGF-binding protein-3,and bone mineral status in newborn infants[J].American Journal of Perinatology,2006,23(8):473-480.
[16]秦楠,呼延武,马雅静.铁缺乏对大鼠胰岛素样生长因子-1水平的影响[J].西部医学,2015,27(6):807-809.
[17]蒋斓,程江,马雅静.围产期铁缺乏对仔鼠肝组织促红细胞生成素表达的影响[J].山东医药,2013,53(27):10-12.
[18]范炜,殷红,李春风,等.胰岛素样生长因子-1调节生长发育的研究进展[J].黑龙江畜牧兽医,2013,1(42):19-22.
Effect of iron deficiency in pregnant rat on GH-IGF-1 axis of offspring
Lu Sang1,Ya-jing Ma1,Zu-zhao Zhou1,Wei Wang2,Lin Lin1,Zhi-feng Qiu1
(1.Medical College of Shihezi University,Shihezi,Xinjiang 832002,China; 2.Lianshui People's Hospital,Huaian,Jiangsu 223400,China)
ObjectiveTo explore how iron deficiency in pregnant rats affected GH-IGF-1 axis of offspring and its mechanism.MethodsFour-week-old healthy female Wistar rats were randomly divided into experimental group(n=18)and control group(n=18).The rats of the experimental group were fed with low iron diet, while the control group were fed with normal diet.After four weeks,according to the 2:1 ratio,the rats were mated with healthy adult male rats.Hematological parameters of the rats'eye vein blood were detected, including hemoglobin(Hb),haematocrit(HCT),mean corpuscular volume(MCV),mean corpuscular hemoglobin (MCH),mean corpuscular hemoglobin concentration(MCHC)and red blood cell distribution width(RDW). Pregnant rats were randomly drawn from each group to measure the iron of bone marrow.The survival rate and weight of newborn rat offspring were observed.The mRNA expressions of growth hormone(GH)in pituitary and insulin-like growth factor-1(IGF-1)in liver of newborn rats were assessed by quantitative real-time PCR.ResultsThe levels of Hb,HCT,MCV,MCH and MCHC in the experimental group were significantly lower(P<0.05)than those of the control group,while RDW increased remarkably(P<0.05).In the experimental group,iron in pregnant rats'bone marrow decreased significantly more than that in the control group,compared with which,the survival rate,weight,and the expression of GH mRNA and IGF-1 mRNA of offspring decreased significantly(P<0.05)in the experimental group.ConclusionsIron deficiency during pregnancy leads to low birth weight through down-regulating the expression of GH mRNA and IGF-1 mRNA ofoffspring.
iron deficiency;growth hormone;insulin-like growth factor-1
R556.3
A
10.3969/j.issn.1005-8982.2017.08.003
1005-8982(2017)08-0012-05
2016-11-10
马雅静,E-mail:mayajing2912@126.com

