不同剂量链脲佐菌素诱导C 57BL/6小鼠1型糖尿病模型的复制与iN KT细胞的检测
陈冬志,尹晓琳,娄永富,杨飞,王园园,刘嘉琳,孟明,侯明辉
(1.河北大学医学部,河北保定071000;2.河北大学附属医院,河北保定071000)
基础研究·论著
不同剂量链脲佐菌素诱导C 57BL/6小鼠1型糖尿病模型的复制与iN KT细胞的检测
陈冬志1,尹晓琳1,娄永富1,杨飞1,王园园1,刘嘉琳1,孟明1,侯明辉2
(1.河北大学医学部,河北保定071000;2.河北大学附属医院,河北保定071000)
目的腹腔注射不同剂量链脲佐菌素(STZ)于雌性C57BL/6小鼠,诱导建立与人类1型糖尿病相似的动物模型,研究最适链脲佐菌素(STZ)建模剂量。方法35只雌性C57BL/6小鼠随机分为正常对照组(n= 5)和模型一、二、三组(STZ剂量分别为40、50和60 mg/kg),每组10只。模型组连续5 d腹腔注射不同剂量STZ,测定注射前、注射后1、2、3、4和5周的空腹血糖和体重,小鼠胰岛素自身抗体(IAA)阳性率,观察小鼠饮食、饮水和排尿情况。流式细胞技术(FACS)分析血和脾细胞悬液中恒定自然杀伤T细胞(iNKT)细胞比例;HE染色观察胰岛病理。结果与对照组比较,模型三组饮水量、进食量和排尿量增加,体重减轻。与对照组比较,模型三组血糖变化明显,注射STZ后第1周迅速升高,第4周达高峰,随后下降,差异有统计学意义(P<0.05)。与对照组比较,模型组3组胰岛萎缩,胰岛细胞不规则,数目减少。模型二组和模型三组IAA阳性率分别达到30%和90%。与对照组比较,模型三组外周血CD4+NK1.1+淋巴细胞和脾CD4+NK1.1+淋巴细胞比例减少,差异有统计学意义(P<0.05)。结论诱导建立雌性C57BL/6小鼠1型糖尿病模型的最适STZ剂量为60 mg/kg。
1型糖尿病;链脲佐菌素;C57BL/6小鼠;恒定自然杀伤T细胞
1型糖尿病(Diabetesmellitustype1,T1DM)是T细胞介导的自身免疫病。主要病理表现为淋巴细胞浸润性胰岛炎,进行性胰岛β细胞功能破坏,使其丧失合成和分泌胰岛素的功能,从而引起糖代谢紊乱[1-2]。若治疗不当或不及时将会产生严重的并发症进而导致死亡,严重影响患者生活质量。近年来T1DM发病率呈现出增长趋势,由于T1DM的病因、发病机制尚未完全阐明,预防和治疗仍不完善,因此建立较理想的动物模型对研究该病的发病机制和治疗具有重要意义[3]。
近年来发现,恒定自然杀伤T细胞(invariant nature killer T,iNKT)在自身免疫性疾病中有重要作用,且与T1DM的发生发展密切相关。多数T1DM患者体内iNKT细胞的数量和功能都低于正常水平,治疗后随着病情的缓解而恢复[4-6],但其机制尚不完全清楚。
链脲佐菌素(streptozocin,STZ)是从链霉菌中提取出来的一种抗生素,由葡萄糖分子和甲基化氮源部分组成,是诱导糖尿病动物模型的常用药物之一。STZ诱导糖尿病的发生及类型与鼠的种系、性别、用药剂量和次数有关[7-9]。一般认为,多次小剂量STZ可诱导T1DM,但用药剂量文献报道不一[10-13]。本研究采用多次腹腔注射不同剂量的STZ诱导C57BL/6小鼠1型糖尿病,以筛选造模的适宜剂量,同时检测外周血和脾iNKT细胞的比例,为进一步探讨iNKT细胞在T1DM发病中的作用打下基础。
1 材料与方法
1.1 实验动物
雌性C57BL/6实验小鼠[北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2012-0001],日龄35~41 d。小鼠饲养于通风、清洁的无特定病原体(specific pathogen free,SPF)级动物室,室温(23±2)℃,相对湿度(50±5)%,12 h光照和12 h黑暗循环进行,所有小鼠均自由摄食、饮水。实验动物严格遵守《实验动物保护条例》,动物处理程序经过河北大学医学部伦理委员会认证。
1.2 主要试剂及仪器
链脲佐菌素(Streptozocin,STZ)(美国Cayman Chemical公司),柠檬酸(C6H5O7H2O)(天津市北方天医化学试剂厂),柠檬酸三钠(C6H5O7Na32H2O)(天津市化学试剂三厂),血糖仪和血糖试纸(湖南省长沙市三诺生物传感股份有限公司),尿糖试纸(广东省广州市花都高尔宝生物技术有限公司),磷酸盐缓冲液(phosphate buffered saline,PBS)(江苏省无锡市傲锐东源生物科技有限公司),荧光单克隆抗体试剂盒(CD4-FITC)(美国BD Pharmingen公司),胰岛素自身抗体(insulin autoantibodies,IAA)试剂盒(北京方程佰金科技有限公司),FACS Calibur细胞仪(美国BD Pharmingen公司),低温低速离心机(美国Beckman Coulter公司)。
1.3 方法
1.3.1 药品溶液配制STZ溶于0.1 mol/L柠檬酸缓冲液氢离子浓度指数(potential of hydrogen,PH)4.5配制。0.22 μm滤器除菌,避光,现用现配。
1.3.2 动物分组雌性C57BL/6实验小鼠35只,适应性饲养1周后随机分为正常对照组(5只/组)和模型一、二、三组,模型组每组10只。四组均给予普通饲料,各组分笼饲养,造模前禁食12 h,自由饮水。
1.3.3 糖尿病模型的复制禁食结束后,正常对照组腹腔注射同体积的0.1 mol/L,pH 4.5柠檬酸缓冲液,模型一、二、三组分别每天1次、连续5 d腹腔注射40、50和60 mg/kg的1%STZ溶液。每周测量1次空腹血糖,监测小鼠体重动态变化,连续5周。空腹血糖值连续2周≥11.1 mmol/L为建模成功。
1.3.4 小鼠IAA检测注射STZ 1周后小鼠眼眶静脉丛取血,每只采血100 μl,室温下血液自然凝固,收集血清。酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)测定血清中IAA,严格按试剂盒说明操作。
1.3.5 小鼠体征末次注射STZ后每天观察并记录小鼠的精神状态、活动情况、毛发颜色、排尿量及死亡情况等;每天测定各组小鼠的摄食量和饮水量。
1.3.6 小鼠组织取材造模后第5周分别取小鼠眼球血。断颈椎处死后置于75%乙醇中消毒3 min,将小鼠仰卧位置于解剖盘上,打开腹腔,取出脾组织、胰腺。胰腺组织用75%乙醇冲洗后置于4%甲醛溶液中固定、石蜡包埋用于病理;取脾制成单细胞悬液用于流式检测脾脏内脾iNKT细胞比例;血液上清冻存用于IAA检测;血细胞用于测试iNKT频率。
1.3.7 流式细胞术检测全血iNKT细胞频率收集各组小鼠各期全血(每只120 μl)置于流式管,牛血清白蛋白(albumin from bovine serum,BSA)阻断后加入(异硫氰酸荧光素fluorescein isothiocyanate,FITC)标记的anti-CD4、NK 1.1-PE-NKH各2μl,4℃避光孵育20 min。然后加红细胞裂解液1 ml,避光8 min,观察澄清透亮后离心弃上清液,PBS重复洗涤2次,重悬,加PBS定容500 μl,用美国BD FACS公司流式细胞仪Calibur上机检测,流式细胞分析软件(FlowJo)进行数据分析。
1.3.8 流式细胞术检测脾脏CD4+NK1.1+细胞比例断颈椎处死小鼠,分离脾脏并剪碎,置于200目筛网中央,加PBS液,用注射器针芯研磨,收集过滤的细胞液,1 000转/min,5 min,4℃,离心去上清液,PBS清洗1次。样品稀释液重悬脾细胞沉淀,加入含5 ml小鼠淋巴细胞分离液的10 ml离心管中,2 000转/min,15 min,4℃,离心,吸取淋巴细胞,PBS清洗2次,计数。取1×106细胞,100 μl PBS重悬,取FITC-CD4单抗、PE-NK1.1单抗各2 μl加入每管细胞中,4℃避光孵育25 min后,PBS清洗2次,500 μl PBS重悬,使用流式细胞仪检测。
1.3.9 小鼠胰腺组织HE染色二甲苯(Ⅰ、Ⅱ)脱蜡,梯度乙醇水化,蒸馏水洗;苏木素染色15 min,水洗;1%盐酸乙醇分化数秒,自来水返蓝15 min,水洗;1%乙醇伊红染色3 min;最后梯度乙醇脱水,二甲苯透明,中性树胶封固,于显微镜下观察。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,统计数据以均数±标准差(±s)表示,多组间比较用重复测量的多因素方差分析,阳性率比较用确切概率(Monte Carlo)计算,P<0.05为差异有统计学意义。
2 结果
2.1 小鼠体征变化
对各组小鼠日常活动状态观察发现,正常对照组C57BL/6小鼠均表现为毛发顺滑有光泽,精神状态良好,反应灵敏。模型组小鼠均有不同程度地表现为活动少,精神萎靡,毛发黄干欠光泽,易脱毛,反应迟钝等现象,尤以模型三组最为明显。模型三组的摄食量和饮水量高于正常对照组;模型三组的垫料比正常对照组的垫料湿度大,多尿症状明显。
2.2 小鼠体重的动态变化
对照组与模型一组、模型二组、模型三组腹腔注射STZ后1、2、3、4及5周的小鼠体重变化比较,采用重复测量数据的方差分析,结果:①不同时间点的体重比较,差异有统计学意义(F=2372.911,P=0.000)。②对照组与各模型组的体重变化比较,差异有统计学意义(F=248.281,P=0.000),模型三组小鼠体重与其余各组相比体重增加最少。③对照组与各模型组的体重变化趋势比较,差异有统计学意义(F=21.953,P=0.000)。见表1和图1。

图1 不同组小鼠体重随时间变化趋势
表1 不同组小鼠各时间点体重比较情况(±s)
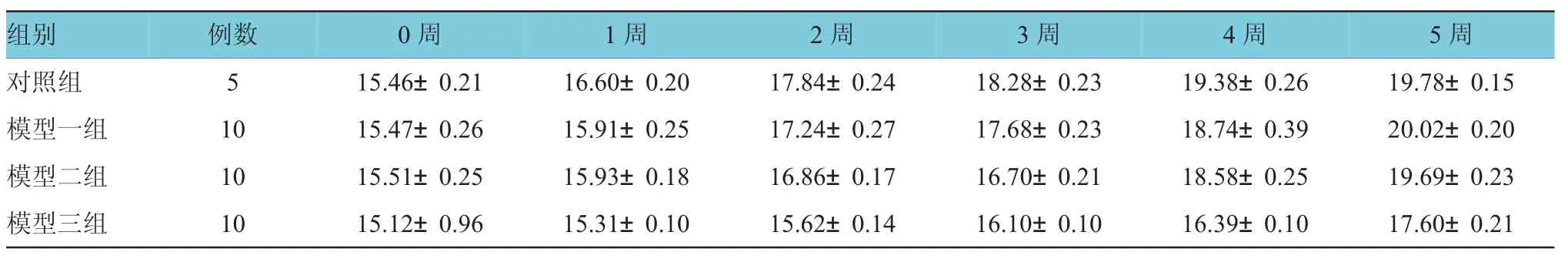
表1 不同组小鼠各时间点体重比较情况(±s)
组别例数0周1周2周3周4周5周对照组5 1 5 . 4 6 ± 0 . 2 1 1 6 . 6 0 ± 0 . 2 0 1 7 . 8 4 ± 0 . 2 4 1 8 . 2 8 ± 0 . 2 3 1 9 . 3 8 ± 0 . 2 6 1 9 . 7 8 ± 0 . 1 5模型一组1 0 1 5 . 4 7 ± 0 . 2 6 1 5 . 9 1 ± 0 . 2 5 1 7 . 2 4 ± 0 . 2 7 1 7 . 6 8 ± 0 . 2 3 1 8 . 7 4 ± 0 . 3 9 2 0 . 0 2 ± 0 . 2 0模型二组1 0 1 5 . 5 1 ± 0 . 2 5 1 5 . 9 3 ± 0 . 1 8 1 6 . 8 6 ± 0 . 1 7 1 6 . 7 0 ± 0 . 2 1 1 8 . 5 8 ± 0 . 2 5 1 9 . 6 9 ± 0 . 2 3模型三组1 0 1 5 . 1 2 ± 0 . 9 6 1 5 . 3 1 ± 0 . 1 0 1 5 . 6 2 ± 0 . 1 4 1 6 . 1 0 ± 0 . 1 0 1 6 . 3 9 ± 0 . 1 0 1 7 . 6 0 ± 0 . 2 1
2.3小鼠空腹血糖变化
对照组与模型一组、模型二组、模型三组腹腔注射STZ后1、2、3、4及5周的空腹血糖浓度变化比较,采用重复测量数据的方差分析,结果:①不同时间点的空腹血糖浓度比较,差异有统计学意义(F= 3 662.117,P=0.000)。②对照组与各模型组的空腹血糖浓度变化比较,差异有统计学意义(F=996.495,P= 0.000),模型三组小鼠与其余各组比较,空腹血糖浓度值最大。③对照组与各模型组的血糖浓度变化趋势比较,差异有统计学意义(F=536.259,P=0.000)。见表2和图2。

图2 不同组小鼠空腹血糖浓度随时间变化趋势图
表2 不同组小鼠各时间点空腹血糖浓度比较情况(±s)
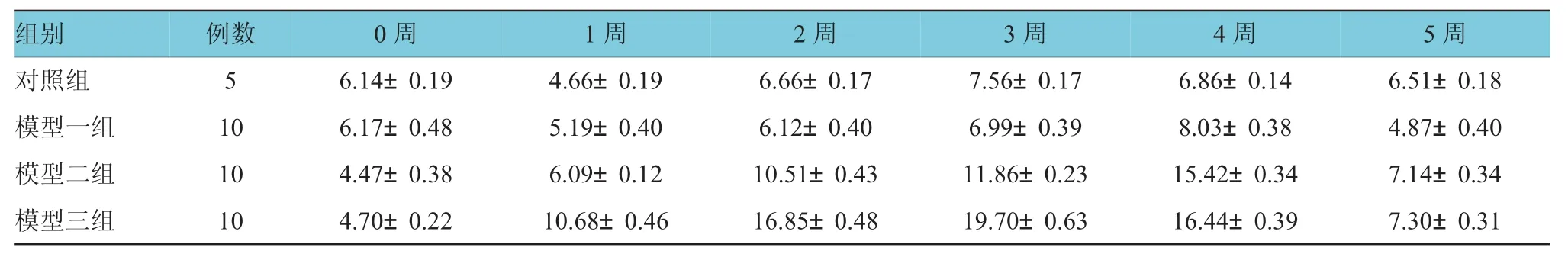
表2 不同组小鼠各时间点空腹血糖浓度比较情况(±s)
组别例数0周1周2周3周4周5周对照组5 6 . 1 4 ± 0 . 1 9 4 . 6 6 ± 0 . 1 9 6 . 6 6 ± 0 . 1 7 7 . 5 6 ± 0 . 1 7 6 . 8 6 ± 0 . 1 4 6 . 5 1 ± 0 . 1 8模型一组1 0 6 . 1 7 ± 0 . 4 8 5 . 1 9 ± 0 . 4 0 6 . 1 2 ± 0 . 4 0 6 . 9 9 ± 0 . 3 9 8 . 0 3 ± 0 . 3 8 4 . 8 7 ± 0 . 4 0模型二组1 0 4 . 4 7 ± 0 . 3 8 6 . 0 9 ± 0 . 1 2 1 0 . 5 1 ± 0 . 4 3 1 1 . 8 6 ± 0 . 2 3 1 5 . 4 2 ± 0 . 3 4 7 . 1 4 ± 0 . 3 4模型三组1 0 4 . 7 0 ± 0 . 2 2 1 0 . 6 8 ± 0 . 4 6 1 6 . 8 5 ± 0 . 4 8 1 9 . 7 0 ± 0 . 6 3 1 6 . 4 4 ± 0 . 3 9 7 . 3 0 ± 0 . 3 1
2.4 小鼠血清中I AA抗体阳性率
阳性率比较采用确切概率(Monte Carlo)计算。造模后第1周,对照组、模型一组、模型二组及模型三组小鼠血清中IAA抗体阳性例数分别为0、1、3及9只,阳性率分别为0%、10%、30%及90%,四组间差异有统计学意义(P=0.00)。两两比较结果:模型三组与对照组比较(χ2=7.813,P=0.005);模型三组与模型一组比较(χ2=9.800,P=0.002);模型三组与模型二组比较(χ2=5.208,P=0.022)。
2.5 小鼠胰岛组织病理变化
胰岛界限清晰,β细胞数量较多且均匀分布。胰岛多为圆形或椭圆形的细胞团,分散于胰腺腺泡之间,组织切片可见胰岛组织无淋巴细胞浸润(见图3)。胰岛明显萎缩,胰岛细胞不规则,数目明显减少,分布稀疏,细胞核固缩。胰岛β细胞有空泡变性(见图3)。
2.6 小鼠外周血C D 4+N K1.1+淋巴细胞亚群比例
与对照组比较,模型二、三组外周血iNKT细胞比例下降,差异有统计学意义(P<0.05),模型三组下降尤为明显(见图4、5)。
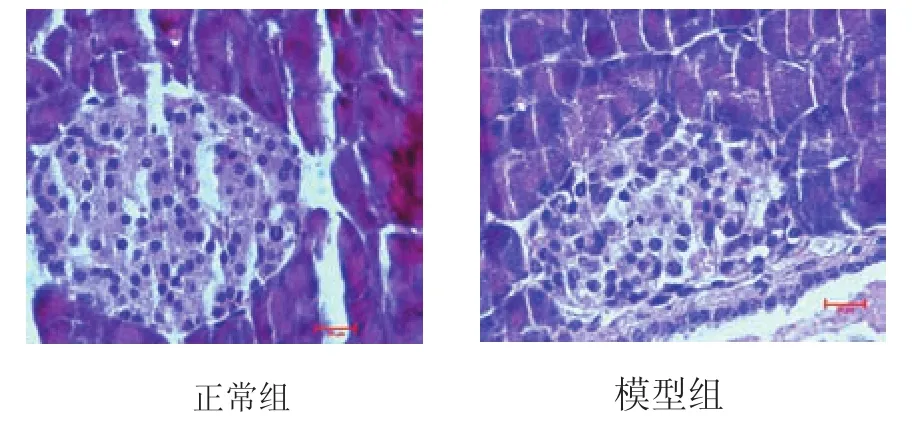
图3 小鼠胰岛组织(×400)

图4 外周血中C D 4+N K1.1+淋巴细胞亚群流式图
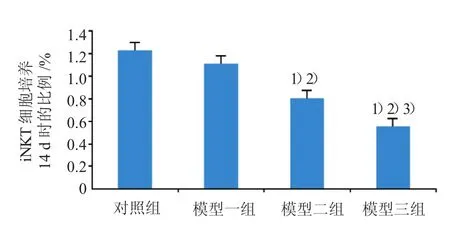
图5 外周血中C D 4+N K1.1+淋巴细胞亚群条形图
2.7 小鼠脾细胞悬液C D 4+N K1.1+淋巴细胞亚群比例
与对照组比较,模型二、三组脾细胞悬液中iNKT细胞比例下降,差异有统计学意义(P<0.05),模型三组下降尤为明显。见图6、7。
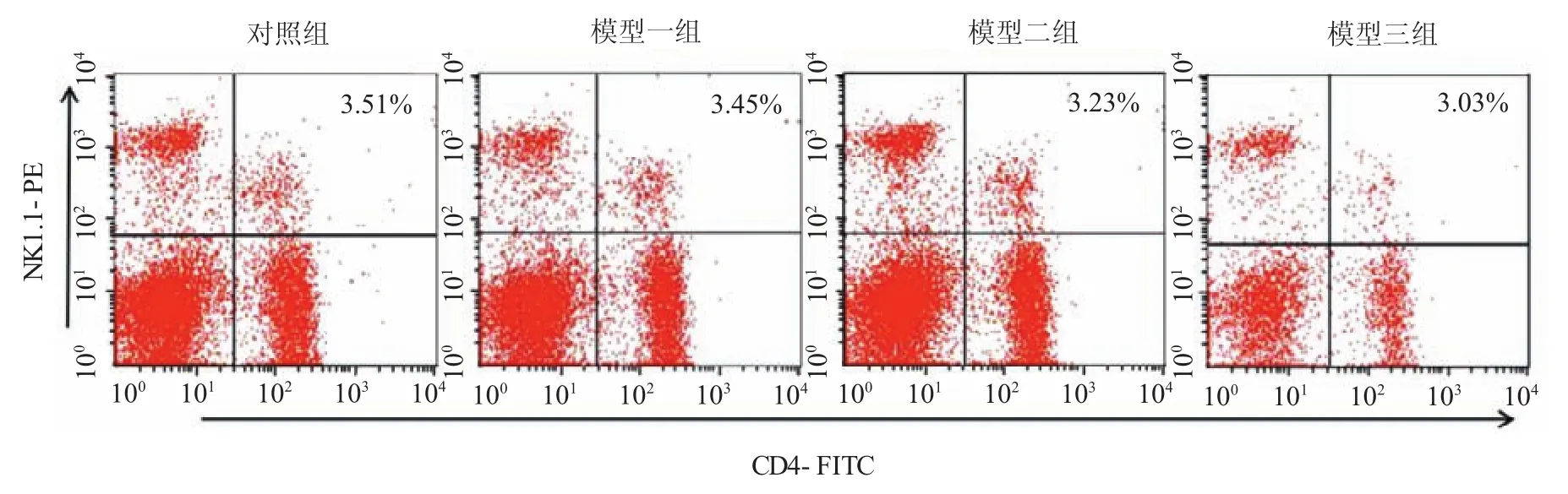
图6 脾中C D 4+N K1.1+淋巴细胞亚群流式图

图7 脾中C D 4+N K1.1+淋巴细胞亚群条形图
3 讨论
多次低剂量STZ注射诱导的糖尿病最早是在1976年由LIKE等人[14]建立,这种方法能引发机体对胰岛的自身免疫应答,诱导产生自身免疫介导的动物模型,能很好的模仿人类T1DM的症状。由于STZ具有半衰期长、造模快速稳定、中枢选择性不强、组织毒性较小及致死率低等优点[15],因此被广泛应用来复制T1DM动物模型。
近来实验已经证明,STZ通过其本身含有的葡萄糖部分结构被胰岛B细胞上低亲和力的葡萄糖转运蛋白(glucose transporters2,GLUT2)转运,可以特异性地作用于胰岛B细胞并引起其结构破坏和胰岛素分泌功能障碍[16-18],但关于STZ的用药次数和用药剂量文献报道不一[19-21]。
本研究发现,模型组小鼠均有不同程度地表现为活动少、精神萎靡、毛发黄干欠光泽、易脱毛及反应迟钝等现象,尤以模型三组最为明显。饮水量和摄食量数据显示,模型三组的摄食量和饮水量高于正常对照组,垫料湿度大,多尿症状明显。小鼠体重的动态曲线显示模型三组较其余三组体重增加缓慢。空腹血糖变化显示,模型一组血糖变化不明显,模型二组和模型三组注射STZ后第1周开始升高,第4~5周达高峰,随后下降,尤以模型三组血糖变化明显。血清中IAA抗体阳性率模型一组为10.00%,模型二组为30.00%,模型三组为90.00%,IAA阳性表明进展为糖尿病的自身免疫倾向,是诊断T1DM的重要参考指标。胰岛病理改变显示正常对照组胰岛界限清晰,β细胞数量较多且均匀分布。胰岛多为圆形或椭圆形的细胞团,分散于胰腺腺泡之间,组织切片可见胰岛组织无淋巴细胞浸润。模型三组胰岛明显萎缩,胰岛细胞不规则,数目减少,分布稀疏,细胞核固缩,胰岛β细胞有空泡变性。综合小鼠一般表现、体重、血糖、自身抗体和胰岛病理变化,模型二、三组符合T1DM,造模是成功的,尤以模型三组更为典型,笔者认为T1DM造模STZ最佳剂量是60 mg/kg。但实验中也观察到模型二组血糖在注射STZ后第5周达到高峰,随后开始下降;模型三组血糖在注射STZ后第4周达到高峰,随后开始下降。由于本实验只观察6周,因此,对模型的稳定性还需进一步研究。
近年来发现,iNKT细胞在自身免疫性疾病中有重要作用,且与T1DM的发生、发展密切相关。多数T1DM患者体内iNKT细胞的数量和功能都低于正常水平[4-6]。本研究还在STZ诱导T1DM模型中观察iNKT的变化,发现小鼠外周血和脾细胞悬液iNKT细胞比例下降,与文献报道情况一致,说明iNKT细胞可能参与STZ诱导T1DM的发生,这为今后进一步研究iNKT细胞在T1DM发病中的作用提供一个可借助的模型基础。
[1]PIGHIN D,KARABATAS L,PASTORALE C,et al.Role of lipids in the early developmental stages of experimental immune diabetes induced by multiple low dose streptozotocin[J].Journal of Applied Physiology,2005,98(3):1064-1069.
[2]ICHINOSE K,KAWASAKI E,EGUCHI K.Recent advancement of understanding pathogenesis of type 1 diabetes and potential relevance to diabetic nephropathy[J].American Journal of Nephrology,2007,27(6):554-564.
[3]李甜,张亚楼,陈龙,等.链脲佐菌素诱导C57小鼠1型糖尿病模型的研究[J].现代生物医学进展,2014,14(26):5031-5033.
[4]FORESTIER C,TAKAKI T,MOLANO A,et al.Improved outcomes in NOD mice treated with a novel Th2 cytokine-biasing NKT cell activator[J].Journal of Immunology,2007,178(3):1415-1425.
[5]DRIVER J P,SCHEUPLEIN F,CHEN YG,et al.Invariant natural killer T-cell control of type 1 diabetes:a dendritic cell genetic decision of a silver bullet or Russian roulette[J].Diabetes, 2010,59(2):423-432.
[6]LI W,JI F,ZHANG Y,et al.Cooperation of invariant NKT cells and CD4+CD25+T regulatory cells in prevention of autoimmune diabetes in non-obese diabetic mice treated with alphagalactosylceramide[J].Acta Biochimica Et Biophysica Sinica,2008, 40(5):381-390.
[7]CUNHA J M,FUNEZ MI,CUNHA F Q,et al.Streptozotocin-induced mechanical hypernociception is not dependent on hyperglycemia[J].Brazilian Journal of Medical&Biological Research, 2009,42(2):197-206.
[8]JUNGOK K,GEEDONG L,JOONGHO K,et al.Anti-diabetic effects of new herbal formula in neonatally streptozotocin-induced diabetic rats[J].Biological&Pharmaceutical Bulletin,2009,32(3):421-426.
[9]HE Y,MARTINEZ-FLEITES C,BUBB A,et al.Structural insight into themechanism of streptozotocin inhibition of O-GlcNA-case[J].Carbohydrate Research,2009,344(5):627-631.
[10]BEAUQUIS J,ROIG P,NICOLA A F D,et al.Short-term environmental enrichment enhances adultneurogenesis,vascular network and dendritic complexity in the hippocampus of type 1diabetic mice[J].PLOSONE,2010,5(11):419-453.
[11]屈彦纯,杜娥,张玥,等.糖尿病小鼠模型制备方法的初步探讨[J].医学研究杂志,2011,40(3):78-80.
[12]QU Y,DU E,ZHANG Y,et al.Preliminary studies on approaches for setting up diabetic mice model[J].Journal of Medical Research,2011,40(3):78-80.
[13]CAO SJ,ZHAO-HUI H E,XUN L I,et al.Preparation of diabetes rat model induced by streptozotocin[J].Anatomy Research, 2012,34(4):295-298.
[14]PAIK S G,FLEISCHER N,SHIN S I.Insulin dependent diabetes mellitus induced by subdiabetogenic doses of streptozotocin:obligatory role of cell mediated autoimmune process[J]. Proceedings of the National Academy of Sciences,1980,77(10):6129-6133.
[15]张远远,杨志伟.啮齿类动物糖尿病模型[J].中国实验动物学报, 2011,19(3):269-274.
[16]PIEPER A A,BRAT D J,KRUG D K,et al.Poly(ADP-ribose) polymerase deficient mice are protected from streptozotocin induced diabetes[J].Proceedings of the National Academy of Sciences of the United States of America,1999,96(6):3059-3064.
[17]KANTO H,FUJII J,SEO H G,et al.Apoptosis cell death triggered by nitric oxide in pancreatic β cells[J].Diabetes,1995, 44(7):733-738.
[18]KWON NS,LEE SH,CHOI CS,et al.Nitric oxide generation from streptozotocin[J].Faseb Journal,1994,8(8):529-33.
[19]YASUDA H,JIN Z,NAKAYAMA M,et al.NO-mediated cytotoxicity contributes to multiple low dose streptozotocin induced diabetes but not to NOD diabetes[J].Diabetes Research& Clinical Practice,2009,83(2):200-207.
[20]XIE X,LI S,LU Y,et al.Proteomic analysis of mouse islets after multiple low dose streptozotocin injection[J].Biochimica Et Biophysica Acta,2008,1784(2):276-284.
[21]REVSIN Y,SARAVIA F,ROIG P,et al.Neuronal and astroglial alterations in the hippocampus of a mouse model for type 1 diabetes[J].Brain Research,2005,1038(1):22-31.
Study on model of type 1 diabetes in C57BL/6 mice induced by different dose of streptozotocin and detection of iNKT cell*
Dong-zhi Chen1,Xiao-lin Yin1,Yong-fu Lou1,Fei Yang1,Yuan-yuan Wang1, Jia-lin Liu1,Ming Meng1,Ming-hui Hou2
(1.Department of Medicine,Hebei University,Baoding,Hebei 071000,China;2.The Affiliated Hospital of Hebei University,Baoding,Hebei 071000,China)
ObjectiveTo establish an animal model of type 1 diabetes mellitus similar to human and study the modeling optimal dose of streptozotocin(STZ).MethodsA total of 35 female C57BL/6 mice were randomly divided into control group(n=5)and model group1,2,3(the dose of STZ was 40 mg/kg,50 mg/kg, 60 mg/kg respectively)with 10 mice in each group.By intraperitoneal injection to the model group of different doses of STZ for 5 days.Blood glucose and body weight before and 1,2,3,4,5 weeks after injection were determined.Possitive rate of insulin autoantibodies(IAA)in mice were determined.The conditions of mice eating,drinking and urination were observed.Flow cytometry(FACS)analysis was used to analyze the proportion of iNKT cells in blood and spleen cell suspension.HE staining was used to observe the pathological changes of pancreatic islets.ResultsCompared with the control group,the amount of drinking water,food intake and urine volume were significantly increased,and the weight was significantly reduced in model group 3.Compared with the control group,the change of blood glucose in model group 3 was obvious,and the first week afterinjection of STZ the blood glucose increased rapidly,and reached its peak in the fourth week and then decreased,the difference was significant(P<0.05).Compared with the control group,the three groups of model group were significantly decreased in the number of islet cells,.The positive rates of IAA in model group 2 and 3 were 30%and 90%respectively.Compared with the control group,the proportion of CD4+NK1.1+lymphocytes in peripheral blood and CD4+NK1.1+lymphocytes in spleen were significantly decreased in model group 3,and the differences were significant(P<0.05).ConclusionsThe optimal dose of STZ is 60 mg/ kg in inducing and establishing of type 1 diabetes mellitus in female C57BL/6 mice.
Type 1 diabetes mellitus;streptozotocin;C57BL/6 mice;iNKT cell
R587.1
A
10.3969/j.issn.1005-8982.2017.08.001
1005-8982(2017)08-0001-06
2016-12-14
国家自然科学基金(No:81373197);河北省自然科学基金(No:H2014201133,No:H2015201131);河北大学医学学科建设项目(No:2014A1001);国家级大学生创新项目基金(No:201510075030)
孟明,E-mail:mengming127@163.com;Tel:15832213318

