利福平耐药实时荧光定量核酸扩增技术(Xpert M TB/R I F)快速诊断淋巴结核及其耐药性
孙海柏,张丽霞,秦中华,郭明日,张东,白虹
(1.天津市医科大学基础医学院,天津300070;2.天津市海河医院,天津300350)
利福平耐药实时荧光定量核酸扩增技术(Xpert M TB/R I F)快速诊断淋巴结核及其耐药性
孙海柏1,张丽霞2,秦中华2,郭明日2,张东2,白虹1
(1.天津市医科大学基础医学院,天津300070;2.天津市海河医院,天津300350)
目的探讨Xpert MTB/RIF试验在诊断淋巴结核及其对利福平耐药的意义。方法选取156例疑似脓肿性淋巴结核患者的脓液分别进行960液体变色培养基培养、涂片镜检、传统比例法药敏试验以及Xpert MTB/RIF试验检测,分析Xpert MTB/RIF试验检测MTB及其耐药性的敏感性和特异性。结果以液体变色培养基培养试验作为金标准,Xpert MTB/RIF试验检测淋巴结核的敏感性和特异性分别为(95.42%,84.00%),Kappa值为0.77,两者一致性较好。以传统比例法药敏试验为金标准,Xpert MTB/RIF试验检测利福平耐药的敏感性和特异性分别为(70.0%,98.42%)两种方法检测结果比较差异无统计学意义。结论Xpert MTB/RIF试验检测淋巴结核及其耐药性与传统的检测方法比较具有较高的敏感性和特异性,并且检测时间短、及时的优点。
淋巴结核;利福平耐药;敏感性;特异性;Xpert MTB/RIF
颈部淋巴结核是结核分枝杆菌侵入颈部淋巴结所致的一种淋巴结病变,按病程可分为结节型、浸润型、脓肿型及溃疡型[1]。以脓肿性淋巴结核最为常见,治疗不及时或不理想结核杆菌还要破坏掉病变处大量组织甚至骨组织,留下功能障碍,所以寻找及时准确快速的实验室诊断方法至关重要。利福平耐药实时荧光定量核酸扩增技术(Xpert mycobacterium tuberculosis/rifampicin,Xpert MTB/RIF)检测痰标本中结核分枝杆菌与TB培养法有较高一致性[2]。本文利用目前快速检测结核菌的方法Xpert MTB/RIF对患者的脓液直接进行检测,并对其敏感性和特异性进行分析。
1 材料与方法
1.1 一般资料
选取2013年8月-2016年10月于天津市海河医院确诊淋巴结核的住院患者156例:单纯颈部淋巴结结核例58例,淋巴结结核合并肺结核89例,腋窝淋巴结结核合并肺结核2例,腹股沟淋巴结结核合并肺结核7例。纳入标准:浅表淋巴结经B超检查提示淋巴结有液化、坏死,或肉眼见脓肿和(或)窦道形成未进行过抗结核治疗的首诊患者;其中,男性41例,女性115例;年龄17~80岁。
1.2 仪器与试剂
PLR-线性探针杂交酶显色法诊断试剂盒(Geno Type MTBDR pIus,德国Hain Life-science公司),Hotstar Taq酶(德国Qiagen公司),MGIT960液体培养基及药敏管(美国BD公司);Hain GT Blot-48全自动杂交仪(德国Hain Lifescience公司),聚合酶链式反应仪(Polymerase chain reaction,PCR)(德国Hain Lifescience公司),Eppen-dorf 5804R高速冷冻离心机(德国Eppendorf公司),生物安全柜(山东省青岛市海尔公司)。
1.3 试验方法
BACTEC MGIT960液体培养及耐药性检测、痰抗酸染色均按照结核病诊断细菌学检验规程进行操作,线性探针法检测淋巴结核及其对利福平耐药性,按照试剂盒说明书进行操作。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,配对计数资料χ2检验,行×列表资料χ2检验,P<0.05为差异有统计学意义,Kappa一致性系数,敏感性及特异性分析。
2 结果
2.1 患者M G I T960液体培养、Xpert M TB/R I F检测以及抗酸染色淋巴结核脓标本情况
3种方法所需检测时间分别为(4~8周、2h及2h),阳性率分别为(83.90%,82.80%和69.23%),χ2=12.39,P<0.01以MGIT960液体培养为金标准,Xpert MTB/RIF检测的敏感性与特异性分别为(95.42%和84.00%),Kappa值为0.77,一致性较好(见表1)。

表1156 例患者M G I T960培养检测及Xpert M TB/R I F阴阳性比较例
2.2 Xpert M TB/R I F法等级与抗酸染色阳性等级
采用行×列表资料χ2检验,χ2=72.66,P<0.01,故两种检测的方法等级比较差异有统计学意义,其中Xpert MTB/RIF“极低”级中5例抗酸染色为阴性的情况,Xpert MTB/RIF低组“低”级中6例抗酸染色为阴性的情况,Xpert MTB/RIF“中”级以及“高”级中未出现抗酸染色阴性的例数(见表2)。
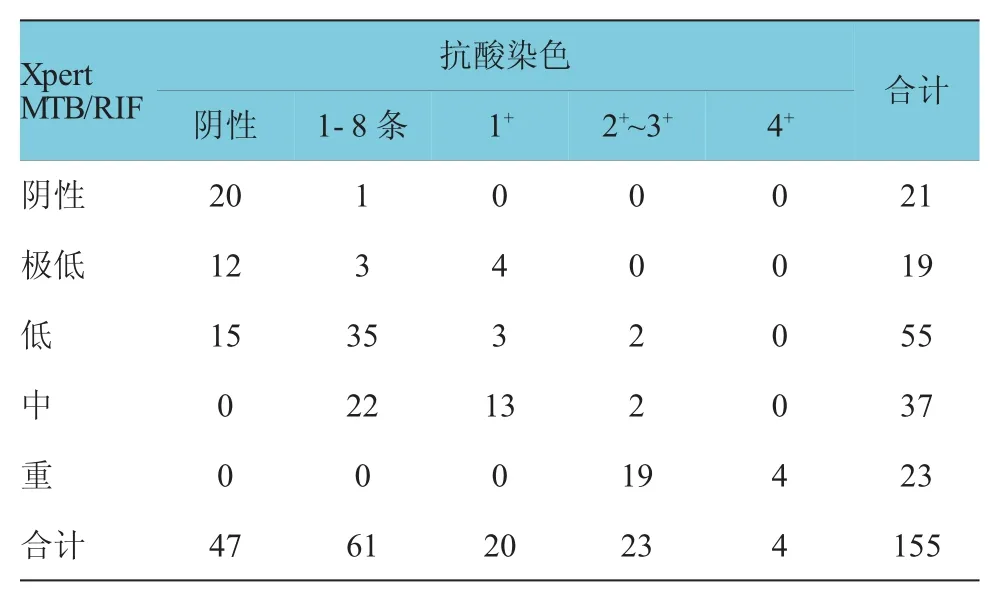
表2156 例标本抗酸染色法阳性级别与Xpert M TB/R I F法检测结果比较例
2.3 Xpert M TB/R I F技术与传统比例法药敏试验耐药性检测结果
156例检测标本以药敏试验检测结果为金标准,采用Xpert MTB/RIF技术检测156例菌株的RFP耐药性,其中有19例标本在检测中未检测出来,137例标本检测后敏感性、特异性分别为(70.00%和98.42%),检测结果(χ2=0.50)(见表3)。

表3137 例菌株比例法药敏试验利福平耐药性与Xpert M TB/R I F方法利福平耐药性检测比较例
2.4 Xpert M TB/R I F法对利福平耐药基因突变位点检测
分析线性探针法检测为阳性的9例标本耐药基因突变位点分析结构图(见表4)。

表4 Xpert M TB/R I F耐药基因突变位点分析及构成比
3 讨论
本研究选取肺外结核中的淋巴结核病为例,用Xpert MTB/RIF与金标准的检测方法MGIT960培养法、抗酸染色法进行比较分析,本实验中抗酸染色的的阳性率仅为69.23%较低,传统结核菌培养法虽然敏感性及特异性较高,结核分枝杆菌(结核杆菌)生长营养要求高,繁殖速度慢所以其检测时间较长,需4~8周,不能及时为临床提供治疗依据,痰涂片对标本含菌量要求高,导致其诊断结核病的敏感性较低,在MTB培养阳性标本中敏感性仅为45%~48%[3-6]Xpert MTB/RIF利福平耐药性遗传学基础是rpoB基因内81bp利福平耐药决定区(RIF)的突变[7]。Xpert MTB/RIF技术是利用MTB耐药性与基因突变有关的分子机制,以rpoB基因为靶基因,设计引物探针选择性覆盖rpoB基因利福平耐药决定区81 bp核心区,以检测标本是否含有结核分枝杆菌复合群以及利福平是否耐药[8]。整个实验仅需要2 h,仪器自动检测是否为结核分枝杆菌复合群(MTB)及是否对利福平耐药。因此,该方法适合于各种标本类型进行检测,所以对肺外结核病的早期诊断及其耐药性的检测占很大优势。
研究结果显示,Xpert MTB/RIF与MGIT960培养法对于MTB的检测率差异无统计学意义,MGIT 960培养和药敏结果为参照,Xpert MTB/RIF诊断淋巴结核的敏感性与特异性分别为(95.42%和84.00%)较高Kappa值为0.77,一致性较好,Xpert MTB/RIF对利福平检测的敏感性/特异性分别为70.00%和98.42%,Kappa值2.54。表明两种方法对利福平耐药性的检测具有极好的一致性。与国内穆成等[9]报道的关于结核分支杆菌的检测的敏感性90.6%稍微偏低,特异性98.7%相近。
本研究中Xpert MTB/RIF检测中与痰抗酸染色比较分析有11例标本痰涂片为阴性而Xpert MTB/ RIF检测为阳性可能与留取的标本中捕获到的结核菌量较少有关系。Xpert MTB/RIF检测利福平耐药性与MGIT960药敏不一致的情况,可能是由于rpoB区内其他突变所致或者由于其他基因突变导致,理论上标本中含有一种以上的MTB混合培养或污染时,若其中一种具有突变探针未涵盖的突变,将出现野生型带型[10],所以不能完全排除部分突变为无义突变的原因。
[1]伏志杰,刘丽.对36例脓肿型颈淋巴结核治疗的观察[J].中国实用医药,2016,11(21):40-41.
[2]邹远妩,刘尚武,朱蕾,等.检测结核分枝杆菌及其耐药性在结核病辅助诊断中的临床价值[J].临床肺科杂志,2015,20(3):568-570.
[3]VAN RIE A,PAGE-SHIPP L,SCOTT L,et al.Xpert MTB/RIF for point-of care diagnosis of TB in high-HIV burden,resourelimited countries:hype or hope[J].Expert Review of Molecular Diagnostics,2014,10(7):937-946(10).
[4]刘家云,郝晓柯.结核病实验室诊断方法新进展[J].临床检验杂志, 2013,32(2):115-117.
[5]全国结核病流行病学抽样调查技术指导组,第四次全国结核病流行病学抽样调查报告[J].中华结核和呼吸杂志,2002,25(1):3-7.
[6]BEHR M A,WARVEN S A,SALAMON H,et al.Transmission of Mycobacterium tuberculosis from patioents smear-negative for acidfast bacilli[J].Lancet,1999,353(9151):444-449.
[7]KIM B J,LEE K H,YUN Y J,et al.Simultaneous identification of rifampin-resistant mycobacterium tuberculosis and nontuberculousmycobacteriaby polymerasechainreaction-singlestrand conformation polymorphism and sequence analysis of the RNA polymerasegene(rpoB)[J].Journal of MicrobiologicalMethods, 2004,58(1):111-118.
[8]BOEHME C C,NABETA P,HILLEMANN D,et al.Rapid molecular detectionof tuberculosis and rifampin resistance[J].New England Journal of Medicine,2010,363(11):1005-1015.
[9]穆成,王志锐,赵慧,等.GenoType MTBDRplus从涂阳痰标本中检测结核分枝杆菌耐药性的效果评价[J].中国卫生检验杂志,2013, 23(26):1601-1602.
[10]郭明日,王冰冰,张丽霞,等.PCR一线性探针杂交酶显色法在结核病诊断与耐药性检测中的应用研究[J].中华医院感染学杂志,2016,26(7):1483-1485.
R522
B
10.3969/j.issn.1005-8982.2017.08.028
1005-8982(2017)08-0137-03
2016-11-01
白虹,E-mail:hongbai25@163.com

