兔病毒性出血症病毒YM 株衣壳蛋白基因的克隆和中国分离株的遗传变异分析
张祎,孙凯
(哈药集团生物疫苗有限公司,哈尔滨 150069)
兔病毒性出血症病毒YM 株衣壳蛋白基因的克隆和中国分离株的遗传变异分析
张祎,孙凯
(哈药集团生物疫苗有限公司,哈尔滨 150069)

应用RT-PCR的方法从某兔场病死兔肝脏组织中分离到RHDV,命名YM株。克隆出衣壳蛋白VP60并测序,测序结果显示VP60全长1 740 bp,编码579个氨基酸。从GenBank下载包括EBHSV、RCV、RHDV共45条序列,运用生物信息学软件分析,构建系统进化树和氨基酸同源性比较,世界不同地区RHDV分离株氨基酸保守性较高,可达94.1%~99.7%,EBHSV与RHDV氨基酸同源性约为75%,而RCV与RHDV的同源性>90%。系统进化树分析显示,所选的RHDV可分为两个基因群,一组是包括WX-84的经典RHDV群,另一组是抗原变异RHDVa群,包括了除WX/84其余所有的中国分离株。总的来说RHDVa已经替代经典的RHDV在中国流行。
RHDV;RHDVa;VP60;系统进化树;序列分析
兔病毒性出血症(RHD)俗称“兔瘟”,该病引起了大量家兔的死亡,造成了毁灭性的经济损失,随后世界多数国家均有该病的报道。引起RHD的病原体是兔出血症病毒(RHDV),属于杯状病毒科兔病毒属。与RHDV相似的病毒还有欧洲野兔综合症病毒(EBHSV),只感染欧洲野兔属。而与RHDV亲缘关系最近的是一种无病原性的杯状病毒(RCV),RHDV、RCV、EBHSV三种病毒同属于杯状病毒科。尽管目前防治本病的唯一手段就是接种组织灭活苗,但是疫苗的质量良莠不齐,缺乏科学的免疫程序,造成该病仍旧呈地方性流行。2016年,从病死兔肝脏中发现,症状疑似兔瘟,据悉该小型兔场使用了兔瘟-巴氏杆菌二联灭活疫苗,为弄清发病原因,对病毒进行分离鉴定,并进行序列分析,以研究RHDV是否发生变异。
1 试验材料
1.1 病料及菌株
病料为某兔场病死兔肝脏,疑为兔瘟。质粒与菌株:pMD18-T载体购自大连宝生物工程有限公司;大肠杆菌感受态JM109为哈药疫苗自制,菌种由研究所保存。
1.2 主要试剂
LA Taq DNA聚合酶、AMV反转录酶、RNA酶抑制剂购自大连宝生物工程有限公司;T4 DNA连接酶购自NEB公司;质粒DNA小量提取试剂盒、Gel Extract Mini试剂盒购自上海华舜生物工程公司;RNeasy plus Mini Kit购自QIAGEN公司。人“O”型红细胞由哈尔滨红十字血液中心提供。兔源抗RHDV高免血清由哈尔滨兽医研究所实验动物中心惠赠。
2 试验方法
2.1 病料的处理及病毒的分离鉴定2.1.1病料的处理
将病死兔肝脏称量后,用灭菌的0.01 M PBS(pH 7.4,含EDTA 1 mM)1∶4(W/V)稀释后研磨,将产物-20℃反复冻融3次,4℃4 000 r·min-1离心30 min,取上清用0.22 μm滤器过滤后作为待检样品,于-20℃冰箱保存。
2.1.2 病毒的鉴定
血凝试验(HA)和血凝抑制试验(HI):取粗提病毒按文献方法进行HA和HI试验。1%人“O”型血红细胞的制备:取2mL人“O”型抗凝血液,用灭菌生理盐水洗涤,每次常温2 000 r·min-1离心10 min,共洗涤3次,取最后一次红细胞泥20μL悬于2mL生理盐水中,混匀后4℃冰箱保存备用,可存放3d。
2.1.3 家兔接种实验
将体重约2 kg,6~8周龄的RHDV阴性健康家兔4只随机分成两组,3只攻毒,1只对照。取待检样品1 mL皮下注射攻毒组,38 h家兔死亡后无菌解剖,观察病变,取兔肝脏,按照上述方法制备粗提病毒液,-80℃保存。
2.2 VP60基因的克隆及序列分析
2.2.1 引物设计
根据GenBank已收录的我国NJ/China/1985株(AY269825)RHDV的VP60基因序列进行比对后,找到序列的保守区,设计一对特异性引物P1、P2,P1:5'-gcagatcgtaagagagtcgt-3',P2:5'-gcaa gtcccaatccgatgaa-3'。扩增含VP60全长的1 815 bp基因片段(相当于全基因组5 251~7 065 nt,其中VP60基因相当于全基因组5 305~7 044 nt共1 740 bp)送往上海英骏生物技术有限公司合成引物。
2.2.2 目的基因的扩增
兔出血症病毒RNA的提取:无菌研磨肝组织病料,收集浆液,4℃12 000 r·min-1离心10 min,吸取上清300 μL,按照RNeasy plus Mini Kit说明书提取病毒RNA。-20℃保存。
兔出血症病毒cDNA的合成与目的基因的PCR扩增:以病毒RNA为模板进行反转录,反应条件为:(20 μL体系)RNA 10.5 μL,dNTP 2 μL,AMV 2 μL,5×AMV buffer 4 μL,抑制剂0.5 μL,引物1 μL,室温作用10min,42℃作用1 h,70°C15 min灭活反转录酶,以此产物为模板进行PCR。PCR反应体系为50 μL:去离子水34.5 μL,模板2μL、LA Taq DNA聚合酶0.5μL、10×PCR Buffer 5μL、2.5 mM dNTP4μL、P1引物2μL、P2引物2μL;反应循环参数:95℃5 min;94℃30 s,55℃40 s,72℃2 min,30个循环;72℃10 min。PCR产物经1%琼脂糖凝胶电泳分析,切胶后用试剂盒纯化回收。
2.2.3 PCR产物的克隆与鉴定
将纯化的PCR产物与pMD18-T载体16℃连接过夜,转化E.coli JM109感受态细胞。提取质粒,命名为YM-VP60。质粒经PCR鉴定正确后送往上海英骏公司测序。
2.2.4 VP60基因的生物信息学分析
参考RHDV、EBHSV、RCV毒株序列资料见附表。
从GenBank上下载包括RHDV、EBHSV、RCV共46条RHDV基因序列(包括RHDV全基因组序列和本次试验分离株YM),用DNAStar软件截取所有序列的VP60完整阅读框。利用DNAStar、Clustal X和Mega 4个软件进行系统进化树的绘制和氨基酸变异分析。

附表参考RHDV、EBHSV、RCV毒株序列资料
3 试验结果
3.1 兔出血症病毒的分离鉴定
3.1.1 敏感兔接种试验
结果表明,攻毒组3只兔体温均升高至41℃以上,于24~38 h内全部死亡,死兔肛门松弛,流出少量淡黄色的粘性稀便。剖检后可见各脏器有不同程度的出血及水肿,胃黏膜脱落,出血斑明显。对照兔健康存活。
3.1.2 HA和HI试验
HA试验测得粗提病毒液的血凝价为1∶1 024,该样品能够凝集人的“O”型红细胞,该血凝特性能被兔病毒性出血症高免血清所抑制,初步判断该病毒为兔病毒性出血症病毒。
3.2 兔出血症病毒cDNA的合成与目的基因的PCR扩增
目的基因片段RT-PCR扩增结果凝胶电泳图见图1。

图1 目的基因片段RT-PCR扩增结果凝胶电泳
以RHDV cDNA为模板,P1、P2为引物进行PCR扩增,产物经1%琼脂糖凝胶电泳分析,在约1 800 bp位置有DNA条带,与目的基因1 815 bp条带大小相符。PCR产物通过切胶试剂盒纯化与pMD18-T载体连接转化E.coli JM109感受态。经PCR鉴定在1 700 bp位置有DNA条带。
3.3 YM株VP60基因的序列测定及生物信息学分析
YM株VP60基因的序列测定结果见图2。结果表明,YM株VP60基因完整阅读框长1 740 bp,编码579个氨基酸。
为了分析中国毒株的流行特性,选取所有可获得的12株中国分离株VP60基因部分及国外的29株RHDV、2株EBHSV和1株RCV的VP60部分。经过氨基酸同源性比较后发现,RHDV与EBHSV的氨基酸同源性约75%,而RCV与RHDV的同源性>90%。中外RHDV分离株的衣壳蛋白的核苷酸同源性在89.1%~98.7%,氨基酸同源性在94.0%~99.8%。中国RHDV各分离株之间的核苷酸同源性在92.2%~99.4%,其中WX/84与其余11株分离株的氨基酸同源性仅约为95%,而其余毒株之间的氨基酸同源性很高均>98%。系统进化树分析结果显示,EBHSV处于独立的分支,RCV进化地位则更接近于RHDV。值得注意的是N11株,是2011年由G. Le-Recule等在西班牙检测到一株非典型性的兔瘟病毒,被归为RHDV2,独立于传统的RHDV毒株,却可以引起幼兔和野兔兔瘟大面积流行。43株RH⁃DV参考毒株可被分为2个明显的基因群:A亚群和B亚群。其中A亚群为经典的RHDV,各分离株之间没有明显的地域与时间的关联,中国的第1株分离株WX/84就包含在A群中。而中国另外11个RHDV分离株则处在B亚群,即RHDVa亚群,提示中国各RHDV分离株之间有较近的亲缘关系。
4 讨论
RHDV由于保守度较高,认为只有一种血清型,然而1997年Capucci等分离到一种新的抗原变异株命名为RHDVa。在意大利,RHDVa已经替代了传统的RHDV在田间流行。2003年法国鉴定的两株病毒也均为RHDVa[1]。2004年末OIE首次报道了RHDVa在乌拉圭的流行,同年在荷兰的野兔中分离到RHDVa[2]。古巴于2004—2005年曾大面积的爆发兔瘟,采集病料后经竞争ELISA检测,同样证明是由变异株RHDVa引起的[3]。2011年,G. Le-Recule等在西班牙检测到一株非典型性的兔瘟病毒,被命名为RHDV2,将该变异株进行测序,命名为RHDV-N11,该病毒能够导致低日龄的幼兔发病[7]。随后该病在意大利、德国等欧洲范围内迅速传播,目前中国还并未有RHDV2流行的报道,但应引起关注[8-10]。
RHD首次报道于中国,但是一些学者经过血清学研究认为,RHDV并不是第一次出现在中国,也不是从中国传播到其他国家而引起世界范围的流行[11]。欧洲对1984年前保存的兔血清进行回顾性分析,数据表明在1975—1987年,英国、新西兰和澳大利亚的野兔和家兔分离的血清中都存在RHD的抗体,表明该病毒在欧洲的兔群中已经存在多年,但当时欧洲的兔群中并没有爆发RHD[4-5]。在另一项调查中指出,英国在1955年的兔血清中就存在与RHDV相关的RNA粒子,其序列与RHDV中部分衣壳蛋白序列十分相似,推测这种无病原性的毒株是由野兔携带的,更加表明了欧洲在很早就存在RHDV样病毒[6]。中国在20世纪80年代初从德国大量引进长毛兔,有人推测1984年在国内爆发的RHD很有可能是存在于欧洲但无致病性的野兔和家兔中的RCV突变或同源重组成高致病性的RHDV引起了疫病的爆发。由此推断,RHDV可能以无病原性的毒株在其他国家流行很多年,最终经过基因同源重组形成具有高致病性的病毒。
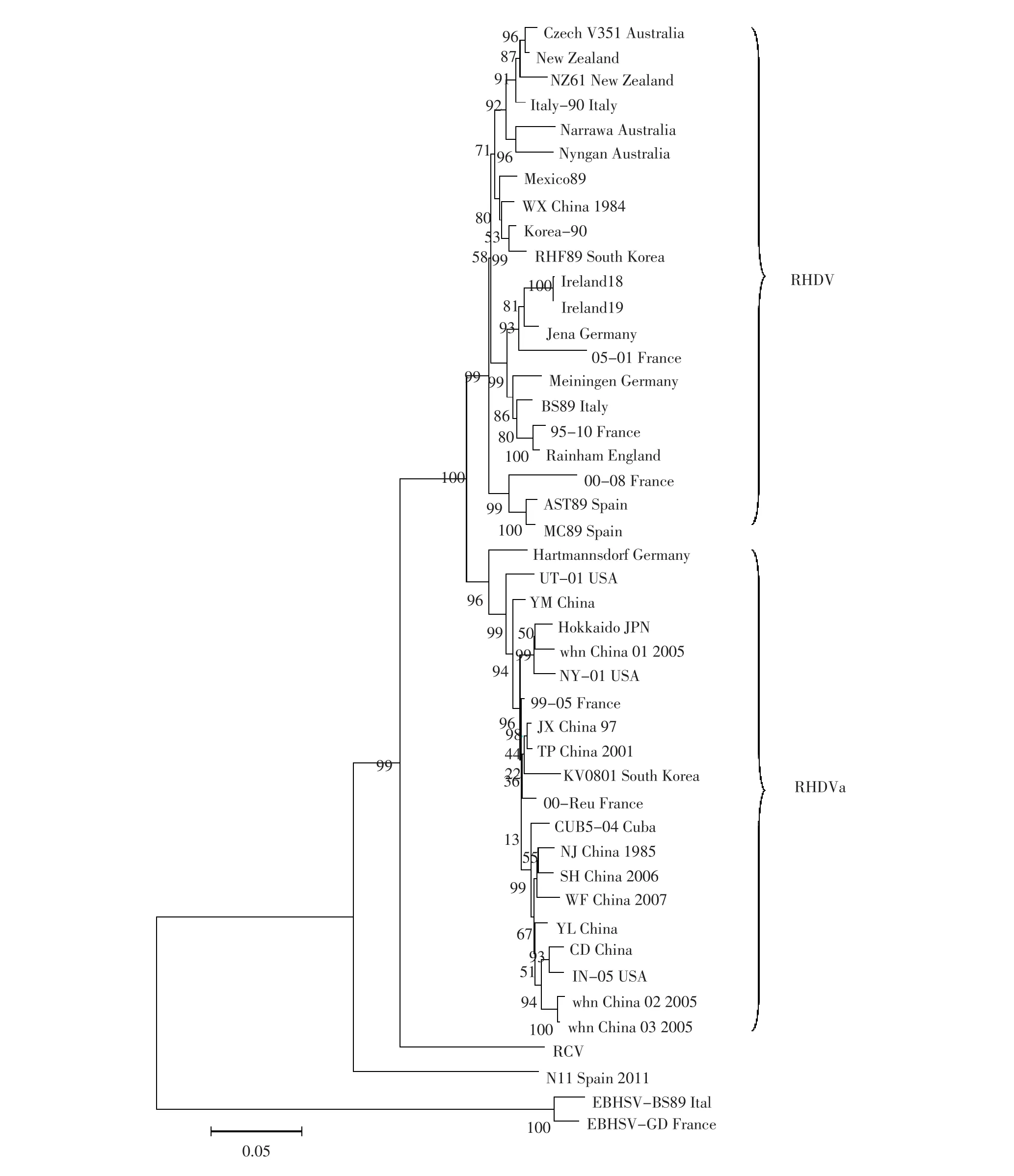
图2 YM株VP60基因的序列测定
尽管一些研究者已对中国部分RHDV分离株做过生物信息学上的研究,但没有明确提出中国RH⁃DVa变异株的流行现状[12-13]。本文将试验分离株YM及GenBank上可获得的全部11株中国的RHDV VP60基因和筛选其他国家不同时段的29株毒株进行基因比对,探讨中国RHDV的生物学特性和遗传变异分析。从RHDV系统进化分析发现,RHDVa群主要包含了中国、韩国、日本这些亚洲国家的分离株,以及美国、古巴和法国的00-Reu、99-05两株分离株。韩国的学者已证明1985年在韩国流行的RHDVa与中国的兔毛皮输入有关,由此可推测亚洲的这些分离株可能来源于同一毒株。对于中国来说,1984年首次报道RHDV的流行,次年NJ/ China/1985株就已经是RHDVa变异株了,随后所有的分离株均属于RHDVa群,因此RHDVa已经在中国流行很多年。
VP60氨基酸序列可被分为6个区域,分别为A(1~21aa)、B(22~300aa)、C(301~328aa)、D(329~343aa)、E(344~434aa)、F(435~580aa)。本次试验分离株YM株在A区的变化主要体现在第7位氨基酸上,RHDV经典株在2000年前,此位点主要为Ala,而后变为Thr,澳大利亚与新西兰的分离株此位点也为Ala,可能与岛国环境较封闭有关。B区有4处主要变化,分别位于37aa、50aa、207aa和219aa。C区和E区变异率较高,主要体现在的305~309aa、346~386aa和412~434aa区域有较大的变异,F区的476~480aa。这种氨基酸的变异呈现出明显的规律性变化,其区分的依据就是RHDV和RHD⁃Va两个亚群的不同。在对VP60的抗原结构进行了详细研究中发现,VP60蛋白上有两个主要抗原区域,分别位于VP60蛋白N端的31~250aa和C端的477~579aa,但最主要的抗原区可能位于VP60蛋白N端的前175个氨基酸。在变异株RHDVa中,可看出在前200个氨基酸中只发生了3个氨基酸点的突变,因此抗原性没有发生明显的变化。这也可以解释传统的组织灭活苗仍旧可以起到很好的保护作用。
[1]Gall-Reculé G L,Zwingelstein F,Laurent S,et al.Phylogenetic analysis of rabbit haemorrhagic disease virus in France between 1993 and 2000,and the characterisation of RHDV antigenic vari⁃ants[J].Archives of Virology,2003,148(1):65-81.
[2]Van de Bildt M W G,Van Bolhuis G H,Van Zijderveld F,et al. Confirmation and phylogenetic analysis of rabbit hemorrhagic dis⁃ease virus in free-living rabbits from the Netherlands[J].Journal of Wildlife Diseases,2006,42(4):808-812.
[3]Farnós O,Rodríguez D,Valdés O,et al.Molecular and antigenic characterization of rabbit hemorrhagic disease virus isolated in Cuba indicates a distinct antigenic subtype[J].Archives of Virolo⁃gy,2007,152(6):1 215-1 221.
[4]Moss S R,Turner S L,Trout R C,et al.Molecular epidemiology of Rabbit haemorrhagic disease virus[J].Journal of General Virology, 2005,83(Pt10):2 461-2 467.
[5]Nagesha H S,Mccoll K A,Collins B J,et al.The presence of crossreactive antibodies to rabbit haemorrhagic disease virus in Austra lian wild rabbits prior to the escape of virus from quarantine[J]. Archives of Virology,2000,145(4):749-757.
[6]Moss S R,Turner S L,Trout R C,et al.Molecular epidemiology of Rabbit haemorrhagic disease virus[J].Journal of General Virology, 2005,83(Pt10):2 461-2 467.
[7]Gallreculé G L,Lavazza A,Marchandeau S,et al.Emergence of a new lagovirus related to Rabbit Haemorrhagic Disease Virus[J]. Veterinary Research,2013,44(1):81.
[8]Puggioni G,Cavadini P,Maestrale C,et al.The new French 2010 Rabbit Hemorrhagic Disease Virus causes an RHD-like disease in the Sardinian Cape hare(Lepus capensis mediterraneus)[J]. Veterinary Research,2013,44:96.
[9]Abrantes J,Lopes A M,Dalton K P,et al.New variant of rabbit hemorrhagic disease virus,portugal,2012—2013[J].Emerging In⁃fectious Diseases,2013,19(11):1 900-1 902.
[10]Lopes A M,Correia J,Abrantes J,et al.Is the new variant RHDV replacing genogroup 1 in portuguese wild rabbit populations[J].Vi⁃ruses,2015,7(1):27-36.
[11]Forrester N L,Trout R C,Turner S L,et al.Unravelling the para⁃dox of rabbit haemorrhagic disease virus emergence,using phylo⁃genetic analysis;possible implications for rabbit conservation strategies[J].Biological Conservation,2006,131(2):296-306.
Cloning and Sequence Analyzing of the Capsid Protein Gene of Rabbit Hemorrhagic Disease Virus Strain YM
ZHANG Yi,SUN Kai
(Biological Vaccine of Harbin Pharmaceutical Group Co.,Ltd.,Harbin 150069,China)
The rabbit hemorrhagic disease virus was obtained in the liver sample from a dead rabbit and named strain YM.The sequenceanalysis showedthat the nucleotidesequenceof VP60 gene of YM was 1 740 bp long and en⁃coded a protein of 579 amino acids.We downloaded 45 published RHDV,RCV,RHDV VP60 gene isolated sequences from GenBank and then constructed phylogenetic tree and drawn homology and divergence form by bioinformatics soft⁃ware.Sequence comparison with other published RHDV VP60 genes showed that the homology of the amino acids was between 94.1%and 99.7%.The result showed that the RHDV VP60 gene was highly conserved.The amino acids ho⁃mology between the RHDV and EBHSV groups was about 75%,but the rate between the RHDV and RCV groups was above 90%.It showed that RHDV and RCV were more closely related to each other than any other calicivirus.These strains could be divided into 2 gene groups,one group was a classic RHDV including the strain WX-84,the other group was a antigenic variation RHDVa and it included all the Chinese isolates except WX-84.Overall RHDVa had replacedtheclassicRHDVwhichpopularinChina.
RHDV;RHDVa;VP60;phylogenetic tree;sequence analysis
S829.1;S852.65
A
1001-0084(2017)04-0024-06
2017-03-22
张祎(1984-),女,黑龙江哈尔滨人,硕士研究生,研究方向为兽医微生物与免疫。

