CO2在正戊醇中的溶解度和体积传质系数
何茂刚,白里航,刘思琦,刘向阳,贺永东
CO2在正戊醇中的溶解度和体积传质系数
何茂刚1,白里航1,刘思琦1,刘向阳1,贺永东2
(1西安交通大学热流科学与工程教育部重点实验室,陕西西安710049;2新疆大学科学与技术学院,新疆乌鲁木齐830046)
基于等体积饱和法搭建了气体在液体中溶解度与体积传质系数的实验测量系统,该实验系统温度、压力、溶解度、体积传质系数的扩展不确定度分别为0.02 K、0.01%、2%、4%。利用该实验系统测量了温度为323~343 K、压力为0.9~5.0 MPa范围内CO2在正戊醇中的溶解度和体积传质系数。CO2在正戊醇中的摩尔分数随着压力的升高而升高,在温度为323 K时,压力从2.5 MPa升高到3.2 MPa,溶解度升高26%。CO2在正戊醇中的摩尔分数随着温度的升高而减小,在压力为0.9 MPa时,温度从323 K升高为343 K,溶解度降低26%。升高温度和压力都有利于提高体积传质系数,当温度和初始压力分别由323 K、1.1 MPa升高至343 K、5.0 MPa时,CO2在正戊醇中的体积传质系数由0.0089 s-1升高至0.0175 s-1。
等体积饱和法;吸收;传质;二氧化碳;正戊醇
引 言
随着温室效应问题日益严重,CO2回收利用技术受到了人们的广泛关注[1-7]。醇作为基础化工原料和工业燃料应用甚广,利用CO2和H2合成C1~C6醇类是非常具有发展前景的醇类生产方式[8-9],在生产过程中醇类产物不可避免地会溶解吸收一定量的CO2,CO2在醇类中的溶解度和传质系数,是反应过程设计、模拟和优化的必要数据[10]。国际上已有学者对CO2在醇类中的溶解度开展了研究,Xia等[11]对288~318 K范围内CO2在醇、醚和酮中的溶解度进行了研究;Gutierrez等[12]和Secuianu等[13]对293~333 K范围内CO2在正戊醇、异丁醇等醇类中的溶解度进行了研究。Raeissi等[14]研究了CO2在丁醇到己醇中的溶解度。Lam等[15]对CO2在丁醇到癸醇混合物中的溶解度进行了研究。传质系数方面,Teramoto等[16]研究了CO2在醇类中的体积传质系数。
本文基于等体积饱和法搭建了气体在液体中溶解度和体积传质系数的实验系统,并对温度为323~343 K、压力为0.9~5.0 MPa范围内CO2在正戊醇中的溶解度和体积传质系数进行了测量。
1 实验原理
1.1 实验系统
等体积饱和法可同时对气体在液体中的溶解度和体积传质系数进行测量,且具有操作简单,精度高的优点,在先前的工作中已得到证实[17-18]。故本文基于此方法搭建了实验系统,如图1所示。实验系统主要包括:气体腔、平衡腔、恒温水浴槽、真空泵、电磁搅拌器以及由电源、万用表和计算机构成的数据采集系统。气体腔和平衡腔分别装有Fluke二等铂电阻温度计、Keller 33X型压力传感器,分别用于对温度和压力的测量[19]。
实验操作步骤如下:(1)在平衡腔中加入一定量的正戊醇,并将温度设置为10℃(防止饱和蒸气压过高,长时间抽真空带走正戊醇),然后对整个系统抽真空;(2)向气体腔中充入一定量的气体,并调节恒温水浴达到目标温度,记录气体腔的温度和压力;(3)从气体腔向平衡腔充入一定量的气体,开启电磁搅拌器,记录气体腔的温度和压力,并记录气体溶解时,平衡腔内压力随时间变化趋势。
1.2 计算公式
气体在液体中的体积传质系数L可以通过如下方程计算[20-21]
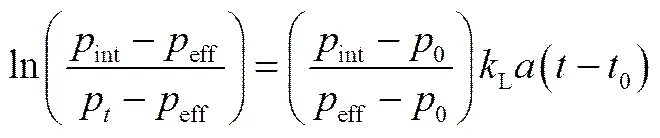
式中,0为充气前平衡腔中预饱和压力;int为向平衡腔充气后平衡腔中的初始压力;t为电磁搅拌器开启后,气体溶解过程中的压力;eff为平衡腔中气体溶解平衡后的压力;0为起始时刻的时间,即为=int时的时刻;表示溶解过程中的时间。
气体在液体中的溶解度可以表示为
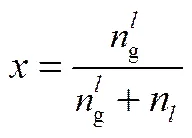
其中,n表示正戊醇溶剂的量,ng表示液体中溶解气体的量,可以表示为
ng=GC(i-f)-g(EC-V) (3)
式中,GC为气体容器的容积;EC为平衡腔的容积;V为平衡腔内正戊醇的体积;i为释放气体到平衡腔之前气体容器中气体的摩尔密度;f为释放气体到平衡腔之后气体容器中气体的摩尔密度;g为气体在正戊醇中达到溶解平衡时平衡腔内气体的摩尔密度。i、f、g可以由REFPROP软件[22]计算得出,不确定度小于0.2%。
1.3 溶解度不确定度分析
温度的测量不确定度主要来源于温度传感器、数据采集系统、恒温槽;压力的测量不确定度主要来源于压力传感器、数据采集系统。压力、温度的测量扩展不确定度由式(4)计算得到。
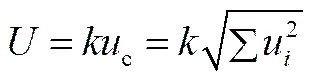
式中,u为各个影响因素的相对标准不确定度;c为综合相对标准不确定度;为置信因子。
通过式(3)可知,溶解到液体中气体量的测量不确定度U的影响因素有GC、EC、V、i、f、g,故U可由式(5)计算得到
(5)
式中,u、、f、g、uGC、uEC、u分别为溶解到液体中气体量、从气体腔释放气体到平衡腔前气体腔中气体摩尔密度、从气体腔释放气体到平衡腔后气体腔中气体的摩尔密度、气体在液体中达到溶解平衡时平衡腔中气体摩尔密度、气体腔容积、平衡腔容积、平衡腔中液体体积的标准不确定度。
由式(2)可知,溶解到液体中气体摩尔分数的影响因素包括溶解到液体中气体量和平衡腔中液体量,因此溶解到液体中气体摩尔分数的测量扩展不确定度U可以表示为
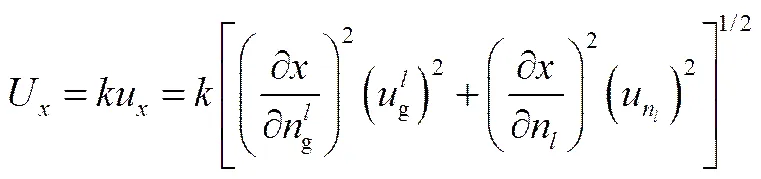
式中,u、u分别为溶解到液体中气体摩尔分数和平衡腔中溶剂量的相对标准不确定度。
1.4 体积传质系数不确定度分析
定义
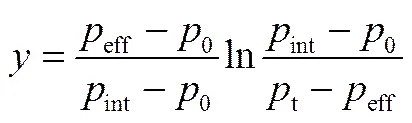
则式(1)可以变换
=L(-0) (8)
的标准不确定度u主要是由压力的测量不确定度造成,包括预饱和压力的不确定度u0、饱和压力不确定度ueff、初始压力不确定度uint、溶解过程压力不确定度u。可以通过式(8)计算得到的标准不确定度u
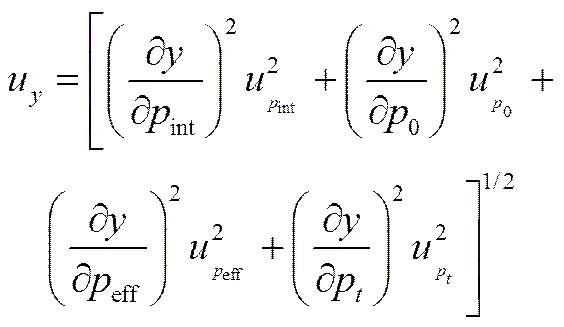
时间的测量精度较高可以忽略其影响,最终L的不确定度UL可以表示为[23-24]
(10)
式中,为记录时间点和压力点的个数,t表示通过计算机采集第个时间的值,表示通过个时间点的平均值。
经计算,本文实验系统温度、压力、溶液中气体的浓度、气体在溶液中体积传质系数的测量扩展不确定度分别为0.02 K、0.01%、2%、4%,(取置信因子=2时,置信度为95%)。
1.5 试剂信息
正戊醇采购于天津市科密欧化学试剂有限公司,纯度为98%(质量分数),分子式为C5H11OH。使用的CO2纯度为99.999%(质量分数),采购于Praxair公司。
正戊醇的密度是通过文献[25-28]实验数据拟合得到
(g·cm-3) =-0.0007+1.0275 (11)
2 实验结果与讨论
利用实验系热力学温度为323、333和343 K时,压力为0.9~5.0 MPa范围内CO2在正戊醇中的溶解度和体积传质系数进行了测量。图2是本文实验数据和其他文献数据[11-13,29-30]温度和压力的分布情况,可以看出本文实验数据填补了CO2在正戊醇中溶解度的数据。CO2在正戊醇中溶解度的测量结果如表1所示。图3显示了不同温度下CO2在正戊醇中溶解度随压力的变化规律。CO2在正戊醇中的溶解度随着压力的升高而增大,例如在温度为323 K时,压力从2.5 MPa升高到3.2 MPa,溶解度升高26%;CO2在正戊醇中的溶解度随着温度的升高而减小,例如在压力为0.9 MPa时,温度从323 K升高为343 K,溶解度降低26%。另外从图3中可以看出,在测量范围内,CO2在正戊醇中的溶解度与压力呈线性关系。

表1 CO2在正戊醇中的溶解度
气体在液体中的溶解度也可以用亨利常数进行表示,亨利常数定义为
基于CO2在正戊醇中摩尔分数的实验数据,得到不同温度下CO2在正戊醇中的亨利常数,如表2和图4所示。从图4中可以看出:亨利常数随着温度升高而增大,而且ln随着1/呈线性变化。图中还显示了文献[11-13]中CO2在正戊醇中亨利常数的实验数据,可以明显看出本文实验结果与文献数据具有良好的一致性,从而也验证了本实验系统的可靠性。

表2 CO2在正戊醇中的亨利常数
测量液相体积传质系数时,从式(8)可知,应该随时间呈线性变化,但是由图5可以看出,值的变化曲线仅在气体溶解中间阶段呈现出线性规律,而在初始阶段和结束阶段发生紊乱。图5区域A中曲线斜率偏大,原因是充气过程气体在平衡腔中发生振荡,造成传质系数偏大。图5区域B中曲线斜率出现振动,这是由于气体溶解接近饱和状态,t趋近eff,压力的测量误差对值的影响变大造成的。因此,在处理数据时,图5区域A、B中的实验数据没有被使用,仅使用区域A、B之间的实验数据拟合得到体积传质系数。
CO2在正戊醇中的体积传质系数的测量结果如表3所示。图6显示了不同温度下CO2在正戊醇中体积传质系数随压力的变化规律。从图6可以发现,在实验的温度和压力范围内,CO2在正戊醇中体积传质系数随压力升高呈现上升的趋势,这是由两方面原因造成的,一方面压力升高有利于降低气液表面张力,促进了气泡的形成,增大了气液接触面积,进而增加了体积传质系数;另一方面,压力升高会提高CO2在正戊醇中的溶解度,降低溶液的黏度,加快CO2在正戊醇中的扩散,使得传质系数L增大。从图6还可以看出,CO2在正戊醇中体积传质系数随温度升高呈上升趋势,原因是温度升高降低了正戊醇的黏度,从而提高了CO2在正戊醇中的扩散系数。
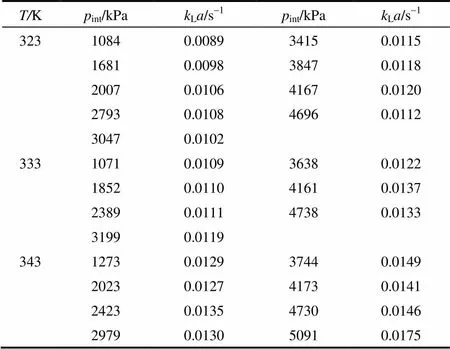
表3 CO2在正戊醇中的体积传质系数
3 结 论
本文基于等体积饱和法测量了温度为323~343 K、压力为0.9~5.0 MPa范围内CO2在正戊醇中的溶解度和体积传质系数。通过比较发现,本文得到的实验数据和文献中的数据吻合良好。CO2在正戊醇中的溶解度随着温度升高而减小,并随着压力的升高呈线性增长;体积传质系数随温度升高而增大,随压力升高而增大。
符 号 说 明

A——气液比表面积,m-1 kL——传质系数,m·s-1 kLa——体积传质系数,s-1 k——置信因子 n——记录时间点i的个数 nl, nlg——分别为溶剂量和溶解在溶剂中的气体量,mol p——压力,kPa peff,pt——分别为溶解平衡后气体腔中气体压力和溶解过程中平衡腔中气体的实时压力,kPa p0,pint——分别为充气前平衡腔中预饱和压力和向平衡腔充气后平衡腔中起始气体压力,kPa T——温度,K ——记录所有时刻的平均值,s ti——记录的第i个数据的时间,s t0——充气后初始时刻,s UkLa——体积传质系数kLa扩展不确定度,s-1 Un——溶液中气体量的扩展不确定度,mol Ux——溶解度的扩展不确定度 ——溶液中气体量标准不确定度,mol upeff, upt——分别为peff、pt的标准不确定度,kPa up0, upint——分别为p0、pint的标准不确定度,kPa uVGC, uVEC, uVl——分别VEC、VGC、Vl的标准不确定度,ml uy——y的标准不确定度 uri, urf, urg——分别为ri、rf、rg的标准不确定度,g·cm-3 VEC, VGC, Vl——分别为平衡腔、气体腔容积以及平衡腔中溶液的体积,ml x——摩尔溶解度 ——yi的平均值 ρi, ρf, ρg——分别为释放气体到平衡腔前后气体腔中气体密度以及溶解平衡时平衡腔中气体的密度,g·cm-3 上角标 l——在液体中 下角标 EC——平衡腔 eff——溶解平衡后 f——气体腔向平衡腔加气后 GC——气体腔 g——溶解后平衡腔中气体 i——气体腔向平衡腔加气前 i——计算采集实验数据点的次序 int——加气后初始时刻 kLa——体积传质系数 l——溶液 t——时刻 0——平衡腔加气前,预饱和
References
[1] Jessop P G, Leitner W. Chapter 1. Supercritical Fluids as Media for Chemical Reactions// Chemical Synthesis Using Supercritical Fluids[M]. Weinheim, Germany: Wiley-VCH Verlag GmbH, 1999: 1-36.
[2] Jessop P G, Ikariya T, Noyori R. Homogeneous catalysis in supercritical fluids[J]. Chemical Reviews, 1999, 99(2): 475-494.
[3] LEITNER W. Carbon dioxide as a raw material: the synthesis of formic acid and its derivatives from CO2[J]. Angewandte Chemie International Edition in English, 1995, 34(20): 2207-2221.
[4] BHANAGE B M, FUJITA S, IKUSHIMA Y,. Synthesis of dimethyl carbonate and glycols from carbon dioxide, epoxides, and methanol using heterogeneous basic metal oxide catalysts with high activity and selectivity[J]. Applied Catalysis A: General, 2001, 219(1): 259-266.
[5] PACHECO M A, MARSHALL C L. Review of dimethyl carbonate (DMC) manufacture and its characteristics as a fuel additive[J]. Energy & Fuels, 1997, 11(1): 2-29.
[6] ARESTA M, QUARANTA E. Carbon dioxide: a substitute for phosgene[J]. Chemtech, 1997, 27(3): 32-40.
[7] SHAIKH A A G, SIVARAM S. Organic carbonates[J]. Chemical Reviews, 1996, 96(3): 951-976.
[8] SUZUKI K, SUE H, ITOU M,. Isothermal vapor-liquid equilibrium data for binary systems at high pressures: carbon dioxide-methanol, carbon dioxide-ethanol, carbon oxide-1-propanol, ethane-ethanol, methane-1-propanol, ethane-ethanol, and ethane-1-propanol systems[J]. Journal of Chemical and Engineering Data, 1990, 35(1): 63-66.
[9] FORZATTI P, TRONCONI E, PASQUON I. Higher alcohol synthesis[J]. Catalysis Reviews, 1991, 33(1/2): 109-168.
[10] SILVA-OLIVER G, GALICIA-LUNNA L A, SANDLER S I. Vapor-liquid equilibria and critical points for the carbon dioxide + 1-pentanol and carbon dioxide + 2-pentanol systems at temperatures from 332 to 432 K[J]. Fluid Phase Equilibria, 2002, 200(1): 161-172.
[11] XIA G, TAMG Z G, FEI W Y. Solubility of CO2in alcohols, glycols, ethers, and ketones at high pressures from (288.15 to 318.15) K[J]. Journal of Chemical & Engineering Data, 2011, 56(5): 2420-2429.
[12] GUTIERREZ J E, BEJARANO A, JUAN C. Measurement and modeling of high-pressure (vapour+ liquid) equilibria of (CO2+ alcohol) binary systems[J]. The Journal of Chemical Thermodynamics, 2010, 42(5): 591-596.
[13] SECUIANU C, FEROIU V, GEANA D. Measurements and modeling of high-pressure phase behavior of the carbon dioxide+ pentan-1-ol binary system[J]. Journal of Chemical & Engineering Data, 2011, 56(12): 5000-5007.
[14] RAEISSI S, GAUTER K, PETERS C J. Fluid multiphase behavior in quasi-binary mixtures of carbon dioxide and certain 1-alkanols[J]. Fluid Phase Equilibria, 1998, 147(1): 239-249.
[15] LAM D H, JANGKAMOLKULCHAI A, LUKS K D. Liquid-liquid-vapor phase equilibrium behavior of certain binary carbon dioxide+-alkanol mixtures[J]. Fluid Phase Equilibria, 1990, 60(1/2): 131-141.
[16] TERAMOTO M, TAI S, NISHII K,Effects of pressure on liquid-phase mass transfer coefficients[J]. The Chemical Engineering Journal, 1974, 8(3): 223-226.
[17] Liu X Y, HE M G, Lv N,. Solubilities of isobutane and cyclopropane in ionic liquids[J]. The Journal of Chemical Thermodynamics, 2015, 88: 30-35.
[18] Liu X Y, HE M, Lv N,. Vapor-liquid equilibrium of three hydrofluorocarbons with [HMIM][Tf2N][J]. Journal of Chemical & Engineering Data, 2015, 60(5): 13u54-1361.
[19] Liu X Y, Bai L H, Liu S Q,. Vapor-liquid equilibrium of R1234yf/[HMIM][Tf2N] and R1234ze (E)/[HMIM][Tf2N] working pairs for the absorption refrigeration cycle[J]. Journal of Chemical & Engineering Data, 2016, 61(11): 3952-3957.
[20] SHARMA A, JULCOUR C, KELKAR A A,. Mass transfer and solubility of CO and H2in ionic liquid. Case of [BMIM][PF6] with gas-inducing stirrer reactor[J]. Industrial & Engineering Chemistry Research, 2009, 48(8): 4075-4082.
[21] 赵亮富, 赵玉龙, 白亮, 等. H2和CO在间二甲苯中的溶解度和体积传质系数的研究[J]. 燃料化学学报, 2000, 28(1): 80-84. ZHAO L F, ZHAO Y L, BAI L,. Research on the solubilities and volumetric mass coefficients of H2and CO in meta xylene[J]. Journal of Fuel Chemistry and Technology, 2000, 28(1): 80-84.
[22] LEMMON E W, HUBER M L, MCLINDEN M O. NIST reference fluid thermodynamic and transport properties–REFPROP[Z]. 2002.
[23] 史彭, 王占民. 一元线性回归的不确定度评定方法[J]. 西安建筑科技大学学报(自然科学版), 2000, 32(1): 82-85.SHI P, WANG Z M. The assessment method of the uncertainty of unary linear regression[J]. Journal of Xi’an University of Architecture & Technology(Natural Science Edition), 2000, 32(1): 82-85.
[24] 米娟层.一元线性回归中的不确定度分析[J]. 煤质技术, 2014, (1): 21-22. MI J C. Uncertainty analysis of monadic linear regression[J]. Journal of Coal Technology, 2014, (1): 21-22.
[25] BONED C, BAYLANCQ A, BAZILE J P. Liquid density of 1-pentanol at pressures up to 140MPa and from 293.15 to 403.15 K[J]. Fluid Phase Equilibria, 2008, 270(1): 69-74.
[26] Al-JIMAZ A S, Al-KANDARY J A, ABDUL-LATIF A H M. Densities and viscosities for binary mixtures of phenetole with 1-pentanol, 1-hexanol, 1-heptanol, 1-octanol, 1-nonanol, and 1-decanol at different temperatures[J]. Fluid Phase Equilibria, 2004, 218(2): 247-260.
[27] WENG W L. Viscosities and densities for binary mixtures of anisole with 1-butanol, 1-pentanol, 1-hexanol, 1-heptanol, and 1-octanol[J]. Journal of Chemical &Engineering Data, 1999, 44(1): 63-66.
[28] INDRASWATI N, MUDJIATI, WICAKSANA F,. Measurements of density and viscosity of binary mixtures of several flavor compounds with 1-butanol and 1-pentanol at 293.15 K, 303.15 K, 313.15 K, and 323.15 K[J]. Journal of Chemical & Engineering Data, 2001, 46(3): 696-702.
[29] Pereira L, dos S P G, Scheer A P,. High pressure phase equilibrium measurements for binary systems CO2+ 1-pentanol and CO2+ 1-hexanol[J]. The Journal of Supercritical Fluids, 2014, 88: 38-45.
[30] Silva-Oliver G, Galicia-Luna L A, Sandler S I. Vapor-liquid equilibria and critical points for the carbon dioxide + 1-pentanol and carbon dioxide + 2-pentanol systems at temperatures from 332 to 432 K[J]. Fluid Phase Equilibria, 2002, 200(1): 161-172.
Solubility and volumetric mass transfer coefficient of CO2in 1-pentanol
HE Maogang1, BAI Lihang1, LIU Siqi1, LIU Xiangyang1, HE Yongdong2
(1MOE Key Laboratory of Thermo-Fluid Science and Engineering, Xi’an Jiaotong University, Xi’an 710049, Shaanxi, China;2School of Physical Science and Technology, Xinjiang University, Urumqi 830046, Xinjiang, China)
An experimental apparatus based on isochoric saturation method was developed for measuring gas solubility and volumetric mass transfer coefficient in liquid with expanded uncertainties of temperature, pressure, solubility and volumetric mass transfer coefficient at 0.02K, 0.01%, 2%, and 4%, respectively. The solubility and volumetric mass transfer coefficients of CO2in 1-pentanol were determined at temperature from 323 K to 343 K and at pressure from 0.9 MPa to 5.0 MPa. CO2solubility in 1-pentanol increased with the increasing pressure. Mole fraction of CO2in 1-pentanol was risen by 26 % at 323 K, when pressure was increased from 2.5 MPa to 3.2 MPa. However, CO2solubility of in 1-pentanol decreased with the increasing temperature. Mole fraction of CO2in 1-pentanol also dropped by 26 % at pressure of 0.9 MPa when temperature was increased from 323 K to 343 K. Volumetric mass transfer coefficient of CO2was risen with increasing temperature and pressure. The CO2volumetric mass coefficient showed an increase from 0.0089 s-1to 0.0175 s-1when conditions of temperature and pressure were changed from 323 K and 1.1 MPa to 343 K and 5.0 MPa.
isochoric saturation method; absorption; mass transfer; CO2; 1-pentanol
10.11949/j.issn.0438-1157.20161745
TQ 021.4
A
0438—1157(2017)05—1780—06
何茂刚(1971—),男,教授。
国家杰出青年科学基金项目(51525604)。
2016-12-13收到初稿,2017-02-12收到修改稿。
2016-12-13.
Prof.HE Maogang, mghe@xjtu.edu.cn
supported by the National Science Fund for Distinguished Young Scholars of China(51525604).

