辣椒疫霉效应因子RxLR101012的表达纯化与结晶初探
马璐璐,王玉姣,孙柏华,陈姗姗,张修国
山东农业大学 植物保护学院,山东省蔬菜病虫生物学省级重点实验室,山东 泰安 271018
辣椒疫霉效应因子RxLR101012的表达纯化与结晶初探
马璐璐,王玉姣,孙柏华,陈姗姗,张修国*
山东农业大学 植物保护学院,山东省蔬菜病虫生物学省级重点实验室,山东 泰安 271018
植物病原卵菌会分泌一系列的效应分子进入寄主体内,从而促进病原菌的侵染。这些效应分子或在质外体积累或进入宿主细胞内来调控寄主的免疫反应。但效应分子如何逃避寄主的免疫识别,使植物发病的分子机制目前还不清楚。本研究从辣椒疫霉强致病性菌株SD33中克隆分离获得1个效应分子RxLR101012,利用相关生物信息学软件分析了该效应分子的基因序列,并对其进行了原核表达与纯化,确定了该基因高效表达条件,利用亲和层析、离子交换层析和凝胶过滤层析,获得RxLR101012高纯度蛋白,得到RxLR101012蛋白晶体,为后续解析RxLR效应分子蛋白三维结构,从结构生物学角度探知RxLR效应分子生理生化功能奠定了基础。
辣椒疫霉;效应分子;原核表达;蛋白纯化
疫霉菌是一类重要的植物病原菌,由其引起的植物病害统称为疫病,常给农业生产带来重大损失[1],辣椒疫病由辣椒疫霉侵染导致的重要土传病害[2,3]。辣椒疫霉隶属于植物病原卵菌,分布广泛,寄主范围广谱。卵菌是一类真核生物,包括许多重要的植物和动物病原菌。其中疫霉属包含许多能够引起作物毁灭性病害的病原菌,如19世纪中叶危害马铃薯引起爱尔兰大饥馑的致病疫霉[4]。
植物病原卵菌在侵染寄主或为在寄主中顺利定殖会分泌大量的效应分子(Effectors)调控寄主的防卫反应以躲避寄主的免疫识别[5]。卵菌效应分子被分泌到质外体或进入寄主细胞内
从而调控寄主的免疫反应[6,7]。近年来,关于辣椒疫霉关键效应分子及致病流行机制研究已受到越来越多的关注。病原卵菌效应分子能够引发寄主细胞坏死或诱导寄主细胞产生防卫反应[8]。生物信息学分析表明卵菌基因组中存在大量效应蛋白,其中辣椒疫霉基因组中有300多个效应分子基因[9]与大豆疫霉中的效应分子数量相当[10]。它们大都有保守的N端序列,C端具有多态性。有报道发现N端保守的RxLR基序参与效应分子向寄主细胞转运的功能[11,12]。许多效应分子能够抑制由其它效应分子或病原菌引发的细胞程序性死亡或是效应分子本身能够引起细胞坏死[13]。效应分子有的被分泌到质外体,有的效应分子被分泌到细胞质内,分别与不同的亚细胞结构相结合。有关辣椒疫霉RxLR效应分子蛋白表达纯化及其功能机制特性的研究资料积累较少,本研究克隆了辣椒疫霉的1个RxLR效应分子,基于原核表达及蛋白纯化技术获得了该效应分子较高纯度的可溶性蛋白,并筛选得到了该蛋白的晶体生长条件,为该蛋白晶体继续优化培养及结构解析提供了基础。
1 材料方法
1.1 材料来源
高致病性辣椒疫霉(Phytophthora capsici Leonian)菌株SD33由山东省蔬菜病虫生物学重点实验室分离鉴定。
1.2 辣椒疫霉效应分子RxLR101012引物设计与克隆
基于辣椒疫霉全基因组数据库,利用生物信息学软件比对发现,辣椒疫霉基因组中含有1个效应蛋白分子RxLR101012。依据RxLR101012基因去掉信号肽之后的片段5’端和3’端序列分别设计含有BamH I和Xho I酶切位点的特异性克隆引物RxLR101012-F:5’-CGGG
ATCCGCTGTCCAAGACAACGAGTA-3’;RxLR101012-R:5’-CCGCTCGAGCGAGGTGCGGTATT TCTTGG-3’,该引物序列由铂尚生物技术(上海)有限公司合成。
基于辣椒疫霉全基因组数据库,利用辣椒疫霉SD33菌株的cDNA为模板,对RxLR101012进行PCR扩增:95℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,共30个循环;最后72℃延伸5 min;4℃保存。
扩增后的基因通过1%的琼脂糖凝胶电泳验证,进行纯化回收。对回收后的DNA片段和pET-28a载体进行双酶切,酶切产物回收后进行连接转化。重组后的质粒经菌落PCR筛选,测序验证正确后,提取重组质粒备用。
1.3 重组蛋白的表达
将测序正确的重组质粒转入表达宿主E.coli Rosetta(DE3)菌株中进行表达。涂布于具有卡那霉素抗性的LB固体培养基上37℃培养12~14 h;挑取10个生长良好的单克隆菌落,接入1 mL含有卡那霉素抗性的LB培养液中,37℃震荡培养3~5 h至菌液浑浊;各取200µL菌液于5 mL含卡那霉素的LB培养液中,37℃,200 rpm震荡培养至OD为0.6~0.8之间,取1 mL菌液做诱导前对照;加入5 μL的IPTG(1 mol/L,终浓度为1 mmol/L),37℃,200 rpm诱导表达3 h;诱导结束后各取1 mL菌液,与诱导前的对照菌液共离心,12000 rpm离心2 min;弃上清,各加入50 μL的2×Binding Buffer和50 μL的2×Loading Buffer混匀;沸水煮10 min,每5 min涡旋震荡1次,离心12000 rpm,2 min;15%SDS-PAGE电泳分析。根据电泳结果,将原始菌液活化后按照1:50的比例接种到含有卡那霉素抗性的1 L LB培养基中,37℃,180 rpm震荡培养至OD600为0.6~0.8;培养基降温到16℃后,加入1 mL 1 mol/L的IPTG,120 rpm培养20 h;离心收集菌体,4℃,8000 rpm,4 min;预冷的50 mL重悬液(20 mmol/L Tris pH7.5,150 mmol/L NaCl)重悬菌体,-20℃保存备用。
1.4 重组蛋白的纯化
1.4.1 亲和层析纯化 细胞破碎及亲和层析前处理(1)Ni-NTA层析柱的预处理:用0.5 mol/L的EDTA螯合除去介质中的金属离子,超纯水冲洗3个柱体积,加入0.5 mol/L的氯化镍浸泡30 min,之后用重悬液平衡1到2个柱体积4℃放置备用。(2)细胞超声破碎:将收集好的放置于-20℃保存备用的50 mL细胞菌体置于冰上,加入10%的甘油,0.5%的TWEEN-20,冰浴下混匀后超声破碎(超声3 s、间隔3 s、30 min、功率280 w)。4℃,14000 rpm高速离心30 min,收集上清液,置于冰上。
1.4.2 亲和层析纯化 (1)将离心后的上清液,4℃条件下通过处理好的Ni-NTA亲和层析柱中,反复过柱3遍;(2)用低浓度洗杂液(20 mmol/L Tris-HCl,150 mmol/L NaCl,20 mmol/L咪唑,pH7.5)冲洗亲和层析柱,冲洗200 mL;(3)加入15 mL洗脱液(20 mmol/L Tris-HCl,150 mmol/L NaCl,400 mmol/L咪唑,pH7.5)冲洗挂过蛋白的层析柱,收集目标蛋白。
1.4.3 离子交换层析 RxLR101012蛋白预测等电点PI为9.4左右,在pH6.8的PBS缓冲液中可以结合在阳离子交换柱上,通过降低缓冲液的盐浓度增加蛋白质与介质的亲和度,目的蛋白通过亲和介质后,逐步提高盐离子浓度,将目标蛋白洗脱下来。具体步骤为:(1)将亲和层析纯化之后的重组蛋白样品用A泵液(25 mmol/L PBS pH6.8)稀释后注入50 mL上样环;(2)将HiTrap SP FF-5 mL预装柱连接到ÄKTA蛋白纯化系统上,用A泵液(25 mmol/L PBS pH6.8)平衡3个柱体积;(3)预设程序,并运行,B泵液(25 mmol/L PBS pH6.8,1 mol/L NaCl)进行梯度洗脱纯化目标蛋白;
1.4.4 凝胶过滤层析纯化 (1)将Superdex200预装柱接到ÄKTA蛋白纯化仪上,用A泵平衡液(20 mmol/L Tris,150 mmol/LNaCl,pH7.5)平衡2个柱体积;(2)将离子亲和层析之后目的蛋白置于截留分子量为10 KDa的超滤管中,4℃,3000 rpm,离心浓缩至1 mL;(3)将1 ml蛋白样品4℃,12000 rpm,离心5 min,将蛋白样品注入1 mL上样环,运行程序;(4)取峰值对应处的蛋白做样,并进行SDS-PAGE检验分离纯化效果。
1.5 晶体的筛选
本实验形成晶体的方法采用蒸汽扩散法,包括悬滴法和坐滴法。本试验所有的蛋白质结晶试剂盒均购自Hampton Research公司包括Crystal screen、Crystal screen II、SaltRx I、SaltRx II、PEGRx I、PEGRxII、PEG ion I、PEG ion II等,从中筛选生长晶体的条件。
2 结果与分析
2.1 辣椒疫霉RxLR101012基因克隆与基因序列结构分析
依据辣椒疫霉基因组中效应蛋白RxLR101012基因序列设计引物,从高致病性菌株SD33中克隆RxLR101012基因。基因测序以及BLAST比对最终获得了RxLR101012基因,其核苷酸序列和氨基酸序列(见图1)。

图1 辣椒疫霉菌效应蛋白分子RxLR101012基因氨基酸序列(*为终止密码子)Fig.1Amino-acid sequence of Phytophthora capsici effector gene RxLR101012(*is terminal code)
2.2 RxLR101012蛋白的理化性质
辣椒疫霉效应蛋白RxLR101012基因完整的开放阅读框ORF序列为672 bp,编码224个氨基酸,预测编码蛋白的分子量为26.1 kD。利用SignalP4.1 Server预测RxLR101012基因含有一个长度为19个氨基酸的信号肽,有跨膜区(见图2)。去掉信号肽之后预测发现跨膜区消失。该基因预测存在信号肽和跨膜区,并且去掉信号肽之后跨膜区消失,说明该基因编码的是外泌蛋白(见图3)。
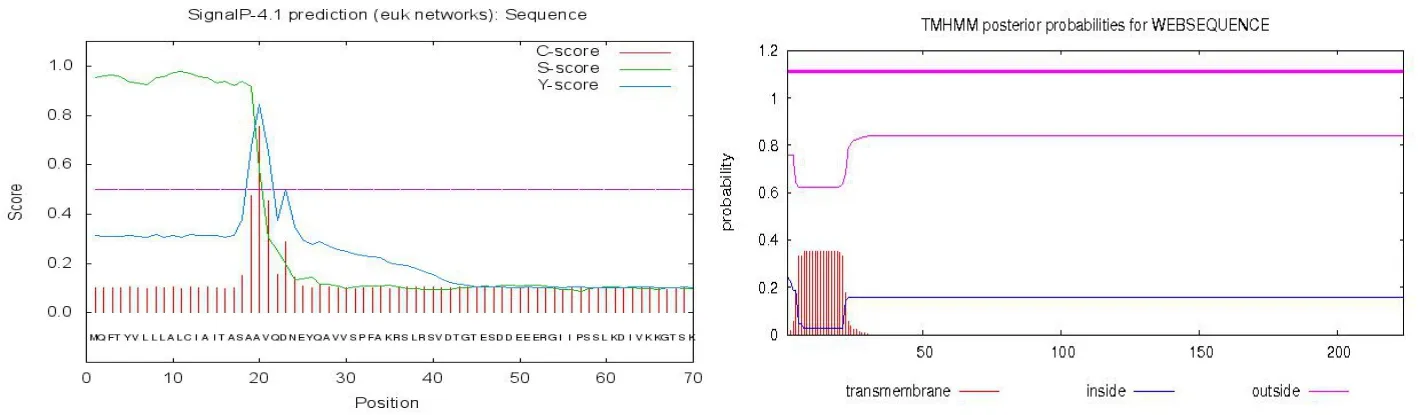
图2 效应分子RxLR101012信号肽预测与跨膜区预测Fig.2 The predication of RxLR101012 signal peptide and transmembrane domain

图3 效应分子RxLR101012去掉信号肽之后的跨膜区预测Fig.3 The predication of RxLR101012 transmembrane domain without signal peptide sequence
2.3 RxLR101012重组质粒构建与鉴定
PCR扩增产物经1.0%琼脂糖凝胶电泳检测,电泳图显示有DNA条带,与预期值675 bp大小相符(见图4)。RxLR101012-28a重组质粒构建经PCR筛选,送上海铂尚生物公司测序,结果表明开放阅读框架完全正确,表明重组质粒构建成功。
2.4 RxLR101012蛋白表达
将重组质粒转到表达菌株Rosetta中,经诱导表达后取样进行SDS-PAGE检测,电泳图显示RxLR101012重组蛋白在大肠杆菌中表达明显提高,图中1号泳道为marker,2号泳道为诱导前CK,3~6号泳道为加入IPTG 37℃诱导3 h后样品,电泳结果显示诱导表达效果明显,与目标目的蛋白26.1 KDa相似(见图5)。

图4 RxLR101012基因PCR扩增结果Fig.4 PCR amplification of RxLR101012

图5 RxLR101012诱导表达结果Fig.5 The induced expression of RxLR101012
2.5 RxLR101012蛋白纯化
经镍柱亲和层析,离子交换层析及凝胶层析之后的蛋白纯化结果(见图6,图7)。

图6 A:RxLR101012阳离子交换柱纯化结果;B:RxLR101012凝胶层析结果Fig.6A:Ion Exchange Chromatography of RxLR101012;B:Gel filtration purification of RxLR101012

图7 凝胶层析之后的SDS-PAGE电泳结果Fig.7 SDS-PAGE after Gel filtration purification analysis
2.6 蛋白晶体的初筛
将纯化获得的目的蛋白进行超滤浓缩,获得浓度为12 mg/mL,纯度95%以上的目的蛋白,用坐滴法筛选晶体生长初始条件筛选得到的蛋白晶体(见图8)。

图8 RxLR101012经筛选得到的蛋白晶体Fig.8 The crystals of RxLR101012
3 讨论
对于众多用生物化学和生物物理学进行的实验研究来讲,成功获得高纯度高浓度可溶性蛋白溶液是至关重要的一步。本研究从辣椒疫霉全基因组中克隆得到1个效应分子,并利用原核表达体系对其进行了高效表达。卵菌效应分子信号肽具调控效应分子分泌的功能,效应分子RxLR101012经生物信息学分析发现有长度为19个氨基酸的信号肽,在辣椒疫霉菌侵染致病的过程中,可被分泌至寄主细胞行使其相应功能,基于上述分析推测RxLR101012基因可能是有重要的作用的功能基因。
在蛋白纯化和晶体筛选过程中,我们发现当蛋白纯度达到90%以上,浓度达到10 mg/mL,适合进行蛋白晶体筛选,并利于获得蛋白晶体。晶体生长的临界条件是溶液达到一个适宜的过饱和度,才会生成少数的晶核,随着溶液过饱和度逐渐降低,最后溶液和晶体处于平衡状态,晶体就停止生长。如果过饱和度太高,晶体会大量析出形成微晶,甚至成无定型状态[14]。蛋白晶体生长过程中选择不同的方法会直接影响到晶体的生长[15]。在晶体优化过程中,缓冲液pH的选择,离子浓度的改变,温度的调节以及添加剂的有无等都会影响蛋白晶体的生长。在晶体优化过程中通常会选择保持唯一变量,通过设置一系列条件梯度进行晶体优化,以期得到衍射数据良好的蛋白晶体。
目前关于卵菌效应分子结构生物学研究信息较少,其致病机理亦不明了。因此,开展卵菌效应分子表达纯化,获得高纯度蛋白,对于开展晶体结构生物学研究具重要的意义。本研究制备了该效应分子的高纯度蛋白,并得到了蛋白晶体,为进一步优化及进行蛋白结构生物学研究提供了依据。
[1]郑小波.疫霉菌及其研究技术[M].北京:中国农业出版社,1997
[2]张海英,刘永刚,吕和平,等.河西地区辣椒疫病菌的形态特征及其致病力的初步研究[J].西北农业学报,2008,17(1):74-76
[3]王晓敏,巩振辉,逯红栋,等.辣椒疫霉菌孢子诱导技术研究[J].西北农业学报,2006,15(2):59-62
[4]熊 琴.疫霉菌RNA沉默抑制子PsPSR2及其同源效应分子的功能分析[D].江苏:南京农业大学,2014
[5]Yu D,Mpina MH,Birch PRJ,et al.Phytophthora infestans RxLR effector AVR1 interacts with exocyst component Sec 5 to manipulate plant immunity[J].Plant Physiology,2015,169(3):1975-1990
[6]KamounS.Acatalogueof theeffectorsecretomeof plantpathogenicoomycetes[J].AnnuRevPhytopathol,2006,44(1):41-60
[7]Oliva R,Win J,Raffaele S,et al.Recent developments in effector biology of filamentous plant pathogens[J].Cell Microbiol,2010,12(7):705-715
[8]Saunders DGO,Breen S,Win J,et al.Host Protein BSL1 Associates with Phytophthora infestans RXLR Effector AVR2 and the Solanum demissum Immune Receptor R2 to Mediate Disease Resistance[J].Plant Cell,2012,24:3420-3434
[9]Baxter L,Tripathy S,Ishaque N,et al.Signatures of adaptation to obligate biotrophy in the Hyaloperonospora arabidopsidis genome[J].Science,2010,330(6010):1549-1551
[10]Jiang RH,Tyler BM,Govers F.Comparative analysis of Phytophthora genes encoding secreted proteins reveals conserved synteny and lineage-specific gene duplications and deletions[J].MPMI,2006,19(12):1311-1321
[11]Dou D,Kale SD,Wang X,et al.RXLR-mediated entry of Phytophthora sojae effector Avr1b into soybean cell does not require pathogen-encoded machinery[J].Plant Cell,2008,20(7):1930-1947
[12]Whisson SC,Boevink PC,Moleleki L,et al.A translocation signal for delivery of oomycete effector protein into host plant cells[J].Nature,2007,450(7166):115-118
[13]Wang Q,Han C,Ferreira AO,et al.Transcriptional programming and functional interactions within the Phytophthora sojae RxLR effector repertoire[J].Plant Cell,2011,23(6):2064-2086
[14]Chernov AA.Protein crystals and their growth[J].Journal of structural biology,2003,142(1):3-21
[15]舒占永,毕汝昌.蛋白质晶体的优化生长[J].生物化学与生物物理进展,1997,24(5):396-401
PreliminaryExplorationforExpression,PurificationandCrystallization ofRxLR101012fromPhytophthoracapsici
MALu-lu,WANG Yu-jiao,SUN Bai-hua,CHEN Shan-shan,ZHANG Xiu-guo*
College of Plant Protection,Key Laboratory of Vegetable Pest and Biology of Shandong Province/Shandong Agricultural University,Tai’an 271018,China
A number of effector proteins are delivered by phytopathogens into host plant cells to promote infection.These proteins accumulate in the plant intercellular space or translocate into host cells to modulate host immune responses. However,the immunolohical recognition how effectors escape hosts and pathogenetic molecular mechanisms in plants have been understood.In this study,we cloned an effector gene RxLR101012 from high-virulent Phytophthora capsici SD33 and then analyzed the sequence structure of RxLR101012 gene based on the BLAST and SignalP4.1 Server software.At the same time,we expressed and purified of RxLR101012 effector in the Escherichia coli and determined the optimization conditions that could induce RxLR101012 gene to be effective expression.Finally,we prepared the high quality protein of RxLR101012 gene which would be beneficial to further study on crystal structure of it.
Phytophthora capsici;effector;prokaryotic expression;protein purification
S436.418.1+2
:A
:1000-2324(2017)02-0210-05
10.3969/j.issn.1000-2324.2017.02.009
2016-11-07
:2017-01-23
国家大宗蔬菜产业技术体系(CARS-25-03B)
马璐璐(1990-),女,在读硕士研究生.研究方向:植物病原真菌学和真菌资源利用.
*通讯作者:Author for correspondence.E-mail:zhxg@sdau.edu.cn

