白藜芦醇处理对猪孤雌激活囊胚抗冻能力的影响
陈亚宁,吴彩凤,张树山,张德福,戴建军
(1上海海洋大学水产与生命学院,上海 201306;2上海市农业科学院畜牧兽医研究所,上海 201106;3上海市农业遗传育种重点实验室动物遗传工程研究室,上海 201106)
白藜芦醇处理对猪孤雌激活囊胚抗冻能力的影响
陈亚宁1,2,3,吴彩凤2,3,张树山2,3,张德福2,3,戴建军2,3
(1上海海洋大学水产与生命学院,上海 201306;2上海市农业科学院畜牧兽医研究所,上海 201106;3上海市农业遗传育种重点实验室动物遗传工程研究室,上海 201106)
为研究白藜芦醇(Resveratrol,RES)处理对猪孤雌激活囊胚抗冻能力的影响,利用2μmol/L RES在卵母细胞体外成熟、玻璃化冷冻与解冻和随后的胚胎培养过程中进行全程添加,观察其对猪孤雌激活囊胚冻后线粒体膜电位、TUNEL凋亡水平、多种Caspase活性、凋亡相关功能基因mRNA表达水平和体外发育能力的影响。结果显示:体外成熟和胚胎培养过程中添加RES能显著提高卵母细胞孤雌激活后的卵裂率和囊胚率(9518%vs.85.79%,51.85%vs.41.46%,P<0.05)。RES全程添加后其孤雌激活囊胚的抗冻能力显著提高,表现为囊胚腔恢复率和囊胚细胞数增高(35.09%vs.31.25%,37.95 vs.31.81,P<0.05),线粒体膜电位升高(092 vs.0.46,P<0.05),囊胚细胞凋亡比例下降(8.24%vs.10.13%,P<0.05),Pan-caspase、Caspase-8、Caspase-9和Caspase-3的荧光强度值和Caspase-8,Caspase-9,TNF-α基因表达水平下降,Bcl-2和SOD-1表达水平升高(P<0.05)。与冷冻囊胚相比,新鲜囊胚的线粒体膜电位水平、Bcl-2和SOD-1基因表达量更高;细胞凋亡比例、Pan-caspase、Caspase-8、Caspase-9、Caspase-3荧光强度值以及Caspase-8、Caspase-9、TNF-α基因表达水平则更低(P<0.05)。因此,RES全程添加可通过改善冻后猪孤雌激活囊胚的线粒体功能,降低囊胚细胞凋亡水平,从而提高其抗冻能力。
猪;孤雌激活;囊胚;线粒体;凋亡;玻璃化冷冻;白藜芦醇
目前,冷冻保存是哺乳动物种质资源保存的主要方法。自1985年Rall等[1]首次利用玻璃化冷冻法成功冷冻鼠8-细胞胚胎以来,玻璃化冷冻技术日益成熟,应用已经越来越广泛。然而仍有许多因素影响玻璃化冷冻效率,如冻后出现细胞骨架损伤、线粒体功能下降和细胞凋亡等现象[2]。
培养液是胚胎体外发育直接接触的液体环境,可直接影响胚胎的质量和抗冻能力[3-4]。氧化应激是造成体外生产胚胎发育能力下降的一个重要原因,研究表明在培养液中添加抗氧化剂如β-巯基乙醇、半胱氨酸、巯基乙胺等可以显著提高胚胎的体外发育质量[3]。白藜芦醇(Resveratrol,RES)是一种植物抗毒素,具有抗氧化作用,其广泛存在于花生、李子、葡萄等70多种植物中,在红葡萄酒预防人类心血管疾病的功能上发挥主要作用。近年来有将RES应用于哺乳动物胚胎体外发育上的研究,如Wang等[5]发现在牛卵母细胞培养液中添加RES,卵母细胞第一极体排出率和囊胚数量明显提高。Abdel-Wahab等[6]在牛胚胎体外培养过程中添加0.5μmol/L的RES,发现RES具有抵抗胚胎细胞冷冻损伤的作用。然而RES对猪孤雌激活囊胚抗凋亡能力影响的研究还未见报道。
本研究通过比较在猪卵母细胞体外成熟(In vitromaturation,IVM)、孤雌激活囊胚体外培养、玻璃化冷冻解冻和冻后恢复培养的全部过程中添加2μmol/L的RES,研究RES对猪孤雌激活囊胚冻后线粒体功能、凋亡水平和体外发育的影响。
1 材料与方法
1.1 化学试剂
本研究所用试剂除标注外均购自美国Sigma公司。
1.2 卵母细胞的采集和体外成熟
猪卵巢由屠宰场提供,卵巢取出后迅速置于35—37℃,0.9%的NaCl溶液(含75μg/mL青霉素和50μg/mL链霉素)中,并尽快运回实验室。用18号针头的10 mL注射器,选取直径为2—8 mm的卵泡抽取其中的卵丘卵母细胞复合体(Cumulus oocyte complexes,COCs)。放入39℃预温的15 mL离心管中,沉淀至少15 min后弃上清。在显微镜下挑选胞质均匀且有3层以上颗粒细胞的COCs,在台式液和M199(Gibco,美国)中分别洗涤3次,移入提前2 h预温平衡的体外成熟培养液中培养44 h,培养条件为385℃,5%CO2,饱和湿度。IVM用M199加10 IU/mL孕马血清促性腺激素(Pregnant mare serum gonadotropin)(宁波市第三激素制品有限公司)、10 IU/mL人绒毛膜促性腺激素(Human chorionic gonadotropin)(宁波市第三激素制品有限公司)、10%(V/V)猪卵泡液PFF(实验室自制)、10%(V/V)胎牛血清(Fetal bovine serum,FBS)(Gibco,美国)、0.1 mg/mL的L-半胱氨酸、10 IU/mL双抗、10 ng/m L表皮生长因子(Epidermal growth factor)配得。成熟过程中如进行RES添加,其终浓度为2μmol/L。
1.3 卵母细胞的孤雌激活和体外培养
IVM培养44 h后的COCs经0.1%的透明质酸酶消化,M199洗涤后用于电激活,电激活参数为1.2 kV/cm、30μs、一次脉冲。激活液为0.3mol/L甘露醇、50μmol/LCaCl2和0.1mmol/LMgCl2。激活后的卵母细胞在PZM-3(自制)+5μmol/L细胞松弛素B(Cytochalasin B)中培养4 h,然后用PZM-3洗3次,移入每孔含有500μL PZM-3和500μL矿物油的四孔板(NUNC,丹麦)中培养。培养条件为38.5℃,5% CO2,饱和湿度。培养48 h统计卵裂率,168 h统计囊胚率。体外培养过程中如进行RES添加,其终浓度为2μmol/L。
1.4 囊胚的玻璃化冷冻和解冻
冷冻方法:培养所得的囊胚用PZM-3洗3遍,移入平衡液(PZM-3含7.5%EG、7.5%DMSO、20% FBS)中平衡5 min,然后移入冷冻液(PZM-3含0.4 mol/L蔗糖、15%EG、15%DMSO、20%FBS)中,20 s后立即用实验室自制的OPS管吸取囊胚,并迅速投入液氮中。
解冻方法:取出液氮中的OPS管,将含有囊胚的一端迅速放入37℃预温的解冻液Ⅰ(PZM-3含0.3 mol/L蔗糖、20%FBS)中,置于恒温培养箱中平衡3 min,然后移入同样预温的解冻液Ⅱ(PZM-3含015 mol/L蔗糖、20%FBS)中,在恒温培养箱中平衡3 min后,用PZM-3洗3遍,置于PZM-3(或PZM-3+2μmol/L RES)中培养备用。
培养24 h后统计囊胚腔恢复率(即:囊胚腔恢复的囊胚数占解冻囊胚总数的比例)。
1.5 试验设计
本试验所用囊胚共分3组,新鲜组:卵母细胞经过IVM培养、孤雌激活、PZM-3培养所得的囊胚;冷冻组:新鲜组囊胚经玻璃化冷冻解冻后在PZM-3中孵育24 h所得的囊胚;RES冷冻组:卵母细胞经IVM+2μmol/L RES成熟培养、孤雌激活后在PZM-3+2μmol/L RES培养的囊胚再经过冷冻解冻后在PZM-3+2μmol/L RES中孵育24 h所得的囊胚。
对上述3组囊胚进行线粒体膜电位(ΔΨm)、TUNEL凋亡水平、多种Caspase活性、凋亡相关基因表达和体外发育能力检测。
1.6 线粒体膜电位(ΔΨm)的JC-1检测
使用含10μg/m L JC-1(5,5’,6,6’-tetrachloro-1,1’,3,3’-tetraethyl-imidacarbocyanine iodide)(碧云天,中国)的PZM-3溶液对上述3组囊胚进行线粒体膜电位检测,染色条件为37℃,避光孵育20 min,然后用PZM-3洗涤3次,用激光共聚焦显微镜(TCSSP2,Leica,德国)进行检测。在囊胚细胞最大横截面处,分别观察和记录红色和绿色荧光信号强度。红色(RITC)和绿色(FITC)荧光强度的比值即为ΔΨm。每组试验重复3次,每次约20个囊胚。
1.7 TUNEL凋亡染色
使用一步法TUNEL检测试剂盒(碧云天,中国)进行凋亡检测。3组囊胚经4%的多聚甲醛固定60 min,用PZM-3洗3遍,再用含0.1%Triton X-100的PZM-3重悬囊胚,冰浴2 min。PZM-3洗3遍后移入事先配好并预温平衡的50μL TUNEL检测液(2μL TdT酶+48μL荧光标记液)中37℃避光孵育60 min,然后用PZM-3洗3遍。用5μg/mL的Hoechst33342染色液37℃避光孵育10 min,进行细胞核染色,PZM-3洗3遍后放于载玻片上压片,在倒置荧光显微镜(IX71,OLYMPUS,日本)下观察。分别记录囊胚的细胞数和凋亡细胞数。每组重复3次,每次约20个囊胚。
1.8 Caspase染色
对3组囊胚分别进行Pan-caspase、Caspase-8、Caspase-9和Caspase-3荧光染色。采用Promega(美国)公司生产的Pan-caspase原位荧光染色试剂盒进行染色。用PZM-3将FITC-VAD-FMK稀释至10μmol/L,囊胚在染色液中37℃避光孵育15 min后用PZM-3洗3遍,然后在荧光显微镜下观察拍照。Caspase-8、Caspase-9和Caspase-3原位荧光染色参照对应的说明书(BioVision,美国)进行,用PZM-3进行1∶300稀释配成染色液,然后将囊胚移入染色液中37℃避光孵育15 min。用PZM-3洗3遍,置于荧光显微镜下观察拍照。使用Image-Pro Plus 6.0软件对荧光照片进行量化并记录荧光强度值,结果用荧光平均相对密度表示。每组重复3次,每次约25个囊胚。
1.9 凋亡相关基因的表达检测
在冰上进行RNA提取及逆转录反应,同时要尽量减少操作时间。(1)总RNA提取:3组囊胚分别以150枚为一组进行一次反应。使用RNA prep Pure Micro Kit试剂盒(TIANGEN,中国)提取总RNA,得到的RNA溶液其OD260/OD280应在1.9—2.1。(2)cDNA的制备:采用TIANGEN(中国)公司生产的Fast Quant RT Kit试剂盒,将抽提所得的RNA进行逆转录,获得cDNA。从NCBI中获得猪GAPDH、Caspase-8、Caspase-9、TNF-α、BCL-2、SOD-1的cDNA序列并设计引物,引物信息如表1所示。(3)实时荧光定量聚合酶链式反应(Real-time RT-PCR);反应体系为2μL cDNA、0.8μL引物、10μL SYBR Premix Ex Taq(TaKaRa,日本)、0.4μL ROX Reference DayⅡ(50X)、6μL ddH2O。每个反应重复3次,在PCR仪(Biosystems7500 Fast Real-Time PCR System,美国)上进行反应,反应条件为95℃30 s,95℃5 s,60℃34 s,95℃15 s,60℃1 min,95℃15 s,60℃15 s,40个循环,循环结束后完成溶解曲线图。以GAPDH作为内参基因,2-ΔΔCt为统计量比较组间差异。每组重复3次,每次150枚囊胚。

表1 qRT-PCR所需基因引物信息Table 1 Information of primers for qRT-PCR
1.10 数据分析
采用SPSS 13.0进行统计学处理,每组至少重复3次。结果以平均数±标准差表示,P<0.05为差异显著性标准。
2 结果与分析
2.1 RES添加对猪卵母细胞孤雌激活胚胎体外发育能力的影响
培养过程添加RES,猪卵母细胞孤雌激活卵裂率和囊胚率与新鲜组相比显著增高(表2)。

表2 RES添加对猪卵母细胞孤雌激活发育能力的影响Table 2 Effect of RES addition on developmental capacity of porcine parthenogenetic oocytes
2.2 RES添加对猪孤雌激活囊胚冻后存活与发育的影响
冷冻组和RES冷冻组囊胚解冻孵育24 h后囊胚腔恢复率和囊胚细胞数的结果如表3所示,RES冷冻组的囊胚腔恢复率和囊胚细胞数(35.09%,37.95±6.88)与冷冻组(31.25%,31.81±4.59)相比均显著增高(P<0.05)。RES冷冻组的囊胚细胞数(37.95±6.88)比新鲜囊胚的囊胚细胞数(38.17±5.78)略低,差异不显著(P>0.05)。图1为解冻孵育24 h后各实验组的囊胚恢复照片。

表3 RES添加对冷冻后囊胚腔恢复率和囊胚细胞数的影响Table 3 Effects of RES addition on blastocoel recovery rate and blastula’s cell num ber
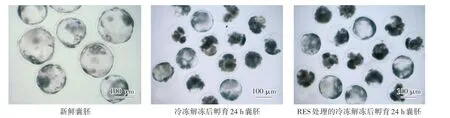
图1 新鲜囊胚、冷冻解冻后孵育24 h囊胚和RES处理的冷冻解冻后孵育24 h囊胚(100×)Fig.1 Fresh blastulas,24 h incubated blastulas after freeze-thaw and 24 h incubated blastulas after freeze-thaw under RES treatment(100×)
2.3 RES添加对猪孤雌激活囊胚冻后线粒体功能和凋亡水平的影响
如表4和图2所示,玻璃化冷冻后RES冷冻组囊胚的线粒体膜电位显著高于冷冻组,但低于新鲜囊胚。经过JC-1染色后新鲜囊胚显示黄色或橘黄色,冷冻组囊胚显示绿色,RES冷冻组囊胚显示淡黄色。TUNEL染色检测囊胚中细胞的凋亡水平发现:添加RES后冷冻囊胚的细胞凋亡比例虽然高于新鲜囊胚,但是显著低于未添加RES的冷冻组凋亡比例。

表4 RES添加对冷冻后孤雌激活囊胚线粒体膜电位(ΔΨm)和凋亡水平的影响Table 4 Effects of RES addition on m itochondrialm embrane potential(ΔΨm)and apoptosis level of vitrified parthenogenetic blastulas

图2 三组囊胚(新鲜囊胚、冷冻囊胚和培养过程添加RES的冷冻囊胚)的JC-1染色(100×)Fig.2 JC-1 staining of fresh blastocysts,vitrified blastocysts and vitrified blastocystswith RES addition(100×)
2.4 RES添加对冷冻后猪孤雌激活囊胚Pan-caspase、Caspase-8、Caspase-9、Caspase-3活性的影响
3组囊胚分别经多种Caspase原位荧光染色,结果如表5和图3所示。RES冷冻组囊胚Pan-caspase、Caspase-8、Caspase-9、Caspase-3荧光强度值(表5)显著低于冷冻组,但均高于新鲜囊胚。荧光强度越高,Caspase活性就越高。图3中RES冷冻组囊胚荧光强度明显低于冷冻组,但高于新鲜囊胚的荧光强度。

表5 RES添加对冷冻后孤雌激活囊胚Caspase活性的影响Table 5 Effects of RES addition on caspase activities of vitrified parthenogenetic blastocysts

图3 新鲜囊胚、冷冻囊胚和RES处理的冷冻囊胚凋亡相关Caspase荧光强度的比较(100×)Fig.3 Comparison of caspase fluorescence intensities related to apoptosis of fresh blastulas,vitrified blastulas and vitrified blastulas w ith RES treatment(100×)
2.5 RES添加对猪孤雌激活囊胚冻后基因表达的影响
通过qRT-PCR对3组囊胚凋亡相关基因的mRNA表达水平进行分析,结果如图4所示,RES冷冻组Caspase-8、Caspase-9、TNF-α基因的表达量显著低于冷冻组(4.80 vs.9.96,3.57 vs.10.29,4.09 vs.9.47;P<0.05),但均显著高于新鲜组(1,1,1;P<0.05)。RES冷冻组BCL-2和SOD-1基因的表达量(0.72,071)与冷冻组(0.30,0.34)相比显著升高(P<0.05),但均显著低于新鲜组(1,1;P<0.05)。

图4 RES添加对冷冻后孤雌激活囊胚凋亡相关基因表达量的影响Fig.4 Effects of RES addition on expression levels of apoptosis-related genes from vitrified parthenogenetic blastulas
3 讨论
众所周知,玻璃化冷冻会造成胚胎的冷冻损伤和发育能力下降。研究发现RES具有一定的抗冷冻损伤的作用,Comizzoli等[7]在猫的卵母细胞冷冻中发现未成熟卵母细胞经过RES处理后会显著提高冻后胚胎的发育能力和胚胎质量。Salzano等[8]在进行牛胚胎冷冻时发现培养过程中添加0.5μmol/L的RES能显著增加冻后胚胎的发育率和孵化率。RES的生物学作用具有剂量依赖效应,高浓度和低浓度RES往往具有相反的生物学效应[9-10]。Kwak等[11]在猪,Mukherjee等[12]在山羊和Abdel-Wahab等[6]在牛上的研究结果表明,RES的最佳工作浓度为2μmol/L。本研究结果与上述研究结果相似,在猪孤雌激活胚胎培养以及胚胎冷冻解冻后的孵育过程中添加2μmol/L RES,显著提高了囊胚腔恢复率及囊胚细胞数。本研究结果进一步说明了RES具有一定的抗冷冻损伤的能力。
线粒体是细胞的能量工厂,在胚胎发育过程中具有重要作用。线粒体膜电位是线粒体功能的一个重要指标。Dai等[13]在猪和Lei等[14]在鼠的卵母细胞冷冻时发现冷冻会造成线粒体膜电位下降。Sang等[15]在研究玉米烯酮诱导HEK293细胞毒性试验时发现RES预处理后细胞中线粒体的膜电位高于未处理的细胞。Takeo等[16]在牛卵母细胞培养过程中添加RES后检测线粒体膜电位,发现添加RES的卵母细胞线粒体膜电位显著增高。与上述结果相似,本研究在进行猪孤雌激活囊胚冷冻时发现,添加RES后冷冻胚胎的线粒体膜电位显著增高,由此推测,RES能抵抗冷冻造成的线粒体膜电位的下降。
多项研究证实,玻璃化冷冻是造成细胞凋亡的原因之一。Wu等[17]和Inaba等[18]分别在玻璃化冷冻猪孤雌激活早期胚胎和牛胚胎时发现,冷冻后其胚胎的细胞凋亡比例显著增高。RES是芳烃受体拮抗剂,研究发现在雄性动物中,RES能够对抗精子的DNA损伤和凋亡[19],在雌性哺乳动物中,RES能延缓卵巢退化、抑制原始卵泡分化和凋亡、维持规律性的发情周期,推迟更年期[20]。Giaretta等[21]在猪卵母细胞成熟培养以及冷冻解冻过程中添加RES,发现RES能调节卵母细胞的凋亡程序,提高抵抗冷冻损伤的能力。本研究发现冷冻可导致猪孤雌激活囊胚细胞凋亡比例的显著提高,RES的添加则可显著降低其凋亡水平,该结果与上述研究相一致。然而也有不一样的报道,Jeong等[22]在鼠的胚胎培养过程中添加0.5μmol/L的RES,发现RES会诱导2-细胞期胚胎的DNA损伤。不同的物种,不同的发育阶段和不同的RES添加浓度可能导致了该结果的发生。
细胞凋亡是由Caspase家族介导的级联反应共同完成的,当细胞发生凋亡时各种Caspase的活性会显著升高。在人卵母细胞慢速冷冻研究中发现,冻后卵母细胞的Pan-caspase水平显著升高[23]。在猪上,Vallorani等[24]利用Cryotop法对猪MII期卵母细胞进行玻璃化冷冻,结果冷冻后的卵母细胞Pan-caspase水平也显著提高。本试验与上述研究结果相似,冷冻解冻后囊胚的Pan-caspase水平显著升高,表明冷冻可引起细胞凋亡。但是RES冷冻组的Pan-caspase水平虽然高于新鲜囊胚,但与未添加RES的冷冻囊胚相比显著降低。由此推断,胚胎培养以及冷冻解冻过程中添加RES可以通过降低Caspase活性而影响冻后囊胚的凋亡水平。
SOD-1是铜锌超氧化物歧化酶,其表达在一定程度上反应了线粒体的功能,可清除因线粒体损伤而造成的氧化损伤,抑制线粒体途径介导的细胞凋亡。Caspase-9是线粒体凋亡途径的重要激发蛋白,Caspase-3是两者共同作用途径的执行蛋白。本研究发现添加RES后冷冻囊胚的SOD-1表达水平比未添加组的冷冻囊胚显著增高,而Caspase-3活性和Caspase-9表达水平显著降低。由此说明RES能通过抑制线粒体内源性凋亡途径而降低冷冻囊胚的细胞凋亡。
肿瘤坏死因子(TNF-α)是细胞凋亡死亡受体途径中重要的细胞因子而Caspase-8是死亡受体途径的重要激发蛋白。Etewa等[25]的研究表明,鼠血清中的TNF-α水平与细胞的凋亡程度相关。本研究发现冷冻后的猪孤雌激活囊胚TNF-α、Caspase-8基因的表达量比新鲜囊胚显著升高,这与Niu等[26]在猪卵母细胞上的研究结果相似。但在囊胚培养以及冷冻解冻过程中添加RES后TNF-α、Caspase-8基因的表达量会显著降低。由此推断,RES也能通过抑制死亡受体凋亡途径而降低冷冻囊胚的细胞凋亡。
众所周知,BCL-2是凋亡抑制基因,具有抗凋亡和促进细胞存活的能力。本研究发现冷冻后囊胚BCL-2表达量显著降低,这与之前在小鼠[27]和人类[28]胚胎中的研究结果相似,说明冻后囊胚的BCL-2抗凋亡能力显著下降。但是在添加RES的冷冻囊胚中其表达量比未添加RES的冷冻囊胚显著升高。由此推测,添加RES后能显著提高抗凋亡基因BCL-2的表达,抑制冷冻造成的囊胚细胞凋亡。
4 结论
在猪孤雌激活囊胚培养及冷冻解冻过程中添加2μmol/L的RES能显著提高胚胎发育能力,抵抗冷冻造成的胚胎线粒体损伤以及抑制冷冻造成的线粒体途径和死亡受体途径引起的细胞凋亡。
[1]RALLW F,FAHYGM.Ice-free cryopreservation ofmouse embryos at-196 degree by vitrication[J].Nature,1985,313(6003):573-575.
[2]FULDA S.Alternative cell death pathways and cellmetabolism[J/OL].International Journal of Cell Biology,2013,2013(8):463637[2016-09-01].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3564271/pdf/.DOI:10.1155/2013/463637.
[3]HOSSEINISM,FOROUZANFAR M,HAJIAN M,etal.Antioxidant supplementation of culturemedium during embryo development and/or after vitrication-warming;which is themost important?[J].Journal of Assisted Reproduction and Genetics,2009,26(6):355-364.
[4]DURANTHON V,WATSON A J,LONERGAN P.Preimplantation embryo programming:transcription,epigenetics,and culture environment[J].Reproduction,2008,135(2):141-150.
[5]WANG F,TIAN X,ZHANG L,et al.Benecial effect of resveratrol on bovine oocytematuration and subsequent embryonic developmentafter in vitro fertilization[J].Fertility and sterility,2014,101(2):577-586.
[6]ABDEL-WAHAB A M,ZULLO G,BOCCIA L,et al.132 Resveratrol during in vitro culture improves cryotolerance of in vitro produced bovine embryos[J].Reproduction,2013,25(1):213-214.
[7]COMIZZOLIP,WILDT D E,PUKAZHENTHIB S.In vitro compaction of germinal vesicle chromatin is benecial to survival of vitried cat oocytes[J].Reproduction in Domestic Animals,2009,44(Suppl.2):269-274.
[8]SALZANO A,ALBERO G,ZULLO G,et al.Effect of resveratrol supplementation during culture on the quality and cryotolerance of bovine in vitro produced embryos[J].Animal Reproduction Science,2014,151(3-4):91-96.
[9]SZENDE B,TYIH/K E,KIR/LY-V/GHELY Z.Dose-dependenteffect of resveratrol on proliferation and apoptosis in endothelial and tumor cell cultures[J].Experimental and Molecular Medicine,2000,32(2):88-92.
[10]KUWAJERWALA N,CIFUENTESE,GAUTAM S,et al.Resveratrol induces prostate cancer cell entry into s phase and inhibits DNA synthesis[J].Cancer Research,2002,62(9):2488-2492.
[11]KWAKA S S,CHEONGA S A,JEON Y,et al.The effects of resveratrol on porcine oocyte in vitro maturation and subsequent embryonic development after parthenogenetic activation and in vitro fertilization[J].Theriogenology,2012,78(1):86-101.
[12]MUKHERJEE A,MALIK H,SAHA A P,et al.Resveratrol treatment during goat oocytes maturation enhances developmental competence of parthenogenetic and hand-made cloned blastocysts bymodulating intracellular glutathione level and embryonic gene expression[J].Journal of Assisted Reproduction and Genetics,2014,31(2):229-239.
[13]DAIJ J,WU C F,MUNERICW,et al.Changes in mitochondrial function in porcine vitrified MII-stage oocytes and their impacts on apoptosis and developmental ability[J].Cryobiology,2015,71(2):291-298.
[14]LEIT,GUO N,TAN M H,et al.Effect of mouse oocyte vitrification on mitochondrial membrane potential and distribution[J].Journal of Huazhong University of Science and Technology(Medical Sciences),2014,34:99-102.
[15]SANG Y,LIW,ZHANG G.The protective effect of resveratrol against cytotoxicity induced by mycotoxin,zearalenone[J].Food&Function,2016,7(9):3703-3715.
[16]TAKEO S,SATO D,KIMURA K,et al.Resveratrol improves the mitochondrial function and fertilization outcome of bovine oocytes[J].The Journal of Reproduction and Development,2014,60(2):92-99.
[17]WU G Q,QUAN G B,SHAO Q Y,et al.Cryotop vitrication of porcine parthenogenetic embryos at the early developmental stages[J].Theriogenology,2016,85(3):434-440.
[18]INABA Y,MIYASHITA S,SOMFAIT,et al.Cryopreservationmethod affects DNA fragmentation introphectoderm and the speed of re-expansion in bovine blastocysts[J].Cryobiology,2016,72(2):86-92.
[19]REVEL A,RAANANIH,YOUNGLAIE,etal.Resveratrol,anatural aryl hydrocarbon receptor antagonist,protects sperm from DNA damage and apoptosis caused by benzo(a)pyrene[J].Reproductive Toxicology,2001,15(5):479-486.
[20]KONG X X,FU Y C,XU J J,et al.Resveratrol,an effective regulator of ovarian development and oocyte apoptosis[J].Journal of Endocrinological Investigation,2011,34(11):374-381.
[21]GIARETTA E,SPINACIM,BUCCID,et al.Effects of resveratrol on vitrified porcine oocytes[J].Oxidative Medicine and Cellular Longevity,2013,2013(7):920257.
[22]JEONG JK,KANG M H,GURUNATHAN S,et al.Pithrin-a ameliorates resveratrol-induced two-cell block in mouse preimplantation embryos in vitro[J].Theriogenology,2015,83(5):862-873.
[23]GUALTIERIR,IACCARINO M,MOLLO V,et al.Slow cooling of human oocytes:ultrastructural injuries and apoptotic status[J].Fertility and Sterility,2009,91(4):1023-1034.
[24]VALLORANIC,SPINACIM,BUCCID,et al.Pig oocyte vitrification by Cryotop method and the activation of the apoptotic cascade[J].Animal Reproduction Science,2012,135(1/2/3/4):68-74.
[25]ETEWA S E,ABDEL-AAL N F,ABDEL-RAHMAN S A,et al.Studies on the role of tumor necrosis factor-alpha(TNF-α)in hepatocytes induced apoptosis in vaccinated,Schistosomamansoni-challengedmice[J].Journal of the Egyptian Society of Parasitology,2015,45(1):47-60.
[26]NIU Y F,DAIJ J,CHEN Y N,et al.Positive effect of apoptotic inhibitor Z-VAD-FMK on vitrified-thawed porcine MII stage oocytes[J].Cryo Letters,2016,37(3):188-195.
[27]DHALIA,ANCHAMPARUTHY V M,BULTER SP,etal.Gene expression and developmentofmouse zygotes following dropletvitrification[J].Theriogenology,2007,68(9):1292-1298.
[28]BRENNER C A,EXLEY G E,ALIKANIM,et al.Apoptosis and human embryo survival[J].Fertility and Sterility,1997,68(Suppl.):86.
(责任编辑:程智强)
Effect of resveratrol on freezing tolerance of porcine parthenogenetic blastulas
CHEN Ya-ning1,2,3,WU Cai-feng2,3,ZHANG Shu-shan2,3,ZHANG De-fu2,3,DAIJian-jun2,3
(1College of Fisheries and Life Science,Shanghai Ocean University,Shanghai201306,China;2Animal Husbandry and Veterinary Research Institute,Shanghai Academy of Agricultural Sciences,Shanghai201106,China;3Division of Animal Genetic Engineering,Shanghai Key Laboratory of Agri-Genetics and Breeding,Shanghai201106,China)
In order to evaluate the freezing tolerance of porcine parthenogenetic blastulas as influenced by resveratrol(RES)treatment,2μmol/L RESwas added in the whole courses of oocyte in vitromaturation,freeze-thaw and embryo culture,and the mitochondrial membrane potentials of thawed porcine parthenogenetic blastulas,TUNEL apoptosis level,activities of several caspases,mRNA expression levels of genes related to apoptotic pathways and in vitro developmental capacity were investigated.The results showed that RES addition during in vitro maturation and embryo culture could significantly increase both cleavage and blastula rates(9518%vs.85.79%,51.85%vs.41.46%,P<0.05).RES addition significantly increased the freezing tolerance of porcine parthenogenetic blastulas,i.e.,the recovery rate of blastocoeles and the cell number of blastulas increased(35.09%vs.31.25%,37.95 vs.31.81,P<0.05),the mitochondrialmembrane potential improved(0.92 vs.0.46,P<0.05),the apoptosis rate decreased(8.24%vs.10.13%,P<0.05),thefluorescence intensities of Pan-caspase,Caspase-8,Caspase-9 and Caspase-3 and the expression levels of Caspase-8,Caspase-9 and TNF-αgenes decreased(P<0.05),and the expression level of Bcl-2 and SOD-1 genes increased(P<0.05).Compared with vitrified blastulas,the fresh blastulas were higher in the mitochondrialmembrane potentialand the expression levels of Bcl-2 and SOD-1 genes,and lower in the apoptosis rate and the fluorescence intensities of Pan-caspase,Caspase-3,Caspase-8,Caspase-9 as well as the expression levels of Caspase-8,Caspase-9,TNF-αgenes(P<0.05).Itwas concluded that RES addition could improve the mitochondrial function of vitrified porcine parthenogenetic blastulas,decrease their apoptosis level,and so enhance their freezing tolerance.
Pig;Parthenogenetic activation;Blastulas;Mitochondria;Apoptosis;Vitrification;Resveratrol
S828
:A
1000-3924(2017)02-096-08
10.15955j.issn1000-3924.2017.02.18
2016-11-02
国家自然科学基金(31372315);国家转基因生物新品种培育科技重大专项(2014ZX08006-005);上海市自然科学基金(15ZR1430100)
陈亚宁(1990—),男,在读硕士,主要从事动物胚胎工程研究。E-mail:chenyaning1102@hotmail.com
,张德福E-mail:zhangdefuzd f@163.com;戴建军E-mail:blackman0520@126.com

