BHK-21单细胞克隆敏感株筛选及日本脑炎病毒分离
向卫军,杨涛涛,李润成,余兴龙
(湖南农业大学动物医学院,湖南长沙 410128)
BHK-21单细胞克隆敏感株筛选及日本脑炎病毒分离
向卫军,杨涛涛,李润成,余兴龙*
(湖南农业大学动物医学院,湖南长沙 410128)
为筛选出日本脑炎病毒(JEV)敏感度高的BHK-21细胞株,采用终点稀释法从母代BHK-21混合细胞中分离单细胞克隆株,应用接种BHK-21克隆株方法,从JEV阳性蚊子样品研磨液中分离病毒,筛选出的3号单细胞克隆株经3次传代后细胞产生明显病变,分离到1株JEV,5号单克隆株培养物核酸检测呈阳性,但是不产生细胞病变,母代混合细胞没有病变,JEV核酸检测阴性。根据1、3型JEV的prM与E基因设计4对引物初步鉴定分离株基因型,鉴定分离株为1型JEV。综合以上结果,构建的BHK-21单细胞克隆株比BHK-21混合细胞对分离JEV株敏感,更适合JEV的分离与培养。
BHK-21单克隆细胞株;病毒分离鉴定;1、3型JEV分型引物
日本脑炎(Janpanses encephalitis)是由黄病毒科(Flaviridae)黄病毒属(Flavivirus)的日本脑炎病毒(Janpanese encephalitis virus)JEV引起的一种重要的蚊媒性人兽共患传染病[1]。日本脑炎以三带喙库蚊为主要传播媒介,属于自然疫源性疾病。猪日本脑炎与人日本脑炎密切相关,猪是日本脑炎病毒的重要贮存宿主与增殖宿主,也是日本脑炎的主要传染源,蝙蝠、水鸟和蚊虫是该病毒的主要携带者,动物被蚊虫叮咬后,JEV可在人群和猪群之间形成“蚊-猪-蚊-易感人群”的循环传播[2-3]。控制猪日本脑炎不仅对生猪养殖业而且对人类的健康具有重要的意义。
细胞培养是病毒学研究的基础,JEV能感染多种细胞,能在多种组织培养细胞内增殖,如C6/36、BHK-21和Vero等传代细胞,并产生细胞病变(cytopathic effect,CPF)反应[4]。BHK-21广泛应用于日本脑炎病毒、口蹄疫病毒等的疫苗生产基质,新型微载体培养系统中成功实现了BHK-21细胞的高密度培养,为病毒疫苗培养提供高效方法[5]。目前实验室从病料中分离JEV主要应用BHK-21细胞。据研究报告,全血中黄病毒在56℃置放30 min病毒就会失活[6],研究发现当死于感染JEV蚊子在一定湿度、温度为28℃~32℃条件下,病毒在24 h之内失活,这表明JEV在活的宿主外迅速失活,同时也可得知JEV在自然环境抗逆性较差,容易失活,所以临床采集的样本保存与运送应当考虑温度条件[7]。病毒分离对样本要求较高,样本的质量对分离率有较大影响,从而需要敏感的细胞株来分离JEV。本试验发现同一份JEV阳性蚊子滤液样本接种于BHK-21母代细胞及其单克隆细胞,出现不同的结果,接种JEV阳性蚊子滤液后3号单细胞克隆株经3次传代后获得1株JEV,5号单克隆株培养物核酸检测呈阳性但不产生细胞病变,而母代混合细胞没有病变且JEV核酸检测阴性,现报告如下。
1 材料与方法
1.1 材料
1.1.1 样本采集与保存 2015年4月至8月期间,在湖南岳阳3个种猪场采集不同猪舍蚊子。晚20:00至22:00,用诱蚊器捕获蚊子,栏舍内挂3个诱蚊器,捕获的蚊虫经-20℃冻死,进行计数、分装入离心管中(约100只/管),标号登记,用于日本脑炎病毒的分离鉴定。样品先在-20℃保存,然后运送到实验室置-80℃保存。
1.1.2 细胞和试剂 仓鼠肾细胞(BHK-21)由本实验室保存;细胞培养板为Corning公司产品;DMEM培养基(含4 500 mg/L葡萄糖,含4.00 mmol/L谷氨酰胺,含丙酮酸钠)为HyClone公司产品;新生犊牛血清、5 mL/L的Trypsin-EDTA均为Gibco公司产品;配制双抗用青霉素钠(80万单位)为哈药集团制药总厂产品;配制双抗用硫酸链霉素(100万单位)为瑞阳制药有限公司产品;柱式病毒RNAout试剂盒、即用型PCR试剂盒均为北京天恩泽基因科技有限公司产品;DL5000、Super DNA Marker为康为世纪公司产品。
1.2 方法
1.2.1 蚊子样品处理 将不同猪舍采集的蚊子样品分别分装到2 mL离心管中,然后加入含双抗的DMEM培养基后组织匀浆机研磨2 min,于4℃条件下12 000 r/min离心5 min后,将上清取出更换置于另一离心管,然后4℃条件下12 000 r/min再次离心20 min,继而将上清用0.22 μm滤膜过滤,取200 μL滤液用于提取RNA,其余滤液于-80℃保存。
1.2.2 RNA提取及cDNA合成 参照天恩泽基因柱式病毒RNAout试剂盒说明书提取蚊子样品滤液的RNA,并按Thermo逆转录试剂盒说明书合成cDNA,PCR反应程序为:25℃ 20 min;42℃ 45 min;72℃ 5 min;10℃结束反应。反转录完毕后将cDNA放入-20℃保存。
1.2.3 PCR鉴定 采用天恩泽基因即用型PCR试剂盒配制体系并扩增。根据JEV UTR3′设计引物,上游引物:5′-AAGCCCTCAG AACCGTCTCG-3′;下游引物:5′-CTCCTCTAACCTCTAGTCCTTC-3′。PCR反应程序:94℃ 5 min; 94℃ 30 s,59℃ 30 s,72℃ 20 s,扩增35个循环;最后72℃延伸7 min。取5 μL PCR产物在8 g/L琼脂糖凝胶进行电泳鉴定。1.2.4 BHK-21单克隆细胞制备 将生长状态良好的单层BHK-21细胞按照终点稀释法制备单克隆细胞,即将处于旺盛生长期的单层细胞培养物用胰酶消化下来后,并用细胞计数仪对消化的细胞进行细胞计数;应用“条件化”了的营养液作高倍(从10-1~10-7左右)稀释,然后根据细胞计数的结果从计数结果为10个细胞/mL~100个细胞/mL的稀释度开始分别接种于96孔细胞培养板,每个稀释度接种96个孔;从培养48 h~72 h后开始,逐日在倒置显微镜下观察;取最高稀释度有细胞增殖的孔,用胰酶消化并扩增培养后,继续按上述方法重复克隆,至少2次以上,即可获得克隆细胞株。
1.2.5 病毒分离及鉴定 将PCR鉴定为JEV阳性的样品滤液按1/10、1/100和1/1 000稀释接种到BHK细胞及BHK单克隆细胞,24孔板接种100 μL /孔,37℃感作1 h,不弃掉病毒液,加入0.4 mL维持液培养,每日观察细胞是否出现CPE,培养96 h后收获并将细胞培养物冻融1次,然后继续盲传至第3代。
将JEV阳性样品滤液第3代细胞培养物提取RNA进行RT-PCR扩增,用JEV检测通用引物及JEV基因分型引物进行鉴定。JEV基因分型引物信息见表1。
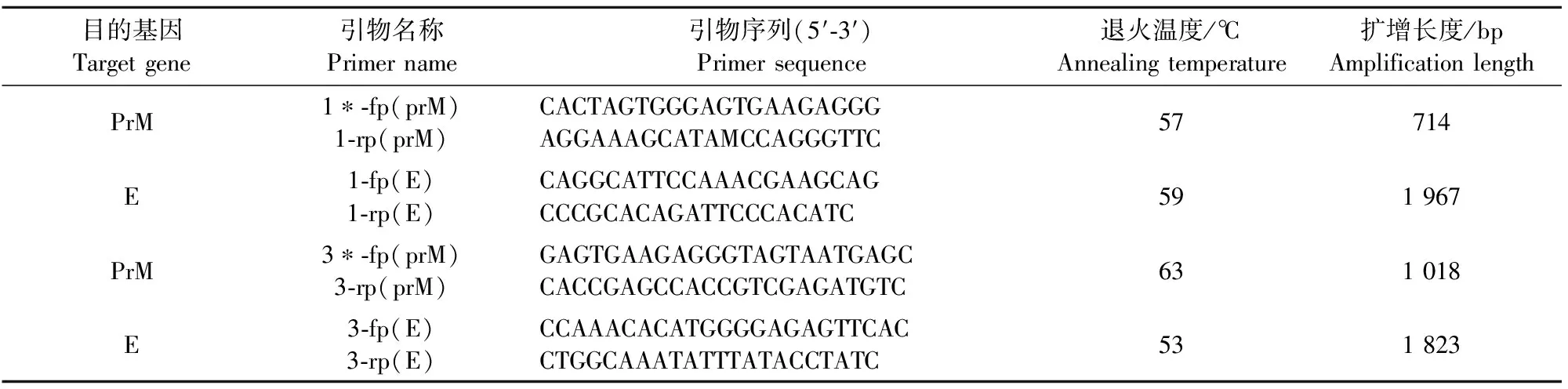
表1 JEV基因分型引物信息
注:*表示JEV基因型。
Note:*JEV genotype.
2 结果
2.1 蚊子样本中JEV阳性样本PCR鉴定
共对43份蚊子样本进行了JEV鉴定,JEV阳性样本共18份,阳性率为41.8%,选取其中3份阳性样本接种BHK-21细胞及BHK-21单克隆细胞进行JEV分离。
2.2 BHK单克隆细胞制备
共获得5株BHK-21单克隆细胞,分别命名为BHK-1,BHK-2,BHK-3,BHK-4和BHK-5(图1)。
2.3 JEV分离
BHK-3单克隆细胞接种JEV 2号阳性样本后第3代细胞培养物(3个稀释度)在72 h出现明显的CPE(图2),另外,第3代BHK-5细胞培养物也可检测到JEV,但CPE不明显。第3代BHK-21母代细胞无CPE没有检测到JEV。
2.4 JEV鉴定
用1型和3型JEV的分型引物对该分离株进行JEV基因型鉴定(图3~图5),1型prM基因引物扩增出714 bp大小的目的条带;1型E基因引物扩增出1 967 bp大小的目的条带,结果显示该JEV分离株属于JEV基因1型。

A.BHK-1; B.BHK-2; C.BHK-3; D.BHK-4; E.BHK-5

A.病变的BHK-3细胞; B.正常的BHK-3细胞

1.阴性对照; 2.BHK; 3.BHK-1; 4.BHK-2; 5.BHK-3; 6.BHK-4;7.BHK-5; 8.阳性对照; M.DNA标准DL 5 000
3 讨论
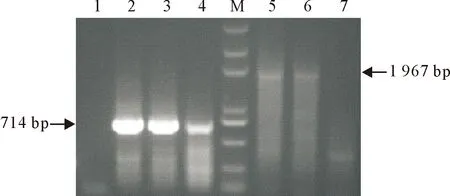
1.阴性对照;2.BHK-3(prM);3.BHK-5(Prm);4.SA14-14-2(prM);M.DNA Marker DL 5 000;5.BHK-3(E);6.BHK-5(E);7.SA14-14-2(E)
1.BHK-3(E);2.BHK-3(E);3.SA14-14-2(E);M.DNA Marker DL 5 000;4.阴性对照;5.BHK-3(prM);6.BHK-5(prM);7.SA14-14-2(prM)
从湖南岳阳地区3个种猪场采集约4 300只蚊虫样本,用JEV阳性样本接种于BHK-21单克隆细胞方法分离到一株JEV,同时也筛选出了适合JEV 分离株培养的克隆细胞,根据1、3型JEV其prM与E基因设计4对引物鉴定分离株为JEV基因1型。根据国外研究报告,流行性感冒病毒在同种绿猴肾细胞(Vero)表面存在的受体的类型和数量不同,通过将Vero细胞连续传代20代后获得适应于流感病毒培养的高产量Vero细胞株[8],研究发现病毒与细胞表面受体结合是其实施感染的重要一步,同时影响细胞中病毒增殖效率,提高细胞表面病毒受体水平,可提高细胞中病毒增殖效率[9-10]。先培养包含对PCV2感染易感性不同的细胞的异质细胞群,再将PK-15混合细胞消化后稀释于96孔细胞培养板中每孔1个细胞,获得高度允许PCV2感染的连续细胞系[11]。本试验通过构建BHK单克隆细胞分离到1株JEV,而母代BHK细胞未分离到,将分离JEV重新接种母代BHK细胞也未能培养,说明构建的BHK单克隆细胞与母代BHK混合细胞存在着某些方面的差异,病毒侵入细胞的关键的第一步是与细胞表面的受体结合,不同的病毒侵入细胞所结合的受体不尽相同,研究发现JEV的受体是一种分子质量(Mr)约为90 ku的热休克蛋白90β,利用兔抗人HSP90β单克隆抗体进行免疫印迹与ELISA试验,证明在细胞膜中HSP90β可与JEV特异性结合, HSP90β是HeLa细胞膜JEV受体候选分子[12],与日本脑炎病毒同科病毒在人单核巨噬细胞(mononuclear phagocyte)及人神经母细胞瘤细胞(SH-SY5Y)的受体是HSP90和HSP70结合物[13]。通过此次试验可以看出,不同的BHK细胞对JEV的敏感性不同,这可能与BHK细胞上存在的与JEV结合受体的有无和多少有关,这有待进一步研究。
目前JEV的基因型鉴定有两种方法,第一种是Chen W R等[14]建立的基于prM 基因(456-695)的240个核苷酸序列进行基因分型,第二种方法由Paranjpe S等[15]基于E基因全序列分型,前者只能将JEV 分成4个基因型,而依据E基因全序列可将JEV分成5个基因型,在本试验中依据1、3型JEV 其prM和E基因设计4对引物鉴定JEV分离株基因型。 综上所述,本试验筛选的BHK-21单克隆细胞株表现出对JEV比母代混合细胞要高的敏感性,获得JEV新分离株适应性细胞单克隆,同时设计JEV 1与3基因型鉴定引物,初步鉴定JEV新分离株为1型日本脑炎病毒。
[1] 殷 震,刘景华.动物病毒学 [M].北京:科学出版社,1997:631-640.
[2] 张海林,张云智,黄文丽,等.蝙蝠作为流行性日本脑炎病毒宿主的研究 [J].动物医学进展,2002,23(5):58-61.
[3] Unni S K,Ruzek D,Chhatbar C,et al.Japanese encephalitis virus:from genome to infectome[J].Microbes Infect,2011,13:312-321.
[4] Tajima S,Kotaki A,Yagasaki K,et al.Identification and amplification of Japanese encephalitis virus and Getah virus propagated from a single porcine serum sample:a case of coinfection[J].Arch Virol,2014,159(11):2969-2975.
[5] 王进产,焦金波,孙进忠,等.新型微载体培养系统中BHK-21细胞的生长特性研究 [J].动物医学进展,2013,34(3):32-36.
[6] Jeffrey J.猪病学[M].北京:中国农业出社,2014:549-559.
[7] Jonhanson C A,Hall R A,Van den Hurk A F,et al.Detection and stability of Japanese encephalitis virus RNA and virus viability in dead infected mosquitoes under different storage conditions.[J]AM J Trop Med Hyg,2002,67:656-661.
[8] Hu W,Zhang H,Han Q,et al.A Vero-cell-adapted vaccine donor strain of influenza A virus generated by serial passages[J].Vaccine,2015,33(2):374-381.
[9] Abdoli A,Soleimanjahi H,Jamali A,et al.Comparison between MDCK and MDCK-SIAT1 cell lines as preferred host for cell culture-based influenza vaccine production[J].Biotechnol Lett,2016,38(6):941-948.
[10] Hatakeyama S,Sakai Tagawa Y,Kiso M,et al.Enhanced expression of an α 2,6- linked sialic acid on MDCK cells improves isolation of human influenza viruses and evaluation of their sensitivity to a neuraminidase inhibitor[J].J Clin Microbiol,2005,43 (8):4139- 4146.
[11] Chen H C,Kuo T Y,Yang Y C,et al.Highly permissive subclone of the porcine kidney cell line for porcine circovirus type 2 production[J].J Virol Meth,2013,187(2):380-383.
[12] 王 媛,时 莹,丁天兵,等.HeLa细胞膜上日本脑炎病毒受体候选分子的初步鉴定[J].热带医学杂志,2016(1):18-21
[13] Huerta V,Toledo P,Fleitas N,et al.Receptor-activated human α 2-macroglobulin interacts with the envelope protein of dengue virus and protects virions from temperature-induced inactivation through multivalent binding.[J].J Gen Virol,2014,95(Pt12):2668-2676.
[14] Chen W R.Genetic variation of Japanese encephalitis virus in nature[J].J Gen Virol,1990,71(12):2915-2922.
[15] Paranjpe S,Banerjee K.Phylogenetic analysis of the envelope gene of Japanese encephalitis virus[J].Virus Res,1996,42(1/ 2):107-117.
Screening of BHK-21 Monoclonal Cell Sensitive Strain and Isolation of Japanese Encephalitis Virus
XIANG Wei-jun,YANG Tao-tao,LI Run-cheng,YU Xing-long
(CollegeofVeterinaryMedicine,HunanAgricultureUniversity,Changsha,Hunan,410128,China)
To screen single clone cell line for cultivation of JEV with high sensitivity,dilution method was used to isolate single clone line from BHK-21 heterogeneous cells.The obtainted single cell clones were subjected to JEV positive mosquito sample.The screened No.3 monoclonal cell line,1 strain of JEV was obtained after 3 passages.The No.5 monoclonal strain cultured in nucleic acid testing was positive,but didn’t produce cytopathic effect.The heterogeneous cells showed no CPE and nucleic acid test was negative.According to the type 1,3 JEV prM and E genes,four pairs of primers were designed to identify the isolated strains,and the isolates were identified as type 1 JEV.These results suggested the BHK-21 monoclonal cell line is more suitable to cultivate JEV compared to BHK-21 heterogeneous cells.
BHK-21 monoclonal cell; isolation and identification; type 1,3 JEV genotyping primer
2016-10-09
湖南省科技厅重点课题(2012NK2001)
向卫军(1983-),男,湖南邵阳人,博士研究生,主要从事动物疾病发病机理及防控研究。*通讯作者
S852.65
A
1007-5038(2017)05-0022-04

