沙利度胺联合华蟾素治疗肝癌恶病质的临床研究
谢明智,李 崇,刀凤亭,陈晓菊(广西医科大学附属肿瘤医院综合内科,广西医科大学,广西南宁5300)
·临床与转化医学·
沙利度胺联合华蟾素治疗肝癌恶病质的临床研究
谢明智1,李 崇2,刀凤亭2,陈晓菊2(1广西医科大学附属肿瘤医院综合内科,2广西医科大学,广西南宁530021)
目的:探讨沙利度胺联合华蟾素治疗肝癌恶病质的临床价值.方法:筛选47例确诊肝癌恶病质患者,随机分为试验组及对照组.试验组给予沙利度胺150 mg/d+华蟾素胶囊2700 mg/d,对照组给予华蟾素胶囊2700 mg/d.观察两组患者营养状况、生活质量、生存期及副反应情况.结果:12周后华蟾素联合沙利度胺(试验组)可显著改善肝癌恶病质患者生活质量及生存期,且优于对照组,副反应发生率比对照组低,耐受性好.结论:沙利度胺联合华蟾素对抑制肝癌恶病质患者的营养状况、生活质量均有明显改善,优于单用华蟾素,且耐受性好,具有较高的临床价值.
沙利度胺;华蟾素;肝癌恶病质
0 引言
癌症恶病质(Cancer anorexia⁃cachexia syndrome,CACS)是一种持续的骨骼肌肉质量损失(伴或不伴脂肪的损失),不能采用常规营养支持完全逆转,并导致渐进性功能障碍的多因素综合征.在肿瘤的终末期有50%~80%患者出现进行性消瘦、乏力、食欲不振、全身脏器不同程度损害等恶病质表现,严重影响其生活质量,缩短生存期,而且影响治疗方案的实施,降低化疗敏感性[1-2].
CACS的发病机制非常复杂,目前已经针对癌症恶病质进行了大量的基础研究,指出可能是一种慢性的、低级别的、肿瘤激活的自身免疫反应,而且目前有大量研究证实一些炎性细胞因子的过表达,如肿瘤坏死因子α(TNF⁃α),IL⁃1,IL⁃6等可能与癌症恶病质的进展有关[3],抑制这些细胞因子合成和活性的治疗对改善CACS有效[4].
恶病质的治疗旨在改善体力活动能力及提高健康相关的生活质量.而这一目标的实现与逆转或稳定肌肉流失,改善肌肉质量和功能息息相关.目前临床上对恶病质的治疗主要分为最佳营养支持治疗及药物治疗.许多药物例如皮质醇激素、非甾体抗炎药、细胞因子拮抗剂等治疗癌症恶病质被证明是有效的[5],然而,因为药物副反应或者难以解决的恶病质耐受性,目前仍未有明确的癌症恶病质的药物治疗指南[6].
沙立度胺起初作为一种口服的镇静和抗炎症药物,后来因为其公认的致畸作用而不再使用.但目前沙利度胺正在被广泛研究用于晚期癌症以及多种自身免疫性疾病的治疗[7-9].研究表明,沙利度胺可能是唯一可以减少CACS患者体质量降低和增加无脂肪体质量的药物.沙利度胺可能通过以下免疫调节机制达到其抗肿瘤作用:①通过减少细胞间黏附分子和血管细胞黏附分子与基质细胞结合,从而抑制IL⁃6、TNF⁃α等致炎因子的释放;②通过抑制B细胞生成VEGF、bFGF等因子,从而减少血管新生;③通过对单核细胞、CD8等T细胞刺激,上调了IL⁃2和IFN,从而激活NK细胞释放细胞毒介质,诱导肿瘤细胞凋亡[10-11].
华蟾素(cinobufagin)为蟾蜍科动物中华大蟾蜍(bufobufo gargarizans cantor)或黑眶蟾蜍(bufo mela⁃nostietus Schneider)等的全皮提取制剂,具有清热解毒、利水消肿、软坚散结等作用[12].研究表明,华蟾素可能通过影响癌基因表达、诱导肿瘤细胞凋亡、抑制新生血管生成、提高机体免疫力等方面起到抗肿瘤作用[13].目前华蟾素制剂在临床上被广泛用于治疗晚期恶性肿瘤并取得较好疗效[14-15],但国内外鲜有华蟾素联合沙利度胺治疗癌症恶病质的报道.本研究联合沙利度胺及华蟾素治疗肝癌恶病质,观察患者治疗后营养状况、生活质量及药物副反应,以探讨其临床应用价值.
1 资料和方法
1.1 一般资料对广西壮族自治区肿瘤医院2014-06/2015-06收治的68例原发性肝癌患者进行筛选,共有47例患者入组,其中男34例,女13例,研究过程符合医学伦理学原则和赫尔辛基宣言,并取得患者知情同意.
1.1.1 入选标准:符合下列所有条件的患者入选试验 ①年龄>18岁,经广西壮族自治区肿瘤医院病理确诊根据原发性肝癌诊疗规范(2011年版)临床确诊为原发性肝癌;因经济或其他原因放弃化疗、靶向等治疗,并签署知情同意书的患者;②符合癌症恶病质定义患者:6个月内体质量下降>5%或BMI<20 kg/m2者出现体质量下降>2%,或四肢骨骼肌指数与少肌症相符(男性<7.26 kg/m2,女性<5.45 kg/m2)者出现体质量下降>2%.选取3个月内体质量下降5%~10%患者纳入本研究[14];③功能状态评分(performance status,PS)为2~3分;④能提供基本营养支持:根据患者体质量,每日生理需要量为1600~1800 Kcal[10,15],根据生理需要量及饮食习惯,指导患者根据食物分配每日糖、蛋白质、脂肪摄入量,若患者有厌食,适当加用肠内营养剂;⑤能自主完成EORTC QLQ⁃C30量表测试;⑥未行其他任何抗肿瘤治疗.
1.1.2 排除标准 符合下列所有条件之一的患者不可入选该试验:①生育年龄妇女;②存在深静脉血栓;③无法保证基本的营养支持;④无法完成EORTC QLQ⁃C30量表测试.
1.1.3 退出标准 出现深静脉血栓或者其他无法耐受的并发症.
1.2 干预方案所有入选患者随机分为试验组(n= 23)与对照组(n=24),试验组给予华蟾素胶囊(山东鑫齐药业有限公司国药准字Z20090944)900 mg tid/d,联合沙利度胺(常州制药厂有限公司国药准字H32026130)150 mg/d,对照组给予华蟾素胶囊900 mg tid/d.
1.3 观察指标治疗前、治疗后4周、治疗后12周测量以下参数:①营养状况;②上臂中部周径(mid⁃upper arm circumference,MUAC):采用软尺测量右上臂中部周径;③体质量:采用磅秤(江苏苏宏医疗器械有限公司)测量称测量体质量;④血浆白蛋白:采用日立7600全自动生化仪测量;⑤生活质量:测量采用EORTC QLQ⁃C30量表;⑥不良反应:评估按照NCI⁃CTC4.0;⑦平均生存时间及生存率:由第1个患者用药开始随访,电话随访患者健康或生存状况,观察终点6个月,统计患者平均生存时间,使用KM法绘制生存曲线分析两组患者至终点时间总体生存率患者生存率.
1.4 统计学方法使用SPSS17.0统计学软件进行数据分析.数据以表示,计数资料用χ2检验,计量资料采用t检验,各组生存率比较使用Log Rank法进行检验.P<0.05表示差异具有统计学意义.
2 结果
共筛选出47例患者随机进入试验组、对照组,3个月后试验组6例患者死亡,对照组7例患者死亡,最后可评估患者34例,试验组17例,对照组17例.两组患者均为正常发育的成年人,其年龄、性别、基础体质量、上臂中部周径、血浆白蛋白、握力及EORTC QLQ⁃C30评分等经统计学分析比较,差异无统计学意义(P>0.05,表1).

表1 实验组与对照组患者基线比较
2.1 治疗指标
2.1.1 治疗前后效果比较 4周末时试验组以及对照组较基线指标比较,差异无统计学意义(P>0.05).12周末时试验组以下指标显著改善:血浆白蛋白(P=0.019)、EORTC QLQ⁃C30评分(P=0.018);体质量、MUAC虽较前有增加,但差异无统计学意义(P>0.05).对照组所有治疗指标较前差异无统计学意义(P>0.05,表2).
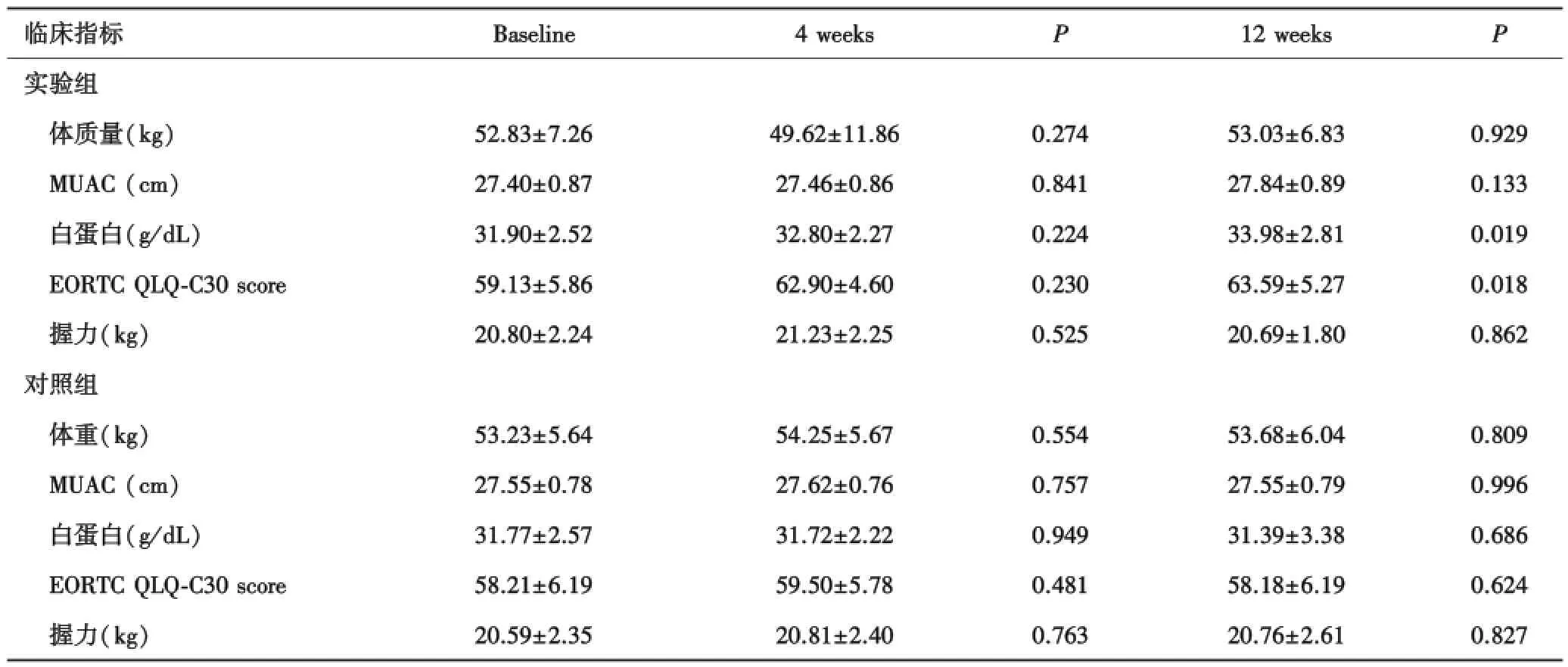
表2 实验组与对照组4周及12周治疗前后效果比较
2.1.2 组间比较 4周末时试验组治疗前后试验组、对照组比较,差异无统计学意义(P>0.05).12周末时试验组治疗前后以下指标平均变化显著大于对照组:体质量(P=0.002),MUAC(P=0.014),血浆白蛋白(P=0.002)、EORTC QLQ⁃C30评分(P<0.004)、握力增加实验组较对照组大,但差异无统计学意义(P=0.403,表3).
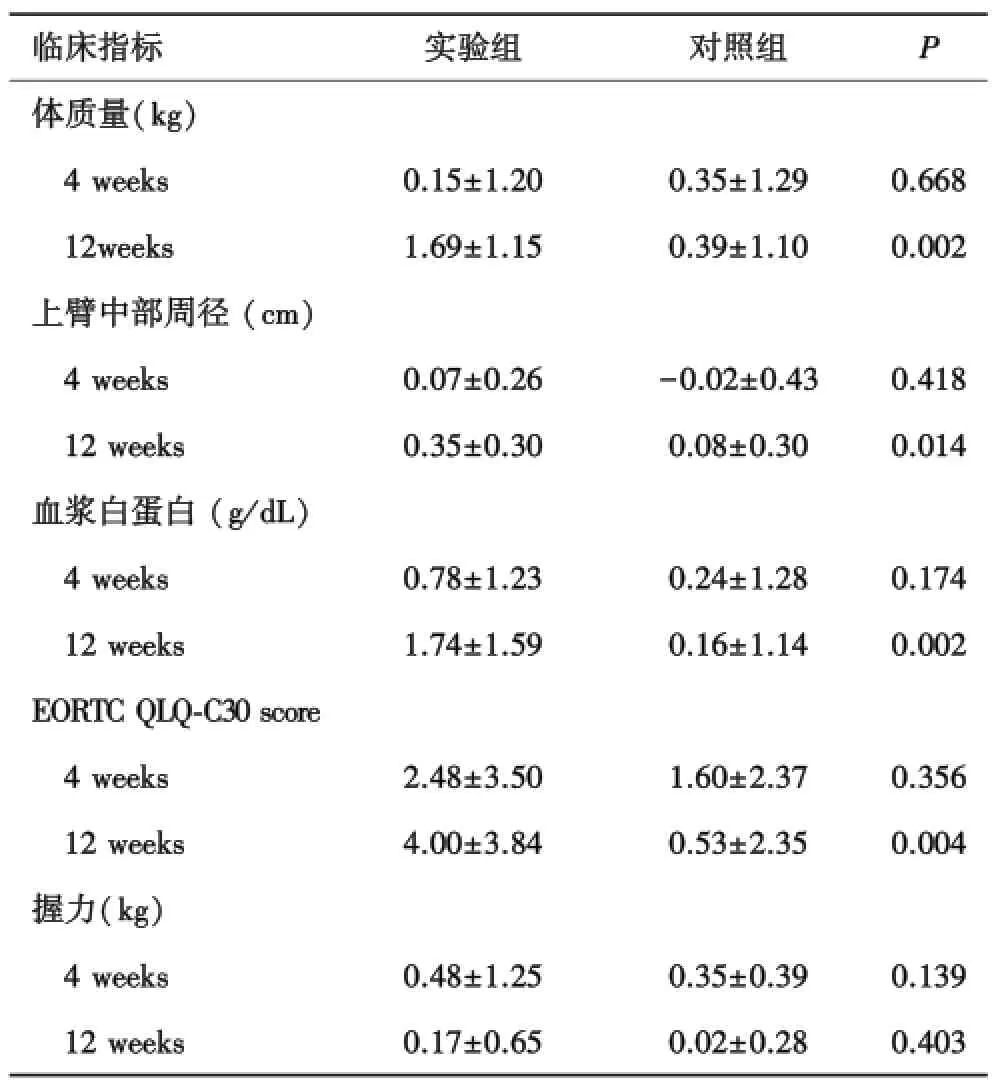
表3 实验组与对照组4周及12周组间比较
2.2 生存率Kaplan⁃Meier法绘制生存曲线,Log⁃Rank统计分析实验组及对照组的生存率.经统计,至观察终点,试验组及对照组的平均生存期分别为137.09±10.17 d及104.29±10.11 d,试验组及对照组的6个月整体生存率分别为30.4%及16.7%,差异具有统计学意义(P=0.041,图1).
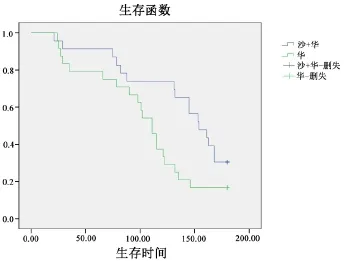
图1 Kaplan⁃Meier法绘制生存曲线,Log⁃Rank检验分析实验组及对照组的整体生存率.经统计,实验组整体生存率显著高于对照组(P<0.05).
2.3 副反应试验组最常见不良反应为恶心、呕吐(8.7%),总不良反应为17.4%,对照组最常见不良反应为恶心呕吐(16.7%),总不良反应为33.3%,多为Ⅰ~Ⅱ级,患者可耐受(表4).
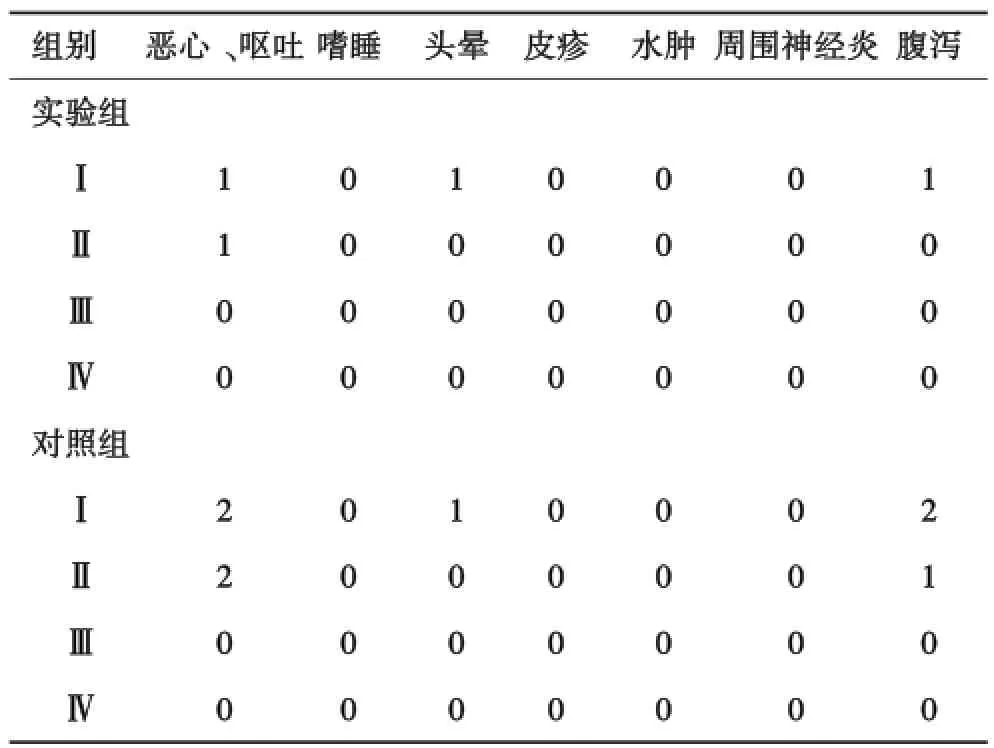
表4 实验组和对照组副反应比较
3 讨论
CACS的治疗一直是临床工作中的重点难点,尽管目前CACS的临床及基础研究均有一定的进展,但仍无确切的治疗指南.部分患者因医疗资源紧缺及经济条件制约等,无法行手术、放化疗等根治性治疗,因此本研究重点在于寻找一种价格低廉、具有良好费用/效益比的方案,延长癌症恶病质患者生存时间及提高其生活质量.目前许多药物如BMS⁃945429(IL⁃6抗体)、Enobosarm(选择性雄激素受体调节剂)、盐酸阿莫西林等被尝试用于治疗癌症恶病质患者[6,16],但鲜有沙利度胺联合华蟾素治疗原发性肝癌恶病质患者的报导.沙利度胺及华蟾素均有抗肿瘤作用,两者均为口服制剂,属医保用药,价格低廉,使用方便,在临床上应用广泛,其抑制肿瘤坏死因子α(TNF⁃α)、IL⁃6等细胞因子的活性已经被证实[17-19].研究表明,抑制这些细胞因子合成和活性的治疗对改善CACS是有效的.因此,我们应用沙利度胺联合华蟾素治疗非小细胞肺癌恶病质,观察患者营养状况、生活质量及6个月生存率的变化.
本研究试验组采用沙利度胺联合华蟾素胶囊治疗癌症恶病质,4周末时试验组治疗前后试验组与对照组比较,差异无统计学意义(P>0.05).12周后对照组营养状况指标较前变化比较,差异无统计学意义(P>0.05).试验组营养状况指标(体质量、MUAC)保持稳定,差异无统计学意义(P>0.05),但血浆白蛋白较前增加,差异有统计学意义(P<0.05).组间指标变化试验组比对照组明显提高,差异有统计学意义(P<0.05).结果表明,沙利度胺联合华蟾素胶囊可能可以改善患者营养状况,且疗效优于华蟾素单药治疗.本研究采用握力了解患者肌肉功能改善情况,试验组及对照组4周及12周握力较前变化比较,差异无统计学意义(P>0.05).组间比较,实验组较对照组明显增加,但差异无统计学意义(P>0.05).从表2及表3可以看出,试验组体质量、MUCA、握力等指标能够保持稳定或较前有所增加,虽然差异无统计学意义,但并未因恶病质引起营养状况进一步下降,且有改善趋势,相对于对照组华蟾素单药,差异有统计学意义,可能由于样本量太少或者12周时间过短,有待进一步试验验证.本研究采用EORTC QLQ⁃C30量表评分,从电话随访得出,试验组能显著改善大多数患者乏力、睡眠欠佳、恶心呕吐等情况,试验组EORTC QLQ⁃C30量表评分较前提高,差异有统计学意义(P<0.05).组间比较,试验组优于对照组,差异有统计学意义(P<0.05).本研究中,沙利度胺联合华蟾素胶囊出现副反应轻微,常见副反应为恶心(8.7%),多为I II级,多能耐受,未有患者因副反应退出试验,而华蟾素胶囊单药治疗最常见不良反应为恶心,发生率为16.7%,由此得出,华蟾素联合沙利度胺较之单药应用华蟾素胶囊患者耐受性好.至观察终点试验组及对照组平均生存期分别为137.09±10.17 d及1104.29±10.11 d,试验组及对照组的6个月生存率分别30.4%及16.7%,差异有统计学意义(P<0.05).沙利度胺联合华蟾素较华蟾素单药能延长平均生存时间及提高生存率.
目前对沙利度胺用量均未有明确指南,对临床上沙利度胺研究用量多为50 mg~200 mg[17],Davis等[20]的研究指出,50 mg沙利度胺即可出现副反应,但增加药物剂量至100 mg副反应并未见明显增加.本研究用沙利度胺150 mg/d是基于作者临床观察,大于150 mg部分患者出现恶心、嗜睡症状的发生率明显增加,而150 mg大部分患者可耐受,试验组和对照组均未出现嗜睡现象.目前许多研究已经使用瘦体质量作为治疗的观察指标[19,21],瘦体质量需依赖器械测量(CT).本研究的局限在于大多数患者因经济以及器械等原因无法测量瘦体质量及行肿瘤疗效评价,而体质量因恶病质出现腹水、胸水等影响测量的准确性,所以我们采用测量上臂中部周径为另一个营养状况的有效性指标.多数研究报道沙利度胺及华蟾素均可通过下调IL⁃6、TNF⁃α等炎性细胞因子起到免疫调节作用,本研究由于患者特殊性,未能行分子指标的监测,但Coronha等[22]的研究指出,体质量及生活质量可影响患者预后.体质量、乏力和生活质量可以作为CACS研究的主要指标,所以本实验选取营养状况、生活质量及生存率等作为疗效指标.
目前晚期原发性肝癌的治疗主要为奥沙利铂为基础的化疗及索拉菲尼靶向治疗,其疗效确切,但化疗药物副作用大,而索拉菲尼费用昂贵,部分癌症恶病质患者行化疗风险高,且晚期肝癌患者体力评分差,按原发性肝癌巴塞罗那分期,ps评分>2分,肝功能差的患者,不建议化疗及靶向药物治疗,多以姑息治疗为主,即在提高患者生活质量的基础上尽可能地延长患者生活质量.本研究采用沙利度胺+华蟾素口服治疗肿瘤恶病质,结果表明治疗能改善患者营养状况及生活质量,且为口服制剂,费用低廉,在大多数患者承受范围.可扩大样本进行进一步实验探究:①联合化疗或靶向药物治疗可否进一步延长患者生存时间及生存率;②能否减轻化疗或者靶向药物治疗副作用;③不同癌症是否疗效一样,何种癌症类型疗效最好.
综上所述,本研究采用的华蟾素联合沙利度胺治疗CACS能较好地改善患者营养状况及生活质量,价格低廉、安全有效,且患者耐受性好,有较好的临床应用价值.
[1]Tazi E,Errihani H.Treatment of cachexia in oncology[J].Indian J Palliat Care,2010,16(3):129-137.
[2]吴国豪.恶性肿瘤病人恶病质发生机制及营养治疗[J].外科理论与实践,2012,17(2):98-101.
[3]Kim HJ,Kim HJ,Yun J,et al.Pathophysiological role of hormones and cytokines in cancer cachexia[J].J Korean Med Sci,2012,27(2):128-134.
[4]Argiles JM,Lopez⁃Soriano FJ,Busquets S.Counteracting inflamma⁃tion:a promising therapy in cachexia[J].Crit Rev Oncog,2012,17(3):253-262.
[5]Schmitz G,Ecker J.The opposing effects of n⁃3 and n⁃6 fatty acids[J].Prog Lipid Res,2008,47(2):147-155.
[6]Fearon K,Arends J,Baracos V.Understanding the mechanisms and treatment options in cancer cachexia[J].Nat Rev Clin Oncol,2013,10(2):90-99.
[7]Cao C,Liu T,Zhu H,et al.Bortezomib⁃contained chemotherapy and thalidomide combined with CHOP(Cyclophosphamide,Doxorubicin,Vincristine,and Prednisone)play promising roles in plasmablastic lymphoma:a case report and literature review[J].Clin Lymphoma Myeloma Leuk,2014,14(5):e145-e150.
[8]Scribano ML,Cantoro L,Marrollo M,et al.Mucosal healing with thalidomide inrefractoryCrohn'sdiseasepatientsintolerantof anti⁃TNF⁃α drugs:report of 3 cases and literature review[J].J Clin Gastroenterol,2014,48(6):530-533.
[9]孙宝信,张晶晶,李青山,等.沙利度胺治疗老年晚期原发性肝癌的疗效[J].中国老年学杂志,2013,33(15):3752-3753.
[10]潘骥群,鲁光平,于志坚.沙利度胺抗肿瘤的研究进展[J].中华肿瘤防治杂志,2012,19(7):552-555.
[11]赵变锋.沙利度胺抗肿瘤机制及临床研究进展[J].内科急危重症杂志,2011,17(1):50-51.
[12]Qi F,Li A,Zhao L,et al.Cinobufacini,an aqueous extract from Bufo bufo gargarizans Cantor,induces apoptosis through a mitochon⁃dria⁃mediated pathway in human hepatocellular carcinoma cells[J].J Ethnopharmacol,2010,128(3):654-661.
[13]杨宏梅,陈 涛.华蟾素在消化系统肿瘤治疗中应用的研究进展[J].广东医学,2014,35(15):2453-2455.
[14]Yin PH,Liu X,Qiu YY,et al.Anti⁃tumor activity and apoptosis⁃regu⁃lation mechanisms of bufalin in various cancers:new hope for cancer patients[J].Asian Pac J Cancer Prev,2012,13(11):5339-5343.
[15]Wang L,Mi R,Wei X,et al.Cinobufagin treatment of relapsed or refractory hematological malignant tumor:8 cases report andliteratures review[J].Zhonghua Xue Ye Xue Za Zhi,2015,36(11):954-956.
[16]Fearon K,Strasser F,Anker SD,et al.Definition and classification of cancer cachexia:an international consensus[J].Lancet Oncol,2011,12(5):489-495.
[17]Ferriolli E,Skipworth RJ,Hendry P,et al.Physical activity monitoring:a responsive and meaningful patient⁃centered outcome for surgery,chemotherapy,or radiotherapy[J].J Pain Symptom Man⁃age,2012,43(6):1025-1035.
[18]Bayliss TJ,Smith JT,Schuster M,et al.A humanized anti⁃IL⁃6 antibody(ALD518)in non⁃small cell lung cancer[J].Expert Opin Biol Ther,2011,11(12):1663-1668.
[19]Mantovani G,Macciò A,Madeddu C,et al.Randomized phase III clinical trial of five different arms oftreatment in 332 patients with cancer cachexia[J].Oncologist,2010,15(2):200-211.
[20]Davis M,Lasheen W,Walsh D,et al.A Phase II dose titration study of thalidomide for cancer⁃associated anorexia[J].J Pain Symptom Manage,2012,43(1):78-86.
[21]Antoun S,Birdsell L,Sawyer MB,et al.Association of skeletal mus⁃cle wasting with treatment with sorafenib in patients with advanced re⁃nal cell carcinoma:results from a placebo⁃controlled study[J].J Clin Oncol,2010,28(6):1054-1060.
[22]Coronha AL,Camilo ME,Ravasco P.The relevance of body composition in cancer patients:what is the evidence[J].Acta Med Port,2011,24(Suppl 4):769-778.
Clinical study on thalidomide combined with cinobufagin in the treatment of primary liver cancer cachexia
XIE Ming⁃Zhi1,Li Chong2,Dao Feng⁃Ting2,CHEN Xiao⁃Ju2
1General Medicine of Cancer Hospital Affiliated to Ghuangxi Med⁃ical University;2Ghuangxi Medical University,Nanning 530021,China
AIM:To discuss and assess the clinical value of thalidomide combined with cinobufagin in the treatment of liver cancer cachexia.METHODS:A cohort of 47 patients diagnosed with liver cancer were randomly divided into trial group and con⁃trol group respectively.The trial group was given 150 mg/day tha⁃lidomide and 2700 mg/day cinobufagin;the control group only re⁃ceived 2700 mg/day cinobufagin.The therapy lasted for 12 weeks,and the nutritional status,quality of life,survival and side effects in patients of the two groups were recorded.RESULTS:The nutritional status,quality of life,and survival of patients with liver cancer cachexia in the trial group were significantly improved than those of the control group.The trial group received 150 mg thalidomide,which by contrast reduced the incidence of side effect and increased tolerance.CONCLUSION:Thalidomide combined with cinobufagin can improve nutritional status and quality of life of patients.The treatment effect is better than that of cinobufagin alone and is well tolerated,and it has higher value.
thalidomide;cinobufagin;liver cancer cachexia
R734.2
A
2016-12-22;接受日期:2017-01-05
2016年度广西壮族自治区中青年教师基础能力提升项目
(KY2016YB075);2015年广西中医药民族中药自筹课题(GZZC15-36)
谢明智.E⁃mail:78109768@qq.com
陈晓菊.博士.研究方向:肿瘤内科.
E⁃mail:chenxiaoju984@163.com

