复合免疫增强剂对刺参生长和非特异性免疫酶活性的影响
张宇鹏,田燚,商艳鹏,蒋亚男,常亚青
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.大连市水产产业技术创新联合会,辽宁大连116023)
复合免疫增强剂对刺参生长和非特异性免疫酶活性的影响
张宇鹏1、2,田燚1,商艳鹏1,蒋亚男1,常亚青1
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.大连市水产产业技术创新联合会,辽宁大连116023)
为研究不同复合免疫增强剂对刺参Apostichopus japonicus非特异性免疫酶的影响,试验设置正常对照组(A组)、芽孢杆菌+壳寡糖+刺五加等中草药组(B组)、芽孢杆菌+壳寡糖+百合等中草药组(C组)、芽孢杆菌+壳寡糖+大黄等中草药组(D组)、芽孢杆菌+壳寡糖+黄芪等中草药组(E组)、芽孢杆菌+壳寡糖组(F组)、壳寡糖组(G组)和芽孢杆菌组(H组)8组,通过在饲料中添加中草药、芽孢杆菌和壳寡糖,研究了芽孢杆菌、壳寡糖和中草药对体质量为(3.87±0.54)g的刺参幼参生长及其酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、溶菌酶(LZM)、超氧化物歧化酶(SOD)等非特异性免疫酶活力的影响。结果表明:投喂芽孢杆菌、壳寡糖和中草药制剂均促进了刺参的生长,各试验组刺参的增重率和特定生长率均显著高于对照组(P<0.05),其中,D和E组均显著高于其他试验组(P<0.05);在饲料中添加不同配伍的复合免疫增强剂对AKP活力无显著性影响(P>0.05);投喂50 d后,C、D、E组ACP活力显著高于对照组(P<0.05);投喂50 d后,除H组外,其他试验组SOD活力均显著高于对照组(P<0.05),其中B、C和D组SOD活力较高;投喂50 d后,除G组外,其他试验组LZM活力均显著高于对照组(P<0.05)。研究表明,饲料中共同添加芽孢杆菌、壳寡糖和中草药复合免疫增强剂能进一步提高刺参非特异性免疫酶活力,其中C、D和E试验组均能提高刺参的非特异性免疫力,且C组效果最好。
刺参;复合免疫增强剂;非特异性免疫酶;生长率;存活率
刺参Apostichopus japonicus是中国北方重要的海水养殖种类,具有较高的营养价值和药用价值。但养殖过程中操作不规范和水质恶化导致刺参免疫力退化及大规模病害频繁发生,给养殖户造成了巨大的经济损失[1]。养殖生产中,人们通过投喂抗生素来防治水产品病害,但却导致了病原体的抗药性,而且还可通过多种途径将其传递给对人类有害的病原体[2-3]。目前,通过提高水产动物免疫力来抵抗疾病已成为提高养殖经济效益的关键点。
免疫增强剂是指单独或同时与抗原使用均能增强机体免疫应答的物质,其通过提高养殖动物的非特异性免疫力来提高机体对病原的抵抗力,具有比抗生素安全、比疫苗作用范围广的优点。芽孢杆菌能够促进养殖动物生长,减少病害发生,并改善养殖环境,具备许多其他益生菌无法比拟的优点,已成为公认的具有发展前景的优良菌种。中草药饲料添加剂具有低毒性,能促进动物生长,可提高养殖动物的抗应激能力和免疫力。
中草药、芽孢杆菌和壳寡糖等免疫增强剂,因其绿色、无污染和无副作用等优点越来越受到水产养殖业者的青睐。已有多项研究表明,免疫增强剂能够显著提高刺参的生长率,以及消化和非特异性免疫酶活力[4-9]。王宜艳等[10]以中草药复合免疫药物虾康素连续投喂中国对虾,显著提高了对虾血淋巴的氧化酶和抗氧化酶活力。陈孝煊等[11]试验证实,大黄与黄连对两种淡水虾血细胞的吞噬活性均有显著提高,攻毒试验显示,免疫保护率为100%。李义等[12]将黄芪、党参、大黄、板蓝根等十余味中草药制成颗粒药饵投喂中华绒螯蟹,结果表明,中华绒螯蟹血细胞吞噬百分比和吞噬指数,以及血清溶菌酶和酚氧化酶活力均显著提高。崔青曼等[13]用0、0.5%、1.0%的复方中草药添加剂饲喂河蟹,结果表明,该添加剂能显著提高河蟹的血细胞吞噬活性、血清杀菌活力、血清凝集效果和抗感染能力,极大增强河蟹机体的免疫功能。罗日祥[14]配伍了两种复方中药免疫增强剂,试验结果显示,中药制剂1号对中国对虾的免疫系统有激活作用,中药制剂2号对中国对虾的免疫系统起抑制、破坏作用。陈学年等[15]筛选了9种中草药组成5个复方,设计了以嗜水气单胞菌为病原菌的鲫鱼败血病防治试验、抑菌定性试验,以及注射、口服药物攻毒试验,结果显示,5个复方均有明显的防病功能,但抗菌作用却有较大差异,显示中草药主要通过调动鱼体非特异免疫力发挥功能。
吴会民等[16]给大菱鲆Psetta maxima和血鹦鹉鱼Amphilophus citrinellus投喂由β-葡聚糖、中草药、维生素B和维生素C等混合配制的复合免疫增强剂后,其非特异性免疫酶活性和抗应激能力显著提高。谷珉[17]研究表明,投喂由β-葡聚糖和甘露聚糖组成的复合免疫增强剂与单独投喂两者相比,能进一步提高刺参的生长率、非特异性免疫酶活性,且其持续时间更长。本试验中,研究了不同复合免疫增强剂对刺参生长和非特异性免疫酶活性的影响,以期对刺参的免疫防御机制获得更深的认识,为刺参的健康养殖、疾病防治和探索合适的复合免疫增强剂提供参考。
1 材料与方法
1.1 材料
试验用刺参幼参取自大连海源水产有限公司,刺参初始体质量为(3.87±0.54)g,暂养于大连海洋大学农业部北方海水增养殖重点实验室。暂养期间,以基础饲料饱食投喂,水温为15℃。
1.2 方法
1.2.1 试验饲料的配制 试验用饲料为大连海洋大学自制饵料,基础饲料[18]及试验组饲料配方见表1。饲料原料经超微粉碎过100目筛,各原料按配比定量,加入适量水搅拌均匀,经双螺杆挤条机挤压成直径为1.0 mm的颗粒饲料,干燥后备用。
1.2.2 试验设计 选取试验用刺参,随机分配于200 L水槽中进行试验,并称量体质量。试验设置7个处理组,每组设3个平行,每个平行放30头刺参,分别记为B~H组,对应投喂7种试验饲料,并设对照组A,投喂不添加任何免疫增强剂的基础饲料。其中,芽孢杆菌、壳寡糖和中草药总量的添加量分别为0.1%、0.2%和0.2%,B、C、D、E组中各种中草药成分的配比均为1∶1。
养殖试验持续50 d。初始投饵量为其体质量的10%,并根据刺参的摄食情况进行调整,每天17:00投喂1次,次日8:00吸除残饵和粪便。试验期间,连续充气,水温为(15±0.5)℃,盐度为32,pH为7.8~8.2,溶解氧不低于5 mg/L,并定时观察刺参的生长和健康状况。分别于试验的第10、20、30、40、50天测定刺参的体质量。根据下述公式计算刺参的存活率(%)、增重率(%)和特定生长率(%/d):
存活率=(Nt/N0)×100%,
增重率=(Wt-W0)/W0×100%,
特定生长率(SGR)=(ln Wt-ln W0)/t×100%。其中:N0和Nt分别为试验初始、结束时刺参的数量;W0和Wt分别为试验初始和结束时刺参的体质量(g);t为试验时间(d)。
1.2.3 样品的采集与测定 分别于试验的第10、20、30、40、50天在冰盒中抽取刺参体腔液,每次抽取5头刺参的体腔液,将体腔液装入1.5 mL离心管中,取样完成后在4℃下以3000 r/min离心10 min,取上清液,在超低温冰箱(-80℃)中保存备用。使用南京建成生物工程研究所的试剂盒和酶标仪测定各样品中酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、溶菌酶(LZM)和超氧化物歧化酶(SOD)的活力。
1.3 数据处理
试验数据均用平均值±标准差(mean±S.D.)表示,采用SPSS 11.5软件对所得数据进行组间单因素方差分析,若差异显著,则用Duncan法进行多重比较,显著性水平设为0.05。

表1 试验组饲料配方Tab.1 The dietary formulation in the expreriment
2 结果与分析
2.1 复合免疫增强剂对刺参生长的影响
从表2可见:饲料中添加复合免疫增强剂未对刺参的存活率产生显著影响(P>0.05),各组刺参的存活率均在95%以上;各试验组刺参的增重率和特定生长率均显著高于对照组(P<0.05),其中,同时添加芽孢杆菌、壳寡糖和中草药的D组和E组刺参的生长效果较好,其增重率和特定生长率均显著高于其他试验组(P<0.05)。
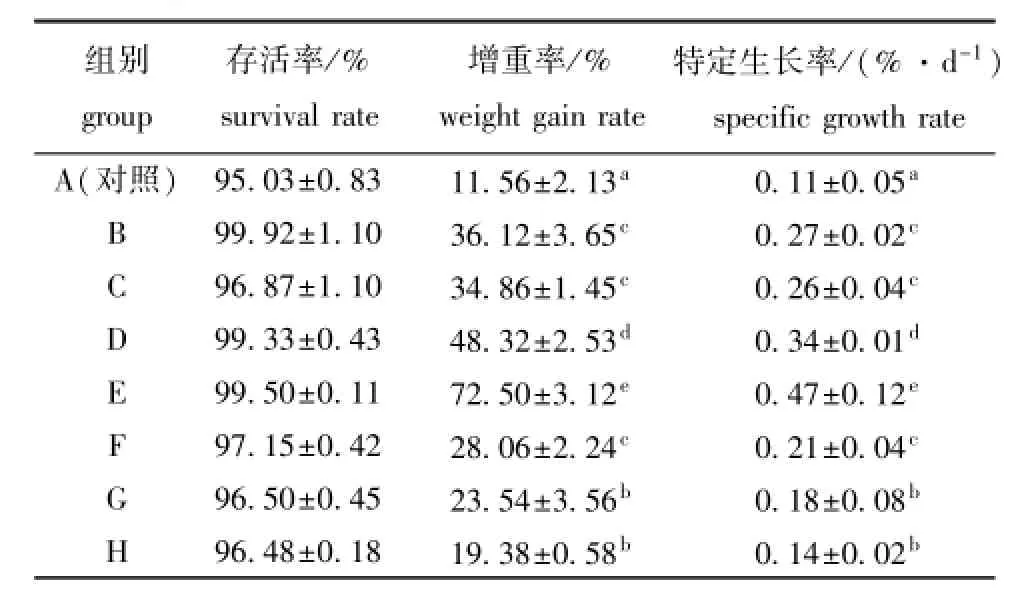
表2 复合免疫增强剂对刺参存活率及生长的影响Tab.2 Effects of immunostimulant compound on survival rate and growth of sea cucumberApostichopus japonicus
2.2 复合免疫增强剂对刺参AKP活力的影响
从表3可见:在饲料中添加不同配伍的复合免疫增强剂对AKP活力均无显著性影响(P>0.05);在整个试验期间,除C组刺参的AKP活力在第30天大幅升高外,其他试验组AKP活力变化趋势基本一致,即AKP活力呈先升高后下降并趋于稳定的趋势。
2.3 复合免疫增强剂对刺参ACP活力的影响
在饲料中添加不同配伍的复合免疫增强剂均不同程度地提高了刺参体腔液中的ACP活力。从表4可见:投喂10 d时,C、D、E、G组ACP活力显著高于对照组(P<0.05),其中C组ACP活力最高;投喂20 d时,所有试验组ACP活力均显著高于对照组(P<0.05);投喂30 d时,除B组外,其他试验组ACP活力均显著高于对照组(P<0.05);投喂40 d时,除B组和H组外,其他试验组均显著高于对照组(P<0.05);投喂50 d时, C、D、E、F组ACP活力均显著高于对照组(P<0.05)。将各时间段刺参ACP活力的平均值进行比较,各试验组ACP活力的平均值均显著高于对照组(P<0.05),其中C、D、E组ACP活力的平均值较高。
随着试验时间的延长,对照组未有显著变化,而试验组ACP活力总体变化趋势基本一致,均呈现先升高后降低的趋势,B、C、D组ACP活力在第20天时达到最高,E、G、H组ACP活力在第30天时达到最高,F组则在第40天时达到最高(表4)。
2.4 复合免疫增强剂对刺参SOD活力的影响
在饲料中添加不同配伍的复合免疫增强剂均不同程度地提高了刺参体腔液中SOD活力。从表5可见:投喂10 d时,各试验组刺参体腔液SOD活力均显著高于对照组(P<0.05),其中B组SOD活力最高;投喂20 d时,仅H组SOD活力显著低于对照组(P<0.05);投喂30 d时,各试验组SOD活力均显著高于对照组(P<0.05);投喂40 d时,除H组外,其他试验组SOD活力均显著高于对照组(P<0.05);投喂50 d时,除G、H组外,其他试验组SOD活力均显著高于对照组(P<0.05)。将各时间段SOD活力的平均值进行比较,除H组外,其他试验组SOD活力的平均值均显著高于对照组(P<0.05),其中B、C、D组SOD活力平均值显著高于其他试验组(P<0.05)。
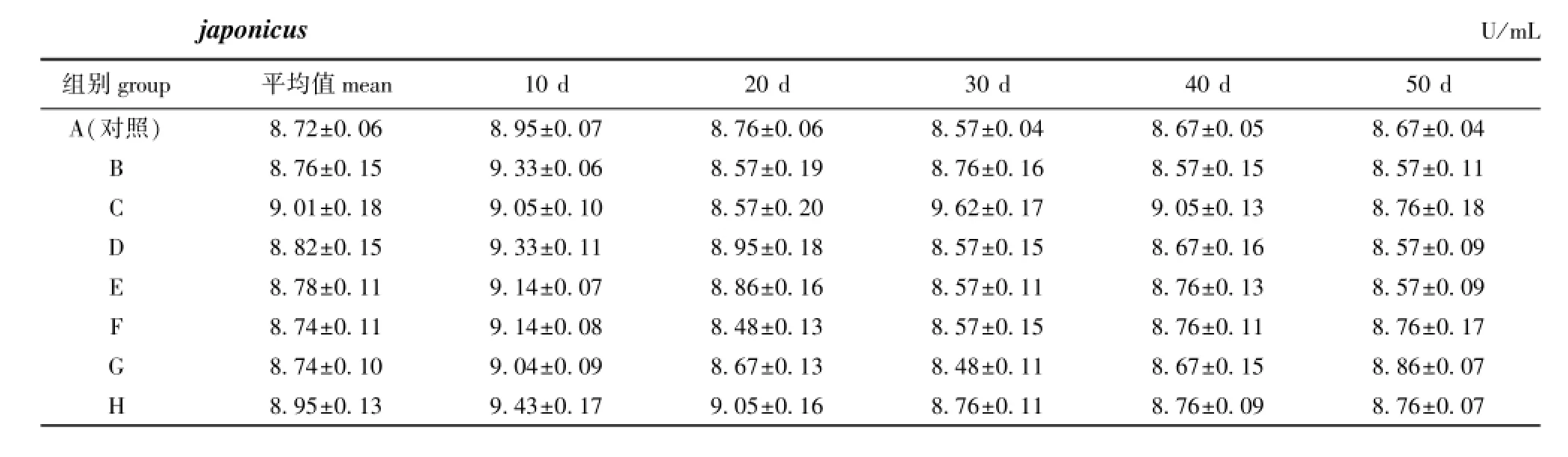
表3 复合免疫增强剂对刺参体腔液中碱性磷酸酶活力的影响Tab.3 Effects of immunostimulant compound on AKP activity in coelomic fluid of sea cucumberApostichopus
随着试验时间的延长,除H组外,各试验组SOD活力均呈先升高后降低的趋势,B、F、G组SOD活力在第40天时达到最高,C、D、E组SOD活力在第30天时达到最高,H组则在第50天时达到最高(表5)。
2.5 复合免疫增强剂对刺参LZM活力的影响
在饲料中添加不同配伍的复合免疫增强剂均不同程度地提高了刺参体腔液中的LZM活力。从表6可见:投喂10 d时,只有D、E组LZM活力显著高于对照组(P<0.05),其他试验组均与对照组无显著性差异(P>0.05);投喂20 d时,B、C、D、E组LZM活力均显著高于对照组(P<0.05),其中C组LZM活力最高;投喂30 d和40 d时,各试验组LZM活力均显著高于对照组(P<0.05);投喂50 d时,除G组外,其他试验组LZM活力均显著高于对照组(P<0.05)。将各时间段LZM活力的平均值进行比较,各试验组LZM活力的平均值均显著高于对照组(P<0.05)。
随着试验时间的延长,各试验组LZM活力的变化趋势基本一致,均为先上升后趋于平稳,后期又上升的趋势,其中B、C、F、G和H组LZM活力在第50天时达到最高,D、E组则在第10天时达到最高(表6)。
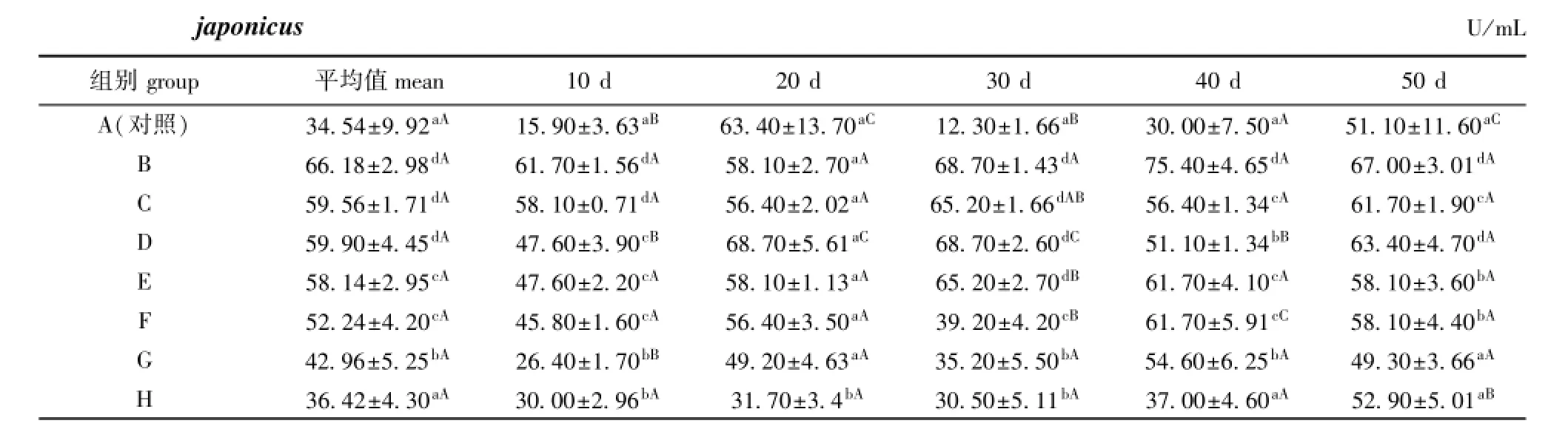
表5 复合免疫增强剂对刺参体腔液中超氧化物歧化酶活力的影响Tab.5 Effects of immunostimulant compound on SOD activity in coelomic fluid of sea cucumberApostichopus
3 讨论
3.1 不同复合免疫增强剂对刺参生长的影响
研究表明,中草药和微生态制剂可以促进养殖动物生长,增强其抵抗疾病的能力。另有研究表明,许多中草药成分对细菌的生长代谢有促进作用,可以促进微生态制剂中微生物的增殖。同时,微生态制剂(益生菌)也可以促进中草药的吸收和利用。袁成玉等[19]在基础饲料中分别添加光合细菌、芽孢杆菌和复合菌饲喂幼刺参,结果表明,试验组刺参的特定生长率、成活率和消化酶活力均显著提高。此外,王际英等[5]在给幼刺参投喂添加半乳甘露寡糖的饲料后发现,其特定生长率显著提高并能改善刺参体壁氨基酸组成。本研究结果显示:投喂添加芽孢杆菌、壳寡糖和中草药制剂的饲料均能促进刺参生长,各试验组刺参的增重率和特定生长率显著高于对照组;而投喂由芽孢杆菌、壳寡糖和中草药制剂混合配制而成的复合免疫增强剂,其增重率和特定生长率显著高于投喂单独添加壳寡糖和芽孢杆菌的试验组。该结果与于明超[20]进行的芽孢杆菌和中草药在凡纳滨对虾饲料中的应用研究结果相一致。于明超[20]研究发现,同时添加0.10%中草药制剂和0.15%芽孢杆菌制剂组的投喂效果最好,优于单独添加两者之一的试验组,表明中草药和芽孢杆菌共同添加时具有叠加效应,比单独添加的效果要好。本试验表明,壳寡糖、芽孢杆菌和中草药在提高刺参的特定生长率和增重率的过程中具有相互促进的作用。
3.2 不同复合免疫增强剂对刺参非特异性免疫酶活力的影响
刺参主要依靠非特异性免疫来抵抗外源病原体,包括体壁防御和体液防御,其中,AKP、ACP、SOD和LZM为刺参体液免疫中最重要的几种免疫酶类,其浓度高低反映了刺参的免疫力。于明超[20]研究表明,芽孢杆菌与中草药通过交互作用对血清酚氧化酶(PO)产生显著影响(P<0.05),高浓度的中草药可以提高血清PO和溶菌酶活力。骆艺文[21]的研究表明,添加单一和复合芽孢杆菌制剂均能提高刺参攻毒后的存活率,其中添加复合制剂组与对照组差异显著,表明芽孢杆菌能够提高刺参免疫力。樊英等[8]将黄柏、苦参、菊粉和天蚕素等中草药和天然物质注射到仿刺参体内后发现,其体腔细胞总量(TCC)、呼吸爆发活性、吞噬活性、PO活性、ACP活性和SOD活性均显著提高,表明中草药有助于提高刺参的抵抗力。而谷珉[17]的研究表明,投喂由β-葡聚糖和甘露聚糖组成的复合免疫增强剂与单独投喂两者之一相比,能进一步提高刺参的生长率、免疫力,且其作用时间更长。上述试验结果与本试验结果基本一致。本试验中,各试验组在整个试验过程中, SOD、ACP和LZM活力均高于对照组,尤其是同时添加芽孢杆菌、壳寡糖和中草药混合制剂的试验组表现更加明显。采用壳寡糖、芽孢杆菌和中草药不同配伍的复合免疫增强剂能显著提高刺参的生长率和体腔液中ACP、LSZ、SOD等非特异性免疫酶活力,从而提高刺参的非特异性免疫力,但各组分在提高刺参非特异性免疫力过程中的作用及交互作用机制还需要进一步研究。
综上所述,饲料中同时添加芽孢杆菌、壳寡糖和中草药复合免疫增强剂,能进一步提高刺参的特定生长率、增重率和非特异性免疫酶活力,C、D和E试验组均能提高刺参的非特异性免疫力,其中,C组(芽孢杆菌、壳寡糖、百合、当归、牛膝)的免疫效果最好,在饲料中添加此配方的复合免疫增强剂将有利于刺参的健康养殖。
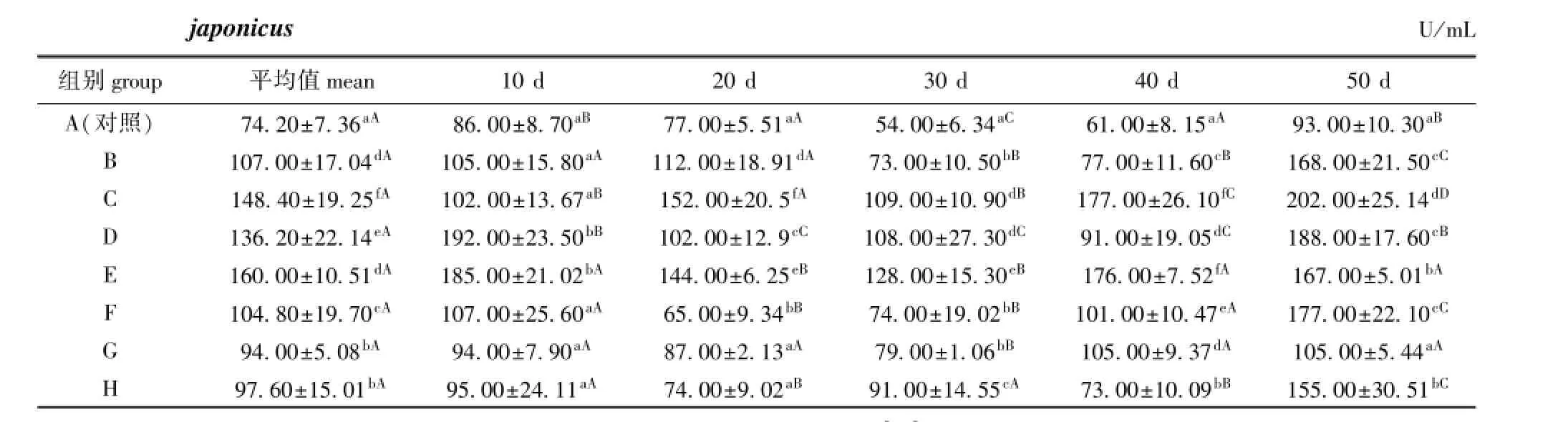
表6 复合免疫增强剂对刺参体腔液中溶菌酶活力的影响Tab.6 Effects of immunostimulant compound on LZM activity coelomic fluid of sea cucumberApostichopus
[1] 李继业.养殖刺参免疫学特征与病害研究[D].青岛:中国海洋大学,2007.
[2] 王印庚,荣小军,张春云,等.养殖海参主要疾病及防治技术[J].海洋科学,2005,29(3):1-7.
[3] Moriarty D J W.Control of luminous Vibrio species in penaeid aquaculture ponds[J].Aquaculture,1998,164(1-4):351-358.
[4] 赵坤,田相利,董双林,等.芽孢杆菌不同使用方式对刺参生长、消化和免疫防御因子的影响[J].海洋湖沼通报,2015(1): 63-72.
[5] 王际英,宋志东,李培玉,等.饲料添加半乳甘露寡糖对刺参幼参生长、体壁营养组成及免疫力的影响[J].中国水产科学, 2014,21(2):310-319.
[6] 李斌,张秀珍,马元庆,等.生物絮团对水质的调控作用及仿刺参(Apostichopus japonicus)幼参生长的影响[J].渔业科学进展,2014,35(4):85-90.
[7] 向枭,陈建,周兴华,等.黄芪多糖对齐口裂腹鱼生长、体组成和免疫指标的影响[J].水生生物学报,2011,35(2):291-299.
[8] 樊英,李乐,于晓清,等.仿刺参新型免疫增强剂的应用[J].福建农林大学学报:自然科学版,2014,43(4):408-413.
[9] 马悦欣,许珂,王银华,等.κ-卡拉胶寡糖对仿刺参溶菌酶、碱性磷酸酶和超氧化物歧化酶活性的影响[J].大连海洋大学学报,2010,25(3):224-227.
[10] 王宜艳,孙虎山,李光友.复合免疫药物对中国对虾血淋巴氧化酶和抗氧化酶活力的影响[J].海洋科学进展,2002,20 (3):79-83.
[11] 陈孝煊,吴志新,张厚梅.大黄与黄连对二种淡水虾血细胞吞噬活性的影响[J].水生生物学报,2002,26(2):201-204.
[12] 李义,吴婷婷,谭夕东.左旋咪唑对中华绒螯蟹非特异性免疫功能及抗病力的影响[J].水产学报,2002,31(6):785-791.
[13] 崔青曼,张耀红,袁春营.中草药、多糖复方添加剂提高河蟹机体免疫力的研究[J].水利渔业,2001,21(4):40-41.
[14] 罗日祥.中药制剂对中国对虾免疫活性物的诱导作用[J].海洋与湖沼,1997,28(6):573-578.
[15] 陈学年,郭玉娟.中草药防治鲫鱼败血病试验[J].淡水渔业, 2001,31(1):43-45.
[16] 吴会民,姜巨峰,张振国,等.一种复合免疫增强剂对大菱鲆和血鹦鹉鱼酶活性及抗病力的影响[J].江西水产科技,2014 (1):21-23.
[17] 谷珉.仿刺参(Apostichopus japonicus)免疫增强剂的体外筛选与养殖试验的评估[D].青岛:中国海洋大学,2010.
[18] 郝佳,吴英茜,刘晗奇,等.几种微生态制剂对刺参幼参生长、存活和消化酶活性的影响[J].大连海洋大学学报,2015,30 (3):248-252.
[19] 袁成玉,张洪,吴垠,等.微生态制剂对幼刺参生长及消化酶活性的影响[J].水产科学,2006,25(12):612-615.
[20] 于明超.芽孢杆菌和中草药在凡纳滨对虾(Litopenaeus vannamei)饲料中的应用研究[D].青岛:中国海洋大学,2007.
[21] 骆艺文.刺参有益菌制剂的研制与应用研究[D].青岛:中国海洋大学,2009.
Effects of compound immunostimulant on growth and non-specific immune enzyme activity in sea cucumber Apostichopus japonicus
ZHANG Yu-peng1,2,TIAN Yi1,SHANG Yan-peng1,JIANG Ya-nan1,CHANG Ya-qing1
(1.Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China;2.Dalian Fisheries Industry Technology Innovation Association,Dalian 116023,China)
The survival,growth,and activities of acid phosphatase(ACP),alkaline phosphatase(AKP),lysozyme(LZM),and superoxide dismutase(SOD)were studied in juvenile sea cucumber Apostichopus japonicus with initial body weight of(3.87±0.54)g fed basal diet(control group,group A),and basal diet containing Bacillus+ chitosan oligosaccharide+Acanthopanax root compound(group B),Bacillus+chitosan oligosaccharide+lily compound(group C),Bacillus+chitosan oligosaccharide+Rheum officinale compound(group D),Bacillus+chitosan oligosaccharide+Astragalus membranaceus compound(group E),Bacillus+chitosan oligosaccharide(group F), chitosan oligosaccharide(group G)and Bacillus(group H)at water temperature of(15±0.5)℃for 50 d to evaluate the effect of different Chinese herbal medical compound immunostimulants on nonspecific immunity in sea cucumber.The results showed that growth of the sea cucumber was improved by dietary Chinese herbal medicines, Bacillus and chitosan oligosaccharide.There were significantly better weight gain and specific growth rate in the sea cucumber juveniles in the experimental groups than those in the control group(P<0.05),significantly higher in the animals in groups D and E than in the other groups(P<0.05).No significant difference in AKP activity was observed(P>0.05),significantly higher AKP activity in sea cucumber in groups C,D and E than that in the control group in the 50 day feeding trial(P<0.05).The ACP activities were shown to be significantly higher in the sea cucumber in groups C,D and E than those in the control group(P<0.05).There were significantly higher SOD activities in the sea cucumber in groups B,C,D,E,F and G than that in control group,especially higher in groups B,C and D.LZM activities were found to be significant higher in the sea cucumber in groups B,C,D,E, F and H than that the control group(P<0.05).The findings indicate that Chinese herbal medicine,Bacillus and chitosan oligosaccharide in groups C,D and E,especially group C,improve the nonspecific immune enzyme activity and nonspecific immunity in sea cucumber.
Apostichopus japonicus;compound immunostimulant;nonspecific immune enzyme;growth rate;survival rate
10.16535/j.cnki.dlhyxb.2017.02.010
2095-1388(2017)02-0178-06
S917.1;S948
:A
2016-05-30
国家自然科学基金资助项目(41106128);辽宁省高等学校杰出青年学者成长计划项目(LJQ2012064);大连市科技计划项目(2012B11NC049)
张宇鹏(1990—),男,硕士研究生。E-mail:sxzhangyupeng@163.com
田燚(1979—),女,博士,副教授。E-mail:tianyi@dlou.edu.cn

