凡纳滨对虾3种主要病毒和虾肝肠胞虫在辽宁地区的流行情况分析
王博雅,王力,刘美如,叶仕根,黎睿君,李华,李强
(大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
凡纳滨对虾3种主要病毒和虾肝肠胞虫在辽宁地区的流行情况分析
王博雅,王力,刘美如,叶仕根,黎睿君,李华,李强
(大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
为解决近年来辽宁地区凡纳滨对虾Litopenaeus vannamei病害频发的问题,于2015年8月从辽宁省盘锦、营口地区26个发病的凡纳滨对虾养殖池塘中随机采集病虾样本,采用聚合酶链式反应(Polymerase Chain Reaction,PCR)检测对虾传染性皮下及造血组织坏死病毒(IHHNV)、对虾白斑综合征病毒(WSSV)和对虾桃拉综合征病毒(TSV),并用环介导等温扩增(Loop-Mediated Isothermal Amplication, LAMP)技术检测虾肝肠胞虫Enterocytozoon hepatopenaei(EHP)的感染情况。结果表明:IHHNV和EHP的检出率较高,分别为65.4%和34.6%,WSSV和TSV的检出率分别为19.2%和7.7%;EHP的检出率与对虾体型大小密切相关,在小虾样本中检出的阳性率高达100%,而大虾样本中均未检出;26份对虾样本中有7份样本同时携带EHP和IHHNV。研究表明,IHHNV和EHP是2015年8月辽宁地区凡纳滨对虾的主要流行病原,发病率可能与对虾生长缓慢、个体大小差异明显相关。
凡纳滨对虾;传染性皮下及造血组织坏死病毒;白斑综合征病毒;桃拉综合征病毒;虾肝肠胞虫
近年来,随着养虾业的再次兴旺,对虾养殖规模不断扩大,但由于对虾病害严重,给对虾养殖业造成了较大的经济损失。目前,对虾病毒已发现20多种[1-2],其中对对虾养殖业危害严重的主要为对虾白斑综合征病毒(White spot syndrome virus, WSSV)、传染性皮下及造血组织坏死病毒(Infectious hypodermal and hematopoietic necrosis virus, IHHNV)、桃拉综合征病毒(Taura syndrome virus, TSV)[3]。2009年发现的虾肝肠胞虫Enterocytozoon hepatopenaei(EHP)是一种主要寄生于对虾肝胰脏组织中的新病原,可导致对虾生长阻滞,给养殖业造成了严重的经济损失[4]。
盘锦、营口地区是辽宁省最大的两个凡纳滨对虾Litopenaeus vannamei养殖区,目前对辽宁地区对虾病害的研究报道大多集中在中国明对虾及凡纳滨对虾暴发性病害的病原及病理研究方面[5-13],对暴发性死亡病例的病原分析[14]报道甚少。为此,本研究中,于2015年8月对辽宁省盘锦、营口地区26个对虾养殖池凡纳滨对虾的WSSV、IHHNV、 TSV和EHP的流行情况进行了调查和分析并给出防治建议,旨在为该地区对虾养殖业的疾病综合防控提供参考。
1 材料与方法
1.1 材料
1.2 方法
1.2.1 WSSV检测 按照天根公司的基因组DNA提取试剂盒(TIAN amp Genomic DNA Kit)操作步骤提取各组待测样本中基因组总DNA,于-20℃下保存备用。按照OIE的《水生动物疫病诊断手册》(2016版)[15]WSSV套式PCR检测方法进行样品检测。检测WSSV所用引物为
146F1:5′ACTACTAACTTCAGCCTATCTAG 3′;
146R1:5′TAATGCGGGTGTAATGTTCTTACGA 3′; 146F2:5′GTAACTGCCCCT TCCATCTCCA 3′; 146R2:5′TACGGCAGCTGCTGCACCTTGT 3′。
1.2.2 IHHNV检测 各组待测样本中基因组总DNA的提取方法同“1.2.1”。按照OIE的《水生动物疫病诊断手册》[15]IHHNV的检测方法进行样品检测。检测IHHNV所用引物为
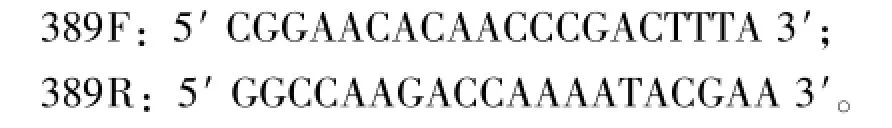
1.2.3 TSV检测 按照天根公司的总RNA提取试剂盒(RNA simple Total RNA Kit)操作步骤提取总RNA,于-80℃下保存备用。以各组样本总RNA为模板,使用全式金公司反转录试剂盒进行cDNA的合成。再以反转录产物为模板,进行PCR扩增。按照OIE的《水生动物疫病诊断手册》[15]进行TSV的RT-PCR检测。检测TSV所用引物为
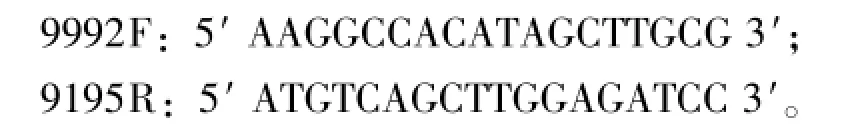
1.2.4 EHP检测 按照中国水产科学研究院黄海水产研究所EHP检测试剂盒的操作步骤进行EHP的LAMP检测,反应结束后直接观察样品反应管中的颜色并与对照管颜色进行比对,判定检测结果。
2 结果与分析
2.1 发病情况与临床症状
2015年8月,辽宁省盘锦、营口地区凡纳滨对虾未见暴发性发病或大量死亡,疾病呈现慢性发病特点,主要特征为生长缓慢,体型大小差异明显,活力差,少数池塘的对虾出现红腿、空肠空胃、头胸甲易剥离且有白斑等症状,偶见对虾不吃料、增氧机下池底有少量虾死亡的情况(表1)。
窖泥质感与原料土的种类及生产过程中物质的积累有关,窖泥制作原料选择黏土,随着时间延长,原料土的颗粒大小及组成形式会发生变化,加之腐殖质、淀粉物质等积累会形成窖泥特殊的质感。
2.2 病原检测结果
2.2.1 WSSV的PCR检测 在26份样品中,5份样品WSSV检测呈阳性,总检出率为19.2%(表2),且主要在大虾样本中检出(表3)。部分被检病虾样品WSSV的PCR检测结果如图1所示,PCR产物经电泳后,阳性对照样品及部分对虾样本在941 bp处出现1条特异性条带,表明这些阳性样品中存在WSSV DNA,对虾已受到WSSV感染。
2.2.2 IHHNV的PCR检测 试验结果显示,在所有检测项目中IHHNV的感染率最高,在26份样品中有17份样品IHHNV检测呈阳性,其阴性率高达65.4%(表2),是本地区该养殖时期最主要的流行病原,其检出率在不同体长对虾样本中无明显差异(表3)。部分病虾样本IHHNV的PCR检测结果如图2所示,阳性对照样品及部分病虾样本在389 bp处出现目的条带。

图1 部分被检病虾样本的WSSV套式PCR检测结果Fig.1 The results of WSSV detected by nested-PCR in Pacific white leg shrimpLitopenaeus vannamei

图2 部分被检病虾样本的IHHNV PCR检测结果Fig.2 The results of IHHNV detected by PCR in Pacific white leg shrimpLitopenaeus vannamei
2.2.3 TSV的PCR检测 26个养殖池塘仅有2个池塘的样本TSV检测呈阳性(表2),且均为小虾样本,阴性率为7.7%(表3)。部分病虾样本TSV的PCR检测结果如图3所示,阳性对照样品及部分病虾样本在231 bp处出现目的条带。

图3 部分被检病虾样本中TSV PCR检测结果Fig.3 PCR detection results of TSV in Pacific white leg shrimpLitopenaeus vannamei
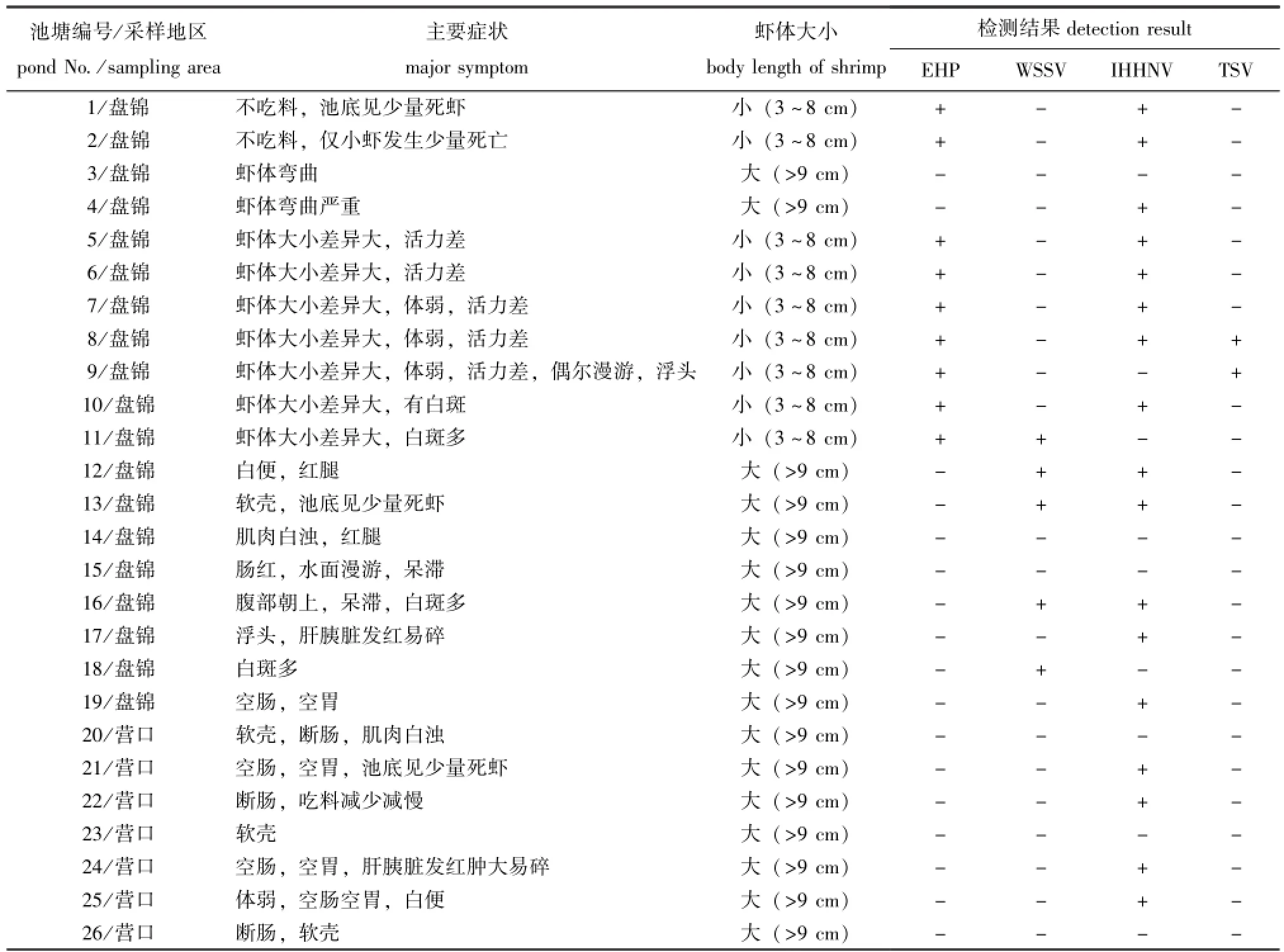
表1 病虾感染EHP、WSSV、IHHNV和TSV的检测结果Tab.1 Detection of EHP,IHHNV,WSSV and TSV by PCR or LAMP among Pacific white leg shrimpLitopenaeus vannameisamples
2.2.4 EHP的LAMP检测 EHP在病虾样品中的检出率也相对较高,为34.6%(表2),且所有小虾样本均呈阳性,阳性率为100%,而在大虾样本中未检出(表3)。部分对虾样本EHP的LAMP检测结果如图4所示,病虾样品检测结果与试剂盒中的阳性和阴性对照进行比对,阳性检测结果呈黄绿色,而阴性检测结果呈橙色。

表2 26个池塘病虾样本中EHP、IHHNV、WSSV和TSV的检出率Tab.2 Incidence rates of EHP,IHHNV,WSSV and TSV among Pacific white leg shrimpLitopenaeus vannameisamples from 26 ponds
3 讨论
3.1 辽宁地区凡纳滨对虾病原的流行特点
本研究结果表明,辽宁地区凡纳滨对虾感染多种病原,在病虾样本中,3种病毒和一种寄生虫均能检测到,其中IHHNV和EHP的感染率较高,分别为65.4%和34.6%,WSSV感染率为19.2%, TSV的感染率最低,只有7.7%。这表明IHHNV和EHP是本地区对虾感染率最高的两种病原。
3.1.1 WSSV的流行特点 本研究结果表明, WSSV的感染率为19.2%,作者认为这与调查工作在8月进行有关。众所周知,WSSV是当前对虾养殖业危害最严重的病原,其感染力强、传播速度快,会导致被感染对虾短时间内大量死亡。中国对虾感染WSSV后死亡率几乎达100%,而南美白对虾则对WSSV具有一定的抵抗力,受感染后有部分个体可存活下来,但终生带毒,其死亡率往往与养殖环境和管理水平呈负相关[16]。在北方地区WSSV引起对虾大批死亡的时间一般在6—7月份,此时可引起暴发性死亡[14],而幸存者则可携带病毒存活到养殖中后期,其发病与否与该地区养殖环境、控制水平和管理的规范程度有关。推测若在6—7月份进行调查,WSSV的感染率会更高。
3.1.2 IHHNV的流行特点 IHHNV能够感染包括受精卵在内的各个生长阶段的对虾,感染后对虾终生带毒,并能通过垂直和水平方式进行传播[17-18]。IHHNV可导致对虾生长缓慢、规格大小差异大和畸形,但死亡率却不高[19-20],也会引起对虾的矮小畸形症候群(Runt-deformity syndrome, RDS)。本试验结果显示,8月份辽宁省盘锦、营口地区的26个自然发病的凡纳滨对虾养殖池塘中, IHHNV的检出率最高,高达65.4%。本次调查中发现,该地区凡纳滨对虾未出现暴发性大规模死亡,而普遍以生长缓慢、个体大小差异大的症状为主。IHHNV感染率高、死亡率低,在本地区该养殖时期成为最主要的流行病原,且与发病特征相吻合。此外,检测结果还显示,IHHNV的检出与对虾体型大小无关,这与Kalagayan等[20]的试验结果相符。该病毒的发病程度与饲养、管理水平有关,一般不急性发病,感染率较高,其危害主要是影响生长。浙江省养殖凡纳滨对虾IHHNV的检出率更高,达100%[3],表明IHHNV已严重感染中国南北沿海地区的凡纳滨对虾,因此,加强对IHHNV的防控措施十分必要。
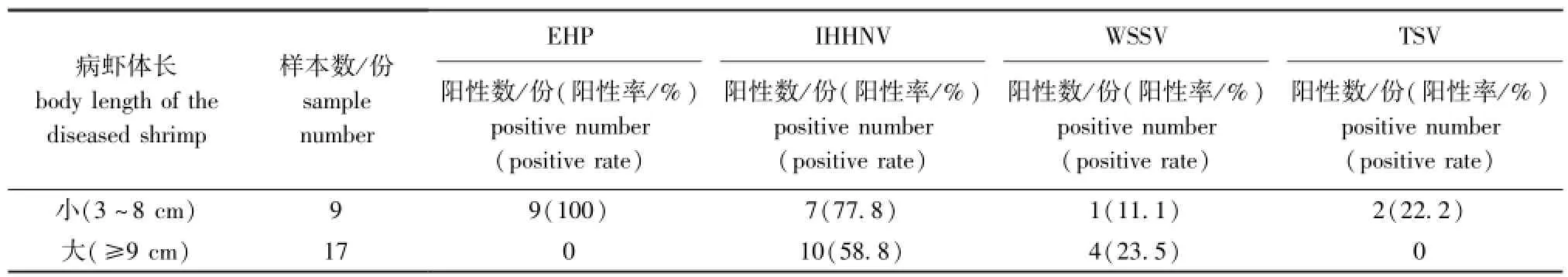
表3 不同体长病虾EHP、IHHNV、WSSV、TSV的感染率Tab.3 Incidence rates of EHP,IHHNV,WSSV and TSV among Pacific white leg shrimpLitopenaeus vannameisamples with different body length

图4 部分被检病虾样本中EHP LAMP检测结果Fig.4 LAMP detection of EHP among Pacific white leg shrimpLitopenaeus vannamei
3.1.3 TSV的流行特点 TSV原本是凡纳滨对虾的主要病原,但此次仅有两个池塘样本呈阳性,且均为小虾样本。这与TSV的感染率逐年下降的趋势相吻合[3]。由此可见,近年来TSV并未对国内凡纳滨对虾的养殖造成大的危害。
3.1.4 EHP的流行特点 目前,EHP已在中国多个对虾养殖区被检出,且检出率有增加的趋势。EHP导致受感染的对虾生长阻滞、个体大小差异明显,且会导致细菌的继发感染[21]。本研究结果表明,辽宁地区对虾EHP的检出率较高,达34.6%,是该地区的主要流行病原。本研究中检测呈阳性的池塘中对虾生长缓慢,个体大小差异极其明显,小虾几乎不蜕壳且活力差,但吃料正常,且EHP仅在小虾样本中检测到,其检出率高达100%,而大虾样本中则均未检出。EHP检测结果呈阳性的9个池塘中有7份样品也同时检出IHHNV,两种病原混合感染比例较高。这与刘宝彬等[22]、陈禄芝等[23]的研究结果相符。
3.2 防治建议及对策
本次调查发现,辽宁省盘锦、营口地区养殖凡纳滨对虾病原以IHHNV和EHP为主,而不是以往备受关注的WSSV和TSV,这表明养殖对虾的疾病是动态发展与变化的。因此,相关部门应加大对养殖对虾主要流行疾病的监测,及时揭示对虾疾病的流行规律及趋势,以便有针对性的指导防控工作。目前,养殖户和科研工作者应更加关注IHHNV和EHP所带来的危害,做好相应防治工作。同时调查还发现,同一池塘对虾存在多种病原同时感染情况,因此,在进行对虾病害防治工作中应对多种病原采取综合防控措施。
[1] Lightner D V,Bell T A,Redman R M.A review of the known host, geographic range and current diagnostic procedures for the virus diseases of cultured penaeid shrimps[C]//Advances in tropical aquaculture,Tahiti,20 Feb.-4 Mar.1989.Actes de Colloque 9.Plouzane:AQUACOP IFREMER.Centre de Brest.Plouzane, France,1990:113-126.
[2] Lightner D V,Redman R M.Shrimp diseases and current diagnostic methods[J].Aquaculture,1998,164(1-4):201-220.
[3] 林开,侯崇林,谢荣辉,等.三种对虾病毒在浙江省凡纳滨对虾中的流行性调查研究[J].水产科学,2013,32(3):161-164.
[4] Tang K F J,Pantoja C R,Redman R M,et al.Development of in situ hybridization and PCR assays for the detection of Enterocytozoon hepatopenaei(EHP),a microsporidian parasite infecting penaeid shrimp[J].Journal of Invertebrate Pathology,2015,130:37-41.
[5] 李强,乔帼,付雷,等.凡纳滨对虾感染白斑综合症病毒后的新症状[J].水产科学,2008,27(9):466-469.
[6] 仇登高,张松柏,孙圣贤,等.辽宁大石桥南美白对虾的常见疾病及其防治[J].渔业致富指南,2008(19):51.
[7] 方倩.辽宁对虾暴发病毒病的调查[J].畜牧兽医科技信息, 2002(1):41.
[8] 赫崇波,党中印,徐盛基,等.辽宁对虾暴发性病毒病防治现状及建议[J].水产科学,2001,20(6):36-37.
[9] 李霞,刘淑范,李华,等.大连地区中国对虾暴发性流行病病理学研究[J].中国水产科学,1997,4(1):52-59.
[10] 王斌,姜静颖,李华,等.中国对虾一种病原病毒负染法电镜检测[J].大连水产学院学报,1996,11(1):22-27.
[11] 李华,王斌,李霞,等.1993年中国对虾暴发性流行病病虾肝胰腺组织病理研究[J].大连水产学院学报,1995,10(1):22-27.
[12] 国际翔,王丽霞,李文清,等.辽宁沿海养殖对虾暴发性病害的病因分析[C]//第八次全国电子显微学会议论文摘要集(Ⅰ).北京:中国电子显微镜学会,1994:355.
[13] 李华,王斌,姜静颖,等.辽宁省中国对虾暴发性流行病病原研究[J].水生生物学报,1998,22(S):63-71.
[14] 姚洪,张吉鹏,杨川,等.辽宁一例凡纳滨对虾大规模死亡的病原研究[J].大连海洋大学学报,2016,31(3):256-260.
[15] Office International Des Epizooties.Manual of Diagnostic Tests for Aquatic Animals[M].Paris:Office International Des Epizooties, 2016.
[16] Tsai Y L,Wang H C,Lo C F,et al.Validation of a commercial insulated isothermal PCR-based POCKIT test for rapid and easy detection of white spot syndrome virus infection in Litopenaeus vannamei[J].PLoS One,2014,9(3):e90545.
[17] Motte E,Yugcha E,Luzardo J,et al.Prevention of IHHNV vertical transmission in the white shrimp Litopenaeus vannamei[J]. Aquaculture,2003,219(1-4):57-70.
[18] Ramasamy P,Brennan G P,Jayakumar R.A record and prevalence of Monodon baculovirus from postlarval Penaeus monodon in Madras,India[J].Aquaculture,1995,130(2-3):129-135.
[19] 杨冰,宋晓玲,黄倢,等.对虾传染性皮下及造血组织坏死病毒(IHHNV)的流行病学与检测技术研究进展[J].中国水产科学,2005,12(4):519-524.
[20] Kalagayan H,Godin D,Kanna R,et al.IHHN virus as an etiological factor in runt-deformity syndrome(RDS)of juvenile Penaeus vannamei cultured in Hawaii[J].Journal of the World Aquaculture Society,1991,22(4):235-243.
[21] Tangprasittipap A,Srisala J,Chouwdee S,et al.The microsporidian Enterocytozoon hepatopenaei is not the cause of white feces syndrome in whiteleg shrimp Penaeus(Litopenaeus)vannamei[J]. BMC Veterinary Research,2013,9:139.
[22] 刘宝彬,杨冰,吕秀旺,等.对虾传染性皮下及造血组织坏死病毒(IHHNV)及虾肝肠胞虫(EHP)的荧光定量PCR检测[C]//2015年中国水产学会学术年会论文摘要集.北京:中国水产学会,2015.
[23] 陈禄芝,余霞艳,胡一丞,等.粤西地区凡纳滨对虾虾肝肠胞虫、传染性皮下和造血组织坏死病毒感染情况的初步调查[J].渔业研究,2016,38(4):273-280.
Epidemiological investigation of three major viruses and Enterocytozoon hepatopenaei(EHP)in Pacific white leg shrimp Litopenaeus vannamei in Liaoning Province
WANG Bo-ya,WANG Li,LIU Mei-ru,YE Shi-gen,LI Rui-jun,LI Hua,LI Qiang
(Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China)
White spot syndrome virus(WSSV),infectious hypodermal and hematopoietic necrosis virus(IHHNV) and Taura syndrome virus(TSV)were detected by nested-PCR and RT-PCR and Enterocytozoon hepatopenaei (EHP)was detected by LAMP(Loop-mediated Isothermal Amplication)kit in diseased Pacific white leg shrimp Litopenaeus vannamei collected from 26 shrimp culture ponds in Yingkou and Panjin,Liaoning Province in August 2015.The results showed that the IHHNV had incidences of 65.4%with positive rates of 19.2%and EHP had incidences of 34.6%.While the TSV showed positive rates of 7.7%.EHP positive was found in all the small shrimp samples and seven diseased shrimp samples showed co-infection of IHHNV and EHP.There was higher positive rate in large-sized shrimp samples(100%)than in small-sized shrimp samples(0%).The findings indicated that IHHNV and EHP were major pathogens in Pacific white leg shrimp in Liaoning Province in August 2015.
Litopenaeus vannamei;infectious hypodermal and hematopoietic necrosis virus(IHHNV);white spot syndrome virus(WSSV);Taura syndrome virus(TSV);Enterocytozoon hepatopenaei(EHP)
10.16535/j.cnki.dlhyxb.2017.02.005
2095-1388(2017)02-0150-05
Q954.4
:A
2016-11-17
辽宁省海洋渔业厅重点攻关项目(201402)
王博雅(1991—),女,硕士研究生。E-mail:769352220@qq.com
李强(1979—),男,博士,教授。E-mail:liqiang@dlou.edu.cn

