大菱鲆脂联素受体基因的克隆及饲料糖脂比对其表达的影响
韩冬冬苗淑彦,聂 琴苗惠君魏泽宏张文兵麦康森
(1. 中国海洋大学水产学院, 农业部水产动物营养与饲料重点实验室, 海水养殖教育部重点实验室, 青岛 266003; 2. 扬州大学动物科学与技术学院, 扬州 225009)
大菱鲆脂联素受体基因的克隆及饲料糖脂比对其表达的影响
韩冬冬1苗淑彦1,2聂 琴1苗惠君1魏泽宏1张文兵1麦康森1
(1. 中国海洋大学水产学院, 农业部水产动物营养与饲料重点实验室, 海水养殖教育部重点实验室, 青岛 266003; 2. 扬州大学动物科学与技术学院, 扬州 225009)
脂联素作为一种重要的细胞因子在哺乳动物中起到调节糖脂代谢的重要作用, 为探究脂联素在大菱鲆糖脂代谢中是否具有同样的调节作用, 研究利用分子克隆和RACE技术克隆到了大菱鲆脂联素AdipoR1受体和AdipoR2受体的基因全长序列。其中AdipoR1受体的核苷酸序列全长为1125 bp, 共编码375个氨基酸, 氨基酸序列与其他脊椎的同源性都很高。AdipoR2受体的核苷酸序列全长为1940 bp, 共编码380个氨基酸, 氨基酸序列与其他脊椎动物同源性也都很高。蛋白跨膜结构域预测得出大菱鲆AdipoR1和AdipoR2都具有7个明显的跨膜区, 最优拓扑模型为N端在细胞内侧模型, 与其他脊椎动物相同。配制不同糖脂比(1:6, 1:2, 2:1和14:1)的饲料养殖大菱鲆9周, 利用实时荧光定量PCR技术检测大菱鲆肌肉和肝脏中脂联素受体基因的表达量。结果显示, 在饲料糖脂比为1:2的处理组中, 大菱鲆肌肉中AdipoR1的表达量显著低于糖脂比为1:6的处理组(P<0.05), 但与其他2组无显著差异。饲料糖脂比的变化对肌肉中AdipoR2和肝脏中这2种受体的表达量均没有产生显著影响(P>0.05)。由此可见, 饲料糖脂比的变化可能通过改变脂联素受体的表达量, 从而间接影响大菱鲆体内脂联素的作用。AdipoR1和AdipoR2对饲料糖脂比变化的反应不同步, 而且肌肉和肝脏中脂联素受体对饲料糖脂比变化的反应也存在不同。适量提高饲料糖脂比可以显著下调肌肉中AdipoR1的表达。
大菱鲆; 脂联素; 脂联素受体; 糖脂比; 基因表达
脂联素(Adiponectin)是哺乳动物脂肪组织特异性分泌的一种胶原样细胞因子, 与C1q和TNF-α家族具有结构同源性[1]。根据聚合度的不同, 可分为球型脂联素和全长型脂联素[2]。在哺乳动物中, 脂联素作用广泛, 参与机体糖脂代谢调控和炎症抵抗等生理活动[3]。特别是在糖代谢调控方面, 其可增强胰岛素敏感性, 改善高脂摄食引起的胰岛素抵抗[4]。还具有阻碍细胞因子诱导的β细胞的凋亡, 修复β细胞功能紊乱的作用[5]。脂联素能够抑制肝脏中的糖异生过程, 减少内源性葡萄糖的生成, 增加肌细胞对葡萄糖的摄取[6,7]。
脂联素通过脂联素受体的介导发挥作用, 后者包含2种亚型, 即AdipoR1和AdipoR2。脂联素受体含有7个跨膜结构, 但与G蛋白偶联受体的结构相反, 它们的N端在细胞内, 而C端在细胞外, 因此脂联素受体可能不通过与G蛋白偶联发挥作用, 而是直接与下游信号分子作用。AdipoR1对球型脂联素亲和力高, 对全长型脂联素亲和力低。而AdipoR2对两种脂联素具有同等亲和力。人体多种组织细胞表面都有脂联素受体, 其中AdipoR1主要在骨骼肌细胞表达, AdipoR2主要在肝细胞中表达。这两种受体的分布与不同类型的脂联素在骨骼肌和肝脏中发挥不同的作用有关[8]。
目前在鱼类中成功克隆到脂联素基因的只有斑马鱼(Danio rerio)和虹鳟(Oncorhynchus mykiss)[9,10]。在斑马鱼中克隆到脂联素2种类型的基因, 但在虹鳟中只克隆到1种类型。斑马鱼和虹鳟脂联素的基因表达受到禁食的影响。在斑马鱼、虹鳟和点带石斑鱼(Epinephelus coioides)中均成功克隆到2种亚型的脂联素受体基因[9,11,12], 此外, 在GenBank数据库中还发现了大西洋鲑(Salmo salar)、青鳉(Oryzias latipes)、罗非鱼(Oreochromis niloticus)和红鳍东方鲀(Takifugu rubripes)等鱼类的2种亚型脂联素受体的基因信息, 其中斑马鱼和红鳍东方鲀的AdipoR1型受体又存在同源性较高的AdipoR1a和AdipoR1b两个亚型。斑马鱼、虹鳟和点带石斑鱼中的研究表明, 脂联素受体基因的表达量均受到禁食状态的影响[9,11,12]。在虹鳟中的研究还表明, 胰岛素、生长激素和炎症反应等会对脂联素受体产生不同的影响, 并且脂联素可以激活肌肉中的Akt信号因子, 可能与促进脂肪酸摄入和氧化的功能有关[12]。
大菱鲆(Scophthalmus maximus)属于鲽形目(Pleuronectiformes), 鲆科(Bothidae)。作为肉食性鱼类的一种, 其对饲料糖的利用能力较弱。当饲料糖含量超过15%时就会抑制其幼鱼的生长, 并会对内脏器官产生不良的影响[13]。Nijhof和Bult[14]的研究表明大菱鲆糖类代谢系统并没有缺陷, 聂琴[15]的研究也表明, 大菱鲆幼鱼糖代关键谢酶的基因表达和活性均会对饲料糖水平的变化做出响应。然而,大菱鲆不耐受高糖的机制仍不清楚。本研究采用RT-PCR和RACE技术, 克隆大菱鲆AdipoR1和AdipoR2的cDNA全长序列, 同时利用实时荧光定量PCR技术, 探讨不同饲料糖脂比对AdipoR1和AdipoR2基因表达的影响, 为研究脂联素及其受体在大菱鲆糖脂代谢中的调控作用提供基础数据。
1 材料与方法
1.1 脂联素受体AdipoR1和AdipoR2基因全长序列的克隆
基因核心片段序列的克隆 采用RNAiso PlusTrizol试剂(TaKaRa, 日本)提取大菱鲆肝脏总RNA, cDNA第一链合成使用PrimeScript Reverse Transcriptase试剂盒(TaKaRa, 日本)。
选取NCBI的GenBank中人(Homo sapiens)、大鼠(Rattus norvegicus)、非洲爪蟾(Xenopus laevis)、斑马鱼(Danio rerio)、虹鳟(Oncorhynchus mykiss)、罗非鱼(Oreochromis mossambicus)和青鳉(Oryzias melastigma)等10个物种脂联素受体氨基酸序列为模板, 通过引物设计软件CODEHOP设计AdipoR1和AdipoR2的简并引物, 见表 1。
PCR扩增体系总体积为25 μL, 包括: 12.5 μL的2×EsTaqMsterMix(北京康为世纪生物科技有限公司), 9.5 μL的dH2O, 1.0 μL的cDNA模板, 以及上游和下游引物(10 μmol/L)各1 μL。PCR扩增反应均在Eppendorf Mastercycler gradient PCR仪(Eppendorf,德国)中进行, 反应条件如下: 94℃预变性3min, 94℃变性30s, 55℃退火30s, 72℃延伸1min, 30个循环, 最后72℃后延伸10min。
用1.2%琼脂糖凝胶电泳检验PCR产物, 采用快速琼脂糖凝胶DNA回收试剂盒(北京康为世纪生物科技有限公司)进行胶回收。选择pEASY-T1载体(北京全式金生物技术有限公司)为连接载体, 将胶回收产物转化至Trans1-T1感受态细胞中, 用蓝白斑筛选的方法和菌落PCR挑选含有目的片段的菌液,送生工生物工程(上海)股份有限公司进行测序。
基因5′端和3′端序列扩增 根据克隆得到的大菱鲆AdipoR1和AdipoR2基因的核心片段, 利用Primer5软件, 设计3′RACE和5′RACE PCR扩增所需要的内、外套引物(表 1)。3′RACE和5′RACE PCR操作所需cDNA第一链的合成采用SMARTer RACE cDNA Amplication Kit试剂盒(Clontech, 美国)。RACE外套PCR扩增使用基因外套引物和试剂盒中提供的UPM引物, 内套PCR扩增使用基因内套引物和试剂盒中提供的NUP引物, 产物回收、纯化和测序均同核心片段克隆。
1.2 AdipoR1和AdipoR2基因全长序列分析
受体基因序列的开放阅读框和编码的氨基酸序列预测采用DNAMAN软件, 使用在线软件TMHMMServer v. 2.0(http://www.cbs.dtu.dk/services/ TMHMM/)进行氨基酸序列的跨膜区预测, 蛋白质分子量和等电点预测采用在线软件Compute pI/Mw tool (http://web.expasy.org/compute_pi/), 氨基酸多重序列比对采用BioEdit软件中的Sequence Alignment Editor, 氨基酸序列的进化树构建采用MEGA 4.0 软件的neighbor-joining方法。
一方面,尽管东昌区政府高度重视并采取一系列卓有成效的措施支持葫芦文化产业的发展,却没有深刻认识到葫芦文化在乡村旅游中的发展地位,没有充分抓住山东省全面开发乡村旅游的良好机遇,利用本地丰富的葫芦文化旅游资源,大力发展极具地域特色的乡村旅游。另一方面,社区居民对种植、加工葫芦的收入较为满意,且因文化层次较低,缺少乡村旅游开发经验,从而对开发葫芦文化旅游缺乏足够的信心和热情。
1.3 AdipoR1和AdipoR2基因组织差异表达检测
提取大菱鲆脑、眼、鳃、肝脏、胃、脾、肾、肠、幽门盲囊和肌肉10个组织的总RNA, 并利用PrimeScript RT reagent Kit with gDNA Eraser (Takara, 日本)试剂盒进行cDNA第一链的合成, 用于反转录的RNA为1 μg。根据得到的基因全长序列, 利用Primer5.0软件设计特异性定量引物, 选择β-actin为内参基因, 作为参照用于定量基因在每个组织中的mRNA水平, 并验证每个组织cDNA模板的完整性, AdipoR1和AdipoR2定量引物和内参基因引物及对应退火温度见表 1。PCR反应体系和反应条件同基因核心序列扩增, 1.2%琼脂糖凝胶电泳检测各组织扩增产物, 根据条带亮度推测基因在不同组织中的表达差异。
1.4 不同饲料糖脂比对大菱鲆肌肉中AdipoR1和AdipoR2表达的影响
实验饲料的设计和配制 以糊精为主要糖源, 鱼油和大豆卵磷脂为主要脂肪源, 白鱼粉、酪蛋白和明胶为蛋白源, 配制等氮等能的实验饲料。对照组为不添加糊精的基础饲料, 粗蛋白和粗脂肪含量分别为50%和12%。其他组分别添加糊精5%、15%和28%, 通过调节鱼油含量使4组饲料糖脂比分别为1:6、1:2、2:1和14:1, 分别命名为Diet-1、Diet-2、Diet-3和Diet-4。饲料原料粉碎并过80目筛, 按饲料配方逐级放大混合均匀, 再加入大豆卵磷脂和鱼油, 手工搓油后混匀, 最后加入蒸馏水揉成面团, 用制粒机(EL-260, 山东威海友谊机械厂)压出直径为1.5 mm的颗粒饲料, 50℃恒温烘干后保存于–20℃备用。饲料配方及成分分析见表 2。
养殖实验和取样 实验用大菱鲆为人工培育的同一批苗种。养殖实验采用室内循环水养殖系统, 位于青岛鳌山卫国家海洋科研中心。在正式实验前, 用商品饲料(青岛七好生物科技有限公司)饱食投喂2周, 使实验用鱼适应养殖环境。禁食24h后, 将体重接近的大菱鲆幼鱼[平均体重(8.06± 0.08) g]随机分为4组, 每组3个重复, 每个实验桶(聚乙烯材料, 500 L)28尾鱼。养殖实验持续9周, 每日上午07:00和下午18:00各饱食投喂1次, 实验期间水温为(19±1)℃, pH为7.7±0.1, 盐度为(25.2±1.0)%, 溶氧大于6.0 mg/L。
实验结束取样前, 实验鱼禁食24h, 每桶随机取3尾鱼用丁香酚麻醉后, 取肌肉和肝脏组织。取样过程在冰上进行, 组织放入1.5 mL无RNase离心管中, 液氮速冻后–80℃保存。
实时荧光定量PCR检测肌肉和肝脏中AdipoR1和AdipoR2基因表达水平 大菱鲆肌肉和肝脏组织总RNA提取, cDNA第一链合成, 以及定量引物同1.3。实时荧光定量PCR反应在Mastercycler ep realplex荧光定量PCR仪中进行(Eppendorf, 德国),采用的荧光染料为SYBR Green I (北京康为世纪生物科技有限公司)。反应体系包括: UltraSYBR Mixture 12.5 μL, cDNA 3 μL (50 ng/μL), 上下游引物(10 μmol/L)各1 μL和dH2O 7.5 μL。反应程序为95℃ 10min后, 40个循环的95℃ 10s, 60℃ 10s, 以及72℃ 20s。反应结束后进行溶解曲线分析: 95℃15s, 60℃ 15s, 然后用15min升温到95℃并保持15s。选择β-actin为内参基因, 目的基因和内参基因的定量引物的扩增效率一致且接近1, 基因的相对表达水平计算用“2–ΔΔCt”法[16]。

表 1 大菱鲆脂联素受体AdipoR1和AdipoR2全长序列克隆和基因表达量检测所用引物Tab. 1 Primers for cloning and RT-PCR
1.5 统计分析
采用SPSS17.0对实验数据进行单因素方差分析, 当差异显著(P<0.05)时, 用Tukey检验进行多重比较。
2 结果
2.1 AdipoR1和AdipoR2基因全长序列分析
大菱鲆AdipoR1核苷酸序列全长1514 bp, 包括开放阅读框(ORF)1125 bp, 5′-非编码区(5′-UTR) 120 bp, 3′-非编码区(3′-UTR) 254 bp。GenBank序列号为KF201648。ORF从第121 bp到第1249 bp编码由375个氨基酸构成的前体蛋白, 预测其分子量为42.25 kD, 等电点为5.62。通过在线功能域预测软件分析发现大菱鲆AdipoR1具有一个保守的Hly III结构域(F130-F353)。经NCBI blastx比对大菱鲆AdipoR1与其他脊椎动物的同源性, 结果显示与人类、斑马鱼、大西洋鲑、红鳍东方鲀、虹鳟、罗非鱼和青鳉同源性分别为80%、81%、92%、93%、92%、97%和94%。结合多种脊椎动物AdipoR1氨基酸序列多重比对结果可以看出, AdipoR1在脊椎动物中的保守性非常高。系统进化树结果表明, 大菱鲆AdipoR1与罗非鱼、红鳍东方鲀、青鳉和大西洋鲑聚为一支, 自展支持率为100%, 哺乳动物和鸟类各自聚为一支后与两栖类共同聚为一支, 自展支持率为100% (图 1)。
大菱鲆AdipoR2核苷酸序列全长1940 bp, 包括5′-UTR 356 bp, 3′-UTR 444 bp, ORF从第357 bp到第1497 bp, 共编码380个氨基酸, GenBank序列号为KP204852。预测AdipoR2蛋白分子量为42.66 kD,等电点为5.73。通过在线功能域预测软件分析发现大菱鲆AdipoR1具有一个保守的HlyIII结构域(F134-F357)。经NCBI blastx比对大菱鲆AdipoR2与其他脊椎动物的同源性, 结果显示, 大菱鲆AdipoR2氨基酸序列与人类、非洲爪蟾、斑马鱼、罗非鱼、红鳍东方鲀和青鳉的同源性分别为78%、74%、93%、92%、89%和87%, 多种脊椎动物AdipoR2氨基酸序列多重比对结果表明, AdipoR2在脊椎动物中的保守性非常高。通过构建系统进化树发现, 大菱鲆AdipoR2与所有鱼类聚为一支, 哺乳动物和鸟类聚为一支(图 2)。
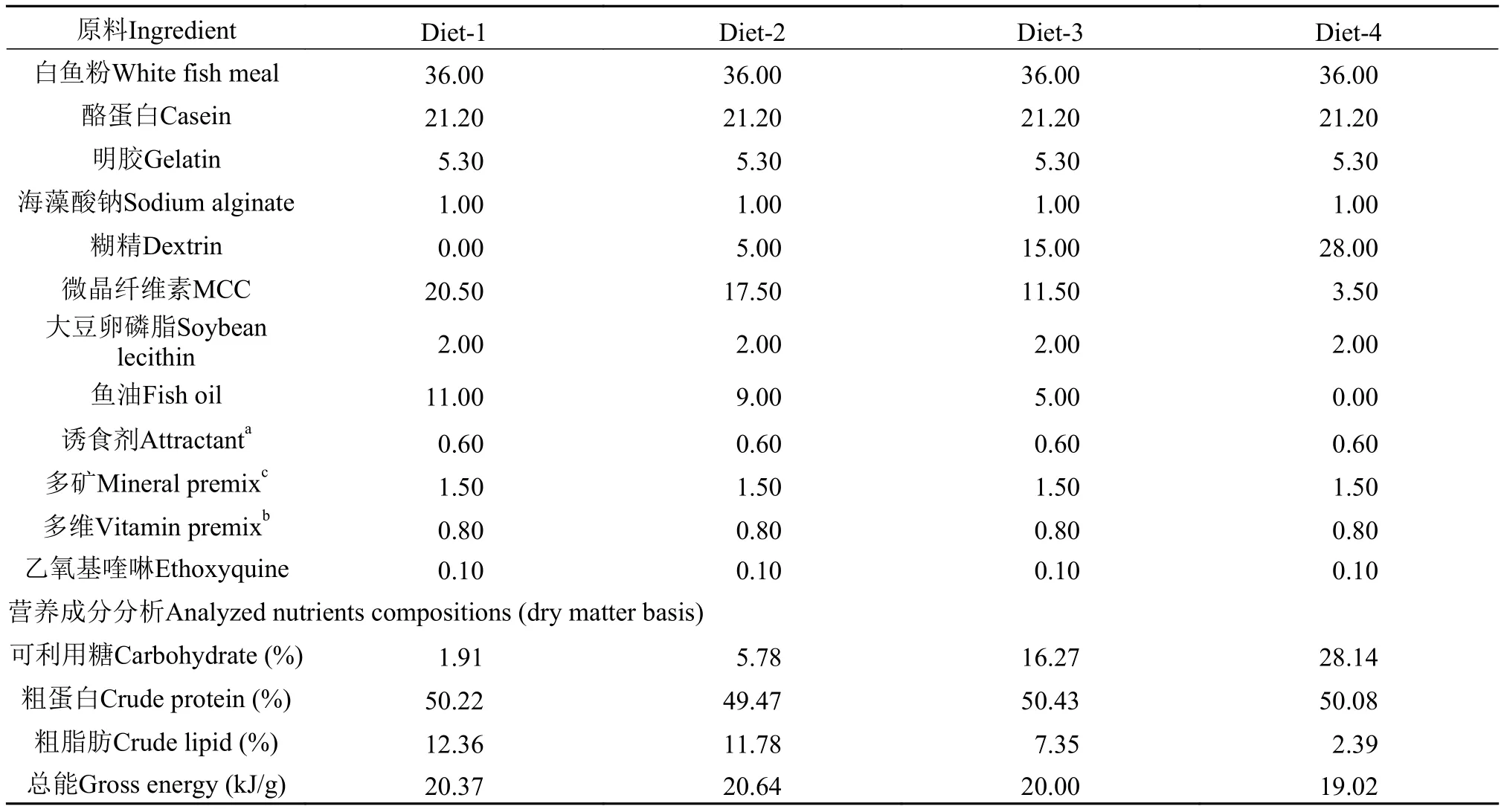
表 2 实验饲料配方及营养组成Tab. 2 Ingredients and compositions of the experimental diets (%)

图 1 大菱鲆与其他物种脂联素受体AdipoR1氨基酸序列系统进化树分析Fig. 1 Phylogenetic analysis of adiponectin receptor AdipoR1每个节点处的数字表示自展支持率, 自展值检验为1000次重复抽样。GenBank序列号分别为: 人(NP_057083.2)、羊(NP_ 001272659.1)、鸡 (NP_001026198.1)、蛙(AAH80374.1)、大西洋鲑 (NP_001133596.1)、红鳍东方鲀a (XP_003973528.1)、红鳍东方鲀b (XP_003973529.1)、罗非鱼(XP_003441547.1)、青鳉(XP_004069161.1)Numbers at nodes indicate the bootstrap value (%) that obtained from 1000 replicates. GenBank Accession No.: Human (NP_ 057083.2); Goat (NP_001272659.1); Chicken (NP_001026198.1); Frog (AAH80374.1); Atlantic salmon (NP_001133596.1); Pufferfish a (XP_003973528.1); Pufferfish b (XP_003973529.1); Tilapia (XP_003441547.1); Japanese medaka (XP_004069161.1)
通过蛋白跨膜结构域预测得出大菱鲆AdipoR1和AdipoR2都具有7个明显的跨膜区, 最优拓扑模型为N端在细胞内侧模型。AdipoR1和AdipoR2氨基酸序列都可以分为4部分: 不保守的N端区、保守的N端区、HlyIII区域(编码7个跨膜螺旋束)和C端区。
2.2 大菱鲆AdipoR1和AdipoR2组织差异表达
AdipoR1在所选10个组织中均有表达, 其中在鳃和肾脏中表达最多, 其次为胃、脾和幽门盲囊; AdipoR2在肠和肾脏中表达量最高, 其次为鳃、胃和幽门盲囊(图 3)。
2.3 不同饲料糖脂比对大菱鲆肌肉和肝脏中AdipoR1和AdipoR2基因表达的影响
饲料糖脂比为1:2处理组肌肉中AdipoR1的表达量显著低于对照组(糖脂比为1:6)(P<0.05), 但与其他两组无显著差异(P>0.05)(图 4A)。饲料糖脂比变化对肌肉中AdipoR2的表达无显著影响(P>0.05,图 4B)。饲料糖脂比变化对肝脏中AdipoR1和AdipoR2的表达均无显著影响(P>0.05, 图 4C、4D)
3 讨论

图 2 大菱鲆与其他物种脂联素受体2氨基酸序列系统进化树分析Fig. 2 Phylogenetic analysis of adiponectin receptor AdipoR2每个节点处的数字表示自展支持率, 自展值检验为1000次重复抽样。GenBank序列号分别为: 人类(NP_078827.2)、小鼠(AAI54263.1)、鸭(EOB08163.1)、红鳍东方鲀(XP_003972858.1)、罗非鱼(XP_003445015.1)、青鳉(XP_004083071.1)、斑马鱼(AAI54263.1)Numbers at nodes indicate the bootstrap value (%) that obtained from 1000 replicates. GenBank Accession No.: Human (NP_ 078827.2); Mouse (AAI54263.1); Duck (EOB08163.1); Pufferfish (XP_003972858.1); Tilapia (XP_003445015.1); Japanese medaka (XP_004083071.1); Zebrafish (AAI54263.1)

图 3 大菱鲆脂联素受体AdipoR1(AR1)和AdipoR2(AR2)的组织差异表达分析Fig. 3 The expression of turbot adipnectin receptor AdipoR1 (AR1) and AdipoR2 (AR2) in multiple tissuesL. 分子量梯度; 1. 眼; 2. 脑; 3. 鳃; 4. 胃; 5. 肠; 6. 肝; 7. 肾; 8. 脾; 9. 幽门盲囊; 10. 肌肉; N. 阴性对照。内参基因β-actin (β-AC)用来验证每个组织cDNA模板的完整性L. Ladder; 1. Eyes; 2. Brain; 3. Gill; 4. Stomach; 5. Intestine; 6. Liver; 7. Kidney; 8. Spleen; 9. Pyloric caeca; 10. Muscle; N. Negative control. β-actin (β-AC) was used as an internal control
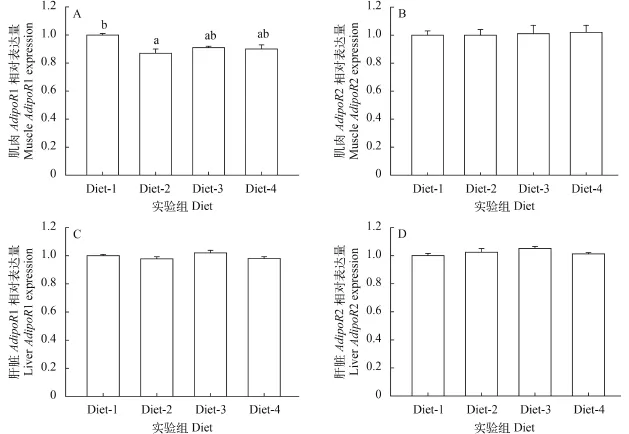
图 4 不同饲料糖脂比对大菱鲆肌肉和肝脏中脂联素受体AdipoR1和AdipoR2基因表达的影响Fig. 4 Effects of dietary carbohydrate-to-lipid ratios on turbot AdipoR1 and AdipoR2 expression in muscle and liver实验数据用平均数±标准误(n=3)表示, 不同字母表示不同处理间有显著差异(P<0.05)Each bar represents the mean ±SEM of three replicates. Significant difference among the diets are indicated by different letters (P<0.05)
与哺乳动物相同, 大菱鲆脂联素受体有AdipoR1和AdipoR2亚型, 其包括N端结构域、HlyIII结构域和C端结构域。HlyIII结构域在脊椎动物中保守性很高, 可能是脂联素受体形成特殊拓扑结构和发挥生理功能的关键。跨膜结构域预测结果显示, 大菱鲆脂联素受体的最优拓扑模型为N端在细胞内, C端在细胞外的模型, 这与小鼠等动物中的研究一致[8], 因此, 脂联素只能与受体在细胞外的C端结合, 进而通过受体在细胞内的N端激活下有信号因子发挥作用。已报道的哺乳动物脂联素受体可以与多种衔接蛋白结合, 激活不同信号通路, 包括亮氨酸拉链基元和蛋白激酶CK2 β亚基等[17,18]。与点带石斑鱼[11]中的结果相似, 大菱鲆AdipoR1和AdipoR2的N端区可以明显划分为两个区域: 一个不保守N端区和一个保守的N端区。与其他区域不同, 鱼类不保守的N端区与其他脊椎动物的同源性很低, 这表明鱼类可能具有一些不同于其他物种的脂联素受体结合蛋白, 鱼类脂联素受体下游信号通路及生理功能可能与其他脊椎动物存在差异。
与其他脊椎动物的脂联素受体一样, 大菱鲆两种脂联素受体组织表达广泛, 说明脂联素受体可以在多种组织中发挥生理功能。在人和小鼠中的研究显示, 脂联素水平与肾脏疾病具有一定相关性,脂联素在肾脏氧化应激等方面发挥重要作用[19]。与点带石斑鱼相似, 大菱鲆AdipoR1在肾脏中的表达量最高, 表明大菱鲆脂联素在肾脏中同样具有重要的作用。此外AdipoR1在大菱鲆鳃中也具有较高的表达水平, 在其他鱼种还未见类似报道, 脂联素在大菱鲆鳃部的功能还需进一步探究。与哺乳动物脂联素受体在肌肉中大量表达不同[8,20], 大菱鲆脂联素受体在肌肉中的表达量较少, 与AdipoR1相比, AdipoR2在肌肉中mRNA水平更低, 推测大菱鲆脂联素主要通过AdipoR1在肌肉中发挥作用。
脂联素受体AdipoR1和AdipoR2的表达受到胰岛素的调控。在AdipoR1和AdipoR2高表达的小鼠骨骼肌中, 补充胰岛素后会引起这两种受体表达的减少[21]。发生胰岛素抵抗的糖尿病小鼠中研究也表明, 血浆胰岛素水平和脂联素受体的表达呈负相关[22]。在本研究中, 随着糖添加量的增加, 大菱鲆血清胰岛素水平从(9.19±0.89) ng/mL上升到(22.20±0.58) ng/mL(未发表数据), 肌肉中AdipoR1表达的下调可能与上升的胰岛素水平有关。此外,在给予胰岛素后, 糖尿病小鼠骨骼肌和C2C12肌细胞中都发现AdipoR1表达量大幅减少, 但AdipoR2的表达没有显著变化[23]。Staiger等[24]在正常葡萄糖耐量的人类肌细胞中的研究也表明, 胰岛素分泌与AdipoR1的表达有关, 而可能与AdipoR2的表达无关。与哺乳动物相似, 虹鳟腹腔注射胰岛素后, 肌肉中AdipoR1表达受到抑制, 但AdipoR2的表达没有显著变化[12]。本研究同样发现, 饲料糖变化引起血清胰岛素水平的改变虽然下调了肌肉中AdipoR1的表达, 却并没有引起肌肉AdipoR2表达量的变化, 推测大菱鲆脂联素可能主要通过AdipoR1在肌肉中发挥与胰岛素或糖代谢相关的作用。
[1]Scherer P E, Williams S, Fogliano M, et al. A novel serum protein similar to C1q, produced exclusively in adipocytes [J]. Journal of Biological Chemistry, 1995, 270(45): 26746—26749
[2]Waki H, Yamauchi T, Kamon J, et al. Impaired multimerization of human adiponectin mutants associated with diabetes molecular structure and multimer formation of adiponectin [J]. Journal of Biological Chemistry, 2003, 278(41): 40352—40363
[3]Yamauchi T, Kamon J, Minokoshi Y, et al. Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase [J]. Nature Medicine, 2002, 8(11): 1288—1295
[4]Berg A H, Combs T P, Du X, et al. The adipocytesecreted protein Acrp30 enhances hepatic insulin action [J]. Nature Medicine, 2001, 7(8): 947—953
[5]Rakatzi I, Mueller H, Ritzeler O, et al. Adiponectin counteracts cytokine-and fatty acid-induced apoptosis in the pancreatic beta-cell line INS-1 [J]. Diabetologia, 2004, 47(2): 249—258
[6]Combs T P, Berg A H, Obici S, et al. Endogenous glucose production is inhibited by the adipose-derived protein Acrp30 [J]. Journal of Clinical Investigation, 2001, 108(12): 1875
[7]González-Périz A, Horrillo R, Ferré N, et al. Obesity-induced insulin resistance and hepatic steatosis are alleviated by ω-3 fatty acids: a role for resolvins and protectins [J]. The FASEB Journal, 2009, 23(6): 1946—1957
[8]Yamauchi T, Kamon J, Ito Y, et al. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects [J]. Nature, 2003, 423(6941): 762—769
[9]Nishio S I, Gibert Y, Bernard L, et al. Adiponectin and adiponectin receptor genes are coexpressed during zebrafish embryogenesis and regulated by food deprivation [J]. Developmental Dynamics, 2008, 237(6): 1682—1690
[10]Kondo H, Suga R, Suda S, et al. EST analysis on adipose tissue of rainbow trout Oncorhynchus mykiss and tissue distribution of adiponectin [J]. Gene, 2011, 485(1): 40—45
[11]Qin C, Wang B, Sun C, et al. Orange-spotted grouper (Epinephelus coioides) adiponectin receptors: Molecular characterization, mRNA expression, and subcellular location [J]. General and Comparative Endocrinology, 2014, 198: 47—58
[12]Sánchez-Gurmaches J, Cruz-Garcia L, Gutiérrez J, et al. Adiponectin effects and gene expression in rainbow trout: an in vivo and in vitro approach [J]. The Journal of Experimental Biology, 2012, 215(8): 1373—1383
[13]Li X N. Effects of dietary carbohydrate levels on growth performance, physiological status and body composition of turbot (Scophthalmus maximus L) and Japanese flounder (Paralichthys olivaceus) [D]. Thesis for Master of Science. Ocean University of China, 2011 [李晓宁. 饲料糖水平对大菱鲆和牙鲆生长, 生理状态参数及体组成的影响. 硕士学位论文, 中国海洋大学, 2011]
[14]Nijhof M, Bult T P. Metabolizable energy from dietary carbohydrates in turbot, Scophthalmus maximus (L.) [J]. Aquaculture Research, 1994, 25(3): 319—327
[15]Nie Q. Effects of glucose, sucrose and dextrin on the activities and gene expression of carbohydrate metabolic enzymes in turbot (Scophthalmus maximus) [D]. Thesis for Master of Science. Ocean University of China, 2013 [聂琴. 饲料糖类物质对大菱鲆糖代谢酶活性和基因表达量的影响. 硕士学位论文, 中国海洋大学, 2013]
[16]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCTmethod [J]. Methods, 2001, 25(4): 402—408
[17]Mao X, Kikani C K, Riojas R A, et al. APPL1 binds to adiponectin receptors and mediates adiponectin signalling and function [J]. Nature Cell Biology, 2006, 8(5): 516—523
[18]Heiker J T, Wottawah C M, Juhl C, et al. Protein kinase CK2 interacts with adiponectin receptor 1 and participates in adiponectin signaling [J]. Cellular Signalling, 2009, 21(6): 936—942
[19]Sweiss N, Sharma K. Adiponectin effects on the kidney [J]. Best Practice & Research Clinical Endocrinology & Metabolism, 2014, 28(1): 71—79
[20]Civitarese A E, Jenkinson C P, Richardson D, et al. Adiponectin receptors gene expression and insulin sensitivity in non-diabetic Mexican Americans with or without a family history of Type 2 diabetes [J]. Diabetologia, 2004, 47(5): 816—820
[21]Tsuchida A, Yamauchi T, ho Y, et al. Insulin /Foxol pathway regulates expression levels of adiponectin receptors and adiponectin sensitivity [J]. Journal of Biological Chemistry, 2004, 279(29): 30817—30822
[22]Inukai K, Nakashima Y, Watanabe M, et al. Regulation of adiponectin receptor gene expression in diabetic mice [J]. American Journal of Physiology-Endocrinology and Metabolism, 2005, 288(5): E876—E882
[23]Debard C, Laville M, Berbe V, et al. Expression of key genes of fatty acid oxidation, including adiponectin receptors, in skeletal muscle of Type 2 diabetic patients [J]. Diabetologia, 2004, 47(5): 917—925
[24]Staiger H, Kaltenbach S, Staiger K, et al. Expression of adiponectin receptor mRNA in human skeletal muscle cells is related to in vivo parameters of glucose and lipid metabolism [J]. Diabetes, 2004, 53(9): 2195—2201
[25]Tsuchida A, Yamauchi T, Had Y, et al. Insulin/Foxo1 pathway regulates expression levels of adiponectin receptors and adiponectin sensitivity [J]. The Journal of Biological Chemistry, 2004, 279(29): 30817—30822
MOLECULAR CLONING OF ADIPONECTIN RECEPTORS IN TURBOT SCOPHTHALMUS MAXIMUS AND ITS EXPRESSION RESPONSE TO DIETARY RATIOS OF CARBOHYDRATE TO LIPID
HAN Dong-Dong1, MIAO Shu-Yan1,2, NIE Qin1, MIAO Hui-Jun1, WEI Ze-Hong1, ZHANG Wen-Bing1and MAI Kang-Sen1
(1. The Key Laboratory of Aquaculture Nutrition and Feeds, Ministry of Agriculture, Ocean University of China, Qingdao 266003, China; 2. College of Animal Science and Technology, Yangzhou University, Yangzhou 225009, China)
The present study cloned the full-length cDNA sequences of adiponectin receptors (AdipoR1, AdipoR2) in turbot. The cDNA sequence of AdipoR1 was 1125 bp, encoding 375 amino acids. The deduced amino acid sequence of AdipoR1 was conserved with the vertebrate’s AdipoR1, such as human (80%) and tilapia (97%). The cDNA sequence of AdipoR2 was 1940 bp, encoding 380 amino acids. The amino acid sequence of AdipoR2 was 78% identical to human and 92% to tilapia. Like invertebrates, both AdipoR1 and AdipoR2 had 7 transmembrane domains, and the N-terminal of the optimal topological structure was inside cells. Turbot adiponectin receptors were widely expressed in all detected tissues. The highest mRNA level of AdipoR1 was found in gill and kidney. The high level of AdipoR2 was found in gill, stomach, intestine, kidney and pyloric caeca. A 9-week feeding trial using diets with different ratios of carbohydrate to lipid (1:6, 1:2, 2:1 and 14:1) indicated that 1:2 dietary carbohydrate-to-lipid ratio but not other two diets significantly decreased the expression of AdipoR1 (P<0.05) in turbot muscle. All 3 diets had no significant effect on the AdipoR2 expression in muscle and the expressions of AdipoR1 and AdipoR2 in liver (P>0.05). These results suggest that the dietary carbohydrate-to-lipid ratios may influence the function of adiponectin through changing the adiponectin receptors expression in muscle.
Turbot; Adiponectin; Adiponectin receptor; Carbohydrate-to-lipid ratio; Gene expression
S965.3
A
1000-3207(2017)03-0565-08
10.7541/2017.73
2015-12-07;
2016-03-14
国家973计划项目(2014CB138600)资助 [Supported by the National Program on Key Basic Research Project (973 Program, 2014CB138600)]
韩冬冬(1990—), 女, 山东滨州人; 硕士; 研究方向为水生动物营养与饲料学。E-mail: douyonghero@163.com
张文兵, E-mail: wzhang@ouc.edu.cn

