硫酸镁在氯化物溶液中的结晶平衡
王 恒,丁伟中,谈定生
(省部共建高品质特殊钢冶金与制备国家重点实验室,上海市钢铁冶金新技术开发应用重点实验室,上海大学 材料科学与工程学院,上海 200072)
硫酸镁在氯化物溶液中的结晶平衡
王 恒,丁伟中,谈定生
(省部共建高品质特殊钢冶金与制备国家重点实验室,上海市钢铁冶金新技术开发应用重点实验室,上海大学 材料科学与工程学院,上海 200072)
氯化物溶液;硫酸镁;结晶;镁离子;铁离子
镍在工业中应用广泛,随镍需求增加和硫化镍矿资源减少,从红土镍矿中提取镍越来越受关注。用湿法处理红土镍矿是常用工艺,浸出则是湿法工艺中的重要步骤,浸出方法有多种,但与其他浸出工艺相比,常压盐酸浸出具有能耗低、速度快、镍浸出率高等优点[1]。然而,红土镍矿中含有大量镁、铁元素,在盐酸浸出过程中会进入浸出液,这不仅大大增加酸耗,也带来浸出液中镁、铁处理难题。因此,研究从浸出液中再生盐酸和合理利用镁、铁对于红土镍矿的常压盐酸浸出工艺的经济性和减少环境污染具有积极意义[2]。
红土镍矿盐酸浸出液中的铁可采用沉淀法去除,对于除铁后的氯化镁溶液,可以加热水解MgCl2得到副产品MgO,同时产生HCl[3],但该方法能耗过高。Smit等[4]提出ARNi(Anglo Research Nickel)工艺,即向氯化镁溶液中添加硫酸使镁离子转化为硫酸镁,在某一温度下,硫酸镁的溶解度小于氯化镁的溶解度,可以获得水合硫酸镁(MgSO4·xH2O)沉淀,同时使盐酸再生。
1 试验部分
1.1 主要试剂与仪器
试剂:盐酸,36%~38%,分析纯;硫酸,95%~98%,分析纯;六水合氯化镁,w(MgCl2·6H2O)≥98%,分析纯;无水硫酸镁,w(MgSO4)≥98%,分析纯;无水氯化铁,w(FeCl3)≥97%,化学纯;硫酸铁,分析纯;丙酮,w(C3H6O)≥99.5%,分析纯。所用试剂均购自国药集团化学试剂有限公司。试验用水为去离子水。
仪器:电子天平(上海良平仪器仪表有限公司),电热恒温水槽(上海博迅实业有限公司),磁力搅拌器(上海梅颖浦仪器仪表制造有限公司),电热恒温鼓风干燥箱(上海跃进医疗器械厂)。
1.2 分析方法
1.3 试验方法
准确称取相应试剂,加入到带有密封装置且含有搅拌子的锥形瓶中,密封后置于恒温水浴,在75 ℃下搅拌6 h。体系达到固液平衡后,溶液为硫酸镁过饱和溶液,在75 ℃恒温水浴中保存48 h后取出,对溶液和固相分别测定。
为减小试验误差,所取溶液质量均大于10 g。所取固体经丙酮充分清洗后于60 ℃下烘干12 h。
2 试验结果与讨论
2.1 硫酸对硫酸镁结晶的影响
在含有Mg2+的溶液中加入硫酸时,硫酸镁结晶反应为
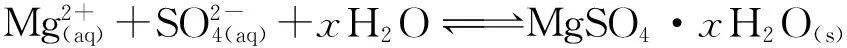
(1)
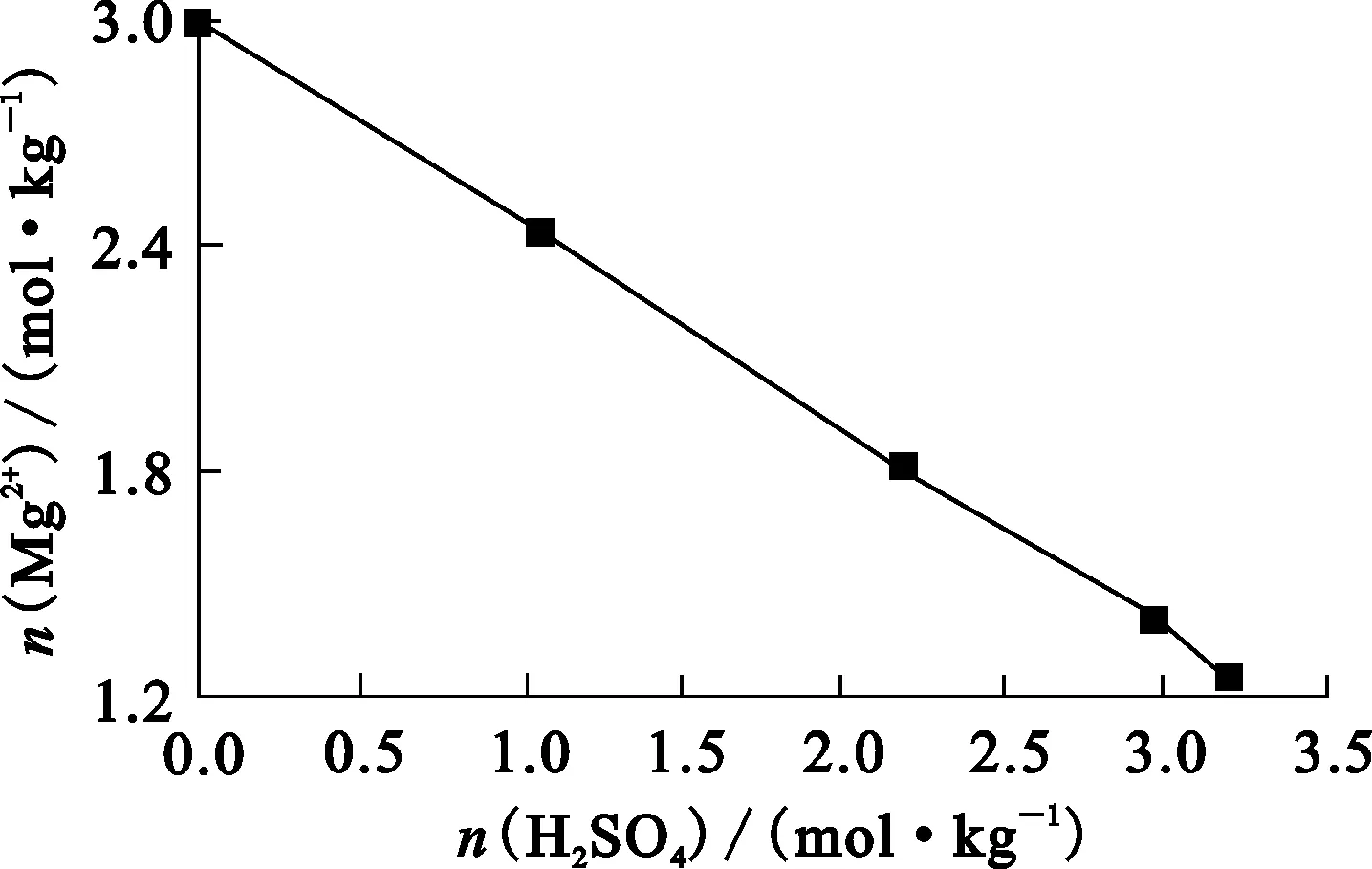
图1 75 ℃下平衡48 h的硫酸浓度对硫酸镁 结晶时溶液中Mg2+浓度的影响
由图1看出,随硫酸浓度增大,溶液中Mg2+浓度降低:未添加硫酸时,Mg2+浓度为3.00 mol/kg;体系中硫酸浓度提高到3.18 mol/kg时,溶液中Mg2+浓度降至1.27 mol/kg。由此说明,氯化镁溶液中加入硫酸可促使溶液中的Mg2+转变为固相。试验所得晶体经XRD分析为MgSO4·H2O。
2.2 SO4-HCl-MgSO4-MgCl2-H2O体系中Mg2+
与MgSO4晶体之间的平衡
红土镍矿盐酸常压浸出液除铁后加入硫酸发生的反应为
MgSO4·xH2O(s)+2HCl(aq)。
(2)
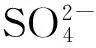
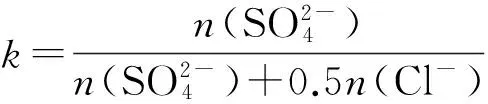
以Mg2+浓度为纵坐标,k为横坐标作图,所得曲线可以反映此五元体系中与硫酸镁晶体相平衡的Mg2+浓度,结果如图2所示。

[H+]/(mol·kg-1):1—0;2—2±0.39;3—4±0.37;4—6±0.37; ▽—Balarew数据[9];△,○,□—Ge数据[10];其余为本试验数据。 图2 75 ℃下平衡48 h的k对溶液中Mg2+浓度的影响
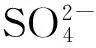
2.3 Fe3+对硫酸镁结晶的影响
红土镍矿盐酸常压浸出液除铁之后仍含有一定浓度的Fe3+,因此需要考察溶液中Fe3+浓度对硫酸镁结晶的影响。
为使反应式(2)向右进行,硫酸须过量,在硫酸大大过量条件下,产物之一的HCl基本挥发,此时溶液可看作为H2SO4-MgSO4-Fe2(SO4)3-H2O体系。在含Mg2+、Fe3+的氯化物溶液中加入硫酸,生成晶体并达到平衡的试验结果如图3所示。
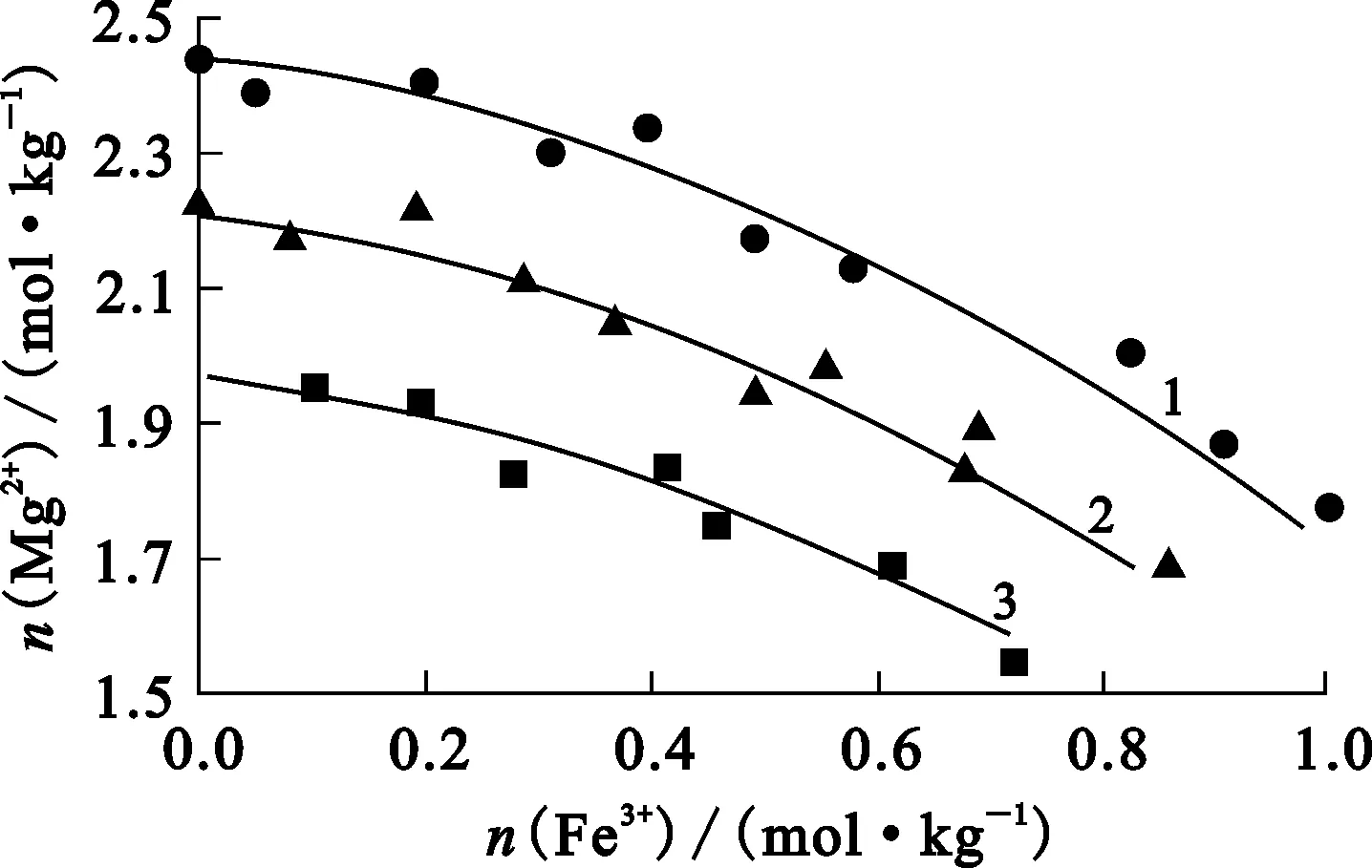
[H+]/(mol·kg-1):1—2±0.25;2—3±0.31;3—4±0.50。 图3 75 ℃下平衡48 h的Fe3+浓度对溶液中 Mg2+浓度的影响
由图3看出:氯化物溶液中Mg2+浓度随Fe3+浓度增大而下降,随H+浓度增大而减小。平衡固相经XRD分析,Fe3+浓度小于0.5 mol/kg时为MgSO4·H2O,超过0.5 mol/kg则为MgSO4·H2O和FeH(SO4)2·4H2O的混合物。FeH(SO4)2·4H2O的形成是因为在形成硫酸镁晶体的同时,溶液中的Fe3+浓度达到一定值,发生如下反应:
FeH(SO4)2·4H2O(s)。
(4)
由上述结果和讨论可知,溶液中存在一定量Fe3+可促进硫酸镁晶体形成。对于红土镍矿盐酸常压浸出液除镁和盐酸再生而言,除镁前的除铁过程并不一定要将Fe3+去除完全,但剩余的Fe3+浓度又不宜超过0.5 mol/kg,否则得不到纯净的MgSO4·H2O产品。
2.4 H2SO4-HCl-MgSO4-MgCl2-Fe2(SO4)3-FeCl3-
H2O体系中MgSO4的结晶
红土镍矿盐酸浸出液中的阳离子主要是Mg2+、Fe3+和Ni2+,浸出液用适当方法提镍除铁后加入硫酸,溶液实际为H2SO4-HCl-MgSO4-MgCl2-Fe2(SO4)3-FeCl3-H2O体系。为了考察以形成MgSO4晶体方式分离溶液中的Mg2+的效果,研究了不同条件下与MgSO4晶体相平衡的溶液中Mg2+浓度的变化规律,结果如图4所示。

[H+]/(mol·kg-1):1—2±0.39;2—2±0.28; 3—4±0.37;4—4±0.29。
[Fe3+]/(mol·kg-1):1—0;2—0.5;3—0;4—0.5。
图4 75 ℃下平衡48 h的H2SO4-HCl-MgSO4-MgCl2-
Fe2(SO4)3-FeCl3-H2O体系中Mg2+平衡浓度的变化
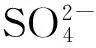
比较图4中曲线1~4可知,溶液中Fe3+的存在会降低Mg2+的平衡浓度,这是因为Fe3+盐起盐析剂作用,可促进硫酸镁的结晶。
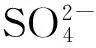
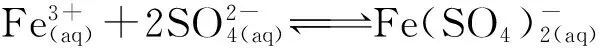
(5)
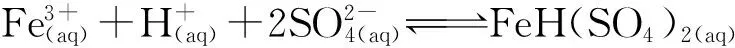
(6)
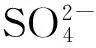
3 结论
[1] 李艳军,于海臣,王德全,等.红土镍矿资源现状及加工工艺综述[J].金属矿山,2010(11):5-9.
[2] HARRIS B,WHITE C,JANSEN M,et al.A new approach to the high concentration chloride leaching of nickel laterites[C]//ALTA Ni/Co 11 Perth,Melbourne:ALTA Metallurgical Services,2006:203-223.
[3] HARRIS G,MAGEE T,LAKSHMANAN V,et al.Sechol laterite project atmospheric chloride leach process[C]//International Laterite Nickel Symposium,2004,Charlotte:The Minerals,Metals and Materials Society,2004:219-241.
[4] SMIT J T,STEYL J D T.Leaching process in the presence of hydrochloric acid for the recovery of a value metal from an ore:EP1809778B1[P].2006-04-27.
[5] MARSHALL W L,SLUSHER R.Aqueous systems at high temperature.xv.solubility and hydrolytic instability of magnesium sulfate in sulfuric acid-water and deuterosulfuric acid-deuterium oxide solutions,200 to 350 ℃[J].Journal of Chemical & Engineering Data,1965,10(4):353-358.
[6] JONES M W,PAPANGELAKIS V G,STEYL J D.Kieserite solubility in the aqueous FeCl3+MgCl2+HCl system between(338 and 378) K[J].Journal of Chemical & Engineering Data,2009,54(7):1986-1990.
[7] LI Yahong,SONG Pengsheng,XIA Shuping,et al.Solubility prediction for the HCl-MgCl2-H2O system at 40 ℃and solubility equilibrium constant calculation for HCl-MgCl2-7H2O at 40 ℃[J].Calphad-computer Coupling of Phase Diagrams & Thermochemistry,2006,30(1):61-64.
[8] LI Yahong,SONG Pengsheng,LI Wu,et al.Solubility prediction of HCl-MgCl2-H2O system at 50 ℃ using the ion-interaction model[J].Calphad-computer Coupling of Phase Diagrams &Thermochemistry,2006,30(4):393-396.
[9] BALAREW C,TEPAVITCHAROVA S,RABADJIEVA D,et al.Solubility and crystallization in the system MgCl2-MgSO4-H2O at 50 and 75 ℃[J].Journal of Solution Chemistry,2001,30(9):815-823.
[10] GE Yong,DING Weizhong,TAN Dingsheng,et al.Recovery of magnesium and recycling of spent solution in chloride‐based atmospheric acid leaching of nickel laterite[C]//MARTYN A. Proceedings of a symposium sponsored by the Magnesium Committee of the Light Metals Division of The Minerals,Metals&Metaerials Society(TMS). San Diego:The Minerals,Metals and Materials Society,2014:39-41.
[11] CASAS J M,CRISSTOMO G,CIFUENTES L.Speciation of the Fe(Ⅱ)-Fe(Ⅲ)-H2SO4-H2O system at 25 and 50℃[J].Hydrometallurgy,2005,80(4):254-264.
[12] CASAS J M,PAIPA C,GODOY I,et al.Solubility of sodium-jarosite and solution speciation in the system Fe(Ⅲ)-Na-H2SO4-H2O at 70℃[J].Journal of Geochemical Exploration,2007,92(2/3):111-119.
Crystalline Equilibrium of Magnesium Sulfate in Chloride Solutions
WANG Heng,DING Weizhong,TAN Dingsheng
(StateKeyLaboratoryofAdvancedSpecialSteel,ShanghaiKeyLaboratoryofAdvancedFerrometallurgySchoolofMaterialsScienceandEngineering,ShanghaiUniversity,Shanghai200072)
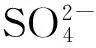
chloride solution;magnesium sulfate;crystallization;Mg2+;Fe3+
2016-07-14
国家重点基础研究发展计划(973计划)项目(2012CB722805)。
王恒(1989-),男,辽宁铁岭人,硕士研究生,主要研究方向为红土镍矿湿法冶金。E-mail:wanghengtg@163.com。
丁伟中(1952-),男,上海人,博士,教授,主要研究方向为冶金热力学。E-mail:wzhding@shu.edu.cn。
TQ132.2;TF111.34
A
1009-2617(2017)01-0046-04
10.13355/j.cnki.sfyj.2017.01.011

