裂殖壶菌补糖发酵研究
赵书林,蔡双山,夏木阳,夏德才,胡 锐,杨齐华,闵征桥,张 念
(湖北福星生物科技有限公司,湖北 孝感 432100)
生物工程
裂殖壶菌补糖发酵研究
赵书林,蔡双山,夏木阳,夏德才,胡 锐,杨齐华,闵征桥,张 念
(湖北福星生物科技有限公司,湖北 孝感 432100)
为了探索不同碳源浓度对裂殖壶菌(Schizochytrium)细胞营养生长和油脂积累的影响,对发酵调控进行研究,同时测定发酵液生物量、含油量、DHA含量和DHA产量。结果表明:发酵过程中通过补糖可以提高发酵液含油量和DHA产量,但糖浓度过高也会抑制发酵;当还原糖质量浓度调控在40 g/L左右时,生物量、含油量、DHA含量和DHA产量均达最高,分别为8.95 g/100 mL、22.42 g/L、41.71%、9.35 g/L,比对照组高出了76.18%、61.88%、4.3%、68.77%。
裂殖壶菌;高强度;发酵调控;DHA
裂殖壶菌(Schizochytrium)是一类属于真菌门(Eumycota)、卵菌(Oomycetes)、水霉目(Saprolegniales)、破囊壶菌科(Thraustochytriaceae)的类藻海洋真菌[1]。利用裂殖壶菌高强度发酵生产富含DHA的油脂,具有很好的经济效益和社会效应[2]。近年来,国内许多企业纷纷加入到DHA发酵生产行列,但在DHA发酵调控过程中,仍存在细胞生长缓慢、活性低、DHA产量少和代谢难以调控等问题,导致产品的产量和质量均与国外企业有一定的差距。因此,稳定、高效的发酵调控技术对DHA的生产至关重要[3]。
裂殖壶菌在细胞生长中若没有及时的碳源补给,便会分解自身的油脂来提供生存所必需的能量,因此应及时补糖,保证裂殖壶菌有充足的碳源进行油脂的积累和DHA的合成。因此,对裂殖壶菌发酵液进行发酵调控,可以提高其含油量和DHA含量[4]。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
裂殖壶菌(Schizochytrium),来自湖北福星生物科技有限公司。培养基均为常用的培养基。
碱性酒石酸铜甲液、碱性酒石酸铜乙液、甲醇、正己烷、95%乙醇、亚甲基蓝、甲基红、碱性蛋白酶(酶活20万U/g)等均为分析纯。
1.1.2 仪器与设备
Agilent 7890A气相色谱仪,D-1高压蒸汽灭菌锅,SW-CJ-1F型超净工作台,RE-52C旋转蒸发器,上海高机100 L发酵罐。
1.2 实验方法
1.2.1 裂殖壶菌的富集和培养[5]
从平板中挑选裂殖壶菌单菌落到摇瓶中进行种子一级培养,摇床培养温度为28℃,转速为200 r/min;一级培养3 d后以10%的接种量进入种子二级培养,摇床培养温度为28℃,转速为200 r/min;二级培养3 d后以5%的接种量进入100 L 发酵罐进行培养,罐压0.03 MPa,通气量8 m3/h,搅拌速度40 r/min,发酵168 h后收获菌体。
1.2.2 裂殖壶菌糖、氮代谢分析
A为对照组,不进行补糖调控;B、C、D、E、F为5个调控实验组,每隔24 h观察碳和氮的利用情况,并且进行补糖调控,调控质量浓度分别约为10、20、30、40、50 g/L。
1.2.3 生物量、含油量、DHA含量和DHA产量的测定计算[6-7]
生物量:取100 mL发酵液通过离心、100℃干燥,获得干菌体称重。
含油量:取1 L发酵液离心酶解,然后用正己烷提取油脂称重。
DHA含量:用气相色谱测定油脂的DHA含量。
DHA产量:用1 L发酵液的含油量乘以DHA含量即为DHA产量。
1.2.4 还原糖和氨基酸的测定
还原糖的测定采用斐林试剂法,氨基酸的测定采用甲醛法。
2 结果与讨论
2.1 裂殖壶菌糖、氮代谢分析
将对照组和实验组发酵培养7 d,每隔24 h观察碳、氮的利用情况,并且适当补充碳源,绘制趋势图,结果如图1~图6所示。

图1 对照组A碳、氮利用变化曲线
从图1首先可以看出,前72 h是裂殖壶菌生长的主要时期,72 h后糖耗和氮耗趋于稳定,72 h时还原糖质量浓度为4.89 g/L;其次糖耗的速率先慢后快,而氮耗的速率则是先快后慢,说明裂殖壶菌对碳源的需求是逐渐增强的,后期补糖可以提高细胞的生长速度和代谢能力。当168 h放罐时发酵液还原糖质量浓度为5.00 g/L,氨基酸质量浓度为0.32 g/L。

图2 实验组B碳、氮利用变化曲线
从图2可以看出,实验组B分别在72、96、120、144 h补糖至10.11、11.05、11.98、10.96 g/L,然后又分别迅速消耗至5.24、5.79、5.42、5.37 g/L,期间裂殖壶菌对碳源的消耗很快,细胞大量繁殖。当168 h放罐时发酵液还原糖质量浓度约为5.37 g/L,与对照组相差不大。
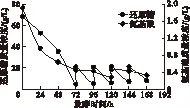
图3 实验组C碳、氮利用变化曲线
从图3可以看出,实验组C分别在72、96、120、144 h补糖至20.15、20.26、20.63、20.50 g/L,然后又分别迅速消耗至5.24、5.47、6.79、7.50 g/L。当168 h放罐时发酵液还原糖质量浓度约为7.50 g/L,超出对照组2.50 g/L。
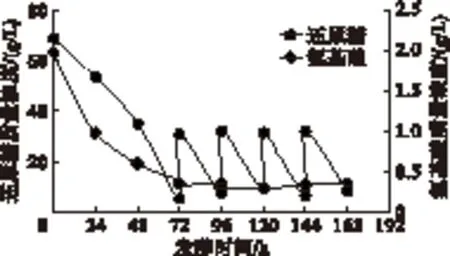
图4 实验组D碳、氮利用变化曲线
从图4可以看出,实验组D分别在72、96、120、144 h补糖至30.34、31.78、31.12、31.55 g/L,然后又分别迅速消耗至7.68、8.31、6.37、8.37 g/L。当168 h放罐时发酵液还原糖质量浓度约为8.37 g/L,超出对照组3.37 g/L。

图5 实验组E碳、氮利用变化曲线
从图5可以看出,实验组E分别在48、72、96、120、144 h补糖至40.65、40.13、40.55、40.35、40.88 g/L,然后又分别迅速消耗至13.54、11.56、15.38、16.49、14.54 g/L。当168 h放罐时发酵液还原糖质量浓度约为14.54 g/L,超出对照组9.54 g/L。

图6 实验组F碳、氮利用变化曲线
从图6可以看出,实验组F分别在48、72、96、120、144 h补糖至50.66、50.32、50.49、49.96、50.11 g/L,然后又分别迅速消耗至19.18、18.69、20.53、21.35、21.56 g/L。当168 h放罐时发酵液还原糖质量浓度约为21.56 g/L,超出对照组16.56 g/L。
2.2 补糖对裂殖壶菌含油量、生物量及DHA的影响
发酵168 h后同时对对照组A和实验组B、C、D、E、F提取油脂,并对其含油量、生物量、DHA产量和DHA含量进行测定及计算,结果见表1。
由表1可知,实验组B、C、D、E、F中生物量、含油量、DHA产量及DHA含量明显高于对照组,特别是E组的含油量及DHA产量分别比对照组高出了61.88%和68.77%。
从调控碳源浓度来看,5个不同的调控实验组油脂的生物量、含油量、DHA含量及DHA产量明显高于对照组。Umemura[8]、Ishida[9]等对此进行了研究:当裂殖壶菌受到氮源的限制,油脂浓度与碳源的增长成正比。Hibbeln等[10]指出碳源浓度过高会导致裂殖壶菌自身分解,也会导致更多的饱和脂肪酸合成,相反氮源的限制可能使得更多的不饱和脂肪酸形成。当氮源耗尽时补糖不仅可以促进油脂的产生,而且对DHA的形成也是有利的[11]。
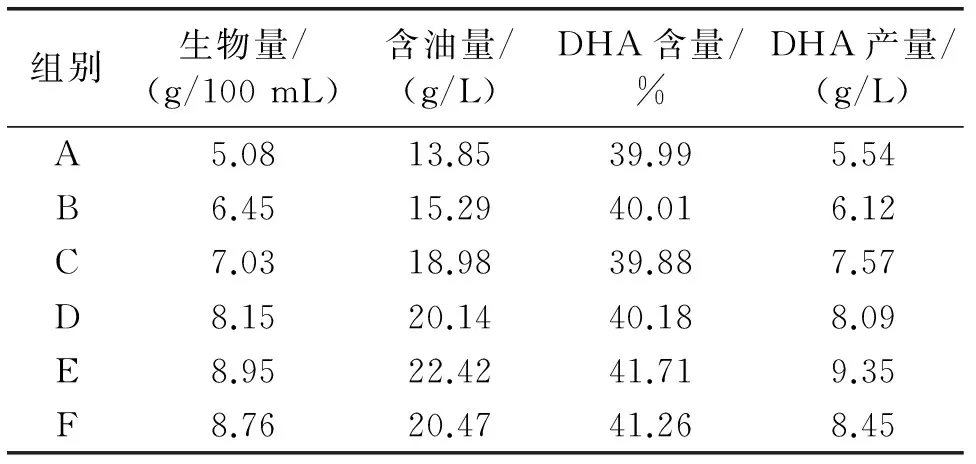
表1 对照组和实验组的生物量、含油量、
3 结 论
补糖可以提高裂殖壶菌含油量和DHA产量,随着发酵的不断进行,裂殖壶菌对碳源的需求也会越来越大。当调控发酵液还原糖质量浓度为40 g/L 左右时,生物量、含油量、DHA产量及DHA含量达到最高,裂殖壶菌生长最旺盛。
[1] 马艳玲. 微生物油脂及其生产工艺的研究进展[J]. 生物加工过程,2006,4(4):7-11.
[2] 何东平,陈涛. 微生物油脂学[M]. 北京:化学工业出版社,2006:28-32.
[3] 徐华顺,罗玉萍,李思光,等. 微生物发酵产油脂的研究进展[J]. 中国油脂,1999,24(2):34-37.
[4] 吴忠兴,庄惠如,陈坚,等. 利用微藻培养生产DHA的研究进展[J]. 江西农业大学学报(自然科学版),2002,24(5):737-740.
[5] 姜剑锋,赵丽芹,陈涛,等. 寇氏隐甲藻不同破壁方法的研究[J]. 中国粮油学报,2011,26(8):92-94.
[6] 廖启斌,李文权,陈清花,等. 海洋微藻脂肪酸的气相色谱分析[J]. 海洋通报,2000,19(6):66-71.
[7] 吕浩,崔丁维,胡学超,等. 酶法破碎裂殖壶菌提取胞内油脂[J]. 生物加工过程,2011,9(3):27-30.
[8] UMEMURA K,TOSHIMA Y,ASAI F. Effect of dietary docosahexaenoic acid in the rat middle cerebral artery thrombosis model [J]. Thromb Res,1995(5):379-387.
[9] ISHIDA S,MARUYAMA T. Determination of trace protein in oils and fats by fluorescence spectrophotometer[J]. Thromb Res,2004(4):239-245.
[10] HIBBELN J R,SALEM J N. Dietary polyunsaturated fatty acids and depression:when cholesterol does not satisfy[J]. Am J Clin Nutr,1995,62(4):1-9.
[11] 张明亮,江贤章,黄健忠. 裂殖壶菌产DHA摇瓶培养优化 [J]. 药物生物技术,2016,28(1):44-48.
Feeding glucose fermentation ofSchizochytrium
ZHAO Shulin,CAI Shuangshan,XIA Muyang,XIA Decai,HU Rui,YANG Qihua,MIN Zhengqiao,ZHANG Nian
(Hubei Fuxing Biological Technology Co.,Ltd.,Xiaogan 432100,Hubei,China)
In order to investigate the effects of different concentrations of carbon source on the vegetative growth and oil accumulation ofSchizochytriumcells,the fermentation regulation was studied and the biomass,oil content,DHA content and DHA productivity of fermented liquid were determined. The results showed that the oil content and DHA productivity in fermented liquid could be improved by feeding glucose fermentation,but high concentration of sugar could inhibit fermentation. Under the conditions of mass concentration of reducing carbon 40 g/L,the biomass,oil content,DHA content and DHA productivity were 8.95 g/100 mL,22.42 g/L,41.71% and 9.35 g/L respectively,which were the highest and increased by 76.18%,61.88%,4.3% and 68.77% respectively than the control group.
Schizochytrium; high intensity; fermentation regulation; DHA
2016-05-07;
2016-11-06
国家高技术研究发展计划(863计划)项目(2014AA021702)
赵书林(1989),男,工程师,硕士,主要从事微生物油脂的研究工作(E-mail)396858346@qq.com。
TS222;Q815
A
1003-7969(2017)02-0113-03

