宫颈癌患者血栓相关的预后因素分析
程薇薇 刘哲言 李雪 刘新建 宋永平
(郑州大学附属肿瘤医院/河南省肿瘤医院 血液科 河南 郑州 450008)
·论 著·
宫颈癌患者血栓相关的预后因素分析
程薇薇 刘哲言 李雪 刘新建 宋永平
(郑州大学附属肿瘤医院/河南省肿瘤医院 血液科 河南 郑州 450008)
目的 探讨以凝血功能为主的危险因素对宫颈癌预后的影响,并进行分析。方法 回顾性分析2014年6月至2016年6月在郑州大学附属肿瘤医院妇瘤科住院治疗的宫颈癌患者的一般临床资料,采用SPSS 22.0统计软件进行分析,Kaplan-Meier法计算生存率,Log-rank法检验比较各组生存差异,Cox模型行多因素预后分析。结果 共纳入分析412例患者,其中血栓组患者47例,非血栓组患者365例,非血栓组患者生存率明显优于血栓组(P=0.002)。单因素分析显示,肿瘤分期(P<0.001)、Khorana评分(P=0.010)、D-二聚体(P<0.001)及APTT(P<0.001)与宫颈癌患者预后有关。多因素分析显示,肿瘤分期、Khorana评分、D-二聚体和APTT为影响患者生存的独立预后因素。死亡组患者D-二聚体(P<0.001)、APTT(P<0.001)和SCC(P=0.032)水平明显高于生存组。结论 宫颈癌患者伴深静脉血栓形成预后不佳,可能与高水平D-二聚体、高水平APTT、高Khorana评分相关。
D-二聚体;宫颈癌;深静脉血栓;Khorana评分
宫颈癌是我国女性常见恶性肿瘤之一,虽发病率为女性全部恶性肿瘤第2位,但病死率却是高居第1位[1-2],故尽早发现并加以干预,可极大地改善其预后、提高生存率,而寻找影响宫颈癌预后的因素,以加强宫颈癌的早期诊断、疗效监测及判断预后,保证患者得到合理的个体化治疗是提高生存率的关键。多数研究发现,影响宫颈癌预后的因素有肿瘤病理类型、分期、是否淋巴结转移等。近年来研究发现,凝血功能异常导致的血液高凝状态或血栓形成与肿瘤的发生发展关系密切[3],许多肿瘤均可导致凝血功能异常。常见凝血指标D-二聚体、活化部分凝血酶时间(APTT)、凝血酶原时间(PT)等可作为预测不同肿瘤预后的指标[4],但在宫颈癌的相关研究中,鲜有此方面的报道。本研究拟探讨与宫颈癌预后相关因素,尤其是凝血相关指标,并进行分析,以为临床提供参考。
1 材料与方法
1.1 一般资料收集2014年6月至2016年6月在郑州大学附属肿瘤医院妇瘤科住院治疗的共412例宫颈癌患者进行回顾性分析。入组标准:①每位患者均有完整的临床病例资料及随访信息。②郑州大学附属肿瘤医院病理科明确诊断为宫颈癌(包括鳞状细胞癌及其他类型),并依据国际妇产科联盟(FIGO)分期标准进行临床分期。③所有患者均完善D-二聚体、凝血功能等检查,若患者出现下肢肿胀、疼痛、浅静脉充盈扩张、皮温升高、股三角区或(和)腓肠肌压痛等症状,行下肢超声检查,以结果提示“受累的深静脉管径增宽,管腔内可见实性团块,后伴声影,无血流信号或血流束狭小,加压探头管腔不凹陷”为标准诊断深静脉血栓形成(DVT)。本研究患者主要接受3种治疗方法,即单纯手术、手术联合放化疗以及放化疗综合治疗。
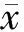
2 结果
2.1 基本情况本研究共纳入分析412例宫颈癌患者,中位年龄为48岁(27~75岁),中位生存时间为27个月。病理类型包括宫颈鳞癌267例,占64.8%,腺癌131例,占31.8%,其他类型14例,占3.4%。见表1。
2.2 单因素预后分析单因素预后分析结果显示分期(χ2=46.895 0,P<0.001)、Khorana评分(χ2=13.248,P=0.010)、D-二聚体(χ2=57.434,P<0.001)和APTT(χ2=57.218,P<0.001)为影响宫颈癌患者预后的因素。见表1。
2.3 多因素预后分析采用Cox模型进行多因素预后分析,结果显示肿瘤分期、Khorana评分、D-二聚体和APTT是影响宫颈癌患者预后的独立因素。见表2。
2.4 凝血功能指标与宫颈癌特异肿瘤标记物差异性分析独立样本t检验结果显示,生存组和死亡组患者间凝血功能及宫颈癌特异肿瘤标记物相比,D-二聚体(P<0.001)、APTT(P<0.001)和SCC(P=0.032)水平比较差异有统计学意义,死亡组明显高于生存组。PT(P=0.743)、凝血酶时间(TT)(P=0.053)和Fib(P=0.508)水平两组相似,差异均无统计学意义(P>0.05)。见表3。
3 讨论
近年来随着对疾病认识的加深和临床医学的不断发展,宫颈癌患者被更早的发现和诊断,报道称其发病率和病死率逐年上升[5]。研究表明,多数晚期宫颈癌患者治疗后2 a内即复发,若病情未及时得到控制,多数患者在1 a内死亡,较少患者可存活超过2 a,复发宫颈癌患者的平均生存期仅为7个月[6-7]。作为首位威胁女性健康和生命的生殖系统恶性肿瘤,尽早发现并加以干预,制定合理个体化治疗方案,将可极大地改善其预后、延长生存时间,而寻找影响宫颈癌预后的因素,以加强宫颈癌的早期诊断、疗效监测及判断预后,保证患者得到合理的个体化治疗是提高生存率的关键。国内外研究发现影响宫颈癌预后的因素有肿瘤分期、盆腔淋巴结转移情况、癌细胞浸润深度以及肿瘤是否侵犯淋巴血管间隙等。近年来研究发现,凝血状态与肿瘤的发生发展密切相关。因此本研究对可能影响宫颈癌患者预后的因素进行分析,结果显示肿瘤分期、Khorana评分、D-二聚体、APTT与宫颈癌的预后密切相关。
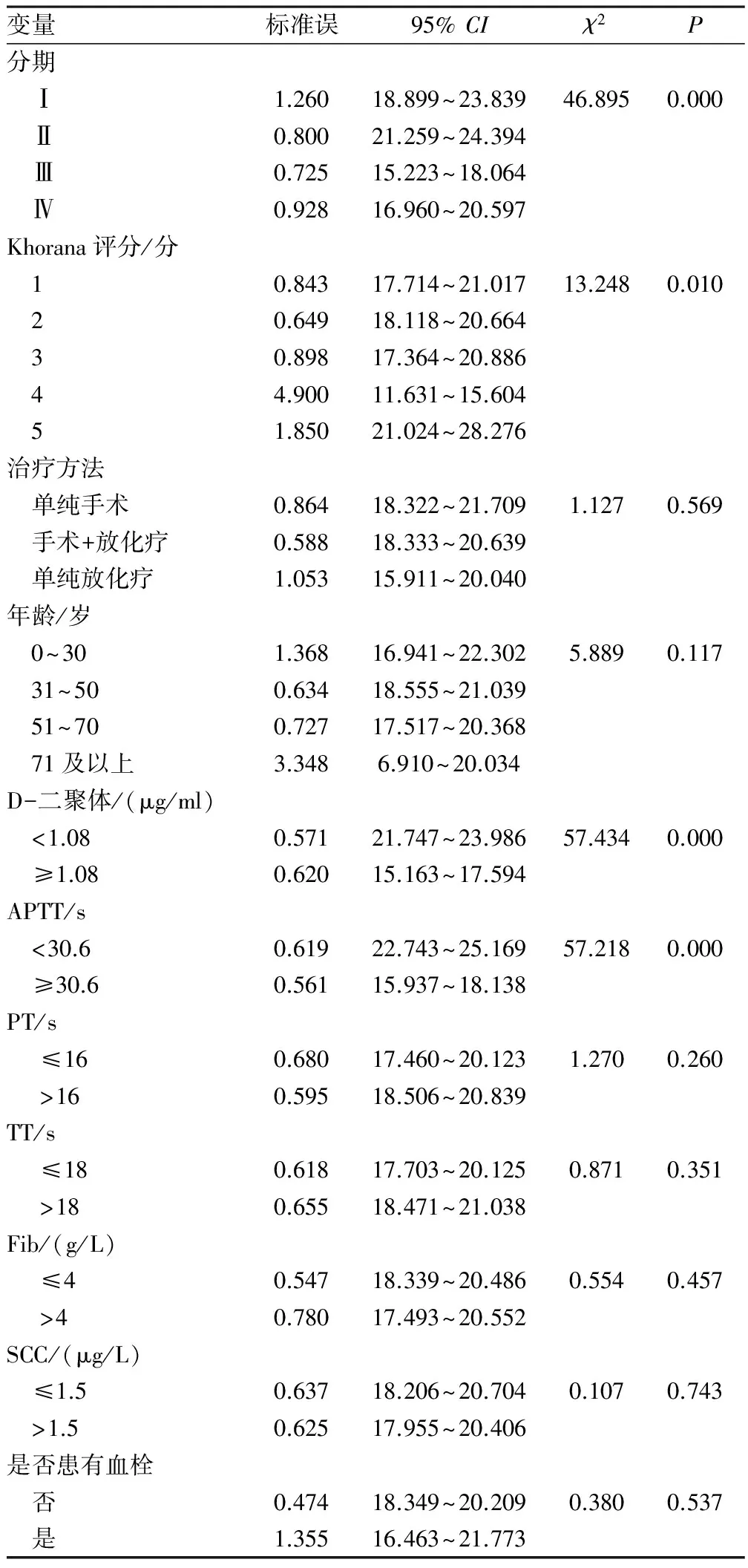
表1 412例宫颈癌患者主要相关临床特征和检查指标情况

表2 412例宫颈癌患者多因素预后分析结果
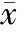
表3 412例宫颈癌患者凝血功能指标与宫颈癌特异肿瘤标记物差异性分析(±s)
肿瘤细胞可激活凝血系统,导致血管内皮细胞的损伤和血小板活性的增加,同时伴有纤维蛋白溶解的异常[8-9]。大量临床资料表明,恶性肿瘤是导致血液高凝状态的首要原因,60%的恶性肿瘤患者血液会呈现高凝状态,甚至形成血栓[10]。宫颈癌瘤体及肿大的淋巴结易侵犯邻近的盆腔静脉,引起血流缓慢,形成涡流,有别于其他恶性肿瘤更易导致凝血功能异常、形成血栓。因此,凝血功能检查是宫颈癌患者必做的检查项目之一。常见各项凝血功能指标中,D-二聚体是交联纤维蛋白的降解产物,反映体内交联纤维蛋白的形成及继发性纤溶活性的强度,其增高代表血液在血管循环系统中形成急性血栓,是诊断深静脉血栓的关键指标,对于诊断和治疗血栓栓塞性疾病,以及溶栓治疗的效果监测具有重要意义[11]。Vecchio等[12]的研究发现,宫颈癌患者的D-二聚体以及反映血小板活性的血栓球蛋白-β明显升高。但D-二聚体对DVT的诊断具有高度敏感性但特异性不高,因此不能单独用于静脉血栓栓塞症(VTE)的诊断[13]。TT和APTT反映内源性凝血系统情况,而PT则反映外源性凝血系统情况。其中APTT是内源性凝血系统较为敏感和最常用的筛选指标,同时也是用于监测凝血因子和肝素治疗效果的主要指标。本研究结果显示常规凝血功能检查项目中,仅D-二聚体和APTT对宫颈癌患者预后有影响。D-二聚体≥1.08 mg/L、APTT<30.6 s者死亡风险较低水平者明显升高(分别为P=0.000,HR=2.445,95%CI=1.789~3.343;P=0.000,HR=2.531,95%CI=1.711~3.744),且差异性分析结果显示存活患者D-二聚体明显低于死亡患者,APTT水平高于死亡患者。由此提示,D-二聚体结合APTT水平可作为预测宫颈癌患者并发下肢深静脉血栓形成(LDVT)危险性的指标。而对于D-二聚体≥1.08 mg/L、APTT<30.6 s的宫颈癌患者,应提高警惕,尽早采取预防措施,纠正凝血功能,改善预后。
恶性肿瘤患者中,血栓的形成本身即是一个影响预后的非常重要的因素[14]。2008年Khorana等[15]提出一项预测恶性肿瘤患者血栓形成风险的评分模型,此模型综合多项临床常见的重要危险因素和相关肿瘤标记物,最终将患者的VTE风险分为高、中、低3个等级。在此基础上,Ay等[16]又将D-二聚体和可溶性P选择素作为危险因素加入模型中,从而得出一个新的预测血栓形成风险的积分系统。本研究利用Ay等的模型对患者进行评分,评分越高,说明其血栓形成的风险越高,最终预后越差,结果显示中、低危组(Khorana积分<3分)患者预后较高危组(Khorana积分≥3分)好,其中位生存时间分别为23.5个月和18.7个月(P<0.005)。高危组患者VTE发生率为7.1%~41%,与既往研究结果相符。单因素分析结果显示Khorana积分为影响宫颈癌患者预后的独立影响因素(P=0.003,HR=7.265;95%CI:1.709~30.886)。但至目前为止,尚无大宗文献报道将Khorana积分系统或Ay等提出的改良后Khorana评分系统用于预测宫颈癌患者血栓风险,最终结果仍需大样本、前瞻性研究加以证实。
SCC-Ag是宫颈癌常用的筛查和预后判断指标,它是一种糖蛋白,存在于子宫、子宫颈、肺、头颈等鳞状上皮细胞癌的细胞质基质中,尤其是非角化类型的癌细胞。文献报道,83%的宫颈癌患者血清中SCC-Ag水平升高,其水平变化可以作为判断鳞状细胞型宫颈癌预后的指标之一[17]。但鳞状上皮来源的细胞分布广泛,且由于是鳞状上皮的抗原,并不适用于所有类型宫颈癌的预后评估。国内有报道在宫颈癌复发患者的预后检测中,SCC-Ag阳性率可达55.9%[18]。本研究单因素分析结果显示SCC并不是影响宫颈癌患者预后的危险因素,考虑可能与本研究样本中病理类型不仅局限为子宫颈鳞状细胞癌有关(宫颈鳞癌267例,占64.8%,腺癌131例,占31.8%,其他类型14例,占3.4%)。
此外,在宫颈癌所有评价预后的指标中,分期对于疾病的影响是毋庸置疑的,分期越晚,生存率越低;而治疗方式往往由其分期决定,早期的宫颈癌患者只需要手术治疗,中晚期患者则以综合治疗为主。妇科肿瘤的手术时间长、切除范围大,也极易形成血栓。在我们的研究中,不同年龄段、不同治疗方法间死亡率并无明显差异,年龄及治疗方法并不影响宫颈癌患者总体生存,这与大多数相关实验及研究结果不符[19],可能与患者手术时长、放化疗方案选择差异有关。本研究条件限制,样本量少,项目分析不完善且随访时间短,需加大改进,同时也期望更多中心、长期的随访以更精确掌握宫颈癌相关预后影响因素,尽早预测,更好预防,更多治疗。
综上,宫颈癌患者伴DVT预后不佳,可能与高水平D-二聚体、高水平APTT、高Khorana评分相关。我们可推测,将D-二聚体和Khorana评分联合预测宫颈癌患者预后,比单纯依靠SCC-Ag更不受病理类型的限制,具有更好的普遍性。
[1] 冯宁, 杜其云, 吴久玲,等. 中国——瑞典宫颈癌筛查服务管理的比较[J]. 中国妇幼保健, 2014, 29(29):4700-4703.
[2] Denny L. Cervical cancer prevention: new opportunities for primary and secondary prevention in the 21st century[J]. Int J Gynaecol Obstet, 2012, 119(1):S80-S84.
[3] Ratib S, Walker A J, Card T R, et al. Risk of venous thromboembolism in hospitalised cancer patients in England-a cohort study[J]. J Hematol Oncol, 2016, 9(1):60.
[4] Khorana A A, Carrier M, Garcia D A, et al. Guidance for the prevention and treatment of cancer-associated venous thromboembolism[J]. J Thromb Thrombolysis, 2016, 41(1):81-91.
[5] Denny I. Cytological screening for cervical cancer prevention[J]. Best Pract Res Clin Obstet Gynaecol,2012,26(2):189-196.
[6] DiMaio D.Nuns Warts Viruses and Cancer[J].Yale J BiolMed,2015,88(2):127-129.
[7] Suh D H,Lee K H,Kim K,et al.Major clinical research ad-vances in gynecologic cancer in 2014[J].J Gynecol Oncol,2015,26(2):158-167.
[8] John A. Cancer and venous thromboembolism:Scope of the problem[J]. Cancer Control,2010,12(1):5-11.
[9] Rickles F R, Falanga A. Molecular basis for the relationship between thrombosis and cancer.[J]. Thrombosis Research, 2001, 102(6):V215-V224.
[10]Thorson C M, Haren R M V, Ryan M L, et al. Pre-existing hypercoagulability in patients undergoing potentially curative cancer resection[J]. Surgery, 2013, 155(1):134-144.
[11]王国杰, 张灼锦. 血浆D-二聚体检测对下肢深静脉血栓的早期诊断价值[J]. 实用医学杂志, 2012, 28(14):2368-2370.
[12]Vecchio R, Cacciola E, Martino M, et al. Modifications of coagulation and fibrinolytic parameters in laparoscopic cholecystectomy[J]. Surg Endosc, 2003, 17(3):428-433.
[13]Righini M, Perrier A, Moerloose P D, et al. D-Dimer for venous thromboembolism diagnosis: 20 years later[J]. J Thromb Haemost, 2008, 6(7):1059-1071.
[14]Falanga A, Schieppati F, Russo D. Cancer Tissue Procoagulant Mechanisms and the Hypercoagulable State of Patients with Cancer[J]. Semin Thromb Hemost, 2015, 41(7):756-764.
[15]Khorana A A, Kuderer N M, Culakova E, et al. Development and validation of a predictive model for chemotherapy -associated thrombosis[J]. Blood, 2008, 111(10): 4902-4907.
[16]Ay C, Dunkler D, Marosi C, et al. Prediction of venous thromboembolism in cancer patients [J]. Blood, 2013, 116(24): 5377-5382.
[17]Wang Y, Cui T, Du L, et al. The Correlation Between the Serum Squamous Carcinoma Antigen and the Prognosis of Recurrent Cervical Squamous Carcinoma[J]. J Clin Lab Anal, 2017,31(1):e22020.
[18]邹杰, 王俊飞, 李亚里. 血浆鳞状细胞癌抗原与宫颈癌期别和预后相关性[J]. 军医进修学院学报, 2011, 32(7):706-707.
[19]孙晓光, 马水清, 吴鸣,等. 妇科恶性肿瘤患者的生存期预测[J]. 中华医学杂志, 2006, 86(3):160-163.
Prognostic factors of thrombosis in patients with cervical cancer
Cheng Weiwei, Liu Zheyan, Li Xue, Liu Xinjian, Song Yongping
(DepartmentofHematopathy,theAffiliatedCancerHospitalofZhengzhouUniversity/HenanProvincialTumorHospital,Zhengzhou450008,China)
Objective To investigate the influence of coagulation-based risk factors on the prognosis of cervical cancer and to analyze the prognostic factors. Methods The clinical data of cervical cancer patients from June of 2014 to June of 2016 were analyzed by SPSS 22.0 statistical software. Kaplan-Meier method was used to calculate the survival rate of patients with cervical cancer. The survival difference of each group was compared by the Log-rank method, and the multivariate prognostic analysis was performed in the Cox model. Results A total of 412 patients were enrolled in this study, including 47 patients with thrombosis and 365 non-thrombotic patients. The mortality rate of non-thrombotic patients was higher than thrombotic patients (P=0.002<0.001). Univariate analysis showed that tumor stage(P<0.001), Khorana score (P=0.010), D-dimer (P<0.001) and APTT (P<0.001) were related to the prognosis of cervical cancer patients. Multivariate regression analysis showed that tumor stage, Khorana score, D-dimer and APTT were independent prognostic factors. D-dimer(P<0.001), APTT (P<0.001), and SCC (P=0.032) in the death group were significantly higher than the survival group. Conclusion The prognosis of cervical cancer patients accompanied by deep vein thrombosis is poor, which may be related to high level of D-dimer, high level of APTT and high Khorana score.
D-dimer;cervical cancer;deep vein thrombosis;Khorana score
R 737.33
10.3969/j.issn.1004-437X.2017.05.001
2016-12-01)

