萝卜水通道蛋白基因RsAQP1b的表达模式及功能分析
周志国 冯 雪
(廊坊师范学院生命科学学院,河北廊坊 065000)
萝卜水通道蛋白基因RsAQP1b的表达模式及功能分析
周志国 冯 雪
(廊坊师范学院生命科学学院,河北廊坊 065000)
以萝卜品种白玉春为材料,利用同源克隆的方法获得萝卜水通道蛋白基因RsAQP1b的编码序列全长,在萝卜苗期干旱胁迫下分析RsAQP1b基因及蛋白的表达模式;在烟草中表达该基因,研究干旱胁迫下烟草中MDA含量及保护酶的活性变化。结果表明:萝卜水通道蛋白基因RsAQP1b的编码序列全长861 bp,编码286个氨基酸。制备了RsAQP1b多克隆抗体,效价在1∶512 000以上。Real time PCR与Western blot检测表明,干旱胁迫导致RsAQP1b基因与蛋白的表达水平整体下降。PEG6000干旱处理下的转基因与野生型烟草MDA含量都增加,但是转基因烟草的增加幅度小;随着干旱程度加重,转RsAQP1b基因烟草中SOD含量呈上升趋势,CAT含量呈先上升后下降趋势,POD含量呈上升趋势,酶活性均高于相应野生型对照。
萝卜;水通道蛋白;表达模式;过表达
萝卜(Raphanus sativusL.)是我国重要的根菜类蔬菜作物。水通道蛋白AQP(aquaporin)属于跨膜通道蛋白MIP(major intrinsic proteins)超家族,是细胞膜上选择性高效转运分子特异的孔道蛋白,广泛分布在植物发育各个时期的各种组织与器官中,介导细胞的水分跨膜转运,在水分运输过程中起到非常重要的作用(Verdoucq et al.,2014)。苗期遭受水分胁迫,容易造成萝卜生理性病害,严重影响生长后期肉质根的产量与品质。研究萝卜水通道蛋白,对选育优质、高产、抗逆性强的萝卜新品种有重要意义。1988年,Agre等在人红细胞膜上发现一个28 kD的跨膜多肽(Denker et al.,1998),直到1992年分离出第一个水通道蛋白(Preston et al.,1992)。迄今,已在拟南芥(Kaldenhoff et al.,1995)、烟草(Sade et al.,2010)、马铃薯(Ibanez et al.,2014)、辣椒(陈儒钢 等,2010)、番茄(李仁 等,2012)、香蕉(Xu et al.,2014)、水稻(Ahamed et al.,2012)、小麦(Pandey et al.,2013)、多年生黑麦草(周春蕾 等,2013)、萝卜(Suga et al.,2001)等多种植物中克隆并研究了水通道蛋白的功能。Suga等(2001)从萝卜cDNA中克隆出了水通道蛋白家族成员PAQ1、PAQ1b、PAQ1c、PAQ2、PAQ2b、PAQ2c,这些蛋白在萝卜植株、花、种子、下胚轴及主根中都有显著的积累;研究还发现水通道蛋白亚型基因表达有器官与组织特异性,各个亚型的水通道蛋白在不同器官中的表达水平不同。研究表明,在干旱、寒冷、盐等逆境条件下,植株通过调控水通道蛋白的活性来抵御各种胁迫(Moshelion et al.,2015)。许多学者通过转基因的方法使AQPs过表达来提高植株对非生物胁迫的抗性(Gao et al.,2010;Tsuchihira et al.,2010)。目前有关干旱胁迫下萝卜水通道蛋白基因与蛋白表达模式及功能分析的研究较少。本试验以萝卜品种白玉春为材料,利用同源克隆的方法得到萝卜水通道蛋白基因RsAQP1b的编码序列全长,并研究基因与蛋白在干旱胁迫下的表达模式,通过在烟草中过表达,研究其在干旱胁迫下丙二醛(MDA)含量的积累与保护酶的活性变化,为萝卜抗逆育种提供理论依据。
1 材料与方法
1.1 试验设计
试验于2014年6月至2015年4月在河北省廊坊师范学院进行,选用韩国萝卜品种白玉春作为试材,该品种属于水分胁迫敏感材料,干旱胁迫下的蛋白表达变化较为明显。选用内径33 cm的塑料盆,分别装相同的风干土,土壤田间最大持水量为26%,pH值7.0,有机质含量2.01%,全氮0.062%。待萝卜幼苗长到5~6 cm时采用水分胁迫法对幼苗进行干旱处理。
设正常供水(CK)、轻度干旱(LS)、中度干旱(MS)和重度干旱(SS)4个处理,其土壤相对含水量分别为土壤田间最大持水量的70~80%、60~70%、50~60%和35~45%,每个处理3次重复。每天8:00~12:00采用称重法补水控水,土壤相对含水量持续达到上述干旱胁迫条件7 d后取样,液氮速冻,置于-80 ℃冰箱内保存备用。
1.2 RsAQP1b基因编码序列的获得
采用Trizol法分别提取4个处理苗期叶片总RNA,采用cDNA Synthesis Kit(TaKaRa)将RNA反转录成cDNA。根据已公布的萝卜水通道蛋白的编码序列,设计引物〔引物由生工生物工程(上海)股份有限公司合成〕(表1)。采用RT-PCR技术以第一链cDNA为模板,以RsAQP1bF1与RsAQP1bR1为引物扩增该基因的编码序列。扩增产物经切胶回收,连接到pMD19-T(TaKaRa)克隆载体上测序。通过NCBI的blastn与blastp对基因与蛋白序列进行分析,把鉴定正确的质粒命名为p19T-RsAQP1b。
1.3 RsAQP1b原核表达载体构建及蛋白纯化
PCR产物与表达载体经酶切后由T4 DNA ligase连接,转化大肠杆菌BL21(DE3)感受态细胞,鉴定后挑取阳性克隆测序,经序列比对确定为RsAQP1b基因,说明该基因的表达载体已构建成功。
植物AQPs的功能主要有促进水分吸收和远距离运输;在逆境应答等过程中促进细胞内外的跨膜水分运输,调节细胞内外水分平衡;调节细胞的胀缩及运输其他小分子物质。植物AQPs在响应外界环境刺激如干旱、盐碱和低温中起着重要的作用(Moshelion et al.,2015)。
将带有p28a-RsAQP1b质粒的大肠杆菌BL21(DE3)接种于LB液体培养基中,以含空载体质粒的大肠杆菌BL21为阴性对照,于37 ℃震荡培养3 h,用终浓度为1 mmol·L-1的IPTG对蛋白进行诱导表达,18 ℃诱导12 h后收集菌体,用1/10体积的PBS溶解菌体,同时加蛋白酶抑制剂PMSF至终浓度为1 mmol·L-1,4 ℃、 10 000 r·min-1离心15 min,弃上清液,沉淀进行超声波破碎,检测包涵体内是否有蛋白存在。将获得的蛋白质溶液用Ni亲和(GE公司)柱进行纯化,SDS-PAGE电泳检测蛋白提取及纯化。将纯度在95%(电泳纯)以上的目的蛋白用PBS透析,用PEG20000对透析后的蛋白进行浓缩,并用BCA法进行蛋白浓度的测定。
刘少奇同志是伟大的马克思主义者,伟大的无产阶级革命家、政治家、理论家,党和国家主要领导人之一,中华人民共和国开国元勋,是党的第一代中央领导集体的重要成员。刘少奇同志的英名,同中国人民、中国共产党、中华人民共和国波澜壮阔的奋斗历史紧密相连。他为中国革命和建设事业殚精竭虑、呕心沥血,在经济、政治、军事、文化、教育、外交和党的建设等领域都建立了卓著功勋,受到全党全军全国各族人民衷心爱戴。
1.4 多克隆抗体制备
Aroca R,Porcel R,Ruiz-Lozano J M.2012.Regulation of root water uptake under abiotic stress conditions.J Exp Bot,63(1):43-57.
1.5 RsAQP1b基因的表达分析
采用德国西门子PLC公司生产的S7200 CPU22X系列产品,其可靠性、扩展性、维护性等功能良好[10],实现了样机电磁阀的控制及各设备操作程序要求功能。系统由接近开关传感器、电磁阀、调压电源、电器控制柜等组成了硬件控制电路,软件设计包括输入/输出分配表、程序流程图的编写等,最后结合硬件进行调试。PLC程控电路见图10。
1.6 Western blot检测干旱胁迫下RsAQP1b蛋白表达
采用RIPA裂解液(碧云天生物技术有限公司)提取各干旱处理及对照的萝卜叶片蛋白,用BCA法测定蛋白浓度,并将蛋白调整成统一的浓度进行SDS-PAGE电泳,然后将蛋白转印至PVDF膜上,脱脂奶粉封闭1 h,加入1∶1 000稀释的anti-RsAQP1b抗体,4 ℃杂交过夜。将PBST清洗后加入HRP标记的山羊抗兔(1∶4 000稀释)二抗,室温放置2 h,PBST清洗后进行曝光。内参选用plant β-actin(1∶2 000稀释,天德悦生物科技有限公司)。用Quantity One图像分析软件分析目标条带与内参条带的光密度值。用β-actin对RsAQP1b的表达进行半定量分析。
1.7 RsAQP1b过表达载体的构建及转基因烟草的获得
由图7可以看出,野生型烟草植株SOD活性呈先升后降趋势,而转基因植株SOD活性则逐渐上升;CAT活性在2种植株中均呈先上升后下降趋势,只是活性达最大时的胁迫浓度不同;而POD活性均呈上升趋势,但转基因植株的增加幅度高于野生型。
1.8 转基因烟草叶片在干旱条件下脂质过氧化及保护酶活性测定
垃圾经柴油机烟气干燥后可以全部焚烧,参照城市生活垃圾焚烧成本,因工艺不同处理费用为 60~250 元 /t[20]不等,取平均值为 155 元 /t,垃圾干燥器运营成本(主要为工人工资)取32.5万元(5人计,工资5万元/人,社保30%计),折旧费取14.3万元,每年焚烧成本为:
当转基因与野生型烟草幼苗长到3~4片真叶时,选择整齐均一的幼苗,移到Hoagland营养液中缓苗2 d。在相同的温度、光照等条件下,用浓度梯度分别为0、10%、20%和30%(m∶V)的PEG 6000溶液进行人工模拟干旱处理,对应的水势分别为-0.05×106、-0.25×106、-0.65×106、-1.25×106Pa。每个处理3次重复,24 h后取样检测各项指标。
叶片中丙二醛(MDA)含量采用TBA法测定,分别用羟胺法、可见光法与比色法测定超氧化物歧化酶(SOD)、过氧化氢酶(CAT)与过氧化物酶(POD)活性(南京建成生物工程研究所),具体方法按说明书操作。
感谢这次英国之旅,让我比起其他同样来英国游学的孩子多了一份特别的体验,相比走马观花的游玩,这样深入体验的学习让我更加欢喜!希望还能再来英国,体验更多他们的校园生活!
1.9 数据处理
随着国家食品安全监管的不断加强,加上农业部推行的“动物用抗菌素减量化使用”行动,抗生素的使用趋于规范化,药物饲料添加剂也逐渐地退出,以往的蛋鸡疾病防控措施已经不再适用,由于抗生素的不规范使用造成的鸡蛋药物残留超标问题已经成了许多蛋鸡养殖场的噩梦,许多养殖场因此受到了处罚,甚至还有的面临着牢狱之灾。那么面对临床疾病该如何控制药物残留就值得每个养殖场去认真思考——
组间比较采用单因素方差分析(ANONA)法,使用SPSS 20.0统计软件进行分析。
2 结果与分析
2.1 RsAQP1b基因的扩增及序列分析
通过RT-PCR法从萝卜cDNA中扩增出约860 bp的片段,将目的片段3′ 端加尾,经回收后连接到克隆载体上进行测序。测序结果表明,RsAQP1b的CDS全长861 bp,编码286个氨基酸。Blast分析表明,该基因与已发表的萝卜AQP1b(AB030695.1)序列同源性达99%,蛋白保守区与已知基因的氨基酸序列的MIP蛋白保守区序列一致,证明扩增结果即为目的基因。
2.2 RsAQP1b原核表达载体构建及蛋白表达与纯化
以质粒p19T-RsAQP1b为模板,以RsAQP1bF2与RsAQP1bR2为引物扩增RsAQP1b基因,PCR产物经纯化后与pET28a(+)载体分别用限制性内切酶BamHⅠ与XhoⅠ(Biolabs)于37 ℃下酶切3 h,回收目的片段与载体,通过T4 DNA ligase(Biolabs)连接后测序,将测序正确的质粒命名为p28a-RsAQP1b。连接产物转化大肠杆菌BL21(DE3)感受态细胞,经鉴定后挑取阳性克隆进行测序。
表达菌株经37 ℃震荡培养3 h后,18 ℃经IPTG诱导12 h,提取蛋白质,并对诱导后的菌体进行超声波破碎,经SDS-PAGE电泳分析,得到分子量约为30 kD的蛋白条带(图1),通过对超声后上清与沉淀进行电泳,结果表明RsAQP1b蛋白是可溶性表达。
重组蛋白用Ni柱进行亲和纯化,用咪唑进行梯度洗脱(图1)。当咪唑浓度达到300 mmol·L-1时,得到30 kD的单一条带,电泳纯度在95%左右。因此选择300 mmol·L-1咪唑洗脱的产物进行透析、浓缩与浓度测定。

图1 蛋白诱导表达与纯化结果
2.3 多克隆抗体制备
利用Real time PCR检测干旱胁迫下RsAQP1b基因的表达模式。以不同干旱胁迫处理样本的cDNA为模板,以RsAQP1bF3与RsAQP1bR3(表1)为引物,以萝卜的看家基因β-actin F/R为内参,采用ABI 7500荧光定量PCR仪对该基因在不同干旱胁迫下的表达进行分析。按照SYBR premix Ex TaqTM(TaKaRa)试剂盒说明书操作,每个样品3次重复,采用2-ΔΔCT法分析基因的相对表达量。
以重组蛋白为抗原,免疫新西兰家兔得到该蛋白的多克隆抗体,经Elisa检测多抗的效价,结果显示该蛋白多克隆抗体的效价达1∶512 000以上。由图2可以看出,抗体纯度在95%以上。BCA法定量的浓度为0.51 mg·mL-1。
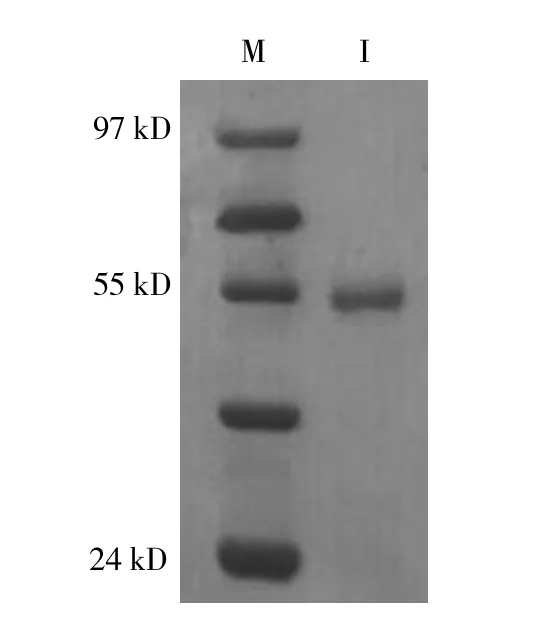
图2 纯化的抗体SDS-PAGE电泳结果
2.4 干旱胁迫下RsAQP1b基因的表达分析
由图3可以看出,随着干旱胁迫的加重,萝卜幼苗RsAQP1b基因表达量逐渐降低,其中中度干旱与重度干旱处理下,RsAQP1b基因表达量显著低于对照,分别比对照降低了26.32%与33.81%。
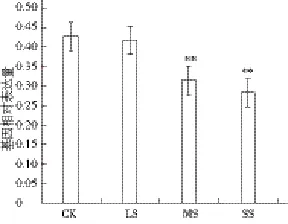
图3 干旱胁迫下RsAQP1b基因表达分析
2.5 Western blot检测干旱胁迫下RsAQP1b蛋白的表达
现阶段,我国一些对于互联网技术的应用不够重视,对其运用也不熟练,所以很多企业并没有设置管理会计这一岗位。因为他们信息不完善,没有意识到这一职位对企业的影响力,公司的整理体制不够完善,导致了企业数据信息不合理与不可靠,不注重先进技术给公司带来的效益,让企业在根本上就失去了核心竞争力。所以现下的企业要想谋求发展,就必须从根本上进行改变,要学会应用技术简化工作流程。
由图4、5可以看出,干旱胁迫处理的萝卜幼苗RsAQP1b蛋白表达量呈整体下降趋势,与Realtime PCR结果一致。
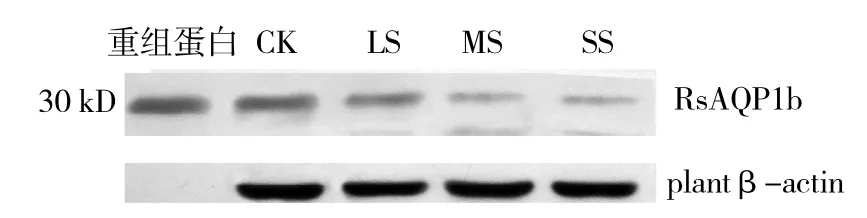
图4 Western blot 检测干旱处理后RsAQP1b蛋白表达

图5 干旱胁迫下RsAQP1b蛋白表达分析
2.6 PEG6000处理后转基因烟草中的MDA含量
干旱胁迫对转基因烟草中MDA含量的影响如图6所示,随着PEG浓度增加,MDA含量持续增加,烟草受干旱伤害程度逐渐加重。但是转RsAQP1b基因烟草MDA含量的增加幅度要比野生型小,野生型烟草各处理MDA含量分别比对照增加了74.54%、132.16和210.51%;转RsAQP1b基因的烟草则分别增加了51.76%、79.81%和126.87%。
2.7 干旱胁迫下转基因烟草叶片SOD 、POD与CAT活性的变化
以p19T-RsAQP1b质粒为模板,用引物RsAQP1bF3与RsAQP1bR4(表1)扩增基因片段,用限制性内切酶BamHⅠ与EcoRⅠ(Biolabs)对纯化的PCR产物与pCAMBIA1303载体进行酶切,凝胶回收后通过T4 DNA ligase(Biolabs)连接,验证后送公司测序,把测序正确的质粒命名为p1303-RsAQP1b。将该质粒通过冻融法转化入农杆菌感受态EHA105中。通过农杆菌介导法将p1303-RsAQP1b质粒转化至烟草中,转化烟草苗使用潮霉素初筛,再经过PCR验证。

图6 不同浓度PEG处理后烟草叶片MDA含量
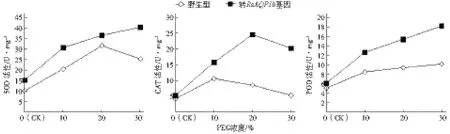
图7 不同浓度PEG处理后烟草叶片SOD、CAT与POD活性变化
3 结论与讨论
当然,就目前中国民主政治的实际运行状况和效果而言,亦即归结到党领导制定宪法、自觉遵守宪法、提议修改宪法、推动以释宪方式提高宪法适应性等问题而言,党的领导体制和领导方式,人民代表大会制度的政治体制,都存在需要完善和进一步改进的地方。比如,如何进一步发挥党的领导和人民代表大会在法治进程中的作用;如何遵照法治进化规律,在党的领导下和人大体制内实施修宪和释宪;如何在宪法法律框架内规范党的领导权力;如何保障全国人大及其常委会有序推进宪法解释权力的有效实施等,都关涉到有效增强宪法适应性问题,并且需要通过构建符合本国民主政治要求的修宪理论、释宪理论和完善修宪、释宪制度加以解决。
本试验通过RT-PCR方法获得了编码萝卜质膜水通道蛋白的基因RsAQP1b,基因与氨基酸序列分析发现,该基因与已发表的萝卜AQP1b(AB030695.1)有99%的同源性,并且与已知蛋白具有相同的保守区域MIP。
由于pET28a(+)载体带有T7强启动子与his标签,故可以利用亲和层析的方法进行蛋白质纯化。本试验将RsAQP1b基因构建到原核表达载体pET28a(+)上,为了减少蛋白形成包涵体,采用低温诱导的方法,用终浓度为1 mmol·L-1的IPTG,18 ℃诱导12 h,RsAQP1b蛋白表现大量的可溶性表达。利用Ni柱纯化蛋白,得到电泳纯度在95%左右的RsAQP1b蛋白,并制备了该蛋白的多克隆抗体,本试验利用抗原亲和纯化的方法纯化该抗体,除去了其他的杂抗体,减少Western blot过程中的非特异性结合。
研究表明,在逆境条件下,为了维持水分平衡,增加对外界胁迫的耐受能力,植物体内大多数AQPs的转录水平降低,同时其蛋白活性下降甚至消失(Aroca et al.,2012)。然而由于植物种类的不同及其所选择的水分胁迫方式不同,APQs对水分胁迫的响应机理也不尽相同。不同的AQPs在相同的胁迫下表达模式不同,相同的亚群在不同的胁迫下有可能呈现不同的表达模式(Alexandersson et al.,2005;Guo et al.,2006)。APQs对非生物胁迫的响应表达模式是多层面的。陈儒钢等(2010)从辣椒材料中克隆了水通道蛋白基因CaAQP,并对耐寒品系P70进行了低温胁迫处理,结果表明随着胁迫时间的延长,CaAQP表达量呈急剧下降趋势。Mahdieh等(2008)研究发现,在干旱胁迫下,烟草的NtPIP1;1和NtPIP2;1转录水平明显下调,而NtAQP1的转录水平则有所上调;周春蕾等(2013)对多年生黑麦草LpAQP基因在干旱胁迫下表达模式分析表明,持续干旱胁迫会导致LpAQP基因表达量先上升后下降,这与李仁等(2012)在番茄上研究AQP表达模式的结果一致。Laur和Hacke(2014)的研究表明,毛果杨在水分胁迫过程中引起所有类型的AQPs都下调表达。颜培玲等(2015)研究发现,抗旱性强的毛葡萄品种花溪-9PIP1基因的表达量随着胁迫时间的延长先增加后降低,而不抗旱的欧亚种红地球PIP1的表达量呈下降的趋势。夏宗良等(2013)从烟草中克隆了一个水通道蛋白基因NtTIP1的编码区,在20% PEG6000诱导的干旱胁迫条件下,NtTIP1在耐旱品种中显著上调表达,而在干旱敏感品种中显著下调表达。此外,在几个转基因材料中也有类似的研究报道,过表达AQPs会增加或降低转基因植物对胁迫的耐受性。例如,小麦与水稻转AQPs基因提高了转基因植物对干旱与盐碱的耐受能力(Gao et al.,2010;Hu et al.,2012),番茄转S1TIP2;2与人参转PgTIP1基因能提高转基因植物抗盐与抗干旱能力(Sade et al.,2009)。相反,过表达一些AQPs降低了转基因植物抗盐与抗寒能力(Katsuhara et al.,2003;Wang et al.,2011),而且过表达AQP引起植物对其中一种胁迫的敏感性,但是增加了对其他胁迫的耐受力。
本试验通过Real time RT-PCR 与Western blot对萝卜品种白玉春干旱胁迫下RsAQP1b基因与蛋白表达进行了检测,结果表明,随着胁迫程度的增加,RsAQP1b基因与蛋白表达整体呈下降趋势,与Laur和Hacke(2014)及夏宗良(2013)的研究结果相似。在烟草中过表达RsAQP1b基因,PEG6000干旱胁迫下转基因烟草比野生型的MDA积累慢,SOD、CAT和POD活性均高于野生型。表明抗旱能力不强的植物可能是通过降低相关基因与蛋白的表达量来减少植物体内水分的流失,从而维持植物体的水分平衡,提高植物对逆境的耐受力。本试验结果为探讨萝卜干旱胁迫机制与抗逆育种提供了重要的理论依据。
超临界流体色谱技术在药物分析领域的应用研究进展…………………………………………………… 张 元等(2):283
陈儒钢,朱文超,巩震辉,李大伟,尹延旭,逯明辉.2010.辣椒水通道蛋白基因CaAQP的克隆与序列分析.中国农业科学,43(20):4323-4329.
李仁,吴新新,李蔚,杨荣超,赵永钦,温常龙,赵冰,郭仰东.2012.番茄水通道蛋白基因SlAQP的克隆与序列分析.中国农业科学,45(2):302-310.
夏宗良,李军旗,刘剑君,苏新宏,张小全.2013.烟草水通道蛋白NtTIP1基因的克隆及其在干旱胁迫下的表达分析.河南农业大学学报,47(5):509-513.
颜培玲,潘学军,张文娥.2015.野生毛葡萄水通道蛋白基因VhPIP1的克隆及其在干旱胁迫下的表达分析.园艺学报,42(2):221-232.
周春蕾,李仁,吴新新,杨荣超,张海军,张娜,赵冰,郭仰东.2013.多年生黑麦草质膜型水通道蛋白基因LpAQP的克隆及功能分析.中国农业科学,46(12):2412-2420.
Ahamed A,Murai-Hatano M,Ishikawa-Sakurai J,Hayashi H,Kawamura Y,Uemura M.2012.Cold stress-induced acclimation in rice is mediated by root-specific aquaporins.Plant Cell Physiol,53(8):1445-1456.
Alexandersson E,Fraysse L,Sjövall-Larsen S,Gustavsson S,Fellert M,Karlsson M,Johanson U,Kjellbom P.2005.Whole gene family expression and drought stress regulation of aquaporins.Plant Mol Biol,59:469-484.
将纯化的蛋白免疫2 kg雄性新西兰大白兔,在免疫前取血清,作为阴性对照。4次免疫,每次间隔15~20 d,心脏取血,收集血清。用ELISA法检测血清效价。用抗原亲和的方法纯化抗血清,用SDS-PAGE电泳检测抗血清的纯度,用BCA法测定浓度。
综上所述,对小儿腹泻采用精细化护理可以改善患儿腹泻症状,提升临床效果,减少并发症的发生,具有一定推广价值。
Denker B M,Smith B L,Kuhajda F P,Agre P.1998.Identification purification,and partial characterizeation of a novel Mr28000 integral membrane-protein from erythrocytes and renal tubules.Journal of Biological Chemistry,263:15634-16542.
Gao Z,He X,Zhao B,Zhou C,Liang Y,Ge R,Shen Y,Huang Z.2010.Overexpressing a putative aquaporin gene from wheat,TaNIP,enhances salt tolerance in transgenic Arabidopsis.Plant Cell Physiol,51:767-775.
Guo L,Wang Z Y,Lin H,Cui W E,Chen J,Liu M,Chen Z L,Qu L J,Gu H.2006.Expression and functional analysis of the rice plasmamembrane intrinsic protein gene family.Cell Research,16:277-286.
Hu W,Yuan Q,Wang Y,Cai R,Deng X,Wang J,Zhou S,Chen M,Chen L,Huang C,Ma Z,Yang G,He G.2012.Overexpression of a wheat aquaporin gene,TaAQP8,enhances salt stress tolerance in transgenic tobacco.Plant Cell Physiol,53:2127-2141.
Ibanez F,Hancock J,Tamborindeguy C.2014.Identification andexpression analysis of aquaporins in the potato psyllid,Bactericera cockerelli.PLoS One,9(10):e111745.
Kaldenhoff R,Kölling A,Meyers J,Karmann U,Ruppel G,Richter G.1995.The blue light-responsive AthH2 gene of Arabidopsis thaliana is primarily expreornssed in expanding as well as in differentiating cells and encodes a putative channel protein of the plasma membrane.The Plant Journal,7(1):87-95.
Katsuhara M,Koshio K,Shibasaka M,Hayashi Y,Hayakawa T,Kasamo K.2003.Over-expression of a barley aquaporin increased the shoot/root ratio and raised salt sensitivity in transgenic rice plants.Plant Cell Physiol,44:1378-1383.
Laur J,Hacke U G.2014.The role of water channel proteins in facilitating recovery of leaf hydraulic conductance from water stress in Populus trichocarpa.PLoS One,9(11):e111751.
Mahdieh M,Mostajeran A,Horie T,Katsuhara M.2008.Drought stress alters water relations and expression of PIP-type aquaporin genes in Nicotiana tabacum plants.Plant Cell Physiol,49(5):801-813.
Moshelion M,Halperin O,Wallach R,Oren R,Way D A.2015.Role of aquaporins in determining transpiration and photosynthesis in water-stressed plants:crop water-use efficiency,growth and yield.Plant Cell Environ,38(9):1785-1793.
Pandey B,Sharma P,Pandey D M,Sharma I,Chatrath R.2013.Identification of new aquaporin genes and single nucleotide polymorphism in bread wheat.Evol Bioinform Online,9:437-452.
Preston G M,Carroll T P,Guggino W B,Agre P.1992.Appearance of water channels in Xenopus oocytes expressing red cell CHIP28 protein.Science,25:385-387.
序列结果用NCBI在线工具Blast在Gene Bank内与标准菌株比对,并用MEGA5.0软件构建系统发育树。
Sade N,Vinocur B J,Diber A,Shatil A,Ronen G,Nissan H,Wallach R,Karchi H,Moshelion M.2009.Improving plant stress tolerance and yield production:is the tonoplast aquaporin SlTIP2;2 a key to isohydric to anisohydric conversion? New Phytol,181:651-661.
地铁使人们出行更加便捷,所以对房价影响较大。小区与地铁站的间距每增加一千米,房价下降356元/m2,对住宅价格影响较显著。交通轨道能使居住区的通达度得到提高,使沿线住房价格得到提高,为开辟和建造新居住区予以潜在的利润保证,开发居住区的最佳位置大多数选择在交通干道两侧和快速路进出口周围区域。
Sade N,Gebretsadik M,Seligmann R,Schwartz A,Wallach R,Moshelion M.2010.The role of tobacco Aquaporin1 in improving water use efficiency,hydraulic conductivity,and yield production under salt stress.Plant Physiol,152(1):245-254.
(3)化学成分分析 在剥落块的低倍试片上从表面、中部、内部分别取样进行化学成分分析,分析结果及70Cr3Mo钢的标准成分如表3所示。
Suga S,Imagawa S,Maeshima M.2001.Specificity of the accumulation of mRNAs and proteins of the plasma membrane and tonoplast aquaporins in radish organs.Planta,212(2):294-304.
Tsuchihira A,Hanba Y T,Kato N,Doi T,Kawazu T,Maeshima M.2010.Effect of overexpression of radish plasma membrane aquaporins on water-use efficiency,photosynthesis and growth of Eucalyptus trees.Tree Physiol,30(3):417-430.
本系统电源模块主要由12 V蓄电池供电,为整个系统提供两种电源5 V和3.3 V,5 V电源主要为二氧化碳、氧气传感器供电,采用LM2596芯片,使外接电路的稳定性和选择性增强。3.3 V电源为单片机[6]系统、温湿度传感器、通信模块供电。5 V电源如图3所示。
Verdoucq L,Rodrigues O,Martini è re A,Luu D T,Maurel C.2014.Plant aquaporins on the move:reversible phosphorylation,lateral motion and cycling.Curr Opin Plant Biol,22:101-107.
Wang X,Li Y,Ji W,Bai X,Cai H,Zhu D,Sun X L,Chen L J,Zhu Y M.2011.A novel Glycine soja tonoplast intrinsic protein gene responds to abiotic stress and depresses salt and dehydration tolerance in transgenic Arabidopsis thaliana.J Plant Physiol,168:1241-1248.
Xu Y,Hu W,Liu J,Zhang J,Jia C,Miao H,Xu B,Jin Z.2014.A banana aquaporin gene,MaPIP1;1,is involved in tolerance to drought and salt stresses.BMC Plant Biol,4:59.
Expression Pattern and Functional Analysis of Aquaporin(RsAQP1b)in Raphanus sativus L.
ZHOU Zhi-guo,FENG Xue
(LifeScienceDepartment,LangfangNormalCollege,Langfang065000,Hebei,China)
Taking the radish cultivar‘Baiyuchun’as material,this paper gained coded sequence of aquaporin geneRsAQP1bby homology-based cloning method;and analyzed the expression pattern ofRsAQP1bgene and protein under drought stress during radish seedling period,and studied the expression of this gene in tobacco,changes in MDA content and activity of protective enzyme under drought stress. The results indicated that CDS ofRsAQP1bwas 861 bp,encoding a protein of 286 amino acids. Polyclonal antibody of RsAQP1b was prepared and its titer was over 1∶512 000. Real time PCR and western blot detection showed that the expression level ofRsAQP1bgene and protein was down-regulated by drought stress. Under PEG6000 drought stress treatment,the MDA content in transgenic and wild type(WT)tobacco was all increased,but the increasing rage of transgenic tobacco was small. The content of SOD in transgenicRsAQP1btobacco showed an increasing tendency,while the CAT content showed a tendency of first rising then declining. The POD content showed an increasing tendency. The enzymatic activity was all exceeded that of the relevant CK of wide type.
Radish;Aquaporin;Expression pattern;Overexpression
周志国,男,讲师,专业方向:蔬菜作物生物技术育种,E-mail:zhiguo__zhou@163.com
2016-04-19;接受日期:2017-02-21
河北省教育厅青年基金项目(QN2017351),廊坊师范学院校级项目(LSLQ201407),廊坊师范学院教改项目(K2015-13)

