乙酰苯胺和2-氯苯磺酰胺诱导IN2-2启动子在芥菜中的表达
周 雯 孙芳芳 杜杨梅 马存发 朱陈曾 郑 敏 任雪松 司 军 宋洪元
(西南大学园艺园林学院,南方山地园艺学教育部重点实验室,重庆市蔬菜学重点实验室,重庆 400715)
乙酰苯胺和2-氯苯磺酰胺诱导IN2-2启动子在芥菜中的表达
周 雯 孙芳芳 杜杨梅 马存发 朱陈曾 郑 敏 任雪松 司 军 宋洪元*
(西南大学园艺园林学院,南方山地园艺学教育部重点实验室,重庆市蔬菜学重点实验室,重庆 400715)
分别用不同浓度(50、100、200 mg·L-1)的除草剂安全剂类似化合物乙酰苯胺和2-氯苯磺酰胺处理IN2-2::GUS转基因芥菜。结果显示:乙酰苯胺和2-氯苯磺酰胺处理后,IN2-2启动子在芥菜根、叶、花器官的花萼、花瓣、雄蕊及花粉中表达,但不在胚珠中表达。100 mg·L-1乙酰苯胺以及50 mg·L-12-氯苯磺酰胺适合用于在芥菜中调控IN2-2启动子的表达,乙酰苯胺较2-氯苯磺酰胺诱导表达所需时间更短。高浓度的2-氯苯磺酰胺影响芥菜种子发芽及生长发育,并且明显抑制IN2-2启动子的表达活性。4 ℃低温胁迫诱导IN2-2启动子在幼苗叶片中表达,IN2-2启动子轻微受150 mmol·L-1NaCl胁迫表达,但不受重金属Gu2+离子的诱导表达。
IN2-2启动子;乙酰苯胺;2-氯苯磺酰胺;芥菜;GUS表达
化学诱导基因表达系统是一种重要的人工调控表达系统,通过化学诱导表达系统可以实现对目标基因转录的去抑制、激活和失活,被用于育性调控、基因功能分析、无标记植物转化、DNA定点删除和基因沉默等多方面的研究(Gatz,1997)。植物中较为常见的化学诱导表达系统包括四环素、糖皮质激素、乙醇和铜离子等诱导系统(Picard et al.,1988;Gossen & Bujard,1992),通过特定转录因子/蛋白诱导基因表达,调控相对复杂(Zuo & Chua,2000)。鉴于部分诱导物可能会对植物产生毒害作用、对环境具有安全隐患以及性质不稳定而不适合在大田应用。如四环素诱导系统需要tet操纵子(Gossen & Bujard,1992),因四环素本身是蛋白合成抑制剂,可能会影响植物蛋白合成(Zuo & Chua,2000)。Cu2+本身是植株生长所必需的微量元素,但施用浓度超出一定范围时会对植株产生毒害作用(Mett et al.,1993)。
除草剂安全剂(safener)又称为解毒剂(antidote)或保护剂(protectant),是一类选择性保护作物免受除草剂伤害而改进杂草防除效果的化合物,通过诱导诸如GSTs和P450s类基因表达,增强植物防御和去毒能力(毕洪梅 等,2007)。谷胱甘肽轭合论认为安全剂的基因活化作用诱导谷胱甘肽-S-转移酶(GSTs)或其他代谢酶活性的产生而达到保护的效果(Lay & Casida,1976)。玉米GST-27基因表达受除草剂安全剂的诱导但不受激素、环境、生理变化的影响(Jepson et al.,1994)。玉米IN2-2基因受除草剂安全剂2-CBSU〔N-(aminocarbonyl)-2-chlorobenzenesulfonamide〕诱导表达,在各种胁迫处理下基本不表达(Hershey & Stoner,1991)。IN2-2::GUS转基因拟南芥分别用4种不同的除草剂安全剂诱导处理后发现,2-CBSU能诱导IN2-2启动子在根、茎尖分生组织和排水孔中表达(de Veylder et al.,1997)。由于基于除草剂安全剂的诱导系统不需要特定转录因子的参与,相对其他化学诱导系统更为简单;且除草剂安全剂在农业生产上应用广泛(高家东 等,2013),开发基于除草剂安全剂诱导的基因调控系统应用前景广阔。先后有来自玉米的GST-27、IN2-1、IN2-2、IN2-5等除草剂安全剂诱导启动子分别在马铃薯、烟草、拟南芥、水稻、玉米中被用于基因表达调控(Robertson et al.,2000;袁媛 等,2004;Behringer et al.,2011)。在模式植物拟南芥中,4种不同的除草剂安全剂中仅2-CBSU能诱导IN2-2启动子在根、茎尖分生组织和排水孔中表达,其他除草剂安全剂只能在根中诱导表达(de Veylder et al.,1997);除草剂安全剂2-CBSU缺少市售标准品,多为实验室专门合成(袁媛 等,2004);另外,受习惯上认为单子叶植物和双子叶植物具有启动子表达偏好性的影响,导致IN2-2启动子除了在模式植物拟南芥中的表达特点被报道外,缺少在其他双子叶植物中的表达分析研究。
目前,IN2-2启动子已被成功用于单子叶植物玉米、水稻、小麦、甘蔗的基因表达调控(Choi et al.,2003;Cho et al.,2014),显现其在植物基因表达调控中的巨大应用价值。而早先在拟南芥中的IN2-2启动子表达信息(缺少雌雄蕊、花粉、胚珠中的表达特性)尚不足以显示该启动子在双子叶植物中的可能应用前景(de Veylder et al.,1997)。另外,在烟草中发现乙酰苯胺化合物可以诱导玉米类似启动子IN5-2的表达(马亮 等,2010);而2-氯苯磺酰胺在分子结构上与除草剂安全剂2-CBSU相似。因此,本试验利用IN2-2::GUS转基因芥菜植株,以35S::GUS转基因芥菜为对照,在转基因植株不同时期分别用不同浓度的乙酰苯胺和2-氯苯磺酰胺进行诱导处理,比较IN2-2启动子对上述不同化学物质诱导响应以及在芥菜各组织、器官中的表达特点;同时,对转基因植株分别进行4 ℃低温、盐胁迫以及Cu2+胁迫处理,观察IN2-2启动子在不同胁迫条件下的表达稳定性。以期为今后在十字花科双子叶植物中利用IN2-2启动子进行基因表达化学调控提供依据。
1 材料与方法
1.1 试验材料
试验于2016年4~8月在西南大学园艺园林学院蔬菜实验室进行。利用常规品种渝丰榨菜获得的IN2-2::GUS转基因种子及35S::GUS转基因芥菜种子均由本院蔬菜实验室保存。诱导剂乙酰苯胺(Acetylaniline)和2-氯苯磺酰胺(2-Chlorobenzenesulfonamide)分别购自生工生物工程(上海)股份有限公司和重庆鼎国生物科技有限责任公司。
1.2 转基因芥菜处理
分别将乙酰苯胺和2-氯苯磺酰胺配制成浓度为50、100、200 mg·L-1的溶液,以野生型芥菜和35S::GUS转基因芥菜清水处理为对照。① 将IN2-2::GUS芥菜种子分别置于添加不同浓度乙酰苯胺溶液、2-氯苯磺酰胺溶液的培养皿中萌发,每处理10~12粒,3次重复,分别调查统计各处理的种子发芽情况;25 ℃处理3 d后将萌发以及未萌发的种子进行GUS组织化学染色。② 分别用不同浓度乙酰苯胺、2-氯苯磺酰胺灌根处理苗龄45 d的IN2-2::GUS幼苗,每处理3株,3次重复;分别在处理后0、2、5、7 d取部分侧根和新生叶片进行GUS组织化学染色。③IN2-2::GUS植株开花后,分别用不同浓度乙酰苯胺和2-氯苯磺酰胺溶液进行灌根处理,每处理3株,3次重复;分别在处理后0、2、5、7 d取新开放的3~5朵花进行GUS组织化学染色。
1.3 转基因芥菜胁迫处理
将野生型和IN2-2::GUS芥菜种子播于温度为25 ℃/15 ℃(昼/夜,下同)的人工气候室内,30 d后幼苗生长至5片真叶左右,分别作如下处理:① 4 ℃恒温培养箱处理;② 150 mmol·L-1的NaCl溶液灌根;③ 250 μmol·L-1的CuSO4溶液灌根。每处理3株,3次重复;胁迫处理0、3 d后取幼苗新生叶片进行GUS组织化学染色。
1.4 GUS组织化学染色
将样品浸泡在染色液{50 mmol·L-1的Na2HPO4和NaH2PO4混合液1 mL,0.1%的Triton X-100溶液0.1 mL,2 mmol·L-1的K3Fe(CN)6溶液0.2 mL,2 mmol·L-1的K4〔Fe(CN)6〕·3H2O溶液0.2 mL,10 mmol·L-1的EDTA溶液0.2 mL,2 mmol·L-1的X-Gluc溶液8.3 mL}中,于37 ℃恒温箱处理6 h;取出样品先后用50%、70%、100%的乙醇漂洗,再加入100%乙醇浸泡直至完全脱色。
2 结果与分析
2.1 乙酰苯胺和2-氯苯磺酰胺诱导IN2-2启动子在芥菜种子萌发期的表达
由图1可知,不同浓度乙酰苯胺处理和清水处理IN2-2::GUS芥菜种子发芽情况与野生型种子清水处理无明显差异;而2-氯苯磺酰胺处理明显抑制IN2-2::GUS芥菜种子发芽,50 mg·L-1浓度处理的下胚轴长度远不及对照,100 mg·L-1和200 mg·L-1浓度处理的芥菜种子几乎不能正常发芽,且发芽时间延长至7 d后胚轴仍未伸长(图片未展示)。

图1 乙酰苯胺、2-氯苯磺酰胺处理对IN2-2::GUS芥菜种子发芽的影响
处理3 d后的种子进行GUS组织化学染色,结果如图2所示,清水处理的IN2-2::GUS种子发芽后无明显GUS活性;乙酰苯胺处理的子叶、下胚轴及根中均有明显的GUS活性,且根中GUS活性随处理浓度的增加表现明显的增强趋势;50 mg·L-1的2-氯苯磺酰胺处理可诱导IN2-2启动子在子叶、下胚轴以及根中表达,100、200 mg·L-1浓度处理未伸长的胚根中有微量的GUS活性。不同浓度乙酰苯胺和2-氯苯磺酰胺处理后,IN2-2::GUS子叶和下胚轴中GUS活性均稍微弱于35S::GUS转基因芥菜,但100 mg·L-1和200 mg·L-1乙酰苯胺处理以及50 mg·L-12-氯苯磺酰胺处理的根中GUS活性明显强于35S::GUS转基因芥菜。

图2 乙酰苯胺、2-氯苯磺酰胺处理3 d后的转基因芥菜种子GUS组织化学染色
2.2 乙酰苯胺和2-氯苯磺酰胺诱导IN2-2启动子在芥菜根中的表达
由图3可知,野生型幼苗根部无GUS活性,而35S::GUS幼苗根部可见明显的GUS活性,IN2-2::GUS幼苗部分根部诱导剂处理前有轻微表达;3个浓度的乙酰苯胺处理2 d后的根部均有明显的GUS活性,5 d后活性增强,至第7天时活性下降;50 mg·L-1的2-氯苯磺酰胺处理2 d后根部有轻微的GUS活性,而100 mg·L-1和200 mg·L-1浓度处理2 d后与处理前无明显差异,但3个浓度的2-氯苯磺酰胺处理5 d后均可见明显的GUS活性,7 d后活性进一步增强,且50 mg·L-1与100 mg·L-1浓度处理根部GUS表达活性明显强于200 mg·L-1处理。上述结果表明,乙酰苯胺能更快启动IN2-2启动子在根中的表达,但处理5 d后表达水平下降;而2-氯苯磺酰胺诱导IN2-2启动子在根中的表达较慢,处理7 d后达到表达高峰,但过高浓度处理明显抑制IN2-2启动子在根中的表达。
2.3 乙酰苯胺和2-氯苯磺酰胺诱导IN2-2启动子在芥菜叶片中的表达

图3 乙酰苯胺、2-氯苯磺酰胺处理后芥菜幼苗根部GUS组织化学染色

图4 乙酰苯胺、2-氯苯磺酰胺处理后芥菜幼苗叶片GUS组织化学染色
由图4可知,35S::GUS植株叶片中GUS活性强,而野生型植株叶片未检测到任何GUS活性;部分IN2-2::GUS植株处理前可在叶缘检测到少量GUS活性;不同浓度乙酰苯胺处理2 d后的叶片可见较为明显的GUS表达,5 d后表达进一步增强,7 d后GUS表达水平出现明显降低,其中100 mg·L-1乙酰苯胺诱导效果较好;2-氯苯磺酰胺处理2 d后叶片中GUS表达与处理前相比无明显差异,50 mg·L-1和100 mg·L-1浓度处理5 d后叶片中可见明显的GUS表达,且50 mg·L-1浓度处理诱导表达效果强于100 mg·L-1处理,而200 mg·L-1浓度处理在叶片未见GUS活性;50 mg·L-1和100 mg·L-1的2-氯苯磺酰胺处理7 d后,GUS表达活性进一步增强,但仍低于35S::GUS。上述结果表明,尽管2-氯苯磺酰胺诱导IN2-2启动子在叶片中表达反应速度弱于乙酰苯胺,但在一定浓度下其诱导表达效果明显优于乙酰苯胺。
2.4 乙酰苯胺和2-氯苯磺酰胺诱导IN2-2启动子在芥菜花器官中的表达
由图5可知,野生型植株花器官未见GUS表达,35S::GUS植株花器官各部分均有GUS表达,雄蕊和花萼中表达尤其强烈。IN2-2::GUS植株处理前均未见明显的GUS表达。100 mg·L-1的乙酰苯胺处理2 d后,在花萼及雄蕊中见到明显的GUS表达活性;5 d后不同浓度处理的花器官(花萼、花瓣、雄蕊)中均可见GUS表达,但仍以100 mg·L-1浓度处理的表达活性最强;第7天,3个浓度处理的花器官中基本检测不到GUS活性。100 mg·L-1的2-氯苯磺酰胺处理2 d后,在花萼中可见微量的GUS表达,其余两个浓度处理未见GUS表达;50 mg·L-1和100 mg·L-1浓度处理5 d后,花器官各组织均可见GUS表达,但200 mg·L-1浓度处理仅在花萼中有微量表达活性;50 mg·L-1和100 mg·L-1浓度处理7 d后,花器官中的GUS表达均有不同程度的下降,而200 mg·L-1浓度处理也基本检测不到GUS表达活性。

图5 乙酰苯胺、2-氯苯磺酰胺处理后芥菜植株花器官GUS组织化学染色
由图6可知,在野生型植株的花药以及花粉中均无GUS活性,35S::GUS植株花药和花粉中均有明显的GUS活性。经不同浓度诱导剂处理5 d后,100 mg·L-1的乙酰苯胺和50 mg·L-1的2-氯苯磺酰胺处理花药和花粉中的GUS活性表达最强。35S::GUS植株在柱头和花柱中可检测到较为明显的GUS活性,但子房胚珠中未有任何GUS表达,而该现象在拟南芥中也被发现(Skinner et al.,2016)。100 mg·L-1和200 mg·L-1的乙酰苯胺处理5 d后,可在柱头以及花柱表面检测到少量GUS活性;50 mg·L-1和100 mg·L-1的2-氯苯磺酰胺处理5 d后,柱头以及花柱表面的GUS活性强于乙酰苯胺处理,但两种诱导剂各浓度处理均未发现子房中的胚珠表达GUS活性。

图6 乙酰苯胺、2-氯苯磺酰胺处理5 d后芥菜花药、花粉、花柱及胚珠GUS组织化学染色
上述结果表明,2-氯苯磺酰胺诱导IN2-2启动子在花器官中的表达特性与在叶片中的表达相似,200 mg·L-1浓度抑制IN2-2启动子表达。相对乙酰苯胺,2-氯苯磺酰胺诱导IN2-2启动子表达滞后,但诱导表达水平高于乙酰苯胺,持续诱导时间长于乙酰苯胺。另外,两种化学诱导剂均能在适当的浓度下诱导IN2-2启动子在花粉及花柱中表达,但不能诱导IN2-2启动子在子房胚珠中表达。
2.5 环境胁迫诱导IN2-2启动子在芥菜叶片中的表达
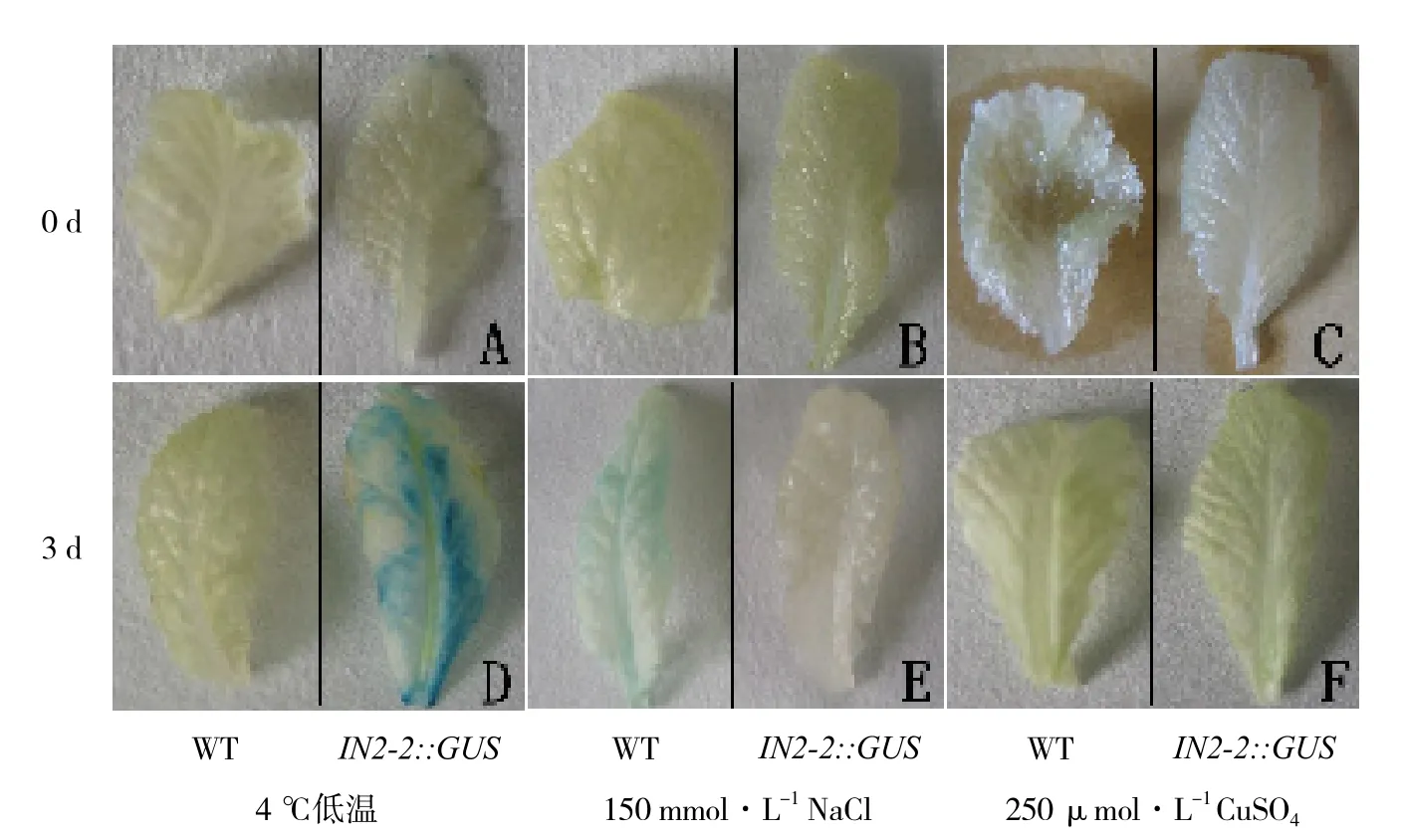
图7 低温、高盐、重金属离子诱导后芥菜叶片GUS组织化学染色
野生型幼苗在4 ℃低温、150 mmol·L-1NaCl溶液以及250 μmol·L-1CuSO4溶液胁迫处理下均未检测到任何GUS活性,IN2-2::GUS幼苗仅个别叶片边缘有极轻微的GUS活性呈现(图7-A、B、C)。IN2-2::GUS幼苗在4 ℃低温胁迫3 d后,叶片可见明显的GUS活性表达,显示IN2-2启动子可被低温逆境诱导表达(图7-D)。150 mmol·L-1NaCl溶液处理3 d后,IN2-2::GUS幼苗叶片有轻微GUS活性,显示IN2-2启动子在高盐胁迫下轻微诱导表达(图7-E)。IN2-2::GUS幼苗经250 μmol·L-1CuSO4溶液胁迫3 d后,未在叶片中检测到GUS活性(图7-F),表明在芥菜中IN2-2启动子不受重金属Cu2+的诱导表达。
3 结论与讨论
目前,基于激素、物理、化学诱导的植物启动子不断被发现(Dutt et al.,2014)。除草剂安全剂诱导启动子属于化学直接诱导型启动子,其中以来自于玉米的IN2-1、IN2-2(Hershey & Stoner,1991)、IN5-2(袁媛 等,2004)与GST27启动子(Jepson et al.,1994)研究及应用较多。除草剂安全剂AD-67(苯叉酰胺)处理水稻幼苗后通过mRNA差异显示法筛选到1个诱导后表达显著增强的Yippee基因序列,但未见启动子表达特性的报道(殷得所 等,2007)。利用IN5-2启动子构建了1套受2-氯-N-苯磺酰胺诱导调控的Cre/lox删除系统,实现了烟草选择标记基因的删除(Yuan et al.,2004;Ma et al.,2011)。Choi等(2003)将IN2-2启动子与扩展蛋白基因OsEXP4融合转化水稻,通过2-CBSU诱导研究OsEXP4扩展蛋白基因在水稻生长发育中的功能。除草剂安全剂诱导响应元件一般位于ATG上游500 bp以内,IN2-1启动子诱导元件(as-1a和as-1b)位于ATG上游-416~-315 bp之间,且-505~-416 bp之间可能有1个抑制诱导表达元件的存在(Behringer et al.,2011)。而IN5-2启动子中受2-chloro-N-(methylaminocarbonyl)benzenesulfonamide诱导的化学诱导元件可能位于ATG上游-388~-86 bp之间(袁媛 等,2004);洋葱表皮细胞瞬时表达结果进一步显示,该响应元件位于-220~-143 bp之间(马亮 等,2010)。结合IN2-2启动子在拟南芥以及水稻中的应用(de Veylder et al.,1997;Choi et al.,2003),本试验中IN2-2启动子使用ATG上游463 bp长度的序列。
玉米IN2-1和IN2-2启动子受酰胺类除草剂安全剂诱导表达(Hershey & Stoner,1991)。分别用浓度为50 mg·L-1的4种不同的酰胺类除草剂安全剂处理IN2-2::GUS拟南芥,仅2-CBSU诱导GUS基因在根、茎尖分生组织以及叶片排水孔中高效表达,其余3种安全剂只能诱导GUS基因在根中表达(de Veylder et al.,1997)。本试验中,乙酰苯胺和2-氯苯磺酰胺均能诱导IN2-2启动子的表达,但表达模式存在一定的差异,乙酰苯胺诱导IN2-2启动子在芥菜根与花器官中(包括花药和花粉)表达,在叶片中的表达量较少;而2-氯苯磺酰胺诱导IN2-2启动子在根、花器官(包括花药和花粉)以及叶片中的表达量都比较高。乙酰苯胺诱导IN2-2启动子表达水平较2-氯苯磺酰胺低,但诱导启动子表达量达到峰值所需时间较2-氯苯磺酰胺短。出现该现象的原因被认为与不同化学诱导物结构差异影响其在植物不同组织细胞中的运输吸收有关(de Veylder et al.,1997)。相对传统的四环素、糖皮质激素、乙醇和铜离子等化学诱导系统,尽管除草剂安全剂化学诱导系统更为简单,但该系统中哪些基因参与到IN2-2启动子的表达调控是不清楚的(de Veylder et al.,1997)。因此,本试验中乙酰苯胺处理浓度范围内,尽管200 mg·L-1处理对植株生长发育无明显的影响,但其在根、叶片以及花器官中的表达水平却低于100 mg·L-1处理,出现该现象的原因有待于进一步的研究。本试验中,发现2-氯苯磺酰胺处理抑制芥菜种子发芽,100 mg·L-1与200 mg·L-1浓度处理对转基因芥菜植株产生药害,出现较严重的叶片卷曲,且该现象在IN2-2::GUS转基因番茄上也有表现(结果未展示)。在拟南芥中,4种除草剂安全剂超过一定浓度也不同程度的影响种子发芽、根伸长以及叶片形态(de Veylder et al.,1997)。因此,从本试验结果来看,IN2-2启动子的诱导表达特性在单子叶和双子叶植物中具有保守性(de Veylder et al.,1997),其作为化学诱导剂直接诱导启动子应用于双子叶植物的分子生物学研究是可行的。另外,乙酰苯胺和2-氯苯磺酰胺均可作为2-CBSU的替代诱导物用于调控IN2-2启动子的表达,100 mg·L-1乙酰苯胺以及50 mg·L-12-氯苯磺酰胺适合用于在芥菜中调控IN2-2启动子的表达,该浓度条件下药剂对植株的生长发育无毒害作用且可实现启动子表达的良好调控。
化学诱导基因表达系统在大田环境中的严谨性是能否应用于实践生产的关键要素之一(Padidam,2003)。在没有诱导剂的情况下,IN2-2启动子可在日历苗龄21~28 d的拟南芥植株根表皮细胞中检测到微量的GUS活性,但在21 d以前的植株中未检测到GUS表达(de Veylder et al.,1997)。GST-27启动子即使在缺少诱导剂的情况下,在马铃薯茎、根和膨大块茎中均可检测到明显的表达(Robertson et al.,2000)。本试验中,刚发芽的芥菜根中未检测到IN2-2启动子表达;未添加诱导剂的情况下,在日历苗龄约30 d的芥菜幼苗叶片中无表达,45 d后的幼苗可在部分根以及叶片中检测到微量的GUS活性;开花后的花器官未添加诱导物时IN2-2启动子不表达。因此,IN2-2启动子表达泄露可能与组织器官以及发育阶段有关。玉米植株经机械损伤、热击、高盐胁迫、GA处理均不能诱导IN2-1、IN2-2启动子的表达(Hershey & Stoner,1991)。但本试验中,IN2-2启动子在芥菜叶片中的表达不受Cu2+的诱导,但轻微受到高盐的诱导表达,在4 ℃低温胁迫下可见明显的表达。如何实现化学诱导型启动子严谨的表达是一个较为复杂的问题。如PR-1a启动子主要受二叔丁对甲酚(BTH)的诱导(Görlach et al.,1996),但该启动子也受环境条件如紫外照射、SO2、臭氧等胁迫因素的诱导表达(Green & Fluhr,1995;Sharma et al.,1996)。因此,可通过对诱导表达启动子关键调控元件的精确分析和突变改造(Kiran et al.,2006;Srivastava et al.,2014),提高表达水平及严谨性。目前,包括IN2-2、IN2-5等除草剂安全剂诱导启动子与其他系统结合,实现了基因删除、雄性不育调控、转基因植株筛选等(Cigan et al.,2001;Yuan et al.,2004;Ma et al.,2011;Cho et al.,2014)。因此,结合其他分子系统改造IN2-2启动子表达严谨性,将有助于实现植物目标基因的精确及复杂调控。
毕洪梅,张金艳,叶非,高爽.2007.除草剂安全剂的作用机制研究进展.农药科学与管理,28(1):32-34.
高家东,田兴山,冯莉,杨彩宏,岳茂峰,崔烨,张泰劼.2013.酰胺类除草剂安全剂的作用机制及研究进展.广东农业科学,(22):101-105.
马亮,梅晓宏,许文涛,罗云波,周忻,唐小革,黄昆仑.2010.玉米In5-2启动子功能区域在洋葱瞬时表达系统中的分析.农业生物技术学报,18(6):1073-1078.
殷得所,孙小琼,李科,王世全,邓其明,李平.2007.一个除草剂安全剂AD-67诱导的水稻基因片段的克隆和分析.中国水稻科学,21(4):439-442.
袁媛,梁本国,刘允军,王涛.2004.玉米In5-2启动子功能区域结构分析.农业生物技术学报,12(6):630-634.
Behringer C,Bartsch K,Schaller A.2011.Safeners recruit multiple signalling pathways for the orchestrated induction of the cellular xenobiotic detoxification machinery in Arabidopsis.Plant,Cell & Environment,34(11):1970-1985.
Cho M J,Ellis S R,Gordon-Kamm W J,Zhao Z Y.2014.Methods and compositions for producing and selecting transgenic plants.The United States:US 2014093485 A1.
Choi D,Lee Y,Cho H T,Kend H.2003.Regulation of expansin gene expression affects growth and development in transgenic rice plants.The Plant Cell,15(6):1386-1398.
Cigan A M,Unger E,Xu R J,Kendall T,Fox W T.2001.Phenotypic complementation of ms45 maize requires tapetal expression of MS45.Sex Plant Reprod,14:135-142.
de Veylder L,van Montagu M,Inze D.1997.Herbicide safenerinducible gene expression in Arabidopsis thaliana.Plant and Cell Physiology,38(5):568-577.
Dutt M,Dhekney S A,Soriano L,Kandel R,Grosser J W.2014.Temporal and spatial control of gene expression in horticultural crops.Horticulture Research,1:140-147.
Gatz C.1997.Chemical control of gene expression.Annual Review of Plant Biology,48(1):89-108.
Görlach J,Volrath S,Knauf-Beiter G,Hengy G,Beckhove U,Kogel K H,Ryals J.1996.Benzothiadiazole,a novel class of inducers of systemic acquired resistance,activates gene expression and disease resistance in wheat.The Plant Cell,8(4):629-643.
Gossen M,Bujard H.1992.Tight control of gene expression in mammalian cells by tetracycline-responsive promoters.Proceedings of the National Academy of Sciences,89(12):5547-5551.
Green R,Fluhr R.1995.UV-B-induced PR-1accumulation is mediated by active oxygen species.The Plant Cell,7(2):203-212.
Hershey H P,Stoner T D.1991.Isolation and characterization of cDNA clones for RNA species induced by substituted benzenesulfonamides in corn.Plant Molecular Biology,17(4):679-690.
Jepson I,Lay V J,Holt D C,Bright S W,Greenland A J.1994.Cloning and characterization of maize herbicide safener-induced cDNAs encoding subunits of glutathione S-transferase isoforms Ⅰ,Ⅱ and Ⅵ.Plant Molecular Biology,26(6):1855-1866.
Kiran K,Ansari S A,Srivastava R,Lodhi N,Chaturvedi C P,Sawant S V,Tuli R.2016.The TATA-Box sequence in the basal promoter contributes to determining light-dependent gene expression in plants.Plant Physiology,142(1):364-376.
Lay M M,Casida J E.1976.Dichloroacetamide antidotes enhance thiocarbamate sulfoxide detoxification by elevating corn root glutathione content and glutathione S-transferase activity.Pesticide Biochemistry and Physiology,6(5):442-456.
Ma L,Dong J L,Jin Y S,Chen M L,Shen X Y,Wang T.2011.RMDAP:a versatile,ready-to-use toolbox for multigene genetic transformation.PLoS ONE,6(5):e19883.
Mett V L,Lochhead L P,Reynolds P H.1993.Copper-controllable gene expression system for whole plants.Proceedings of the National Academy of Sciences,90(10):4567-4571.
Padidam M.2003.Chemically regulated gene expression in plants.Current Opinion in Plant Biology,6(2):169-177.
Picard D,Salser S J,Yamamoto K R.1988.A movable and regulable inactivation function within the steroid binding domain of the glucocorticoid receptor.Cell,54(7):1073-1080.
Robertson N,Paine J A,Sonnewald U,Jepson I.2000.Expression of the chemically inducible maize GST-27 promoter in potato.Potato Research,43(4):335-345.
Sharma Y K,Le ó n J,Raskin I,Davis K R.1996.Ozone-induced responses in Arabidopsis thaliana:the role of salicylic acid in the accumulation of defense-related transcripts and induced resistance.Proceedings of the National Academy of Sciences,93(10):5099-5104.
Skinner D J,Brown R H,Kuzoff R K,Gasser C S.2016.Conservation of the role of INNER NO OUTER in development of unitegmic ovules of the Solanaceae despite a divergence in protein function.BMC Plant Biology,16:143.
Srivastava R,Rai K M,Srivastava M,Kumar V,Pandey B,Singh S P,Bag S K,Singh B D,Tuli R,Sawant S V.2014.Distinct role of core promoter architecture in regulation of light-mediated responses in plant genes.Molecular Plant,7(4):626-641.
Yuan Y,Liu Y J,Wang T.2004.A new Cre/lox system for deletion of selectable marker gene.Acta Botanica Sinica,46(47):862-866.
Zuo J,Chua N H.2000.Chemical-inducible systems for regulated expression of plant genes.Current Opinion in Biotechnology,11(2):146-151.
Expression of IN2-2 Promoter Induced by Acetanilide and 2-Chlorobenzenesulfonamide in Mustard
ZHOU Wen,SUN Fang-fang,DU Yang-mei,MA Cun-fa,ZHU Chen-zeng,ZHEN Min,REN Xuesong,SI Jun,SONG Hong-yuan*
(CollegeofHorticultureandLandscapeArchitecture,SouthwestUniversity,KeyLaboratoryofHorticultureSciencefor SouthernMountainsRegions,MinistryofEducation,ChongqingKeyLaboratoryofOlericulture,Chongqing400715,China)
IN2-2::GUStransgenic mustard was treated with different concentrations(50、100、200 mg·L-1)of acetanilide and 2-chlorobenzenesulfonamide,the herbicide safer analogous chemicals.The results showed thatIN2-2promoter expressed in mustard roots,leaves,flower calyx,petal,stamen and pollen after treated with acetanilide or 2-chlorobenzenesulfonamide,but no GUS expression activity was observed in ovule.100 mg·L-1acetanilide or 50 mg·L-12-chlorobenzenesulfonamide solution were suitable for the expression ofIN2-2promoter in mustard,and the acetanilide induce theIN2-2promoter expression more quickly than 2-chlorobenzenesulfonamide in all tissues and organs.In addition,high concentration 2-chlorobenzenesulfonamide treatment was detrimental to mustard germination and growth,and would obviously inhibit the expression activity ofIN2-2promoter.4 ℃ temperature stress inducedIN2-2promoter expression in seedling leaf blades.This promoter expression was slightly induced by 150 mmol·L-1NaCl,but not by heavy metalions Gu2+.
IN2-2promoter;Acetanilide;2-Chlorobenzenesulfonamide;Mustard;GUS expression
周雯,女,硕士研究生,专业方向:蔬菜育种与生物技术,E-mail:869217196@qq.com
*通讯作者(Corresponding author):宋洪元,教授,硕士生导师,专业方向:蔬菜遗传育种及生物技术,E-mail:yuahs@163.com
2016-11-07;接受日期:2017-03-03
重庆市社会事业与民生保障科技创新专项(cstc2015shmsztzx80005,cstc2015shms-ztzx80007,cstc2015shms-ztzx80009)

