基于时间分辨方法的LicT蛋白荧光动力学特性
常孟方 李 磊 曹潇丹 贾梦辉周加胜 陈缙泉 徐建华,*
(1华东师范大学精密光谱科学与技术国家重点实验室,上海200062;2中国科学院上海光学精密机械研究所,上海201800)
基于时间分辨方法的LicT蛋白荧光动力学特性
常孟方1李 磊1曹潇丹1贾梦辉2周加胜1陈缙泉1徐建华1,*
(1华东师范大学精密光谱科学与技术国家重点实验室,上海200062;2中国科学院上海光学精密机械研究所,上海201800)
使用时间分辨荧光方法,结合紫外吸收光谱和稳态荧光光谱技术,测量了LicT蛋白中色氨酸残基的荧光动力学特性,进而对LicT蛋白质激活前后的局部微环境和结构变化进行了研究。LicT蛋白质的激活态使得有关糖类利用的基因转录过程继续进行,促进机体新陈代谢。通过色氨酸残基的荧光发射和寿命的差异判断出激活型蛋白AC 141和野生型蛋白Q 22不同的结构性质和微环境差异。在此基础上,通过衰减相关光谱(DAS)和时间分辨发射光谱(TRES)阐释了两种蛋白色氨酸残基和溶剂的相互作用,说明了激活型AC 141的比野生型Q 22的结构更加紧密。此外,TRES还说明了蛋白中的色氨酸残基存在连续光谱弛豫过程。各向异性结果则对残基和整个蛋白的构象运动进行了阐述,说明了色氨酸残基在蛋白质体系内有独立的局部运动,且在激活型蛋白中该运动更加强烈。
时间相关单光子计数;色氨酸;衰减相关光谱;时间分辨发射光谱;各向异性
1 引言
荧光光谱技术广泛应用于对生物分子结构和动力学的研究中1。色氨酸是氨基酸中最为重要的荧光发色团,数十年来一直被用来探测多肽和蛋白质的环境和构象变化2,其化学结构及残基结构如图1所示。相较其他氨基酸,色氨酸的吲哚环有着较强的紫外消光系数和较高的量子产率3。其最低单线态1La对周围环境的极性和动力学过程非常敏感4,5。随着色氨酸在水中暴露的部分增多,其发射峰值在308到355 nm之间变化。总体上看,这一点反映了蛋白质周围的静电环境6。许多含有单个色氨酸残基的多肽和蛋白质表现出波长相关的多指数荧光衰减,每个衰减成分都有不同的衰减相关光谱(DAS)7。造成色氨酸荧光多指数衰减的因素有很多,如溶剂弛豫、基态异质性、旋转异构体、局部环境等8-10。蛋白质或多肽内的淬灭因素有肽键、谷氨酰胺、天冬酰胺、半胱氨酸、组氨酸等11。而蛋白质构型的改变也使得色氨酸残基的局部环境发生变化,从而引起色氨酸稳态荧光光谱和时间分辨衰减曲线的改变2。在DAS基础上得到的时间分辨发射光谱(TRES)可用于激发态光谱弛豫的研究和弛豫时间的估计。对于分子各项异性的测量可以判断分子的形状和旋转扩散的情况12。有关蛋白质中色氨酸残基的各向异性的研究可以反映出蛋白的整体旋转扩散和局部转动的速率13,14。
LicT蛋白质是枯草杆菌BglG族的四种反终止子蛋白之一,在碳水化合物的运输和代谢过程中调节有关糖类利用的基因表达。其激活态促使转录过程持续进行,在机体新陈代谢过程中有着十分重要的作用15,16。研究者们已经使用不同的实验方法对LicT蛋白的功能和结构进行了探究,如表面等离子体共振、晶体结构测定、小角度X射线衍射、分析超速离心法、核磁共振等17-19。然而,在LicT蛋白质PRD1区域的120位存在色氨酸残基,除了稳态荧光光谱的测量18,尚未有时间分辨荧光方法运用在探索LicT蛋白及其突变体的动力学中。
本文使用时间相关单光子计数(TCSPC)技术,通过时间分辨手段对野生型及天冬氨酸激活型LicT蛋白的动力学和结构特性进行了深入的探讨。通过耦合了皮秒激光器的TCSPC平台实现了衰减相关光谱,时间分辨发射光谱和各向异性的测量。寿命拟合、DAS、TRES说明了两种蛋白色氨酸残基的微环境和连续光谱弛豫过程。各向异性结果则对残基和整个蛋白的结构运动进行了阐述,说明了色氨酸残基在蛋白质体系内有独立的局部运动。这些结果反映了LicT蛋白在激活前后的荧光动力学变化。
2 样品准备
Q 22是野生型LicT蛋白,AC 141是其激活型,其中His 207和His 269被带负电荷的天冬氨酸所取代,目的是模拟磷酸化的组氨酸残基。蛋白的制备方法见文献18。
将1 mL电阻率为18.2 MΩ·cm的去离子水加入到冻干的Q 22和AC 141粉末中。室温下停放10到15 min之后,摇晃离心管加速溶解。将上层清液移至干净的离心管中,然后以800 r·min-1的速率离心20 min。将500μL的各样品移至600μL(30 mm×10 mm×2 mm)的比色皿中以备测量。
3 实验部分
LicT蛋白的吸收谱由紫外-可见分光光度计(TU1901,北京普析通用仪器有限公司)测量,探测波长为200至900 nm。稳态荧光光谱由荧光分光光度计(4500,Hitachi,日本)测量得出,激发波长为298 nm。所有的时间分辨荧光测量都是使用自主搭建的TCSPC系统完成的。在此系统中,中心波长为298 nm的激发光由皮秒二极管激光器(PDL800-B,PicoQuant,德国)发出,重复频率是10 MHz。荧光信号经紫外-可见光电倍增管(PMA165A-N-M,PicoQuant,德国)探测,由单光子计数模块(PicoHarp300,PicoQuant,德国)记录。在DAS测量中荧光偏振设为魔角(magic angle,54.7°),而对于各向异性的测量分别设为竖直和水平方向。探测光路中通过单色仪(7ISW151,北京赛凡光电仪器有限公司)选择探测的荧光波长。使用0.34%二氧化硅纳米颗粒水溶液的衰减曲线作为仪器响应函数,其半高宽(FWHM)约为500 ps。在自主编写的控制软件中,选择25000个通道,每个时间通道设为4 ps。DAS的探测波长设为325-395 nm,步长为10 nm。各向异性的探测波长设在345 nm。
4 结果与讨论
图2为LicT蛋白的吸收谱。从图2可见,两种样品均有一个280 nm左右的吸收峰,这是色氨酸基团的特征吸收峰。根据Beer-Bouguer定律20:

(其中,Ti为样品的透过率,c为样品浓度,l为样品光程,K是消光系数),由吸收峰值和在RCSB Protein Data Bank中计算得到的消光系数,计算出AC 141和Q 22的浓度分别为1.00和0.95 mg· mL-1。二者浓度基本相同。
图3为LicT蛋白的稳态荧光光谱。由图3可以看出,AC 141相较于Q 22发生了约为5 nm的蓝移。色氨酸有两个等能激发态1La和1Lb,如图4所示。在极性溶剂水中,荧光主要从1La激发态发射21。而1La能态在极性强的溶剂中或在与氢键键合的过程中能量转低,电子跃迁时发射波长变长,光谱发生红移22,23。图3体现了这一溶剂效应。因此,结合图5中LicT蛋白的结构示意图,AC 141的结构比Q 22更加紧密,色氨酸残基得到了保护,更少地暴露在水中。
为了得到LicT蛋白的寿命成分及其比重,依据加权最小二乘法的方法,使用如下公式对TCSPC系统测得的多探测波长衰减曲线进行拟合:
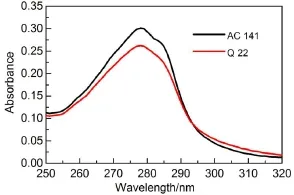
图2 LicT蛋白的吸收谱Fig.2 Absorption spectra of LicT proteins

图4 溶剂效应和激发态连续光谱弛豫(CR)的Jablonski图Fig.4 Jablonskidiagram of solvent effectand excited state continuous spectralrelaxation(CR) hνis the energy of the exciting photons.1Lb(a)and1Laare singletexcited states.F and R representFranck-Condon(unrelaxed)state and relaxed state, respectively.k is fluorescence decay rate.ksis solventrelaxation rate.
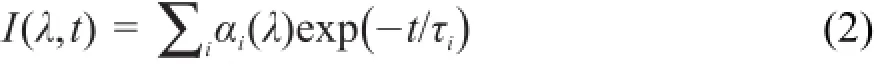
其中I(λ,t)是t时刻波长λ的荧光强度,τi是寿命成分,αi(λ)是该寿命所占比重。拟合的效果通过χR2的值来评价12,本文χR2的范围是1.01-1.20。TCSPC系统的仪器时间分辨率约为250 ps,故整体寿命数值的误差在250 ps左右。在拟合过程中,基线(或者暗噪声)由自己编写的Matlab程序自动扣除。AC 141和Q 22均可用三个寿命拟合。多指数衰减和蛋白质的结构有关12。色氨酸在中性环境里有3.1和0.5 ns两个寿命,约为3 ns的是色氨酸的自然辐射寿命,0.5 ns可能来自于色氨酸的自淬灭或外部淬灭12,24。而在LicT蛋白中,还存在着约为7 ns的寿命,这可能是因为蛋白质的结构为色氨酸残基提供了弱极性的疏水环境,使得色氨酸寿命变长25。
多波长探测的结果经全局拟合处理,得到DAS(如图6)。DAS通常用来确定异质性和弛豫在色氨酸荧光发射中的重要性。而DAS系数的正负则是两态激发态反应的判断标志26。图6使用三指数模型对衰减曲线进行了拟合,得到了3个荧光寿命。鉴于所有的DAS系数均为正值,所以在LicT蛋白的荧光发射中,异质性的作用更为重要。AC 141和Q 22的最短寿命成分(趋近探测极限)曲线没有明显区别。这一现象说明两种蛋白的色氨酸残基受溶剂弛豫的影响相同。对于最长的寿命成分,Q 22的比率高于AC 141,而对于中间的寿命成分3 ns,Q 22的比率低于AC 141。

图5 LicT蛋白结构的带状和空间填充示意图Fig.5 Ribbon and space filling presentations of LicT protein Adapted from Fig.6a of reference 18.
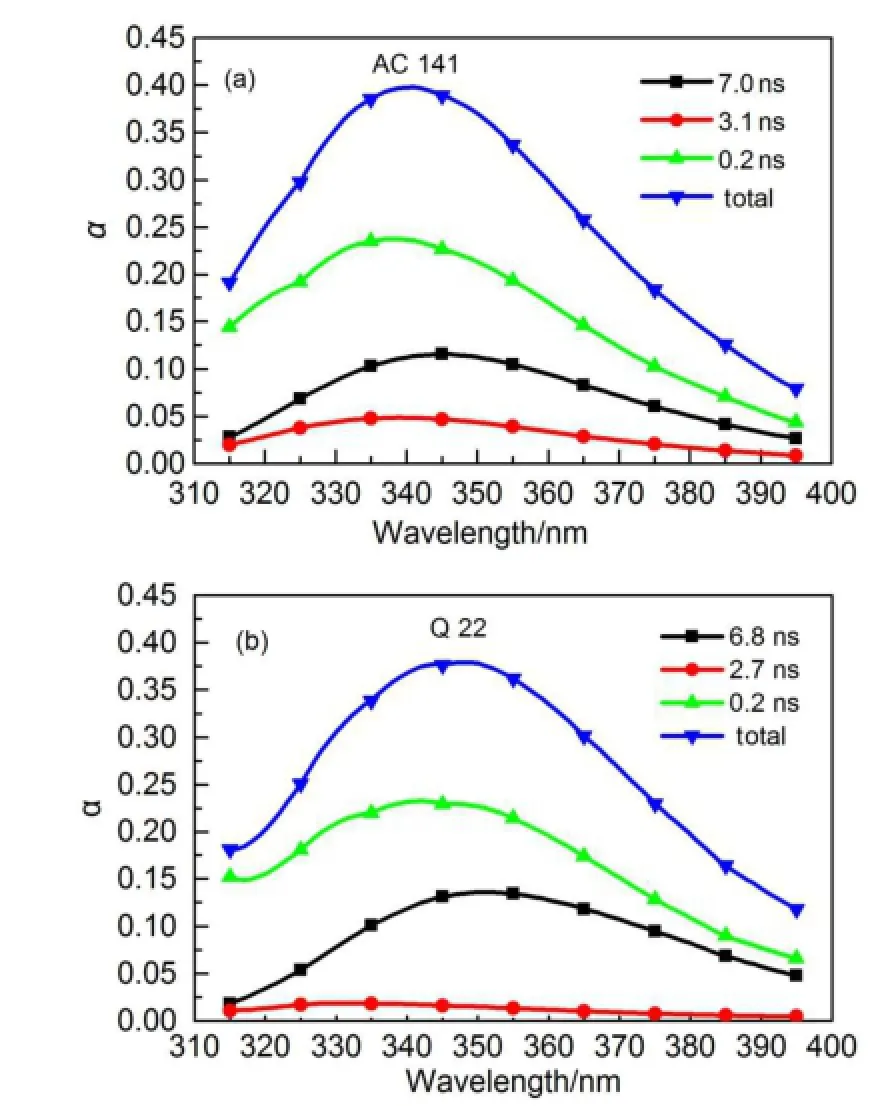
图6 LicT蛋白的DAS图Fig.6 DAS(decay associated spectra)of LicT proteins (a)AC 141;(b)Q 22

图7 LicT的TRES图Fig.7 Time-resolved emission spectra(TRES)of LicT proteins (a)AC 141;(b)Q 22
为了更好地了解LicT蛋白的瞬态过程,由之前DAS的结果做出了TRES。对于激发态过程的研究通常可以借助于TRES的测量。TRES是在脉冲激发之后的时间里立即测量得到的一系列荧光发射光谱12。激发态弛豫过程可用两种模型描述:激发态反应(ESR)模型和连续光谱弛豫(CR)模型。两者的区别在于ESR的弛豫态荧光衰减速率和激发态荧光衰减速率不同,而CR模型的两种衰减速率相同,并且在两种状态转换的中间态里连续衰减。故CR模型的荧光发射光谱的形状不会随记录时间不同而改变,而ESR模型的光谱形状会改变。从图7中可以看出,两种LicT蛋白的荧光衰减均符合CR模型,即激发态电子的弛豫是一个连续发光的过程,并且激发态电子衰减速率与弛豫态相同,如图4所示。对于荧光衰减过程而言,由于从激发态到弛豫态需要时间,而弛豫态能量低于激发态,因此,长波长的荧光衰减寿命更长12。这与我们所测得的数据相吻合。
对于TRES的测量有直接测量和波长相关衰减两种方法。前者虽然也涉及TCSPC技术,但由于仪器响应函数的存在,测得的光谱往往会受到扭曲。因此,我们采用探测不同波长衰减的方法间接测量样品的TRES,数据处理的计算方法如下:
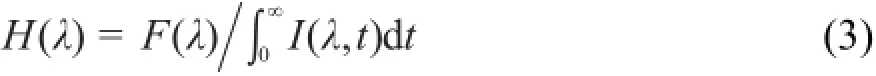
其中F(λ)是稳态发射光谱,I(λ,t)是荧光衰减强度。用寿命和其比率替换荧光衰减强度,得到:

H(λ)乘以相同波长下时间积分的荧光衰减强度等于该波长下的稳态荧光强度。于是,计算TRES的公式为:
这里α′i(λ)=H(λ)αi(λ)12。
值得注意的是,图7中只有0-0.5 ns能够得出可分辨的TRES曲线。由此可以得出在LicT蛋白中存在着约为0.5 ns的弛豫过程,如图4所示。而Q 22相较AC 141在激发的最初时间里红移得更多,说明了前者的弛豫态能量低于后者,这是因为色氨酸周围环境的极性不同所导致的12。极性越大,则激发态能量越低。由此可以推断出AC 141的色氨酸残基更多包裹在蛋白质的结构中。
为了继续研究LicT蛋白的结构转动变化,我们计算了AC 141和Q 22的各向异性参数,结果由Decayfit软件通过加和减的方式得出。设荧光强度衰减光谱中与激发光偏振平行和垂直的分量分别为I∥(t)和I⊥(t),r(t)是时间分辨各向异性,则有如下关系式:

其中,r0=j是没有旋转扩散的限制各项异性,θj是单独的相关时间,gi是每个各向异性衰减相关时间所占的比值,且=1.012。拟合结果见表1。
图8为LicT蛋白的各向异性测量到的衰减曲线及拟合分析。图8中,Q 22的时间分辨各向异性曲线比AC 141的衰减得快一些。这说明了Q 22色氨酸残基更多的暴露于水中,当蛋白被激活时结构变得更加紧密,使得AC 141色氨酸残基受到了保护。表1中,较长的转动相关时间θ1说明了蛋白的整体旋转扩散。转动相关时间θ2说明了由溶液或其他残基转动扩散引起的超快动力学过程。Q 22的θ2所占比率高于AC 141,说明前者的结构较为松散,色氨酸残基的局部运动更加剧烈。相同条件下色氨酸的基本各向异性值为0.3,而AC 141和Q 22的r0值分别为0.209和0.165,均小于0.3。这种各向异性数值的减小是因为色氨酸残基存在着一个快速的运动,且这种运动的时间尺度在测量所用仪器的分辨率之下12。所以,进一步的研究需要使用荧光飞秒上转换装置来完成。
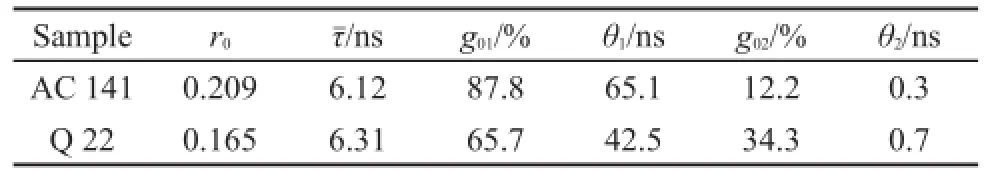
表1 LicT蛋白的各向异性衰减拟合参数Table 1 Fitting parameters of anisotropy decays of LicT proteins
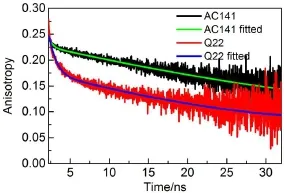
图8 LicT蛋白的各向异性测量到的衰减曲线及拟合分析Fig.8 Measured decay anisotropies and fitting analyses of LicT proteins
5 结论
使用时间分辨荧光方法探讨了LicT蛋白的野生型和突变体的荧光动力学。通过TCSPC技术,DAS、TRES、各向异性的测量和结果分析探讨了LicT蛋白质色氨酸残基的激发态弛豫过程以及局部运动和转动扩散。对两种蛋白荧光寿命的三指数拟合表明了色氨酸残基的不同微环境和淬灭现象。在此基础上,通过DAS展示了两种蛋白中色氨酸残基的溶剂弛豫效应,说明了激活型AC 141的比野生型Q 22的结构更加紧密,使得色氨酸残基受到了更多的保护。通过TRES,说明了蛋白中的色氨酸残基存在0.5 ns的连续光谱弛豫过程。各向异性结果则对残基和整个蛋白的结构运动进行了阐述,说明了色氨酸残基在蛋白质体系内有独立的局部运动,且激活后该运动更加强烈。因此,色氨酸可作为一种内源性探针对LicT蛋白质激活前后的局部微环境和结构进行研究。除此之外,这些结论为研究者们使用时间分辨荧光方法进一步探索皮秒量级LicT蛋白的荧光动力学性质提供了依据。
致谢:感谢CBS(Centre de Biochimie Structurale,France)提供制备LicT蛋白所需的质粒和相关技术支持。
(1)Frauenfelder,H.;Sligar,S.G.;Wolynes,P.G.Science 1991, 254(5038),1598.doi:10.1126/science.1749933
(2)Xu,J.;Toptygin,D.;Graver,K.J.;Albertini,R.A.;Savtchenko, R.S.;Meadow,N.D.;Roseman,S.;Callis,P.R.;Brand,L.; Knutson,J.R.J.Am.Chem.Soc.2006,128(4),1214. doi:10.1021/ja055746h
(3)Schimmel,P.;Cantor,C.Biophysical Chemistry:Part II; Techniques for the Study of Biological Structure and Function; WH Freeman:New York,1980;pp 14-178.
(4)Lu,W.;Kim,J.;Qiu,W.;Zhong,D.Chem.Phys.Lett.2004, 388(1-3),120.doi:10.1016/j.cplett.2004.03.012
(6)Longworth,J.W.Intrinsic Fluorescence of Proteins.In Time-Resolved Fluorescence Spectroscopy in Biochemistry and Biology;Cundall,R.B.,Dale,R.E.Eds.;Springer US:Boston, MA,1983;pp 651-725.
(7)Knutson,J.R.;Walbridge,D.G.;Brand,L.Biochemistry 1982, 21(19),4671.doi:10.1021/bi00262a024
(8)McMahon,L.P.;Yu,H.T.;Vela,M.A.;Morales,G.A.;Shui, L.;Fronczek,F.R.;McLaughlin,M.L.;Barkley,M.D.J.Phys. Chem.B 1997,101(16),3269.doi:10.1021/jp963273i
(9)Ross,J.B.A.;Wyssbrod,H.R.;Porter,R.A.;Schwartz,G.P.; Michaels,C.A.;Laws,W.R.Biochemistry 1992,31(6),1585. doi:10.1021/bi00121a002
(10)Szabo,A.G.;Rayner,D.M.J.Am.Chem.Soc.1980,102(2), 554563.doi:10.1021/ja00522a020
(11)Chen,Y.;Barkley,M.D.Biochemistry 1998,37(28),9976. doi:10.1021/bi980274n
(12)Lakowicz,J.R.Principles of Fluorescence Spectroscopy; Springer Science&Business Media:New York,2006;pp 102-605.
(13)Vincent,M.;Deveer,A.M.;Haas,G.H.;Verheij,H.M.;Gallay, J.Eur.J.Biochem.1993,215(3),531.doi:10.1111/j.1432-1033.1993.tb18062.x
(14)Ross,J.B.A.;Schmidt,C.J.;Brand,L.Biochemistry 1981,20 (15),4369.doi:10.1021/bi00518a021
(15)Deutscher,J.;Francke,C.;Postma,P.W.Microbiol.Mol.Biol. R.2006,70(4),939.doi:10.1128/MMBR.00024-06
(16)Stülke,J.;Arnaud,M.;Rapoport,G.;Martin-Verstraete,I.Mol. Microbiol.1998,28(5),865.doi:10.1046/j.1365-2958.1998.00839.x
(17)van Tilbeurgh,H.;Le Coq,D.;Declerck,N.EMBO J.2001,20 (14),3789.doi:10.1093/emboj/20.14.3789
(18)Declerck,N.;Dutartre,H.;Receveur,V.;Dubois,V.;Royer,C.; Aymerich,S.;van Tilbeurgh,H.J.Mol.Biol.2001,314,671. doi:10.1006/jmbi.2001.5185
(19)Declerck,N.;Vincent,F.;Hoh,F.;Aymerich,S.;van Tilbeurgh, H.J.Mol.Biol.1999,294(2),389.doi:10.1006/jmbi.1999.3256
(20)Gooch,J.W.Beer-Bouguer Law(Beer-Lambert Law).In Encyclopedic Dictionary of Polymers,Gooch,J.W.Ed.; Springer New York:New York,2011;p 72.
(21)Zhang,L.;Kao,Y.T.;Qiu,W.;Wang,L.;Zhong,D.J.Phys. Chem.B 2006,110(37),18097.doi:10.1021/jp063025e
(22)Callis,P.R.;Burgess,B.K.J.Phys.Chem.B 1997,101(46), 9429.doi:10.1021/jp972436f
(23)Pierce,D.W.;Boxer,S.G.Biophys.J.1995,68(4),1583. doi:10.1016/S0006-3495(95)80331-0
(24)Qiu,W.;Li,T.;Zhang,L.;Yang,Y.;Kao,Y.T.;Wang,L.; Zhong,D.Chem.Phys.2008,350(1-3),154.doi:10.1016/j. chemphys.2008.01.061
(25)Gryczynski,I.;Wiczk,W.;Johnson,M.L.;Lakowicz,J.R. Biophys.Chem.1988,32(2),173.doi:10.1016/0301-4622(88) 87005-4
(26)Chen,R.F.;Knutson,J.R.;Ziffer,H.;Porter,D.Biochemistry 1991,30(21),5184.doi:10.1021/bi00235a011
Fluorescence Dynamics of LicT Protein by Time-Resolved Spectroscopy
CHANGMeng-Fang1LILei1CAO Xiao-Dan1JIA Meng-Hui2ZHOU Jia-Sheng1CHEN Jin-Quan1XU Jian-Hua1,*
(1State Key Laboratory of Precision Spectroscopy,EastChina Normal University,Shanghai 200062,P.R.China;2Shanghai Institute of Optics and Fine Mechanics,Chinese Academy of Sciences,Shanghai 201800,P.R.China)
In this paper,the fluorescence dynamics oftryptophan residues in LicT protein is investigated by time-resolved fluorescence method combined with UV absorption and steady-state fluorescence spectroscopy. The localmicroenvironmentand structuralchanges of LicT protein before and after activation are studied.The activated LicT protein AC 141 prevents the antitermination of gene transcription involved in carbohydrate utilization to accelerate the body′s metabolism.The structuralproperties and microenvironment ofactivated protein AC 141 and wild-type protein Q 22 were determined by differentfluorescence emissions and lifetimes of tryptophan residues.The interaction between tryptophan residues and solvent is elucidated by decay associated spectroscopy(DAS)and time-resolved emission spectra(TRES),indicating thatupon activation, the structure of AC 141 is more compact than that of wild-type Q 22.In addition,TRES also showed that tryptophan residues in the protein had a continuous spectralrelaxation process.Anisotropy results illustrated the conformationalmotions ofresidues and whole proteins,suggesting thattryptophan residues had independent localmotions in the protein system,and thatthe motions were more intense in the activated protein.
Time-correlated single-photon counting;Tryptophan;Decay-associated spectra;Timeresolved emission spectra;Anisotropy
.Email:jhxu@ecnu.edu.cn;Tel:+86-21-62233936 ©Editorialoffice ofActa Physico-Chimica Sinica
O643
allis,P.R.Method Enzymol.1996,278,113.
10.1016/ S0076-6879(97)78009-1
doi:10.3866/PKU.WHXB201703061
Received:January 5,2017;Revised:March 1,2017;Published online:March 6,2017.*

